VELOCIDADE DAS REAES QUMICAS Prof Dr ARNALDO ANTONIO










![Curva típica do consumo de um produto através de mecanismo de primeira ordem [A]o Curva típica do consumo de um produto através de mecanismo de primeira ordem [A]o](https://slidetodoc.com/presentation_image_h2/cedc223ea5ff2d21ef5746950d1c09f4/image-14.jpg)
![[A]t = (a-x) = quantidade de reagente remanescente no tempo t a = quantidade [A]t = (a-x) = quantidade de reagente remanescente no tempo t a = quantidade](https://slidetodoc.com/presentation_image_h2/cedc223ea5ff2d21ef5746950d1c09f4/image-16.jpg)








- Slides: 26

VELOCIDADE DAS REAÇÕES QUÍMICAS Prof. Dr. ARNALDO ANTONIO RODELLA ESALQ/USP

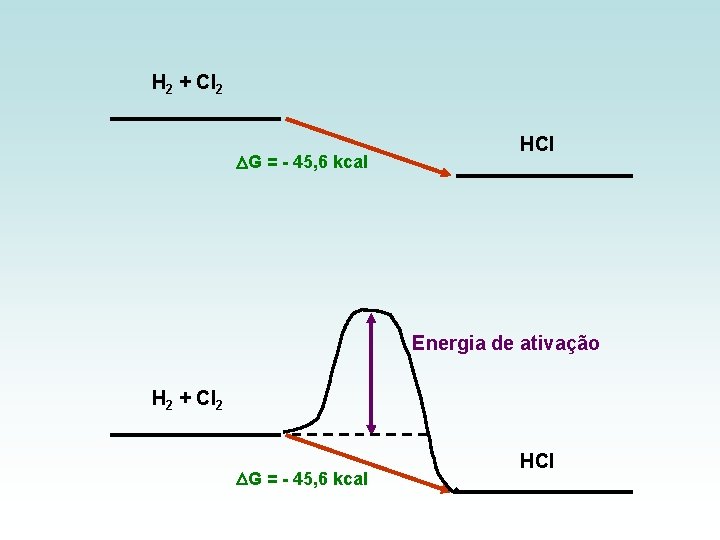
COMO CONHECER E CONTROLAR AS REAÇÕES QUÍMICAS ? H 2 + Cl 2 2 HCl G = - 45, 6 kcal A TERMODIN MICA mostra que a produção de HCl é um processo espontâneo no escuro: H 2 + Cl 2 nada acontece presença de luz: H 2 + Cl 2 explosão

H 2 + Cl 2 G = - 45, 6 kcal HCl Energia de ativação H 2 + Cl 2 G = - 45, 6 kcal HCl

A TERMODIN MICA indica que se a reação ocorre espontaneamente, mas não informa quando isso vai ocorrer O estudo da velocidade com que a reação ocorre é objeto da CINÉTICA QUÍMICA

Velocidade Variação da concentração de um reagente ou de um produto na unidade de tempo Lei de velocidade Equação diferencial que relaciona velocidade de reação com concentração de reagentes Ordem Soma dos expoentes dos termos de concentração da equação de lei de velocidade. Não depende da estequiometria da reação

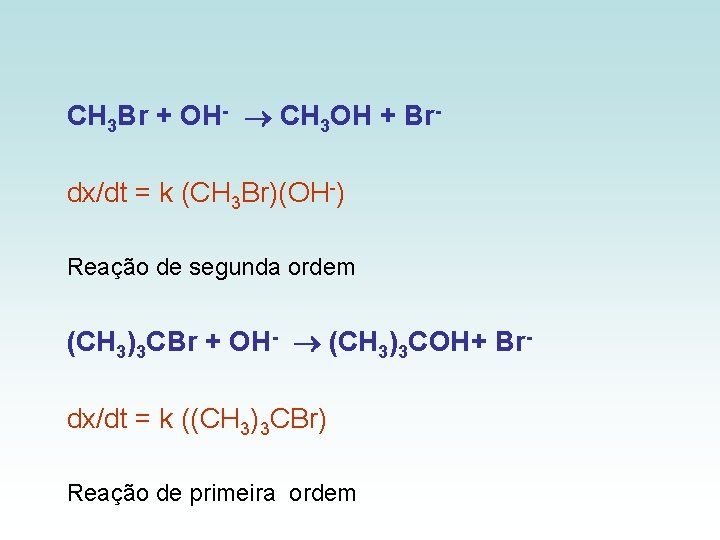
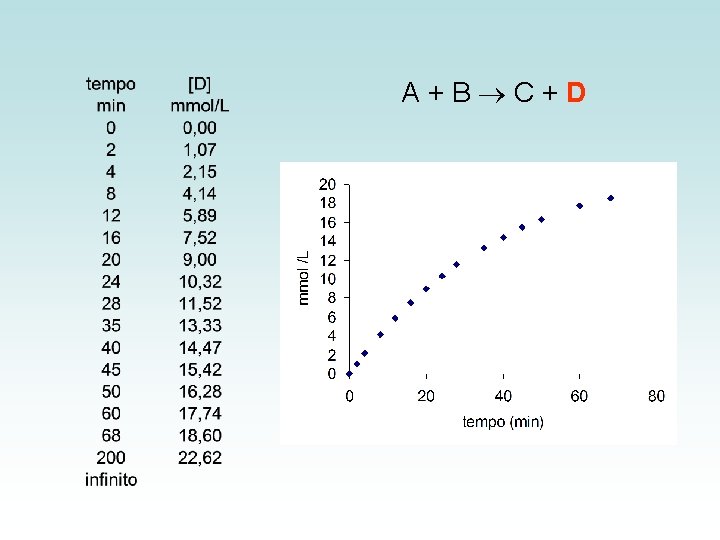
CH 3 Br + OH- CH 3 OH + Brdx/dt = k (CH 3 Br)(OH-) Reação de segunda ordem (CH 3)3 CBr + OH- (CH 3)3 COH+ Brdx/dt = k ((CH 3)3 CBr) Reação de primeira ordem

2 HI(g) H 2(g) + I 2(g) dx/dt = k (HI)2 Reação de segunda ordem Reações de pseudo-primeira ordem A velocidade depende aproximadamente da concentração de apenas um dos reagentes sob condições especiais, como o excesso de um outro reagente

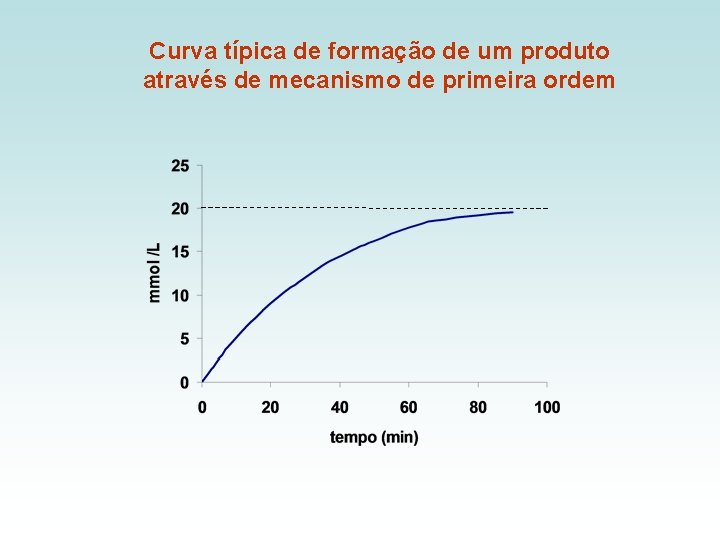
LEI DE VELOCIDADE DE PRIMEIRA ORDEM tempo 0 tempo t A a (a-x) B 0 x Equação diferencial da lei de velocidade de primeira ordem A velocidade de formação de B em cada instante é proporcional à concentração de reagente remanescente Portanto a velocidade de reação decresce continuamente com o tempo

Integrando:

- ln (a-x) = k. t + C quando t = 0 temos que C = - ln a ln (a-x) = - k. t + ln a


Curva típica de formação de um produto através de mecanismo de primeira ordem

Retomando a equação da lei de velocidade de primeira ordem (a-x) = quantidade de reagente remanescente no tempo t = [A]t a = quantidade de inicial de reagente no tempo 0 = [A]o
![Curva típica do consumo de um produto através de mecanismo de primeira ordem Ao Curva típica do consumo de um produto através de mecanismo de primeira ordem [A]o](https://slidetodoc.com/presentation_image_h2/cedc223ea5ff2d21ef5746950d1c09f4/image-14.jpg)
Curva típica do consumo de um produto através de mecanismo de primeira ordem [A]o

A+B C+D
![At ax quantidade de reagente remanescente no tempo t a quantidade [A]t = (a-x) = quantidade de reagente remanescente no tempo t a = quantidade](https://slidetodoc.com/presentation_image_h2/cedc223ea5ff2d21ef5746950d1c09f4/image-16.jpg)
[A]t = (a-x) = quantidade de reagente remanescente no tempo t a = quantidade inicial de reagente

MÉTODO GRÁFICO PARA DE DETERMINAR A ORDEM DA REAÇÃO k = 0, 0255 min-1

MEIA VIDA t 1/2 Período de tempo necessário para ocorrer metade da reação Período de tempo para consumir de metade dos reagentes x = a/2

k = 0, 0255 min-1

Equação de Arrhenius k = constante de velocidade A = fator pré-exponencial E = energia de ativação R = constante dos gases perfeitos T = temperatura Kelvin

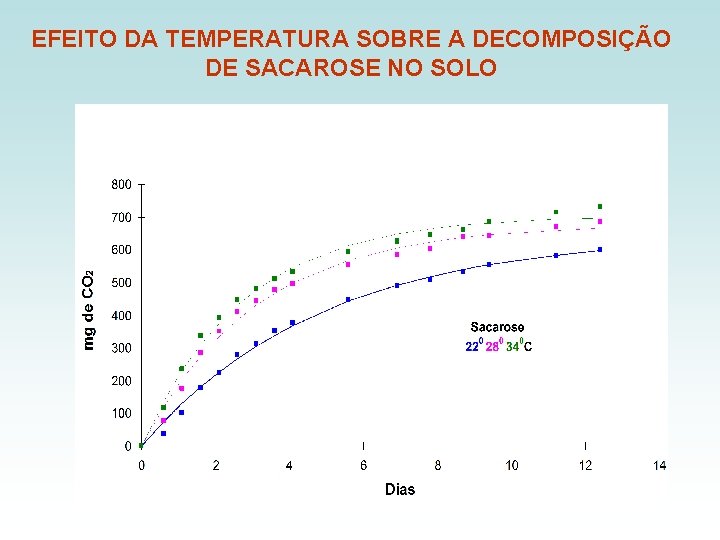
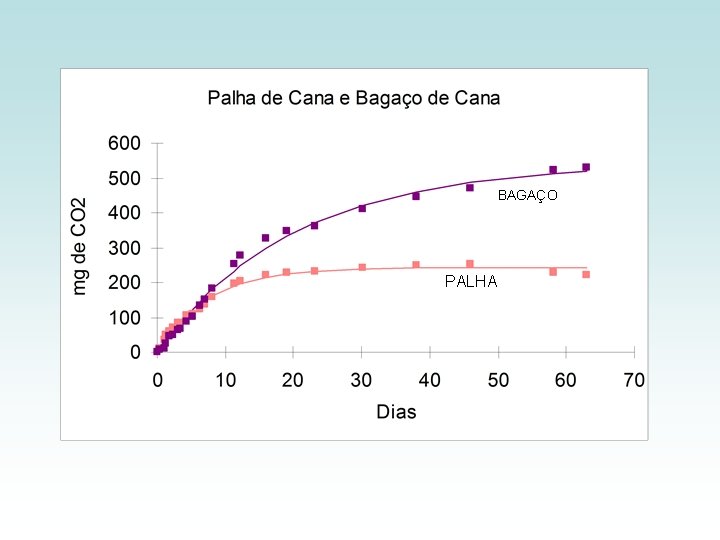
APLICAÇÃO MAIS FREQÜENTE Modelo de primeira ordem na decomposição de materiais orgânicos no solo Limitações: - Não é uma reação química “comportada” - Difícil definir quais compostos estão participando da reação - Depende da atividade microbiológica

EFEITO DA TEMPERATURA SOBRE A DECOMPOSIÇÃO DE SACAROSE NO SOLO


BAGAÇO PALHA

Em ensaio de respirometria 2, 45 g de resíduo com 18, 7 %C é incorporado a 1 kg de solo Massa de carbono incorporada = 2450 x 0, 187 = 458, 2 mg C Massa de CO 2 teoricamente produzida = 1679, 9 mg C orgânico CO 2 Massa de CO 2 evoluída em 58 dias = 785, 9 mg C recalcitrante 458, 2 mg C C mineralizável

PARA QUEM QUISER SABER MAIS: http: //chemed. chem. purdue. edu/genchem/topicreview/index. html Cinética elementar de reação J. L. Lantham Química um tratamento moderno Pimentel & Spratley
 Qumicas
Qumicas Alexandro dantas trindade
Alexandro dantas trindade Arnaldo belzunce manterola
Arnaldo belzunce manterola Arnaldo carneiro filho
Arnaldo carneiro filho Arnaldo jabor
Arnaldo jabor Ucc arnaldo sampaio
Ucc arnaldo sampaio Das alles ist deutschland das alles sind wir
Das alles ist deutschland das alles sind wir Jesus christus spricht ich bin das licht
Jesus christus spricht ich bin das licht Das alte ist vergangen das neue angefangen
Das alte ist vergangen das neue angefangen O menosprezo das artes e das letras
O menosprezo das artes e das letras Eu acredito na pureza da resposta
Eu acredito na pureza da resposta K
K Velocidade constante
Velocidade constante Balla abstract speed
Balla abstract speed Vazão formula
Vazão formula Velocidade de corte
Velocidade de corte Velocidade linear formula
Velocidade linear formula Os poemas são pássaros que chegam
Os poemas são pássaros que chegam Movimento referencial
Movimento referencial Velocidade média matemática
Velocidade média matemática Velocidade angular
Velocidade angular Velocidade do jato
Velocidade do jato Velocidade media
Velocidade media Transportes
Transportes Aceleracao
Aceleracao Phet mru
Phet mru Mcu
Mcu