CINTICA QUMICA La cintica qumica es la rama











- Slides: 16

CINÉTICA QUÍMICA

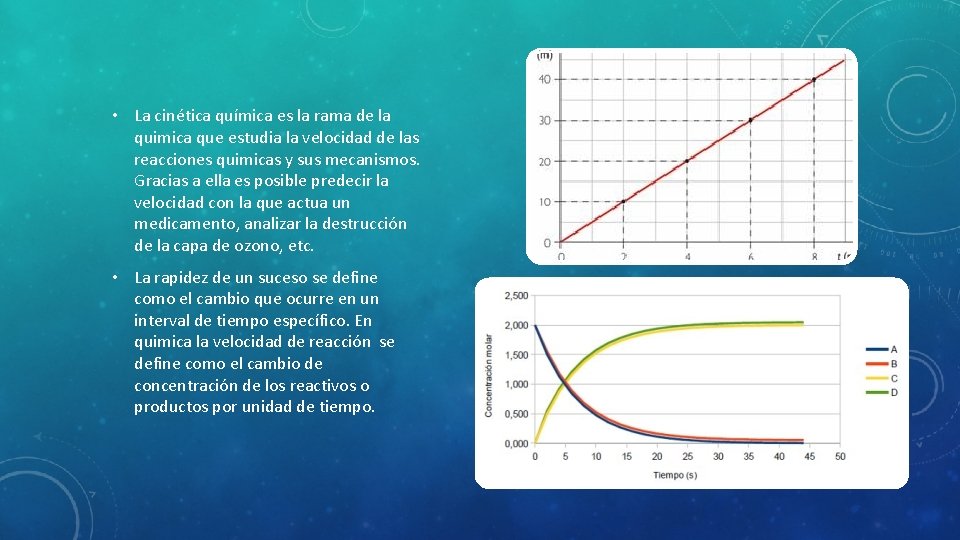
• La cinética química es la rama de la quimica que estudia la velocidad de las reacciones quimicas y sus mecanismos. Gracias a ella es posible predecir la velocidad con la que actua un medicamento, analizar la destrucción de la capa de ozono, etc. • La rapidez de un suceso se define como el cambio que ocurre en un interval de tiempo específico. En quimica la velocidad de reacción se define como el cambio de concentración de los reactivos o productos por unidad de tiempo.

VELOCIDAD DE LA REACCIÓN • La velocidad de reacción (v), se define como el cambio en la concentración molar (M) de un reactante o producto por unidad de tiempo en segundos (s). • Todas las reacciones químicas ocurren a diferentes velocidades, algunas instantáneamente, y otras pueden demorar algunos minutos o puedes tardar muchos años. Por ejemplo, una explosión es inmediata, mientras que la oxidación de hierro de las rejas ocurre con el paso de los años. • La velocidad de reacción se define como el cambio en la concentración de uno de los reactivos o productos, en un intervalo de tiempo en el cual tiene lugar el cambio. Lo anterior, permite saber la velocidad promedio de la reacción. Por lo tanto, la velocidad de reacción es función de los reactivos, de la temperatura a la que se efectúa la reacción, de la superficie expuesta entre los reactivos, de la concentración de los reactivos, y en algunas ocasiones, de los catalizadores.

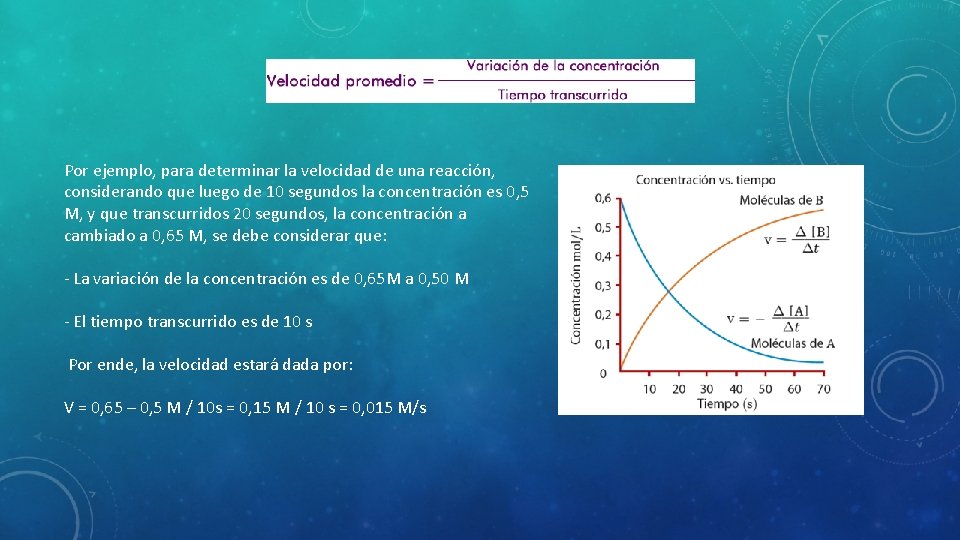
Por ejemplo, para determinar la velocidad de una reacción, considerando que luego de 10 segundos la concentración es 0, 5 M, y que transcurridos 20 segundos, la concentración a cambiado a 0, 65 M, se debe considerar que: - La variación de la concentración es de 0, 65 M a 0, 50 M - El tiempo transcurrido es de 10 s Por ende, la velocidad estará dada por: V = 0, 65 – 0, 5 M / 10 s = 0, 15 M / 10 s = 0, 015 M/s

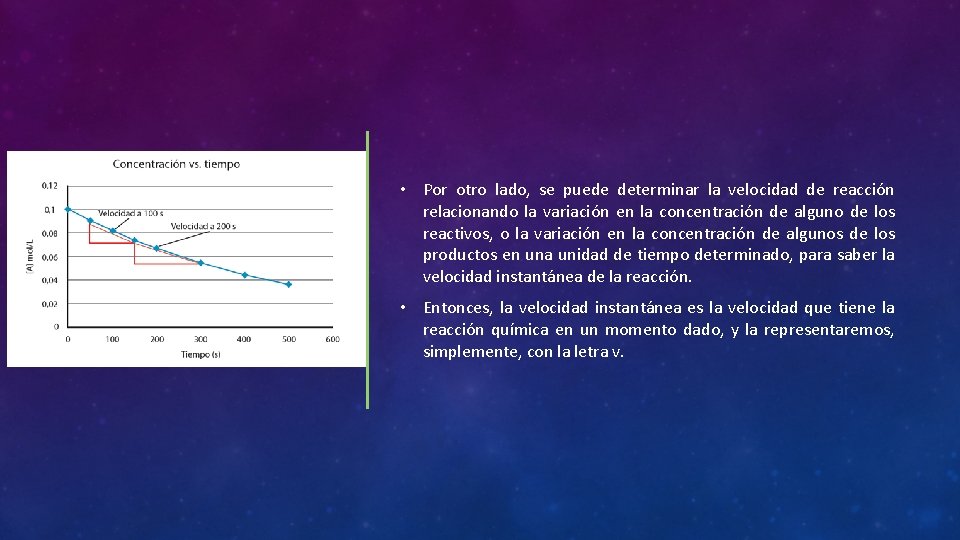
• Por otro lado, se puede determinar la velocidad de reacción relacionando la variación en la concentración de alguno de los reactivos, o la variación en la concentración de algunos de los productos en una unidad de tiempo determinado, para saber la velocidad instantánea de la reacción. • Entonces, la velocidad instantánea es la velocidad que tiene la reacción química en un momento dado, y la representaremos, simplemente, con la letra v.

NATURALEZA QUÍMICA Y FÍSICA DE LOS REACTANTES • Hay dos grandes teorías que intentan explicar las cinéticas de las reacciones químicas: la teoría de las colisiones y la teoría del estado de transición. • La teoría de las colisiones se usa para pronosticar la cinética de las reacciones químicas, particularmente para los gases. La teoría de las colisiones está basada en la suposición de que para que se dé una reacción es necesario que las especies choquen (átomos o moléculas). No todas las colisiones conllevan un cambio químico.

Una colisión será eficaz si las especies que chocan lo hacen con una energía igual o superior a la llamada energía de activación. Además, en la colisión las especies tienen que estar orientadas de una manera favorable a la necesaria reagrupación de sus átomos. Así, según la teoría de las colisiones, la velocidad con que una reacción química avanza estará relacionada con la frecuencia con que se producen las colisiones eficaces. Debido a que la frecuencia con que átomos y moléculas chocan sólo se puede calcular con cierto grado de exactitud en gases (por aplicación de la teoría cinético-molecular), el uso de la teoría de las colisiones está limitada a reacciones en fase gaseosa. Según la teoría de las colisiones, si en una reacción hay pocos choques efectivos por unidad de tiempo, la reacción transcurrirá a baja velocidad.

• Cuando usamos la teoría de las colisiones vemos que sus resultados concuerdan bien con los datos experimentales observados en varias reacciones que implican la colisión de dos moléculas de gas. Esta teoría también es adecuada para explicar reacciones en solución con iones simples. Pero a menudo, las velocidades proporcionadas por este método son muy altas y no coinciden con los valores experimentales (que nos dan valores más bajos de velocidad). Esta discrepancia aumenta con la complejidad de las moléculas que reaccionan.

• En 1930, Eyring, Polanyi et al. aplicaron los principios de la mecánica cuántica a este problema, y el resultado se conoce como Teoría del Estado de Transición (TET). En esta teoría se continúa suponiendo que la reacción se da como resultado de las colisiones entre las moléculas de los reactivos, la novedad de esta teoría es que postula la formación de un complejo activado (o estado de transición) a partir de los reactivos; después, este complejo se descompondría para formar productos. Se asume que el complejo activado está en equilibrio termodinámico con los reactivos. La fase que determinaría la velocidad de la reacción sería la descomposición del complejo activado. Esto resuelve el problema derivado de la teoría de las colisiones sobre por qué no todas las colisiones son efectivas. • Vemos que esta teoría asume que cualquier reacción simple o elemental considerada, realmente no lo es, ya que hay una primera reacción parcial en la que se forma el complejo activado y que está en equilibrio con los reactivos, en una segunda fase, el complejo activado se descompone completamente para dar el producto.

Los perfiles de reacción química corresponde a un diagrama que permite comprender el desarrollo de una reacción química PERFIL DE UNA REACCIÓN

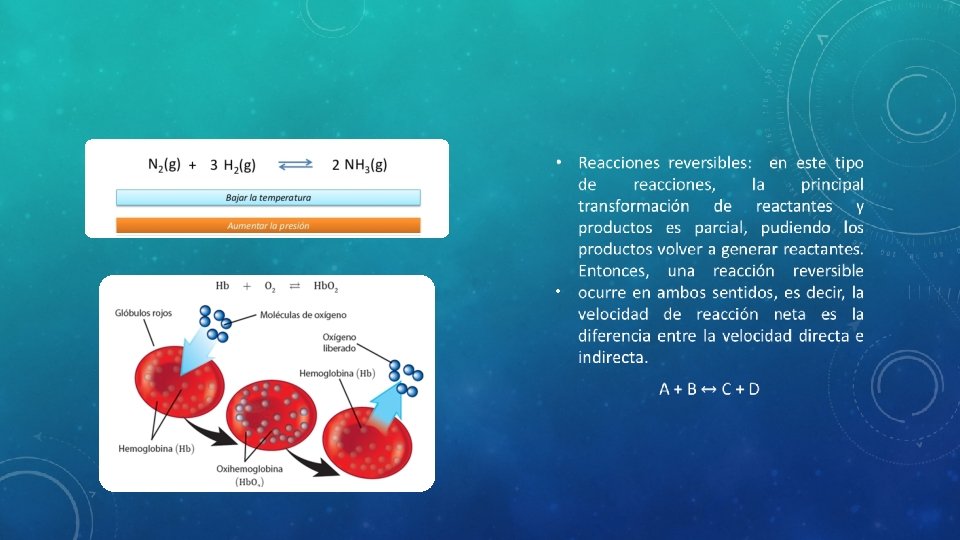
TIPOS DE REACCIONES • Una vez iniciada una reacción química, esta puede evolucionar de dos maneras. Reacciones irreversibles (reacciones que ocurren hasta que los reactivos se agotan) o reacciones reversibles (la reacción se detiene en un punto, aunque aún quedan reactivos). • Reacciones irreversibles: los reactivos se consumen completamente transformándose en los productos, los que tienen características y composición diferentes a los reactivos iniciales. Estas reacciones ocurren en un solo sentido (hacia la formación de productos). A+B C+D


LEY DE VELOCIDAD • La ley de velocidad es una relación matemática entre el cambio de concentración, la velocidad de una reacción y la constante de velocidad. La ley de velocidad se determina experimentalmente de dos formas; realizando varios experimentos en los que se varía la concentración inicial de los reactivos, pudiendo, como no hay producto formado, determinar la ley de velocidad solo con el reactivo presente; o en un solo experimento, midiendo la concentración de un reactivo en diferentes tiempos durante la reacción. • Para una reacción general A + 2 B → C, la expresión de la velocidad instantánea en función de los reactantes y los productos será:


RESPONDE: • ¿Qué teorías explican la velocidad de reacción? • ¿Qué es el complejo activado? ¿en qué afecta la Ea? • ¿Qué es el perfil de una reacción? ¿Cuántos tipos existen? ¿Cómo se diferencian? • ¿De qué habla la ley de velocidad? ¿Qué es el orden de una reacción?

RESPONDE • ¿Qué son los polímeros? • ¿Cuantos tipos de polímeros existen? ¿cuales son? • ¿Cómo se forman los polímeros (tipos de reacción química que los forman)? Describe los mecanismos de formación.