Cintica qumica 1 Velocidad de reaccin 2 Teora



- Slides: 9

Cinética química 1. - Velocidad de reacción 2. - Teoría de las colisiones. 3. - Factores que influyen en la velocidad de reacción

1. Velocidad de reacción La velocidad de una reacción química indica cómo varía la concentración de reactivos o productos con el tiempo Ejemplo: Para la reacción a. A + b. B c. C + d. D La velocidad de la reacción se puede expresar:

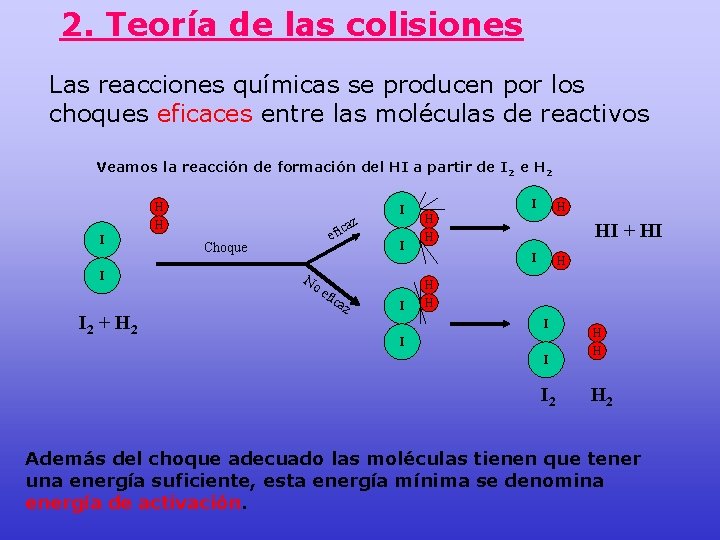
2. Teoría de las colisiones Las reacciones químicas se producen por los choques eficaces entre las moléculas de reactivos Veamos la reacción de formación del HI a partir de I 2 e H 2 H H I I I 2 + H 2 az c efi Choque No efi ca z I I H HI + HI I H H H I I 2 H H H 2 Además del choque adecuado las moléculas tienen que tener una energía suficiente, esta energía mínima se denomina energía de activación.

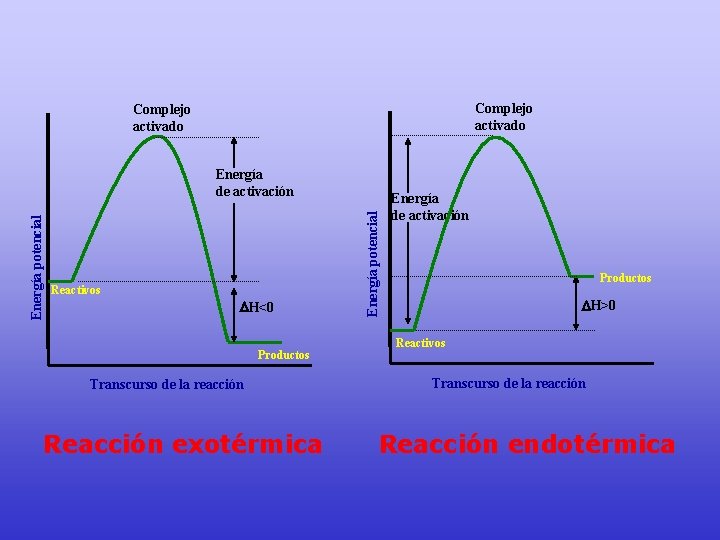
Complejo activado Reactivos H<0 Productos Transcurso de la reacción Reacción exotérmica Energía potencial Energía de activación Productos H>0 Reactivos Transcurso de la reacción Reacción endotérmica

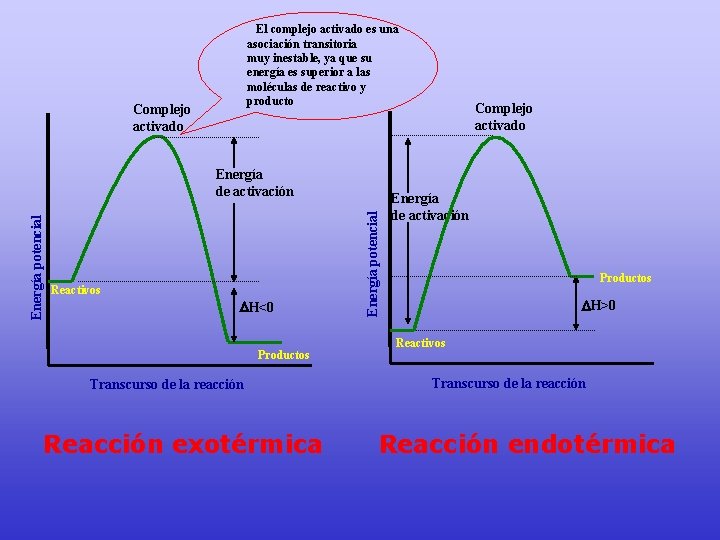
El complejo activado es una asociación transitoria muy inestable, ya que su energía es superior a las moléculas de reactivo y producto Complejo activado Reactivos H<0 Productos Transcurso de la reacción Reacción exotérmica Energía potencial Energía de activación Complejo activado Energía de activación Productos H>0 Reactivos Transcurso de la reacción Reacción endotérmica

3. Factores que influyen en la velocidad de reacción 1. - Estado físico de los reactivos Las reacciones son más rápidas si los reactivos son gaseosos o están en disolución. En las reacciones heterogéneas la velocidad dependerá de la superficie de contacto entre ambas fases, siendo mayor cuanto mayor es el estado de división. 2. - Concentración de los reactivos 3. - Temperatura Un incremento de la temperatura provoca un incremento en la energía cinética de las moléculas, lo que hace que sea mayor el número de moléculas que alcanza la energía de activación. 4. - Catalizadores

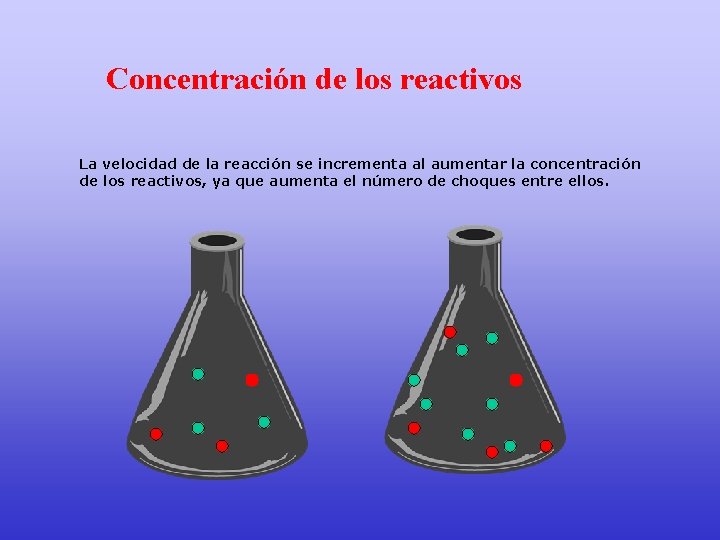
Concentración de los reactivos La velocidad de la reacción se incrementa al aumentar la concentración de los reactivos, ya que aumenta el número de choques entre ellos.

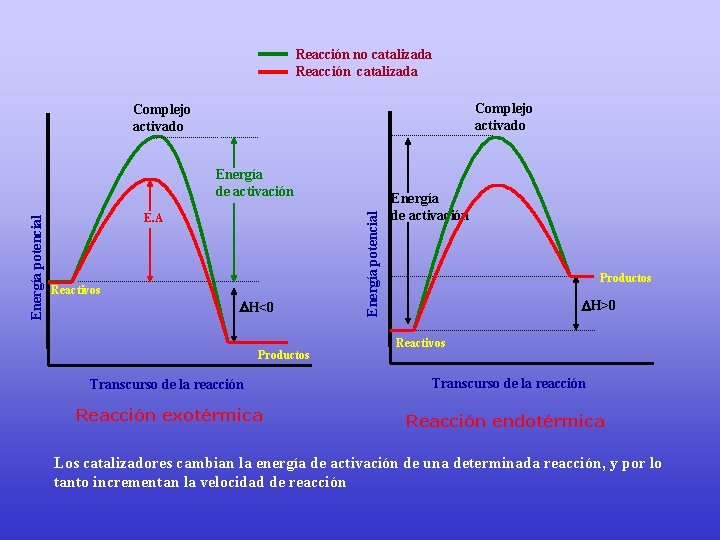
Reacción no catalizada Reacción catalizada Complejo activado E. A Reactivos H<0 Productos Energía potencial Energía de activación Productos H>0 Reactivos Transcurso de la reacción Reacción exotérmica Reacción endotérmica Los catalizadores cambian la energía de activación de una determinada reacción, y por lo tanto incrementan la velocidad de reacción

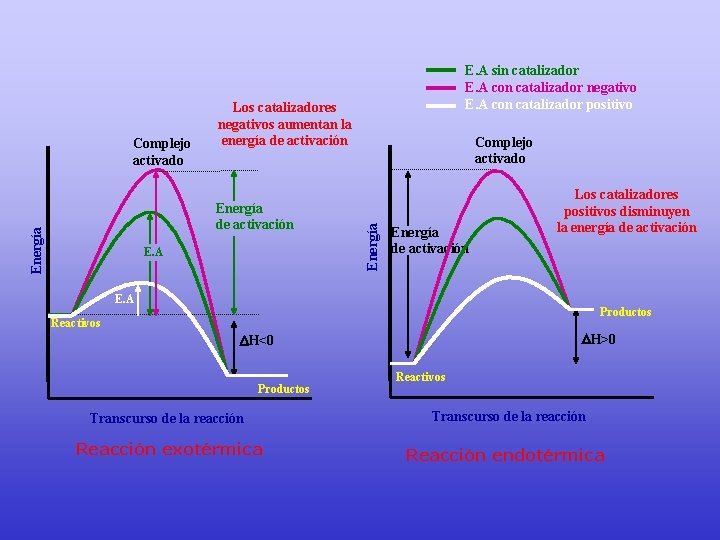
Los catalizadores negativos aumentan la energía de activación Energía de activación E. A Complejo activado Energía Complejo activado E. A sin catalizador E. A con catalizador negativo E. A con catalizador positivo Energía de activación Los catalizadores positivos disminuyen la energía de activación E. A Productos Reactivos H>0 H<0 Productos Reactivos Transcurso de la reacción Reacción exotérmica Reacción endotérmica