Corroso Potencial fora do Equilbrio Cintica Corroso Cintica

Corrosão Potencial fora do Equilíbrio Cinética

Corrosão Cinética de Corrosão Métodos quantitativos para determinar a velocidade de corrosão - Velocidade Média de Corrosão (g m -2 T-1) perda de massa do material metálico ou determinação da concentração de íons metálicos em solução (Gráficos no tempo) - Velocidade Instantânea relaciona a corrente de corrosão com a perda de massa m = K. i. T / F m = massa do metal dissolvida K = equivalente eletroquímico do metal I = corrente de corrosão (anódica, no E corr) T = tempo F = faraday

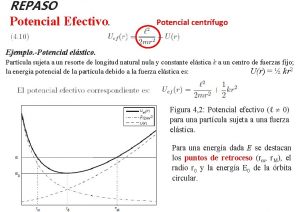
Corrosão Potenciais de Eletrodos Irreversíveis Potenciais Padrão e obtidos pela Equação de Nernst são de Sistemas em Equilíbrio Na Realidade pode haver: 1. Distribuição de Potenciais sobre a Superfície 2. Variação dos Potenciais dos Eletrodos durante a Corrosão Potenciais de Eletrodos Irreversíveis: potenciais dos sistemas para os quais as condições conhecidas não permitem definir a natureza do fenômeno reversível

Corrosão Potenciais de Eletrodos Magnitude das correntes e números de reações Formação de película Formação de íons complexos Impurezas na solução temperatura Potencial de Corrosão ou Potencial Misto potencial diferente do potencial de equilíbrio termodinâmico (reações e fenômenos de superfície) Sobrepotencial (n), alteração do potencial em relação ao potencial de Equilibrio n = E´ - Eo Polarização Fenômeno que surge com a passagem de uma corrente pelo Eletrodo produzindo novos potenciais

Corrosão Polarização Concentração = interferência da agitação e transporte de massa dos reagentes e produtos. Ativação = decorrente de uma barreira energética à transferência eletrônica (comum na redução de hidrogênio e desprendimento de oxigênio) ex. Zn em Ácido não-oxidante. Ôhmica = n = R. I Alteração da resistividade do meio R = 1/k. C R, resistência do eletrólito k, condutividade do eletrólito C, constante da célula Sobretensão total, n = nc + na + no

Corrosão

Corrosão

Corrosão

Corrosão

Té aula que vem !!!!!
- Slides: 10