Doorstroom Scheikunde les 1 Kelly van Helden 1































































- Slides: 74

Doorstroom Scheikunde les 1 Kelly van Helden

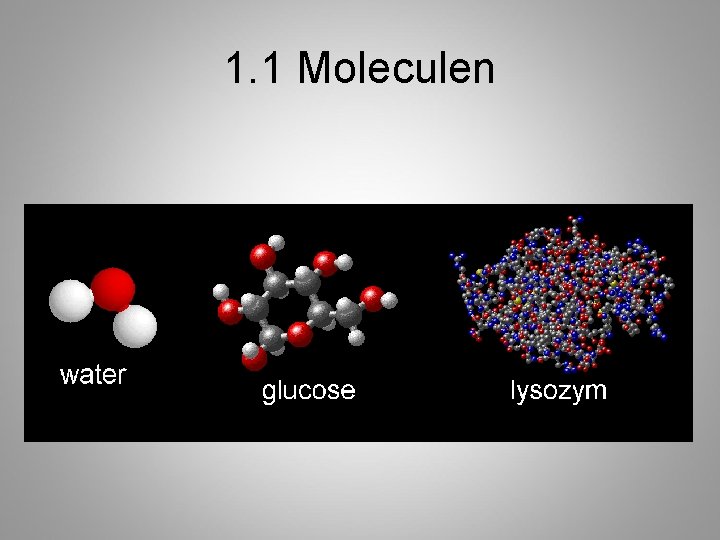
1. 1 Moleculen

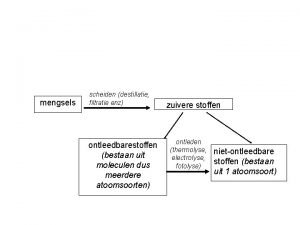
1. 2 Zuiver en onzuiver • Zuivere stof: – Maar 1 soort deeltjes (moleculen) – Niet kleiner te krijgen – Vb: gedestilleerd water, suiker • Mengsel (onzuiver): – Meerdere soorten deeltjes (moleculen) – Kun je door scheiden uit elkaar halen – Vb: suikerwater

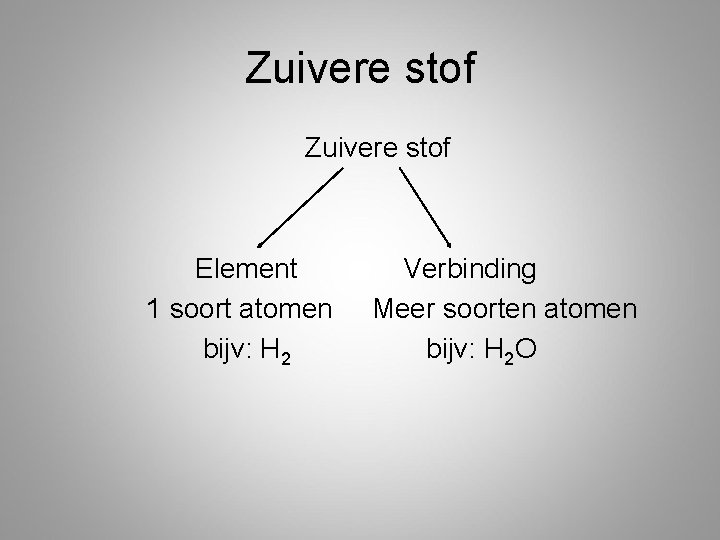
Zuivere stof Element 1 soort atomen bijv: H 2 Verbinding Meer soorten atomen bijv: H 2 O

Stoffen • Stoffen kun je herkennen aan hun stofeigenschappen • Door op verschillende stofeigenschappen te letten kun je stoffen onderscheiden: – Kleur, geur en smaak – Smeltpunt en kookpunt – Dichtheid of soortelijke massa

Dichtheid of soortelijke massa ρ Dichtheid van de stof in kg / m 3 (rho) = m ___ V Massa van de stof in kg Het volume van de stof in m 3 Een blok ijzer met een volume van 3 dm 3 (liter) heeft een massa van 23, 58 kg ρ = 23, 58 kg ____ 0, 003 m 3 = 7860 kg/m 3

Eigenschappen van moleculen • • Moleculen kunnen bewegen Snelheid hangt af van temperatuur Elk molecuul heeft een massa en volume Tussen moleculen komen ruimten voor

Vanderwaalskrachten • aantrekkingskrachten tussen moleculen • Cohesie: aantrekkingskrachten tussen dezelfde moleculen • Adhesie: aantrekkingskrachten tussen verschillende moleculen

1. 3 fasen • Gas (g) • Vloeibaar (l) • Vast (s)

vanderwaalskrachten

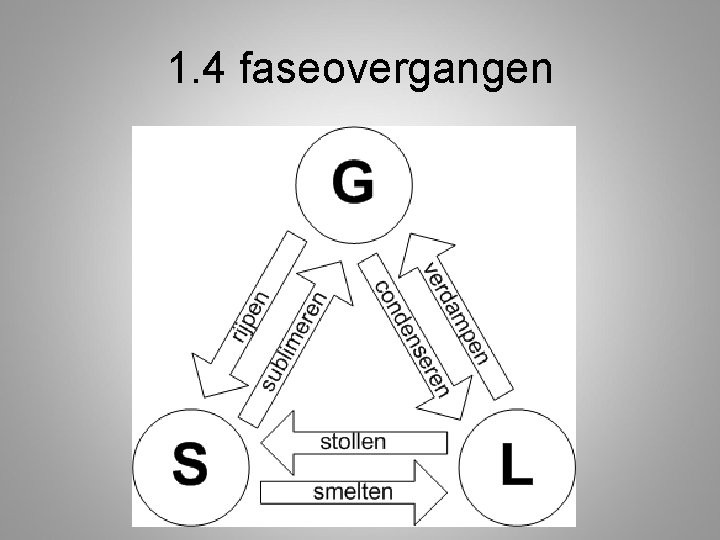
1. 4 faseovergangen

1. 5 atomen • Kleinste deeltjes van een molecuul • Symbolen – Eerste letter van de Latijnse naam – Bijvoorbeeld: • Koolstof = Carboneum dus C • Koper = Cuprum dus Cu • Denk aan hoofdletter kleine letter!!!

1. 6 Elementen • Fientje Cliedert Bruine Inkt Op Haar Neus – Fluor (F), – Chloor (Cl), – Broom (Br), – Jood (I), – Zuurstof (O), – Waterstof (H), – Stikstof (N) • Twee atomige elementen

Opdrachten • Meerkeuze vragen: Opdracht 1 t/m 23 • Open vragen: opdracht 1 t/m 8 • Alles wat niet af is in de les is huiswerk!

Doorstroom scheikunde Les 2 Kelly van Helden

Huiswerk nakijken Meerkeuze vragen 1. C 9. B 2. D 10. A 3. D 11. C 4. C 12. C 5. B 13. B 6. D 14. B 7. B 15. B 8. B 16. B 17. C 18. C 19. A 20. B 21. D 22. A 23. A

Open vragen 1. Waterstof Zuurstof Koolstof Koper Aluminium Chloor Zilver Broom Natrium IJzer H 2. Ca Calcium O Mg Magnesium C Ag Zilver Cu Ba Barium Al S Zwavel Cl P Fosfor Ag N Stikstof Br F Fluor Na K Kalium Fe Ar Argon

3. 4. 5. 6. 7. 8. Zuurstof uit zuurstof moleculen Azijn uit azijnmoleculen Lucht uit stikstof en zuurstof moleculen Melk is een mengsel en bestaat uit verschillende moleculen. Suiker is zuiver dus 1 soort moleculen Ether heeft een laag kookpunt en vervluchtigd dus snel Bij een gas zit er veel ruimte tussen de moleculen bij vaste fase niet Koolstof waterstof en zuurstof Aluminium en zuurstof

Planning vandaag • Atoommodel – Elektronen protonen en neutronen – Atoomnummer – Kernlading – Massagetal – Atoommodel volgens Bohr • Periodiek systeem – Perioden en groepen • Isotopen

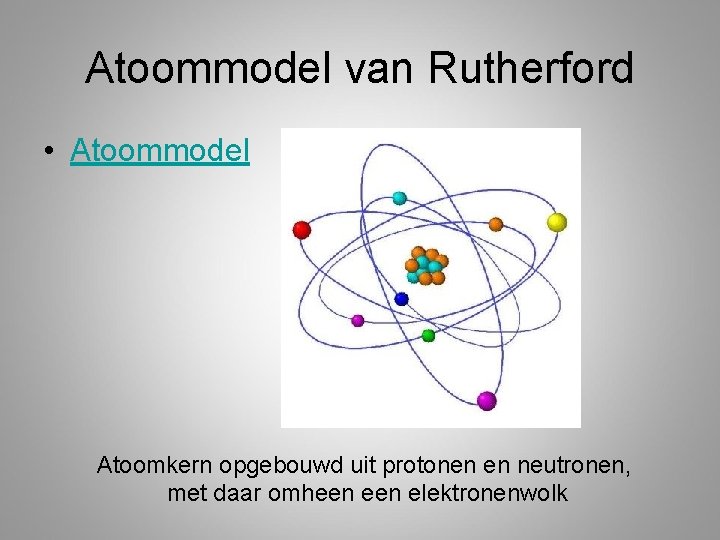
Atoommodel van Rutherford • Atoommodel Atoomkern opgebouwd uit protonen en neutronen, met daar omheen elektronenwolk

Atoomnummer en massagetal • Atoomnummer geeft aan hoeveel protonen en elektronen in een atoom zitten • Massagetal geeft de som van protonen en neutronen aan – K atoomnummer: 19 – K massagetal: 39 – Aantal protonen en elektronen= 19 – Aantal neutronen= 39 -19= 20

Elektronen-verdeling • De elektronen zijn over schillen verdeeld: Schil naam 1 e schil K schil Maximaal aantal elektronen 2 2 e schil L schil 8 3 e schil M schil 18 4 e schil N schil 32 • De elektronen worden van binnenuit naar buiten toe opgevuld • Uit het periodiek systeem is de elektronen-verdeling (elektronenconfiguratie) per atoom af te leiden

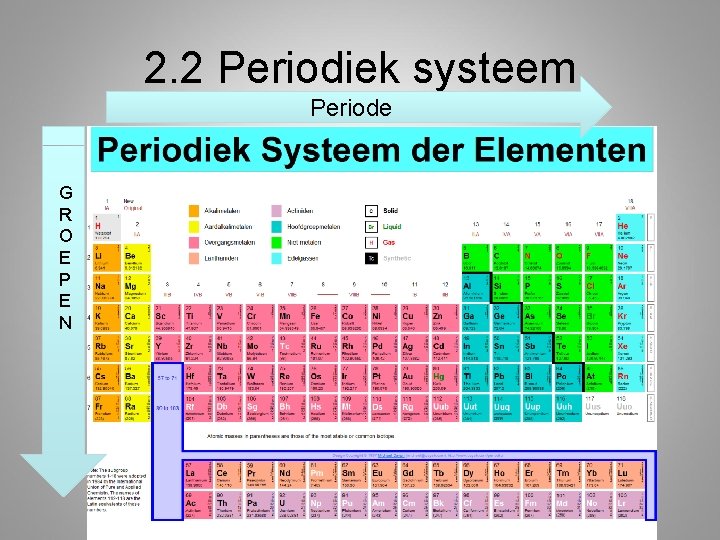
2. 2 Periodiek systeem Periode G R O E P E N

Groepen • Groep 1 Alkalimetalen (Film) – Reageren heftig met water • Groep 2 Aardalkalimetalen – Reageren heftig met lucht (felle vlam) • Groep 17 Halogenen – F, Cl, Br, I reageren goed metalen • Groep 18 Edelgassen – Verbinden zich niet en tasten niets aan

Het atoomnummer geeft het aantal protonen in de kern aan Dit komt overeen met de kernlading (+) en het aantal elektronen in de elektronenwolk (-)

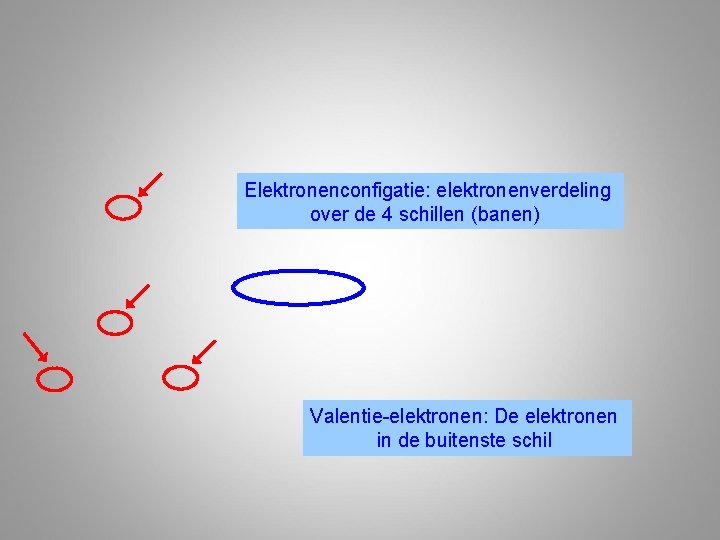
Elektronenconfigatie: elektronenverdeling over de 4 schillen (banen) Valentie-elektronen: De elektronen in de buitenste schil

2. 3 Isotopen • Isotopen zijn elementen met hetzelfde atoomnummer maar met een verschillend massagetal • Aantal neutronen bij een atoom verschillen • Bijv waterstof: – “Gewoon” waterstof 1 proton geen neutronen – “Zwaar” waterstof 1 proton 1 neutron – Tritium 1 proton 2 neutronen

Chloor Lichtere soort komt 3 x zovaak voor Het gemiddelde massagetal wordt dan: Massagetal: (3*35+1*37)/4 = 35, 45 Dit is de massa van het atoom!!!

Opdrachten • Meerkeuze vragen: Opdracht 1 t/m 10 • Open vragen: opdracht 1, 2, 5, 6, 13, 14, 15, 18 en 19 • Alles wat niet af is in de les is huiswerk!

Doorstroom scheikunde Les 3 Kelly van Helden

Herhaling • Atoommodel – Elektronen (-) protonen (+) en neutronen (0) – Atoomnummer (aantal P en E) – Massagetal (aantal N en P samen)

Meerkeuze vragen 1. D 2. D 3. B 4. C 5. D 6. A 7. D 8. B 9. B 10. D

Open vragen 1. Elektronen (-) eromheen, (protonen(+) neutronen(0)) in kern 2. atoomnummer: hoeveel P en E Massagetal: Som van P en N in kern 5. 15, 31 -15=16, periode 3 groep 15 6. H, Mg, Al, O 13. Wolfraam reageert met O 2 niet met Ar 14. Wordt niet snel aangetast, Kwik en zilver Geleiding en wordt niet snel aangetast

15. Deze geleiden geen elektrische stroom 18. Opgebouwd uit moleculen 19. Als er bepaalde stoffen in opgelost zijn

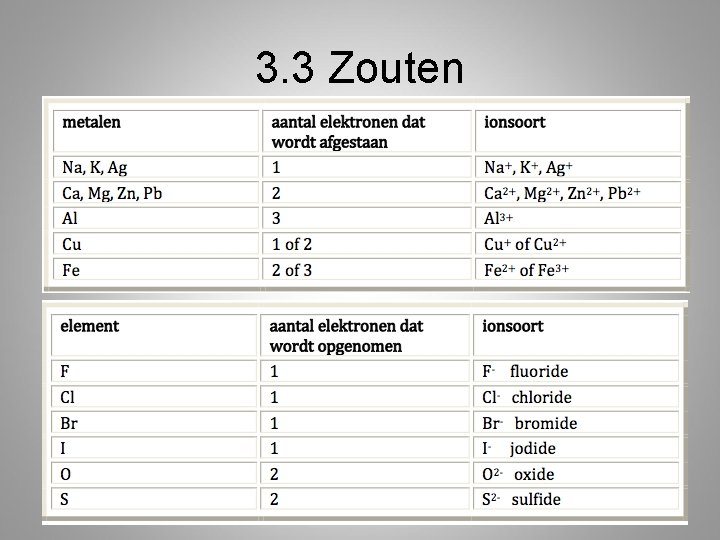
2. 4 Ionen • Atomen kunnen elektronen opnemen of afstaan • Atomen willen zijn als edelgas • Atomen uit groep 1 staan makkelijk 1 elektron af (elektron positief) • Atomen uit groep 17 nemen makkelijk 1 elektron op (elektron negetief)

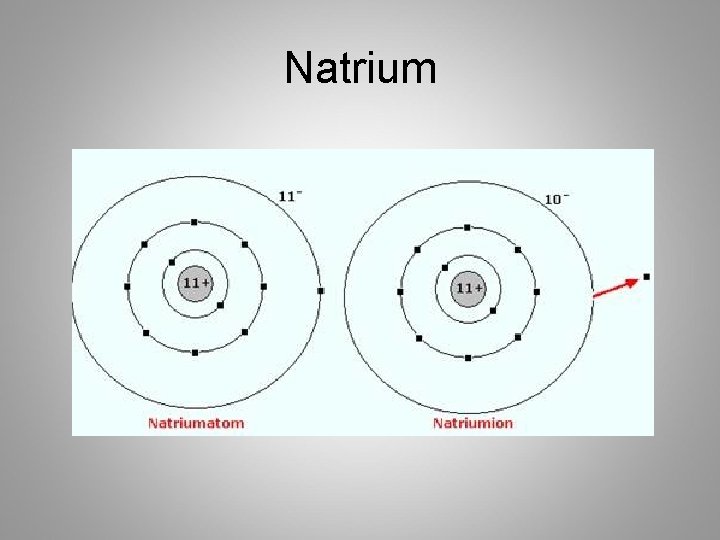
Bijvoorbeeld Na • • Atoomnummer 11 Kernlading is dus +11 11 protonen en 11 elektronen Na kan 1 elektron afstaan – Buitenste schil 1 e • 11 P 10 E (+11 -10= +1) • Natrium ion (Na+-ion)

Natrium

Bijvoorbeeld Cl • • • Atoomnummer 17 Kernlading is dus +17 17 protonen en 17 elektronen Cl kan 1 elektron opnemen 17 P 18 E (+17 -18= -1) Chloride (Cl- ion)

Periodiek systeem en ladingen • Elektronen configuratie geeft lading • Bij metalen is het laatste getal de + lading • Bij niet metalen is 8 - het laatste getal de - lading

Periodiek systeem en ionen • Atomen uit groep 1 – 1 afstaan dus lading van 1+ • Atomen uit groep 2 – 2 afstaan dus lading van 2+ • Atomen uit groep 16 – 2 opnemen dus lading van 2 - • Atomen uit groep 17 – 1 opnemen dus lading van 1 -

Waardigheid van atomen • Atomen uit groep 1 – Waardigheid van 1 • Atomen uit groep 2 – Waardigheid van 2 • Atomen uit groep 15 – Waardigheid van 3 • Atomen uit groep 17 – Waardigheid van 1

2. 5 naamgeving van ionen • Positieve ionen behouden dezelfde naam – Mg 2+ = Magnesium ion – Na+ = Natrium ion – K+ = Kalium ion

Metalen Er zijn metalen die meerdere valenties kunnen hebben (Fe, Cu, Hg, Sn en Pb) Deze geven we aan met romeinse cijfers Fe 2+ of Fe 3+ ijzer(II) ion of ijzer(III)ion Cu+ en Cu 2+ koper(I)ion en koper(II)ion

Negatieve ionen • Achtervoegsel –ide – F– Cl– Br – I– O 2– S 2– N 3 - Fluoride Chloride Bromide Jodide Oxide Sulfide Nitride

Vragen • Meerkeuze vragen: 11 t/m 20 • Open vragen: 3, 4, 7 t/m 12, 16

Doorstroom scheikunde Les 4 Kelly van Helden

Meerkeuze vragen 11. C 12. B 13. D 14. A 15. B 16. A 17. A 18. B 19. D 20. B

Open vragen 3. Geladen atomen (1 of meer elektronen opgenomen of afgestaan) 4. 3+ 7. Positief ion 8. a. Cu+ b. Cu 2+ 9. a. Opnemen b. 1 elektron 10. a. 3 b. 18 e en 15 p 11. a. 2+ b. 20 p en 18 e

12. a. Waar b. Niet waar c. Niet waar d. Waar e. Waar f. Niet waar 16. a. Protonen: 26 neutronen: 56 -26=30 b. 2+ c. Vrije elektronen 17. Bij vaste stof bewegen de elektronen niet bij gesmolten stof wel 20. Zouten

3. 1 groepen stoffen • Allerlei eigenschappen van stoffen worden bepaald door – De manier waarop de atomen in een molecuul aan elkaar gebonden zijn – De sterkte van de bindingen tussen de moleculen

Onderscheid in stoffen 1. Metalen 2. Zouten (opgebouwd uit ionen) 3. Moleculaire stoffen

Stroom geleiden • Een stof kan stroom geleiden wanneer – Er door deze stof geladen deeltjes kunnen bewegen • Geleider – Stof die goed stroom kan geleiden • Isolator – Stof die geen stroom kan geleiden

3. 2 Metalen • Eigenschappen van metalen – Glanzend uiterlijk – Hoog smeltpunt – Geleiden goed warmte – Geleiden elektrische stroom – Goed vervormbaar door walsen en smeden – In gesmolten toestand goed te mengen

Verschillende groepen metalen • Edele metalen – Goud, platina en zilver • Halfedele metalen – Koper en kwik • Onedele metalen – Ijzer, lood, aluminium, e. d. • Zeer onedele metalen – Natrium, kalium, calcium en barium

Even terug • IJzer atoomnummer 26 • Aantal protonen is dus: 26 (positief) • Aantal elektronen is dus: 26 (negatief) • IJzer staat graag 2 elektronen af • Dan krijgt ijzer een lading van: +2 • Dat is het ijzer ion

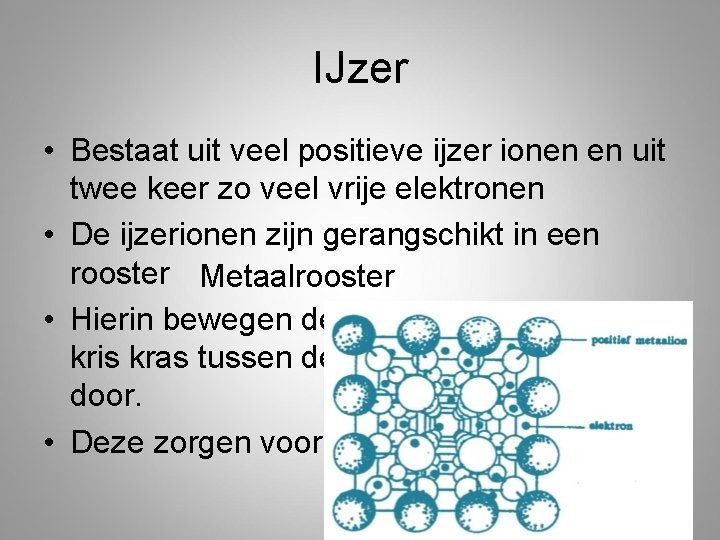
IJzer • Bestaat uit veel positieve ijzer ionen en uit twee keer zo veel vrije elektronen • De ijzerionen zijn gerangschikt in een rooster Metaalrooster • Hierin bewegen de vrije elektronen zich kris kras tussen de positieve ijzerionen door. • Deze zorgen voor de binding

Metaalrooster • Bestaat dus uit positieve metaalionen en uit vrije elektronen die voor de binding (metaalbinding) in het rooster zorgen • Wanneer het metaal aangesloten wordt op stroom gaan alle elektronen dezelfde kant op – De beweging van vrije elektronen wordt gericht

Welke stoffen geleiden niet? • • Gedestilleerd water Alcohol Hout perspex Dit komt doordat deze stoffen geen vrije elektronen bevatten!!

3. 3 Zouten • Stoffen opgebouwd uit positieve en negatieve ionen

Reactie • Natrium en Chloor – Natrium staat steeds 1 elektron af – Chloor neemt steeds 1 elektron op • Er ontstaat Natriumchloride (keukenzout)

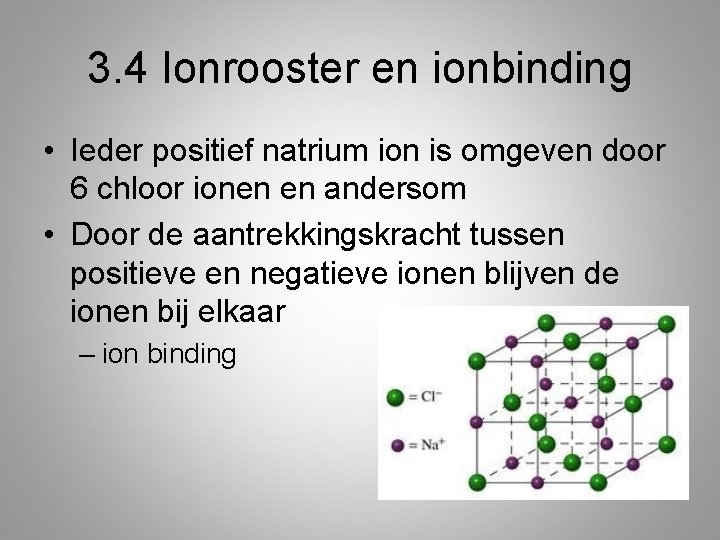
3. 4 Ionrooster en ionbinding • Ieder positief natrium ion is omgeven door 6 chloor ionen en andersom • Door de aantrekkingskracht tussen positieve en negatieve ionen blijven de ionen bij elkaar – ion binding

ionen • • De beweging is erg klein Geen stroomgeleiding Vaak hoge smeltpunten Ion binding is erg sterk

Vragen • Meerkeuze vragen: 1 t/m 10 • Open vragen: 1 t/m 7

Doorstroom scheikunde Les 5 Kelly van Helden

Meerkeuze vragen 1. 2. 3. 4. 5. C B C A B 6. A 7. D 8. B 9. A 10. B

Open vragen 1. 2. 3. 4. 5. 6. 7. Zilverchloride en natriumchloride Vanderwaalskrachten Atoombindingen Molecuulrooster F-F Atoombindingen N≡N

3. 5 Moleculaire stoffen • Deze stoffen kunnen geen stroom geleiden • Bestaan uit moleculen • Molecuulrooster • Vanderwaalskrachten – (niet zo sterk als ionbindingen) • Smelten (lage smeltpunten) – (trillen los van molecuulrooster)

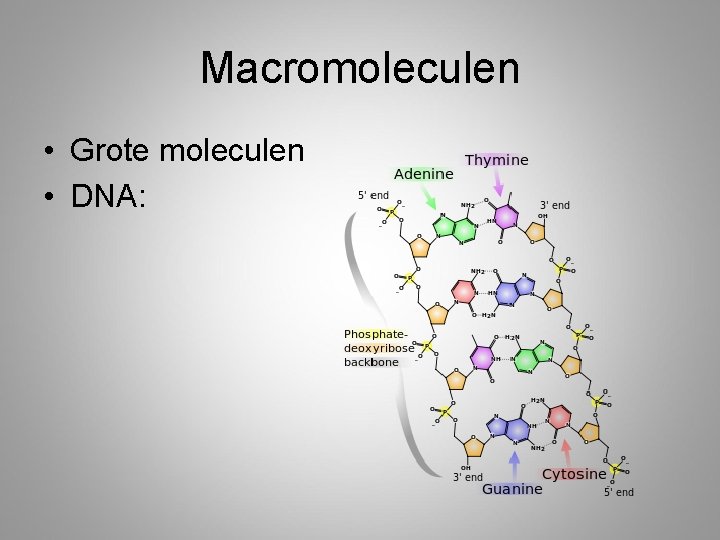
Macromoleculen • Grote moleculen • DNA:

Grootte van moleculen • Kleine moleculen zijn meestal gasvormig • Grote moleculen zijn vaak vast – (grotere moleculen hebben vaak hogere smelt en kookpunten)

3. 6 Atoombinding • Atoombinding: twee niet-metalen met een gemeenschappelijk elektronenpaar • Covalentie: het aantal elektronen dat een atoom beschikbaar heeft voor de atoombinding • H 2

Atoombinding Er zijn ook atomen die meer dan een covalentie hebben. Bijvoorbeeld: Zwavel (S) covalentie 2, 4 en 6

3. 7 Hydrofiel en hydrofoob • Hydrofiel – Stoffen die makkelijk oplossen in water – Suiker, aceton, alcohol, ammoniak • Hydrofoob – Stoffen die niet (makkelijk) oplossen in water – Kaarsvet, olie, benzine, zuurstof en stikstof

Oplosbaarheid • Afhankelijk van temperatuur – Vaste stof lost beter op in warm water dan in koud water – Gas lost beter op in koud water dan in warm water

Volgende week TOETS • Zijn er vragen? ? ?
 Jacques van helden
Jacques van helden Jacques van helden
Jacques van helden Jacques van helden
Jacques van helden Jacques van helden
Jacques van helden Needleman-wunsch
Needleman-wunsch Doorstroom personeel
Doorstroom personeel Leeftijdsbewust personeelsbeleid voorbeeld
Leeftijdsbewust personeelsbeleid voorbeeld Wir sind helden wiki
Wir sind helden wiki Vetharding scheikunde
Vetharding scheikunde Scheidingsmethodes scheikunde schema
Scheidingsmethodes scheikunde schema Mol rekenschema
Mol rekenschema Scheikunde chemie overal vwo 4
Scheikunde chemie overal vwo 4 Gram naar mol
Gram naar mol Binas tabel 45
Binas tabel 45 Woudschoten scheikunde
Woudschoten scheikunde Soorten gereedschap
Soorten gereedschap Indampen
Indampen Index betekenis scheikunde
Index betekenis scheikunde Telwoorden scheikunde
Telwoorden scheikunde Bolbuis scheikunde
Bolbuis scheikunde Scheikunde huiswerk
Scheikunde huiswerk Reactiewarmte berekenen formule
Reactiewarmte berekenen formule Oefeningen mengsels
Oefeningen mengsels Groene chemie scheikunde
Groene chemie scheikunde Indampen
Indampen Organische structuren
Organische structuren Scheikunde brander
Scheikunde brander Ag scheikunde
Ag scheikunde Parts d'una flor
Parts d'una flor Les lettres et les sons
Les lettres et les sons Les 10 volcans les plus dangereux du monde
Les 10 volcans les plus dangereux du monde Les thémes de la ficelle
Les thémes de la ficelle Les constellations les plus connues
Les constellations les plus connues Pronoms convenable
Pronoms convenable Parts de la fulla
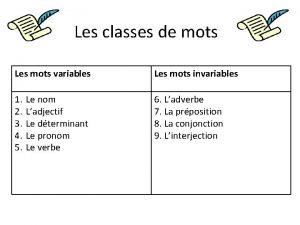
Parts de la fulla Les mots variables et les mots invariables
Les mots variables et les mots invariables Manger est un mot variable ou invariable?
Manger est un mot variable ou invariable? Trouvez les réponses. écrivez-les en chiffres (numbers).
Trouvez les réponses. écrivez-les en chiffres (numbers). Les trains grand corps malade
Les trains grand corps malade Allez vous en sur les places paroles
Allez vous en sur les places paroles Preactionneurs
Preactionneurs Les trois obstacles et les quatre démons
Les trois obstacles et les quatre démons Un appel vient pour des soldats
Un appel vient pour des soldats Podc management
Podc management Qu'est-ce que tu aimes manger
Qu'est-ce que tu aimes manger Les mots qu'on ne dit pas sont les fleurs du silence
Les mots qu'on ne dit pas sont les fleurs du silence Organisateur textuel pour commencer un texte
Organisateur textuel pour commencer un texte Dragibus calories
Dragibus calories Exemple texte expressif
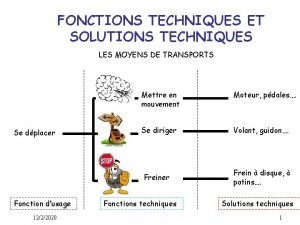
Exemple texte expressif Fonctions techniques et solutions techniques
Fonctions techniques et solutions techniques Les voitures les plus rapides du monde
Les voitures les plus rapides du monde Les paveurs van gogh
Les paveurs van gogh Voorzetselvoorwerp
Voorzetselvoorwerp Einde van de les
Einde van de les Trappe van vergelyking gelukkig
Trappe van vergelyking gelukkig Behoud van impuls
Behoud van impuls Het stokske van johan van oldenbarnevelt
Het stokske van johan van oldenbarnevelt Wet van behoud van gedoe
Wet van behoud van gedoe Gambar model implementasi van meter dan van horn
Gambar model implementasi van meter dan van horn Gambar model implementasi van meter dan van horn
Gambar model implementasi van meter dan van horn Dwarsdoorsnede van de stengel van een zonnebloem
Dwarsdoorsnede van de stengel van een zonnebloem Van social y van privado
Van social y van privado 1 joule
1 joule Uit welke stadia bestaat de levenscyclus van een koolwitje
Uit welke stadia bestaat de levenscyclus van een koolwitje Wybrecht van waerwyck
Wybrecht van waerwyck Kernplasma
Kernplasma Pronounce van gogh
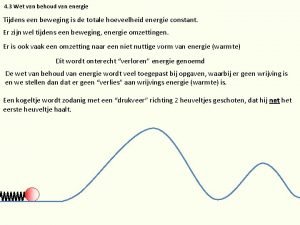
Pronounce van gogh Wet van behoud van energie
Wet van behoud van energie Kelly magelis
Kelly magelis Therapeutic riding lesson plan examples
Therapeutic riding lesson plan examples Kraigher kristofferson
Kraigher kristofferson Ann naylor
Ann naylor Kelly mc hills
Kelly mc hills Kelly criterion continuous distribution
Kelly criterion continuous distribution Classic vs exertional heat stroke
Classic vs exertional heat stroke