Hoofdstuk 3 Kelly van Helden 3 2 elektrisch













































































- Slides: 86

Hoofdstuk 3 Kelly van Helden

3. 2 elektrisch geleidingsvermogen • Een stof kan stroom geleiden: – De stof moet bestaan uit geladen deeltjes – De geladen deeltjes moeten vrij kunnen bewegen

Onderscheid in stoffen 1. Moleculaire stoffen 2. Zouten (opgebouwd uit ionen) 3. Metalen

Welke stoffen geleiden niet? • • Gedestilleerd water Alcohol Hout perspex Moleculaire stoffen (bestaan uit niet-metalen): Dit komt doordat deze stoffen geen vrije elektronen bevatten!!

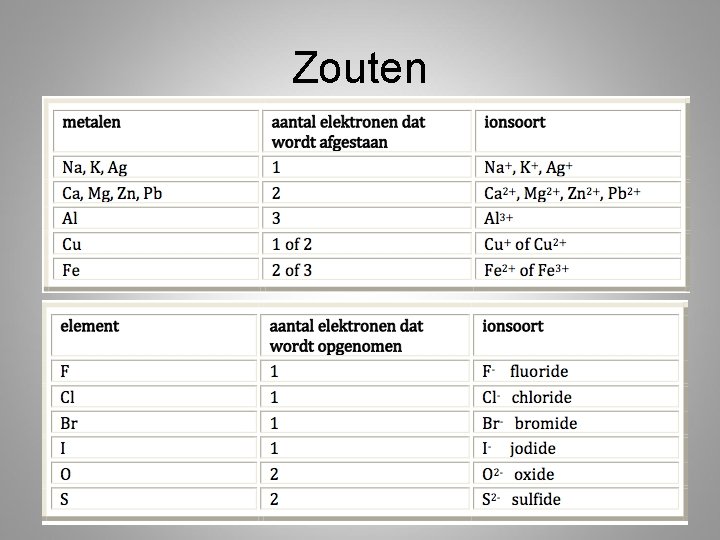
Zouten • Stoffen opgebouwd uit positieve en negatieve ionen

Zouten bestaan uit: een metaal en een niet-metaal • Natrium en Chloor – Natrium staat steeds 1 elektron af – Chloor neemt steeds 1 elektron op • Er ontstaat Natriumchloride (keukenzout)

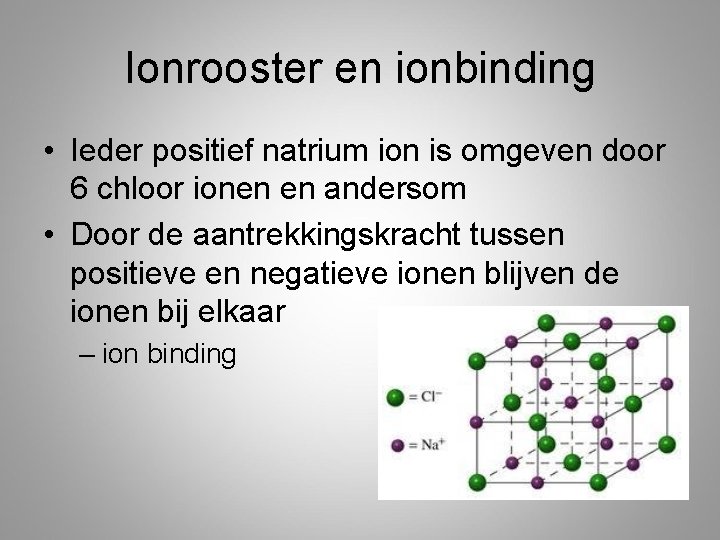
Ionrooster en ionbinding • Ieder positief natrium ion is omgeven door 6 chloor ionen en andersom • Door de aantrekkingskracht tussen positieve en negatieve ionen blijven de ionen bij elkaar – ion binding

Metalen • Eigenschappen van metalen – Glanzend uiterlijk – Hoog smeltpunt – Geleiden goed warmte – Geleiden elektrische stroom – Goed vervormbaar door walsen en smeden – In gesmolten toestand goed te mengen

Even terug • IJzer atoomnummer 26 • Aantal protonen is dus: 26 (positief) • Aantal elektronen is dus: 26 (negatief) • IJzer staat graag 2 elektronen af • Dan krijgt ijzer een lading van: +2 • Dat is het ijzer ion

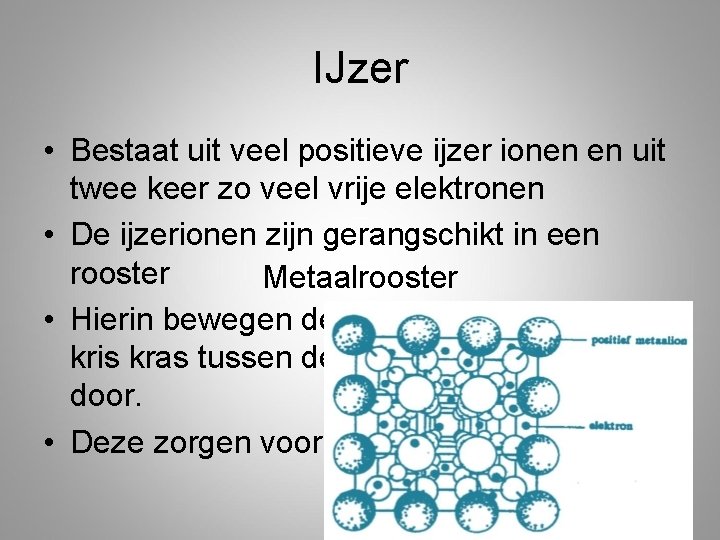
IJzer • Bestaat uit veel positieve ijzer ionen en uit twee keer zo veel vrije elektronen • De ijzerionen zijn gerangschikt in een rooster Metaalrooster • Hierin bewegen de vrije elektronen zich kris kras tussen de positieve ijzerionen door. • Deze zorgen voor de binding

Metaalrooster • Bestaat dus uit positieve metaalionen en uit vrije elektronen die voor de binding (metaalbinding) in het rooster zorgen • Wanneer het metaal aangesloten wordt op stroom gaan alle elektronen dezelfde kant op – De beweging van vrije elektronen wordt gericht

Overzicht Moleculaire stoffen Zouten Metalen Bestaan alleen uit nietmetalen Bestaan uit een metaal en een niet-metaal Bestaan alleen uit metalen Geleiden nooit stroom Geleiden stroom wanneer opgelost in water Geleiden altijd stroom Atoombinding Ionbinding Metaalbinding Molecuulrooster Ionrooster Metaalrooster

Huiswerk • Opdracht: 2 t/m 16 – Niet maken: 8, 11, 12, 15

Hoofdstuk 3 Les 2

Planning • Huiswerk nakijken • Theorie • Huiswerk

Huiswerk nakijken 2. Stof moet bestaan uit geladen deeltjes moeten vrij kunnen bewegen 3. Moleculaire stoffen, zouten en metalen 4. a. deze hebben geladen deeltjes b. metaal en niet-metaal c. metalen 5. Bij plastic kan geen stroom door en schrikdraad wel.

6. ionrooster, molecuulrooster en metaalrooster 7. overeenkomst: beide een rooster met positieve deeltjes Verschil: metaalrooster heeft vrije elektronen bij zouten zitten die vast 9. De positieve en negatieve deeltjes in het rooster van het zout trekken elkaar aan als deze verschuiven komt positief bij positief en negatief bij negatief en breekt het. Bij metalen is dit niet.

10. a. een legering is een mengsel van metalen b. Wanneer koolstof ingebouwd wordt in ijzer. Wanneer er weinig koolstof ingebouwd wordt heet het staal zit er veel koolstof in heet het gietijzer 13. Moleculaire stof bestaat alleen uit niet metalen. Zouten uit metaal en niet-metaal en metalen alleen uit metalen 14. Verbinding is een zuivere stof die uit meerdere atomen bestaat (H 2 O) een element is een zuivere stof die uit 1 soort atomen bestaat (O )

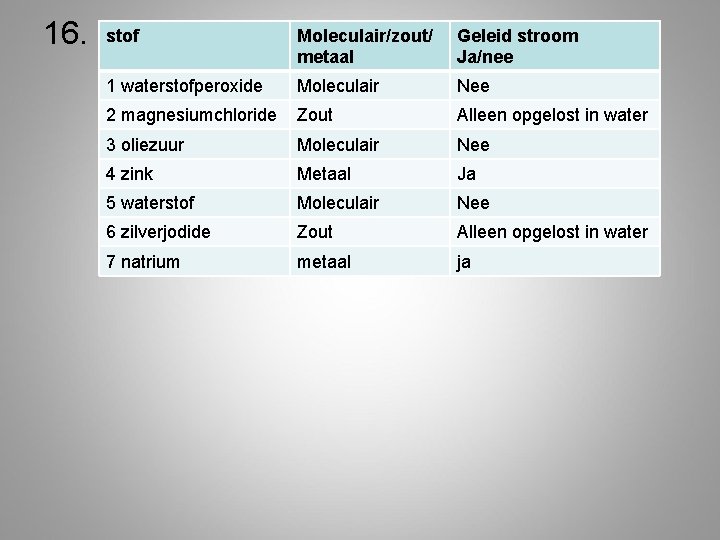
16. stof Moleculair/zout/ metaal Geleid stroom Ja/nee 1 waterstofperoxide Moleculair Nee 2 magnesiumchloride Zout Alleen opgelost in water 3 oliezuur Moleculair Nee 4 zink Metaal Ja 5 waterstof Moleculair Nee 6 zilverjodide Zout Alleen opgelost in water 7 natrium metaal ja

3. 3 structuurformules en namen van moleculaire stoffen • Molecuul bestaat altijd uit 2 of meer atomen • Altijd niet-metalen • Covalentie

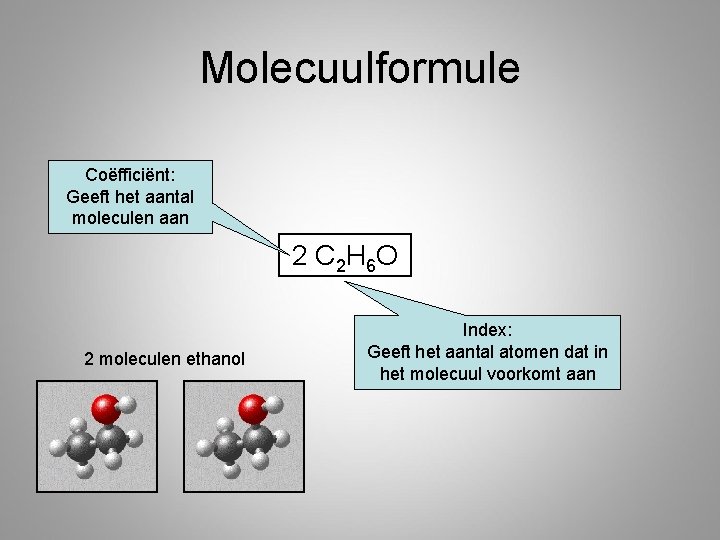
Molecuulformule Coëfficiënt: Geeft het aantal moleculen aan 2 C 2 H 6 O 2 moleculen ethanol Index: Geeft het aantal atomen dat in het molecuul voorkomt aan

Atoombinding • Covalentie: het aantal elektronen dat een atoom beschikbaar heeft voor de atoombinding

Atoombinding Er zijn ook atomen die meer dan een covalentie hebben. Bijvoorbeeld: Zwavel (S) covalentie 2, 4 en 6

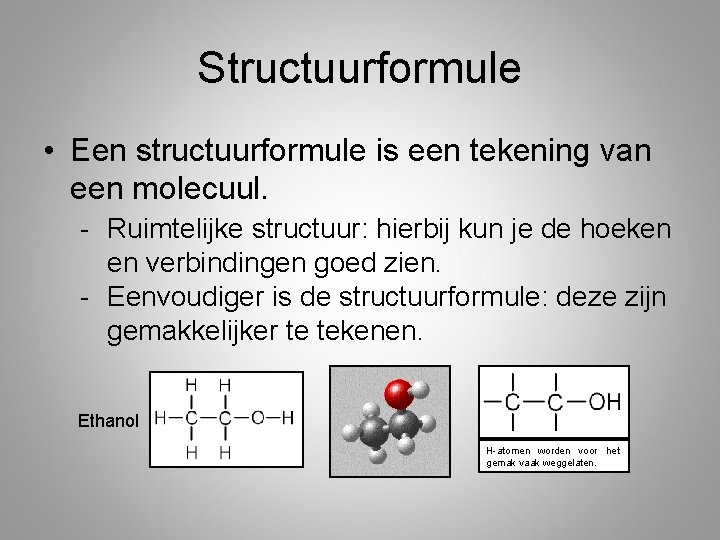
Structuurformule • Een structuurformule is een tekening van een molecuul. - Ruimtelijke structuur: hierbij kun je de hoeken en verbindingen goed zien. - Eenvoudiger is de structuurformule: deze zijn gemakkelijker te tekenen. Ethanol H-atomen worden voor het gemak vaak weggelaten.

Structuurformule • Dubbele bindingen • Drievoudige bindingen

Index en naamgeving Index Voorvoegsel 1 Mono 2 Di 3 Tri 4 Tetra 5 Penta 6 Hexa

Naamgeving • H 2 O – Diwaterstofmono-oxide • P 2 O 5 – Difosforpenta-oxide • Monostikstofdioxide – NO 2

huiswerk • Opdracht: 21 t/m 33 • Niet maken: 22, 26, 29.

Hoofdstuk 3 Les 3

Planning • Huiswerk nakijken • Theorie • Huiswerk maken

Huiswerk nakijken 21. De covalentie van een atoom van een niet-metaal komt overeen met het aantal bindingen dat het atoom kan vormen. 23. Natrium is een metaal en alleen niet metalen hebben een covalentie. 24. De structuurformule geeft aan welke atomen in een molecuul van die stof aanwezig zijn en hoe ze met elkaar verbonden zijn.

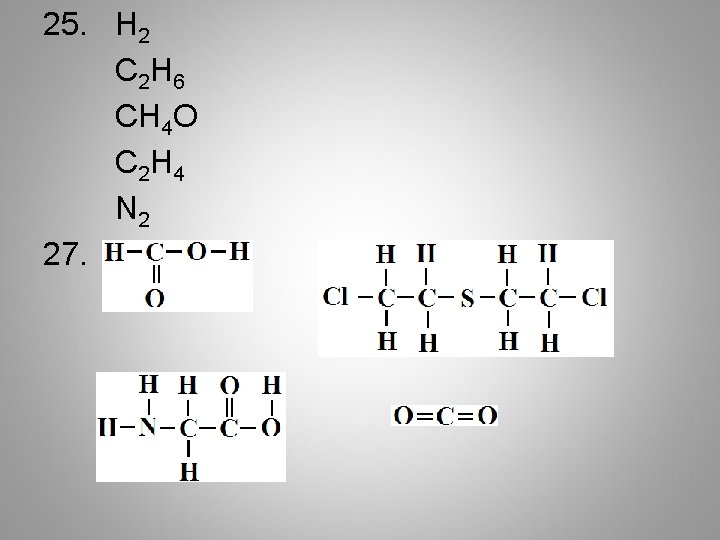
25. H 2 C 2 H 6 CH 4 O C 2 H 4 N 2 27.

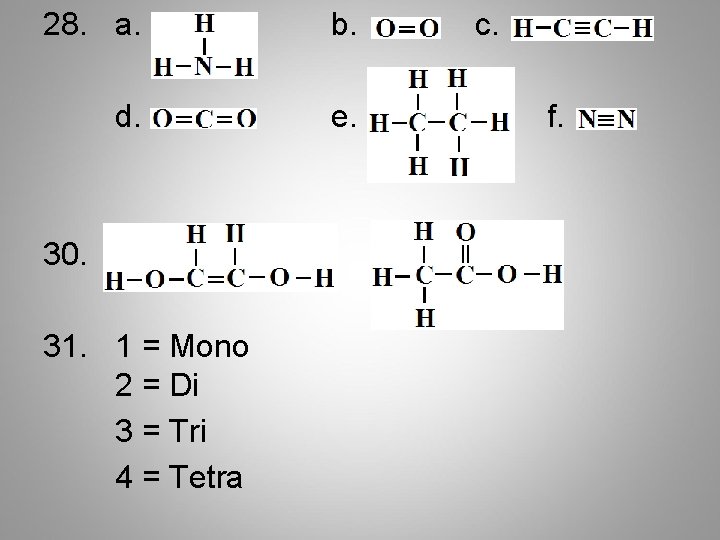
28. a. b. d. e. 30. 31. 1 = Mono 2 = Di 3 = Tri 4 = Tetra c. f.

32. a. (mono)Koolstofmono-oxide b. Zwaveldi-oxide c. Koolstofdi-oxide d. Zwaveltri-oxide e. Di-fosfortri-oxide f. Di-stikstoftetra-oxide 33. a. H 2 O b. PCl 3 c. Si. O 2 d. H 2 O 2 e. N 2 O 4 f. Si. Cl 4

3. 4 Reactievergelijkingen

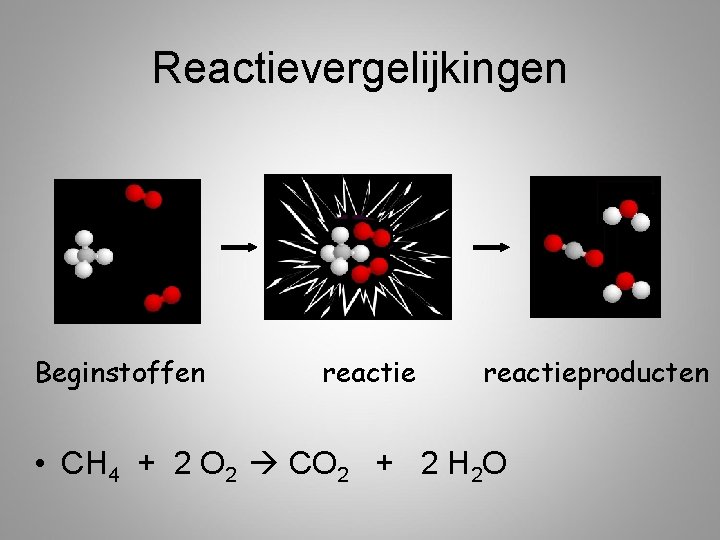
Chemische Reactie • Beginstof • Reactieproduct

Reactievergelijking • Beginstof reactieproduct • Beginstof + beginstof reactieproduct • Beginstof reactieproduct + reactieproduct

In woorden • Bij de verbranding van suiker in zuivere zuurstof komen alleen water en koolstofoxide gas vrij. • Hoe zou je dit opschrijven?

Nog een paar. . . • Bij de ontleding van koperjodide poeder komt jood en koper vrij. • Voor de vorming van vast ijzersulfide moet je zwavel en ijzer in een mortier goed mengen.

Fasen • Stoffen kunnen uit verschillende fasen bestaan: – Vast (s) – Vloeibaar (l) – Gas (g) – Opgelost in water (aq)

Nu met molecuulformules • Bij de vorming van ijzersulfide heb je telkens 1 atoom ijzer (Fe) en 1 atoom zwavel (S) nodig • Fe (s) + S (s) Fe. S (s)

Regels! • Voor de pijl moeten even veel atomen per stof aanwezig zijn als na de pijl!!! • Tijdens een chemische reactie verdwijnen of ontstaan geen atomen. • De atomen worden alleen anders gerangschikt

Reactievergelijkingen Beginstoffen reactieproducten • CH 4 + 2 O 2 CO 2 + 2 H 2 O

Voorbeeld • Bij de reactie van natrium met zwavel ontstaat natriumsulfide (Na 2 S) • Na (s) + S (s) Na 2 S (s) • Niet kloppend!!!

Kloppend maken Na (s) + S (s) Na 2 S (s) voor de pijl na de pijl Na = 1 Na = 2 S = 1 2 Na (s) + S (s) Na 2 S (s) Het getal 2 wordt coëfficient genoemd

Nu zelf • Water ontleedt in waterstof (gas) en zuurstof (gas)

Vraag • P 2 O 5 P + O 2 • 2 P 2 O 5 4 P + 5 O 2 • H 2 O 2 H 2 O + O 2 • 2 H 2 O 2 2 H 2 O + O 2 • Ag. Cl Ag + Cl 2 • 2 Ag. Cl 2 Ag + Cl 2

Nu iets moeilijker • Bij de ontleding van koperjodide poeder komt jood en koper vrij. • 2 Cu. I (s) I 2 (l) + 2 Cu (s) • Bij de verbranding van suiker in zuivere zuurstof komen alleen water en koolstofoxide gas vrij. • C 6 H 12 O 6 (s) + 3 O 2 (g) 6 CO (g) + 6 H 2 O (l)

Huiswerk • Maak opdracht 34, 35, 37 t/m 40

Scheikunde Les 4

Oefenen met reactievergelijkingen • Maak de uitgedeelde blaadjes • Als je het huiswerk van vorige week nog niet af hebt dit ook af maken: opdracht 34, 35, 37 t/m 40

Scheikunde les 5

Planning • Huiswerk bespreken • Reactievergelijkingen zelf opstellen • Huiswerk maken

Huiswerk 34. Index is het getal wat de hoeveelheid atomen in een molecuul aangeeft en de coëfficiënt is het getal dat de hoeveelheid moleculen aan geeft. 35. Een reactievergelijking is een verkorte weergave van een reactie in formules. 37. a. hierbij komt altijd zuurstof voor de pijl b. is een beginstof en meerdere reactieproducten 38. Alleen de coëfficiënt

Opdracht 39 en 40 samen!

Valenties van metalen Metaal valentie Na, K, Ag (1) + Mg, Ba, Ca, Zn, Ni 2+ Al, Cr, Au 3+ Fe 2+ en 3+ Cu, Hg 1+ en 2+ Pb, Sn 2+ en 4+ Uitzondering: Waterstof (enige niet metaal) positieve valentie: H+

Valenties niet metalen Niet-metaal Valentie F, Cl, Br, I (1) - O, S 2 - N, P 3 -

Kruisregel • Valentie van het ene ion wordt index van het andere ion en omgekeerd! • VB: – A 3+: valentie ion A = 3+, dus index B = 3 – B 2 -: valentie ion B = 2+, dus index A= 2 – Formule is dan: A 2 B 3 • Wanneer je formule kan vereenvoudigen moet je dat doen!! – A 2 B 2 AB

Verbrandingsreacties • Verbranding is een reactie met zuurstof – Als er voldoende zuurstof aanwezig is spreken we van volledige verbranding – Is er te weinig zuurstof, dan spreken we van onvolledige verbranding

Volledige verbranding • Bij volledige verbranding van verbindingen met koolstof (C) komt koolstofdioxide (CO 2) vrij. • Bij volledige verbranding van verbindingen met waterstof (H) komt water (H 2 O) vrij. • Bij volledige verbranding van verbindingen met zwavel (S) komt zwaveldioxide (SO 2) vrij.

Voorbeelden • 2 C 2 H 6 + 7 O 2 4 CO 2 + 6 H 2 O • CS 2 + 3 O 2 CO 2 + 2 SO 2 • 2 H 2 S + 3 O 2 2 SO 2 + 2 H 2 O

Onvolledige verbranding • Bij onvolledige verbranding van koolwaterstoffen komt vrij: – koolstof (C of roet) – Koolstofmono-oxide – allerlei andere verbindingen zoals Cx. Hy.

Ontleding en vorming • Ontleding is iets uit elkaar halen • Vorming is iets maken (bij elkaar doen)

Stoffen die je moet kennen!!! • • • Koolstofdioxide CO 2 Koolstofmonoxide CO Water H 2 O Ammoniak NH 3 Suiker C 6 H 12 O 6 Methaan CH 4

• • • De verbranding van suiker. De ontleding van koper(I)jodide. Het vormen vast ijzer(II)sulfide. Verbranding van methaan. Bij de reactie van natrium met zwavel ontstaat natriumsulfide. De ontleding van water. De verbranding van Magnesiumsulfide. De vorming van koper(II)chloride. De ontleding van aluminiumsulfide. De vorming van Ijzer(III)oxide. Opdracht 41

Scheikunde les 6

Planning • Huiswerk nakijken • Theorie (Hoofdstuk 4) • Huiswerk maken

Hoofdstuk 4 Moleculaire stoffen Wie zou dit drinken?

4. 1 Water, een bijzondere stof • Film: http: //www. youtube. com/watch? feature=play er_embedded&v=ivu 4 nlv. D_90

Vanderwaalskrachten • Aantrekkingskrachten tussen moleculen • Cohesie: aantrekkingskrachten tussen dezelfde moleculen • Adhesie: aantrekkingskrachten tussen verschillende moleculen

Vanderwaalskrachten Bij welke stof is de vanderwaalskracht het grootst? a. Alcohol b. Suiker c. Koolstofdioxide Bij welke stof het kleinst?

Hardheid • De hoeveelheid kalk opgelost in water – In hard water veel kalk opgelost – In zacht water weinig kalk opgelost • Bij verhitten slaat kalk neer • In graden Duitse hardheid – (°d. H) – 7, 1 mg per °d. H/ per liter

p. H • Maat voor aantal H+-ionen wat in een oplossing aanwezig is • p. H van 1 tot 14 – 1 = zuur – 7 = neutraal – 14 = basisch (tegenovergestelde van zuur)

Hydrofiel/hydrofoob • Hydro = water • Fiel = houden van • Foob = vrezen • Hydrofiel = houdt van water – Lost dus makkelijk op in water (zout) • Hydrofoob = Houdt niet van water – Lost dus niet makkelijk op in water (Olie)

Geleidbaarheid • Mate waarin een waterige oplossing stroom geleid • Hoeveelheid H+ deeltjes (dus zuur) • Hoeveelheid zouten • In μS/cm (micro. Siemens per centimeter)

Waterstof bruggen • NH • OH

Zelf aan de slag • • Opdracht 1 a t/m e (blz 105) Opdracht 1 h (blz 105) Opdracht 2, 4, 6 a t/m d, 8, 9 (blz 108) Opdracht 10, 11, 12, 14 (Blz 111) Extra informatie voor de opdrachten: 273 K = 0 ⁰C

Scheikunde les 7

Planning • • Huiswerk nakijken Herhaling Vragen stellen Volgende week toets!!!

Huiswerk 1. a. In zuiver water zitten geen zouten. Zouten zorgen ervoor dat water stroom kan geleiden. b. Water bestaat uit waterstof en zuurstof, dit zijn beide niet-metalen dus een moleculaire stof. c. De covalentie van O is 2 en de covalentie van H is 1 d. H-O-H e. Door het delen van een elektronenpaar

1. h. 2 H 2 O 2 H 2 + O 2 2. De vanderwaalsbinding bij moleculen ontstaat door de vanderwaalskrachten 4. De temperatuur heeft invloed op de sterkte van de vanderwaalsbinding b. De vanderwaalsbinding wordt verbroken wanneer een stof verdampt. Dus bij het kookpunt van een stof. 6. a. C en S zijn beide niet-metalen dus is CS 2 een moleculaire stof b. S=C=S

6 c. 273 K = 0 ⁰C (273+20) 293 = 20 ⁰C Dus deze stof is vloeibaar d. de vanderwaalsbinding verbreekt bij koken 8. Als een stof oplost worden de vanderwaalsbindingen verbroken en ontstaan er nieuwe vanderwaalsbindingen tussen de moleculen van de opgeloste stof en het oplosmiddel.

9. a. 273 K = 0 ⁰C 168 K = -105 ⁰C 353 K = 80 ⁰C b. De covalentie moet dus 4 zijn. c. De vanderwaalsbindingen verbreken bij SOCl 2 en bij benzeen en ze maken nieuwe vanderwaalsbindingen aan tussen deze twee stoffen. d. De atoombindingen en de vanderwaalsbindingen.

10. a. Waterstofbruggen zijn bindingen die ontstaan tussen moleculen waarin OH groepen en/of NH groepen aanwezig zijn. b. Een waterstofbrug is sterker dan een vanderwaalsbinding c. OH of NH groepen. 11. Omdat water in vaste vorm in een vast rooster zit en dus niet kan bewegen zoals bij vloeibaar water 12. a. 4 b. Dichtheid is kleiner doordat er ruimtes ontstaan bij ijs.

14. Methaan bevat geen OH of NH groep waardoor deze geen waterstofbruggen kan vormen.

Herhalen en vragen stellen • Volgende week toets!!!
 Needleman-wunsch
Needleman-wunsch Jacques van helden
Jacques van helden Jacques van helden
Jacques van helden Jacques van helden
Jacques van helden Jacques van helden
Jacques van helden Samenvatting belofte van pisa
Samenvatting belofte van pisa Wir sind helden wiki
Wir sind helden wiki Hoofdstuk 4 wiskunde havo 4
Hoofdstuk 4 wiskunde havo 4 Samenvatting bespiegeling hoofdstuk 9 massacultuur
Samenvatting bespiegeling hoofdstuk 9 massacultuur Hoofdstuk 3
Hoofdstuk 3 Veldsterkte symbool
Veldsterkte symbool Joint drehmaschine elektrisch
Joint drehmaschine elektrisch Hoofdstuk in een opera
Hoofdstuk in een opera Aardrijkskunde hoofdstuk 2 havo 4
Aardrijkskunde hoofdstuk 2 havo 4 Radiaal veld
Radiaal veld Hoofdstuk 6
Hoofdstuk 6 Wiskunde 3 havo
Wiskunde 3 havo Heinrich hertz 1887
Heinrich hertz 1887 Noughts and crosses chapter 11 summary
Noughts and crosses chapter 11 summary Badehilfen haßfurt
Badehilfen haßfurt Relais symbool
Relais symbool Symbolen elektrische stroomkring
Symbolen elektrische stroomkring Elektrisch geleidingsvermogen
Elektrisch geleidingsvermogen Trappe van vergelyking opgewonde
Trappe van vergelyking opgewonde Gambar model implementasi van meter dan van horn
Gambar model implementasi van meter dan van horn Van social y van privado
Van social y van privado Kernplasma
Kernplasma Wet van behoud van impulsmoment
Wet van behoud van impulsmoment Gambar model implementasi van meter dan van horn
Gambar model implementasi van meter dan van horn Szfaja
Szfaja Van go or van goff
Van go or van goff Het stokske van johan van oldenbarnevelt
Het stokske van johan van oldenbarnevelt Stadia levenscyclus koolwitje
Stadia levenscyclus koolwitje Doorsnede wortel
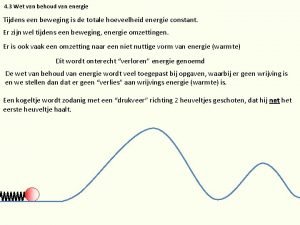
Doorsnede wortel Wet van behoud van energie
Wet van behoud van energie Wet van energiebehoud
Wet van energiebehoud Hak octroi
Hak octroi Kelly cristina vieira
Kelly cristina vieira Kelly riedell biology
Kelly riedell biology Emma castel
Emma castel Kelly proctor dnv
Kelly proctor dnv Kelly dau
Kelly dau Kelly loll
Kelly loll Kelly perales
Kelly perales George kelly kişisel yapılar kuramı
George kelly kişisel yapılar kuramı Ifas shared services
Ifas shared services Dr kelly kasteel
Dr kelly kasteel Simile about sadness
Simile about sadness Dr claire kelly
Dr claire kelly Annie chapman
Annie chapman Personal construct theory george kelly
Personal construct theory george kelly Stansbury functional chew in technique
Stansbury functional chew in technique Welcome thursday
Welcome thursday Howard kelly y el vaso de leche
Howard kelly y el vaso de leche Wilson rib spreader
Wilson rib spreader Kelly wahl ucla
Kelly wahl ucla Kelly magelis
Kelly magelis Kelly kasteel
Kelly kasteel Kelly clarkson neurologist
Kelly clarkson neurologist Dağarcık ızgara tekniği
Dağarcık ızgara tekniği Kelly brown actor
Kelly brown actor Tiny home community las vegas
Tiny home community las vegas Kelly forese
Kelly forese Professor mike kelly
Professor mike kelly Kelly rizzi
Kelly rizzi Construction corollary
Construction corollary Camp joy apopka
Camp joy apopka Maurie kelly
Maurie kelly Dr edward kelly
Dr edward kelly Kelly criterion
Kelly criterion Kelly hoppen facts
Kelly hoppen facts Kelly global logistics
Kelly global logistics Kelly mc hills
Kelly mc hills Kelly doran md
Kelly doran md Kelly yeomans
Kelly yeomans Kelly eom
Kelly eom Greg kelly calculus
Greg kelly calculus Brian kelly email address
Brian kelly email address Walden iop
Walden iop Matthew kelly facebook
Matthew kelly facebook Vickie kelly
Vickie kelly Vicky kelly
Vicky kelly Heamangioma
Heamangioma Curley's wife description
Curley's wife description Kelly reidell
Kelly reidell Kelly scott md
Kelly scott md Kelly king dibble
Kelly king dibble