Allosztrikus fehrjk mkdsi mechanizmus modelljei Szimmetria modell v












- Slides: 45

Allosztérikus fehérjék működési mechanizmus modelljei Szimmetria modell (v. concerted hipotézis) 1965 Jacques MONOD-Jeffries WYMANJean-Pierre CHANGEUX MWC-modell Szekvenciális hipotézis KOSHLAND-NÉMETHY-FILMER KNF-modell

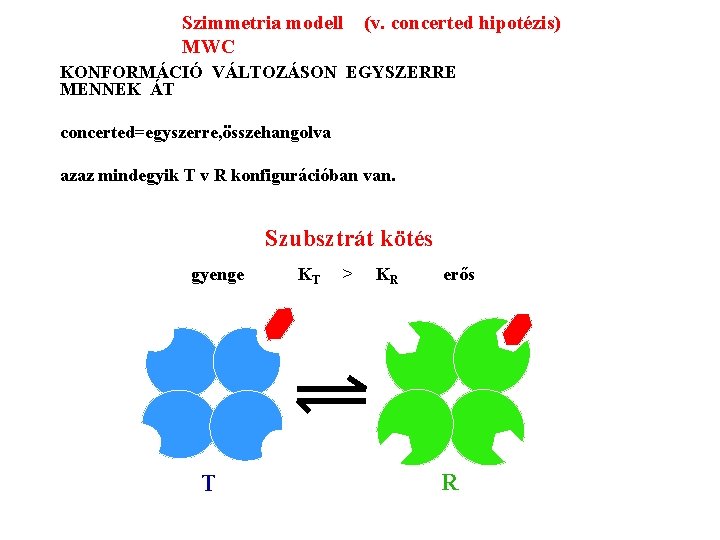
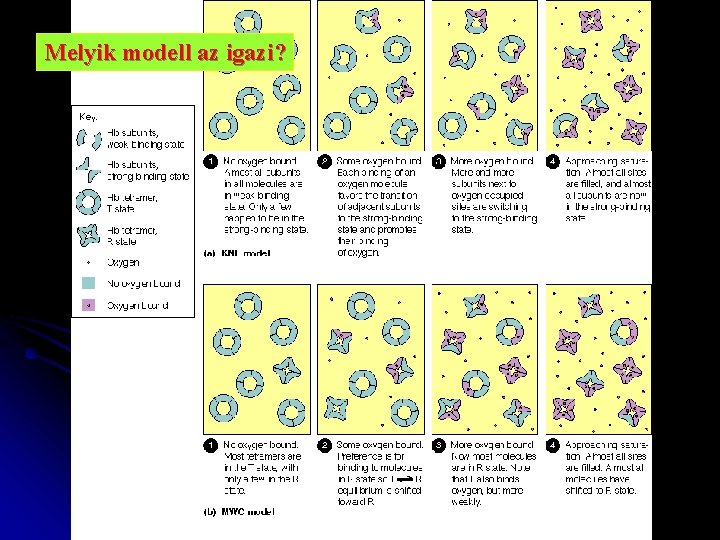
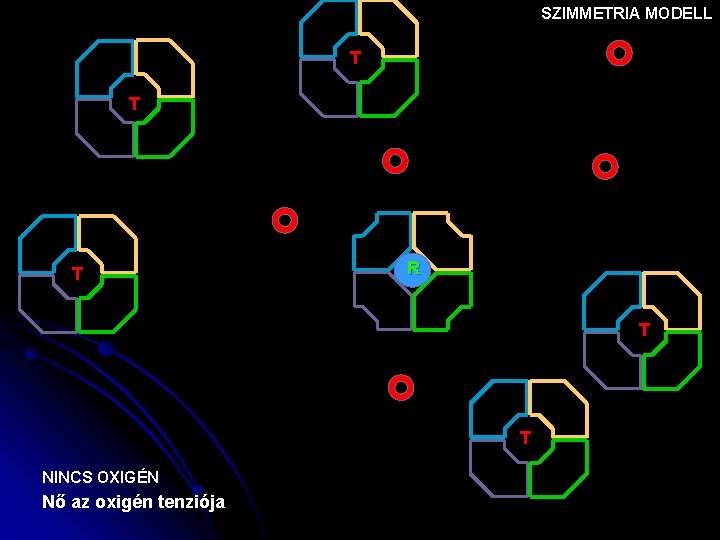
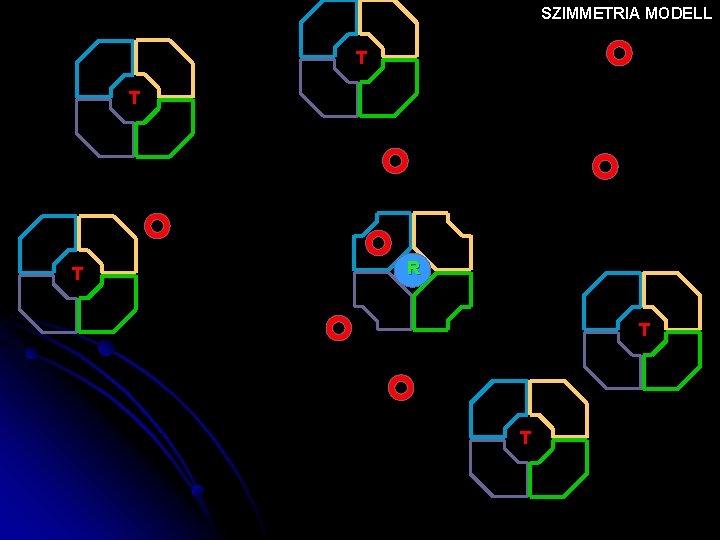
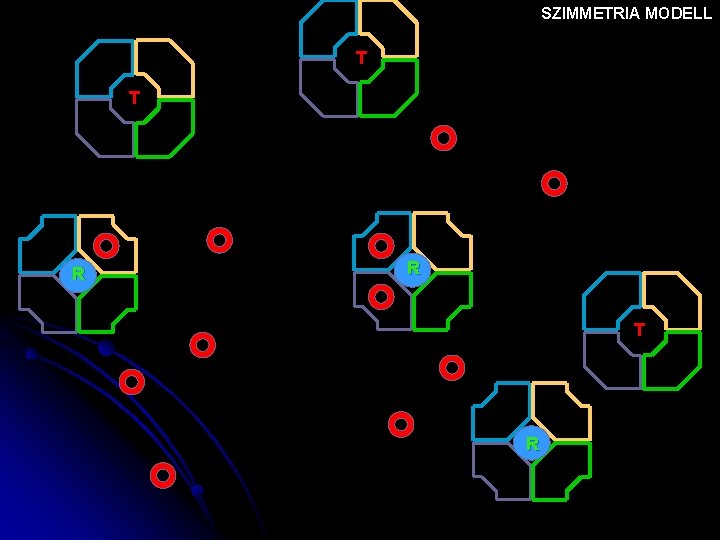
Szimmetria modell (v. concerted hipotézis) MWC ALLOSZTÉRIKUS FEHÉRJÉK EGYSÉGEI: AZONOS PROTOMEREK pl. Hemoglobin 2 x 2 azonos protomerből áll EGY PROTOMER EGY AKTÍV HELYET TARTALMAZ A PROTOMER KÉT KONFORMÁCIÓBAN LÉTEZHET: T(ight) R(elaxed) A LIGANDUM MINDKETTŐHÖZ KÖTŐDHET A KONFORMÁCIÓ VÁLTOZÁS MEGVÁLTOZTATJA AZ AFFINITÁSÁT A LIGANDUMHOZ MINDKÉT FORMA MEGŐRZI AZ OLIGOMER MOLEKULÁRIS SZIMMETRIÁJÁT (=vagy csak R, vagy csak T)

Szimmetria modell MWC (v. concerted hipotézis) KONFORMÁCIÓ VÁLTOZÁSON EGYSZERRE MENNEK ÁT concerted=egyszerre, összehangolva azaz mindegyik T v R konfigurációban van. Szubsztrát kötés gyenge T KT > KR erős R

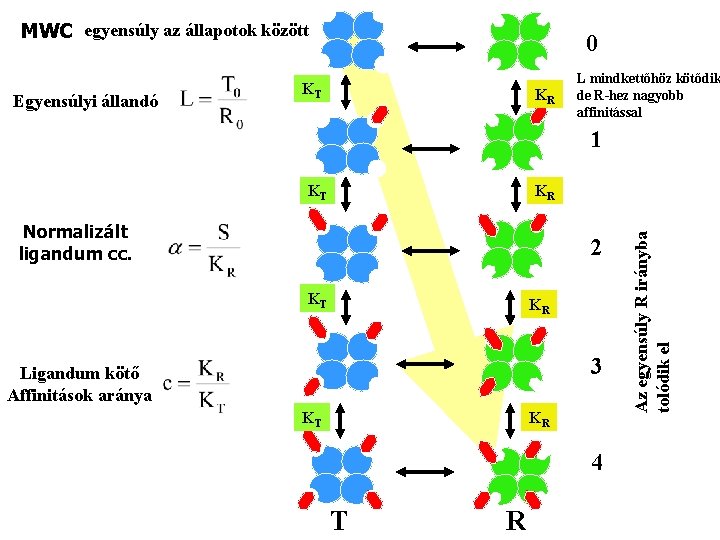
MWC egyensúly az állapotok között Egyensúlyi állandó 0 KT KR L mindkettőhöz kötődik de R-hez nagyobb affinitással 1 KR Normalizált ligandum cc. 2 KT KR 3 Ligandum kötő Affinitások aránya KT KR 4 T R Az egyensúly R irányba tolódik el KT

ADAIR-egyenlet n kötőhelyre Homotrop kooperativitásnál Heterotrop kooperativitásnál

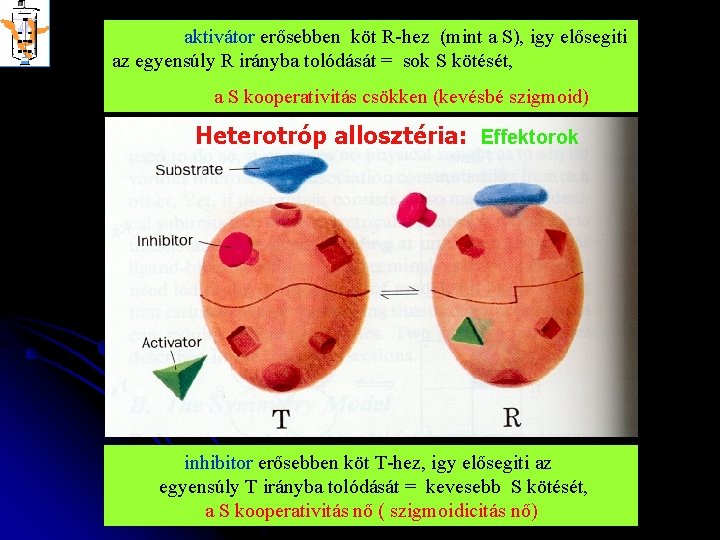
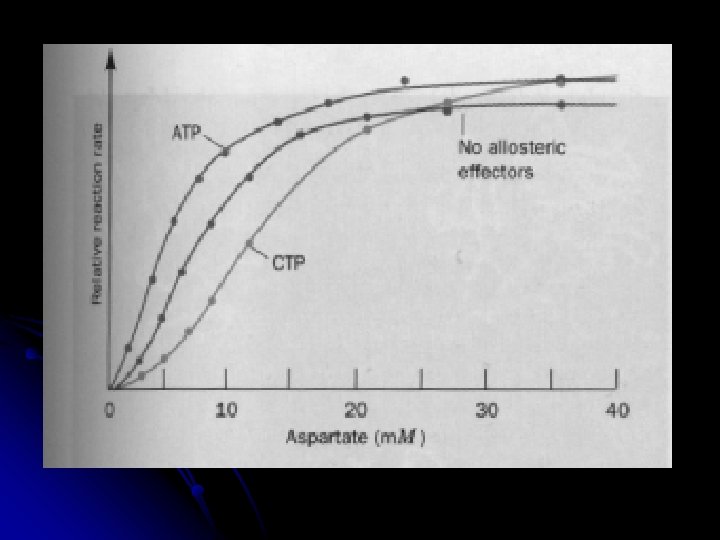
aktivátor erősebben köt R-hez (mint a S), igy elősegiti az egyensúly R irányba tolódását = sok S kötését, a S kooperativitás csökken (kevésbé szigmoid) Heterotróp allosztéria: Effektorok inhibitor erősebben köt T-hez, igy elősegiti az egyensúly T irányba tolódását = kevesebb S kötését, a S kooperativitás nő ( szigmoidicitás nő)

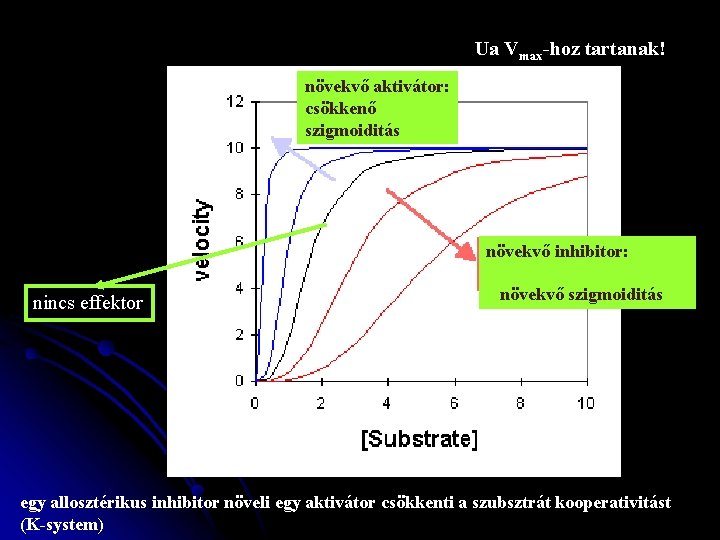
Ua Vmax-hoz tartanak! növekvő aktivátor: csökkenő szigmoiditás növekvő inhibitor: nincs effektor növekvő szigmoiditás egy allosztérikus inhibitor növeli egy aktivátor csökkenti a szubsztrát kooperativitást (K-system)

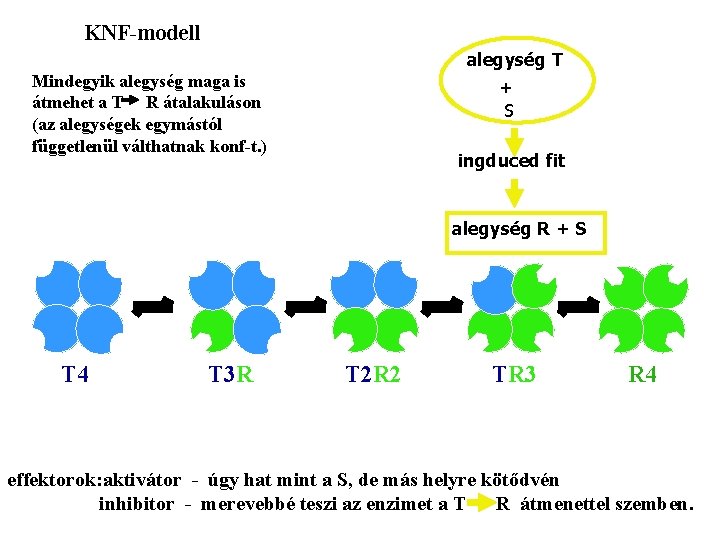
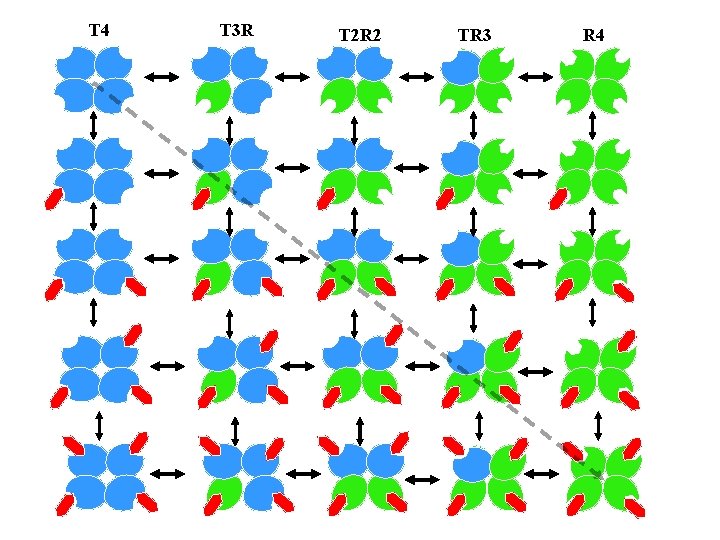
KNF-modell alegység T Mindegyik alegység maga is átmehet a T R átalakuláson (az alegységek egymástól függetlenül válthatnak konf-t. ) + S ingduced fit alegység R + S T 4 T 3 R T 2 R 2 TR 3 R 4 effektorok: aktivátor - úgy hat mint a S, de más helyre kötődvén inhibitor - merevebbé teszi az enzimet a T R átmenettel szemben.

T 4 T 3 R T 2 R 2 TR 3 R 4

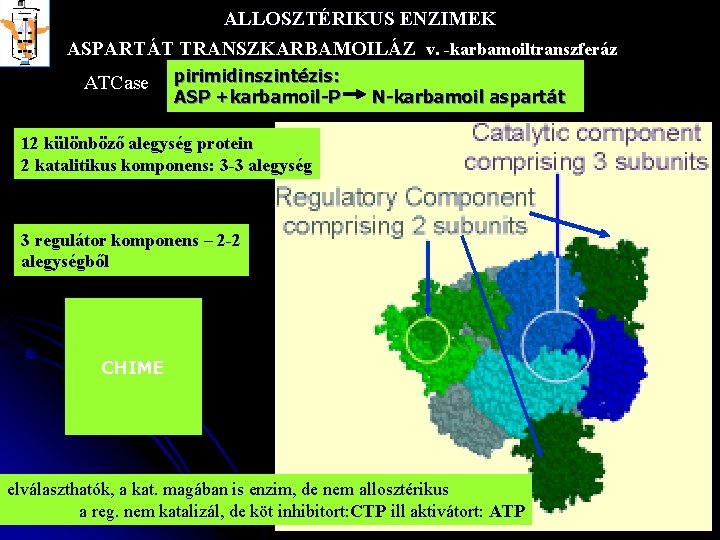
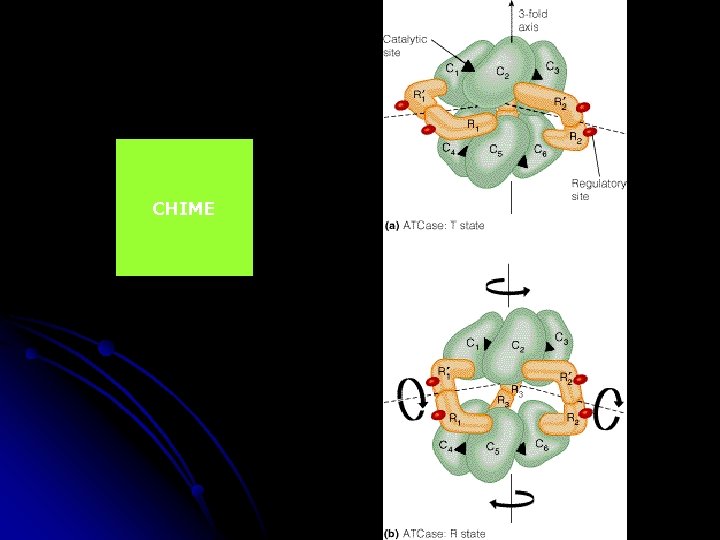
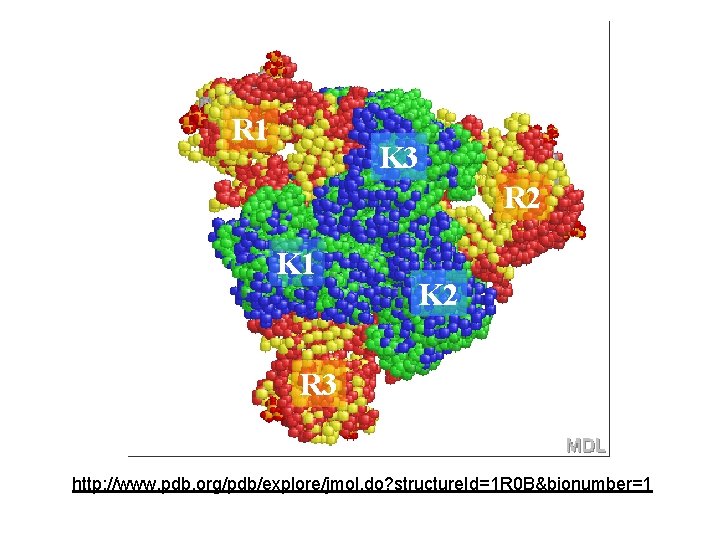
ALLOSZTÉRIKUS ENZIMEK ASPARTÁT TRANSZKARBAMOILÁZ v. -karbamoiltranszferáz ATCase pirimidinszintézis: ASP +karbamoil-P N-karbamoil aspartát 12 különböző alegység protein 2 katalitikus komponens: 3 -3 alegység 3 regulátor komponens – 2 -2 alegységből CHIME elválaszthatók, a kat. magában is enzim, de nem allosztérikus a reg. nem katalizál, de köt inhibitort: CTP ill aktivátort: ATP

CHIME

http: //www. pdb. org/pdb/explore/jmol. do? structure. Id=1 R 0 B&bionumber=1

R 1 K 3 R 2 K 1 K 2 R 3 http: //www. pdb. org/pdb/explore/jmol. do? structure. Id=1 R 0 B&bionumber=1


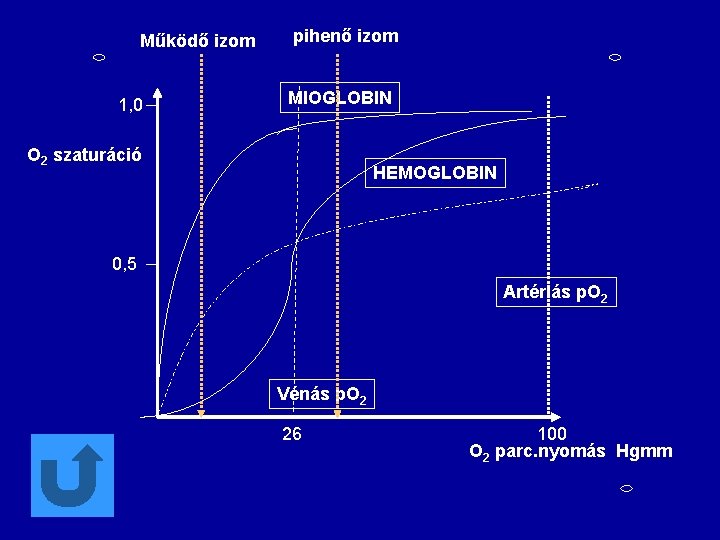
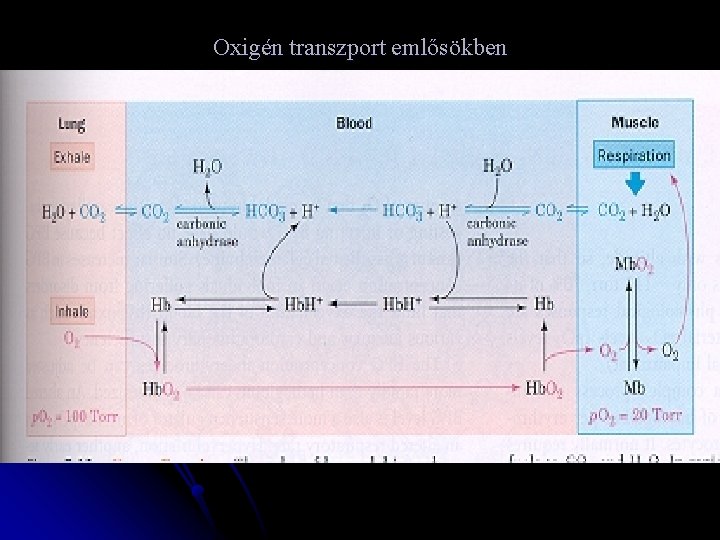
Hemoglobin l l Az allosztéria klasszikus példája Hemoglobin és myoglobin : oxigén transzport és tároló proteinek Oxigén kötési görbék: hemoglobinra és myoglobinra Myoglobin -- monomer; 153 aa, 17, 200 Ms Hemoglobin -- tetrameric 2 α 141 AS 2 β 146

Működő izom 1, 0 pihenő izom MIOGLOBIN O 2 szaturáció HEMOGLOBIN 0, 5 Artériás p. O 2 Vénás p. O 2 26 100 O 2 parc. nyomás Hgmm


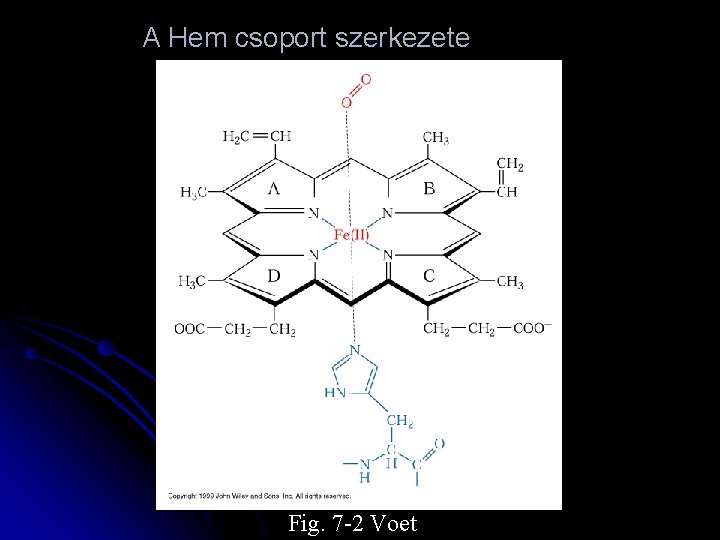
A Hem csoport szerkezete Fig. 7 -2 Voet

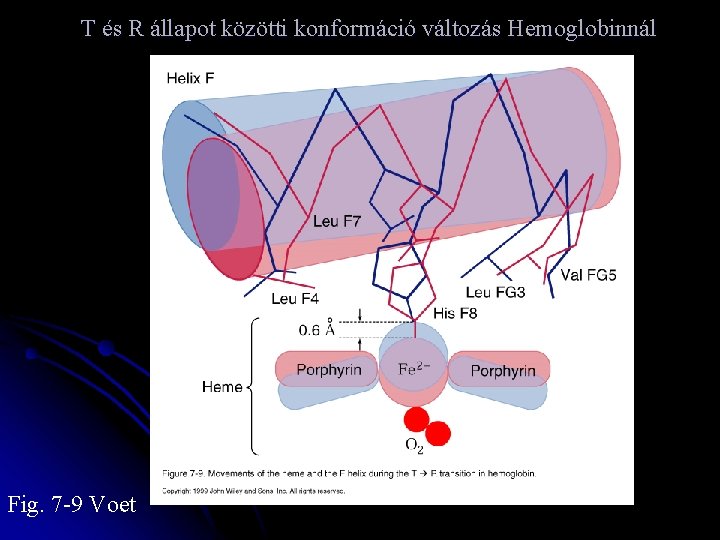
T és R állapot közötti konformáció változás Hemoglobinnál Fig. 7 -9 Voet

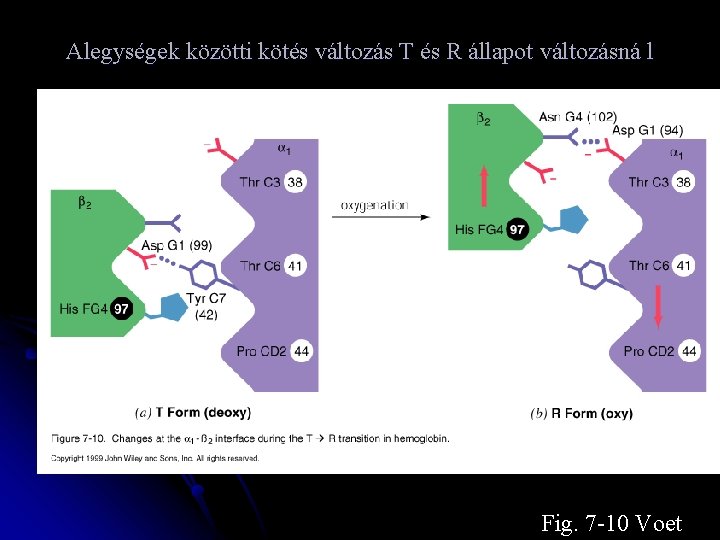
Alegységek közötti kötés változás T és R állapot változásná l Fig. 7 -10 Voet


Melyik modell az igazi?

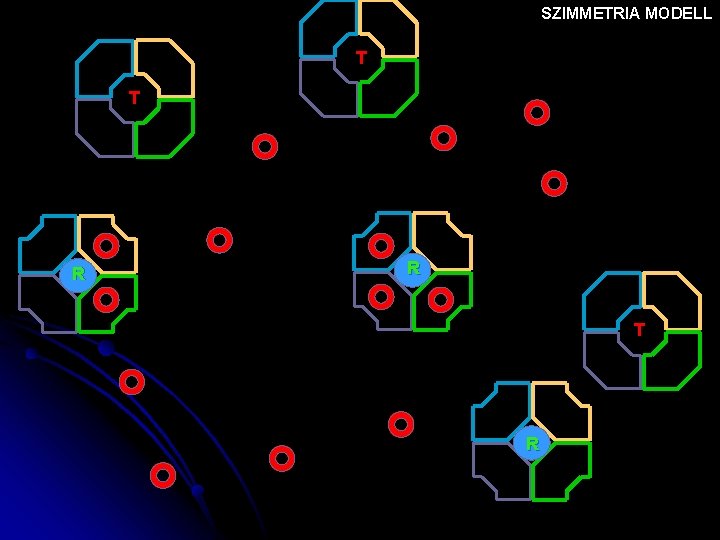
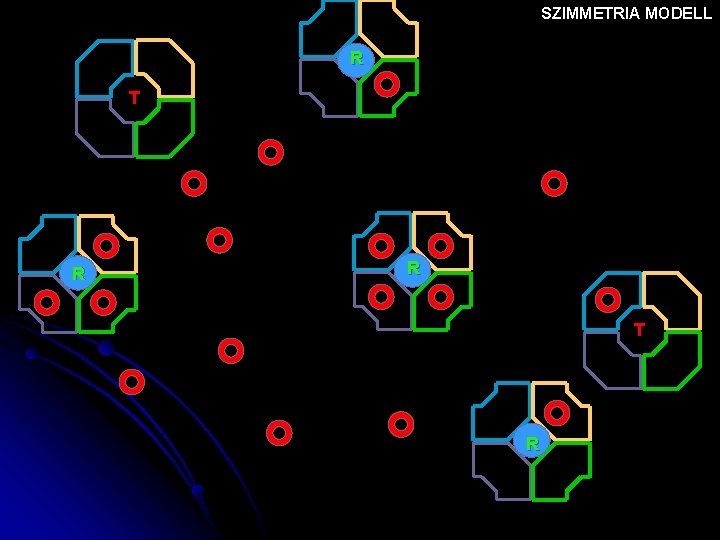
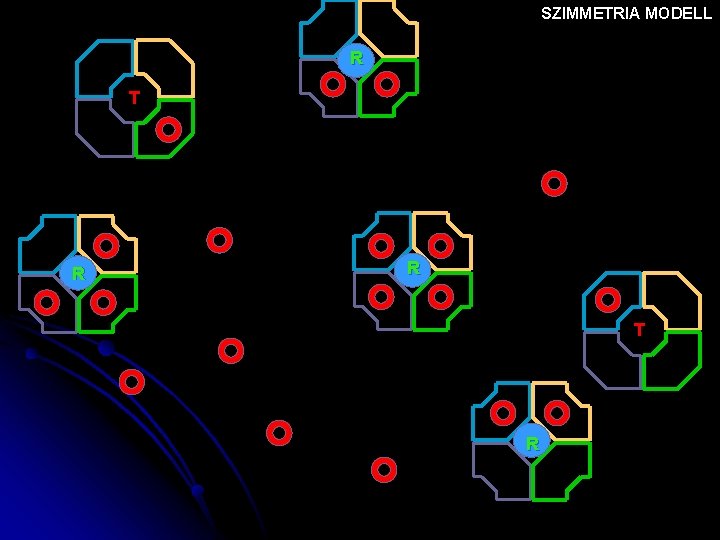
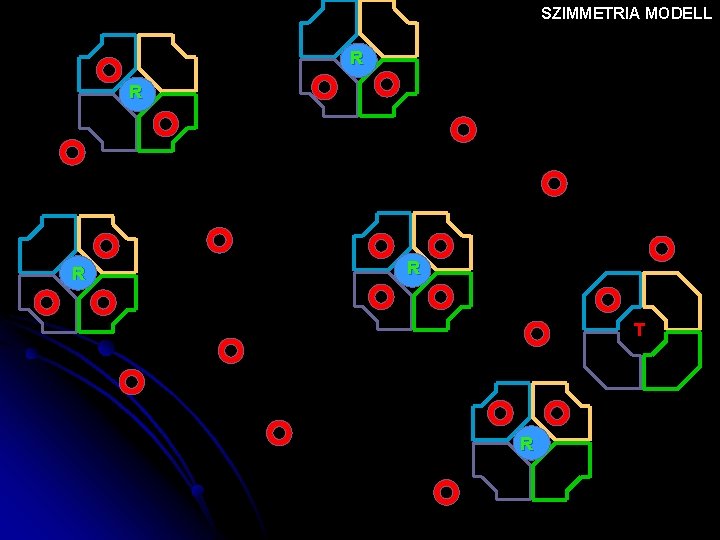
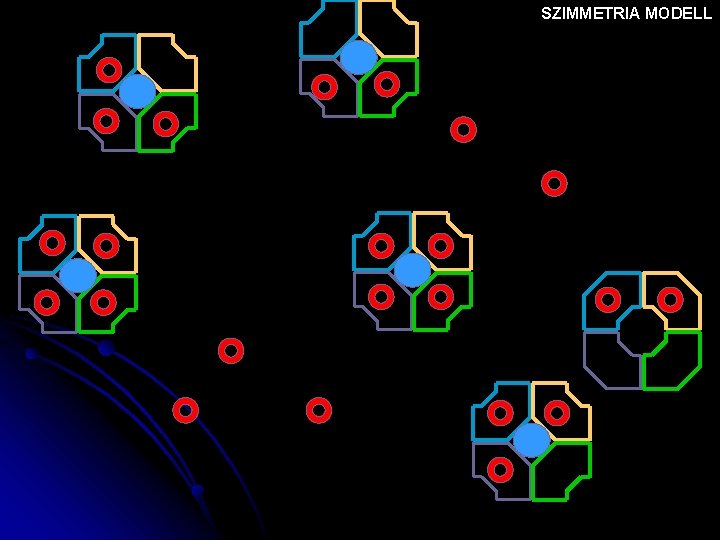
SZIMMETRIA MODELL T T T R T T NINCS OXIGÉN Nő az oxigén tenziója

SZIMMETRIA MODELL T T T R T T

SZIMMETRIA MODELL T T R R T R

SZIMMETRIA MODELL T T R R T R

SZIMMETRIA MODELL R T R

SZIMMETRIA MODELL R T R

SZIMMETRIA MODELL R R T R

SZIMMETRIA MODELL



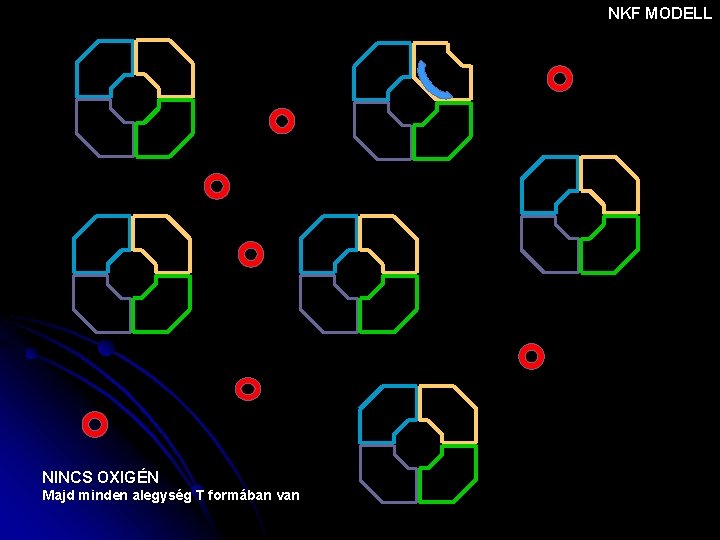
NKF MODELL NINCS OXIGÉN Majd minden alegység T formában van

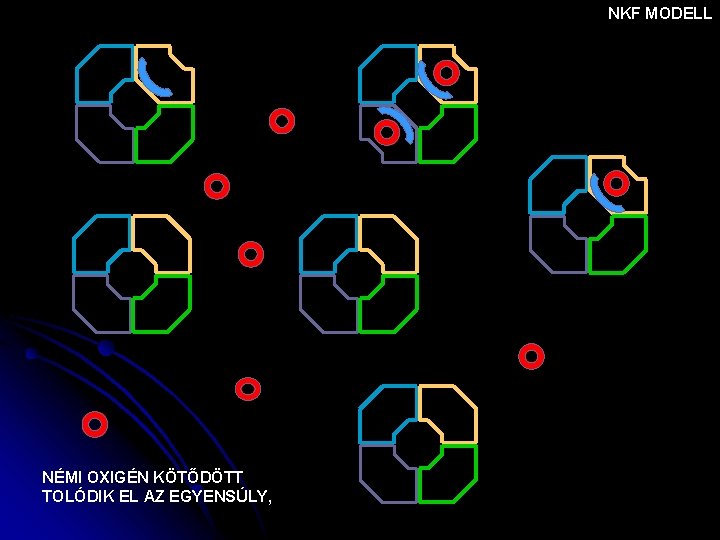
NKF MODELL NÉMI OXIGÉN KÖTŐDÖTT TOLÓDIK EL AZ EGYENSÚLY,

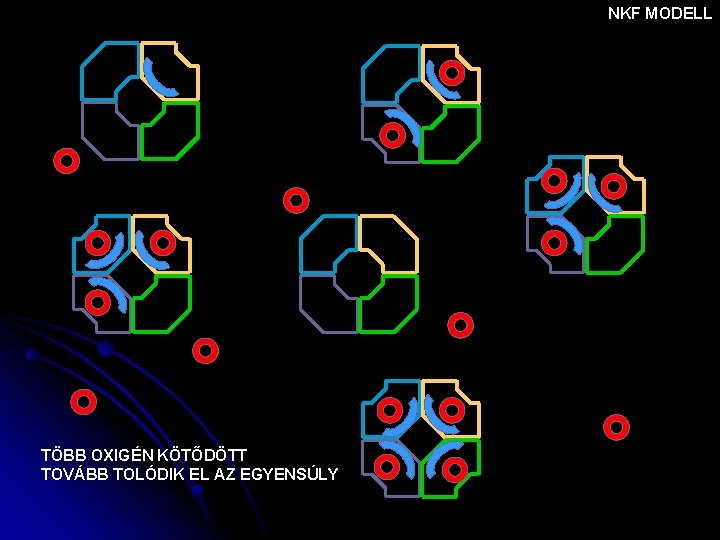
NKF MODELL TÖBB OXIGÉN KÖTŐDÖTT TOVÁBB TOLÓDIK EL AZ EGYENSÚLY

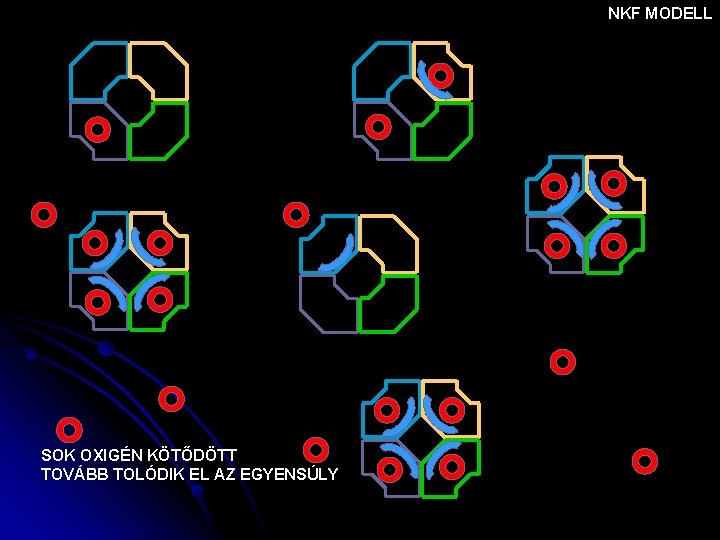
NKF MODELL SOK OXIGÉN KÖTŐDÖTT TOVÁBB TOLÓDIK EL AZ EGYENSÚLY

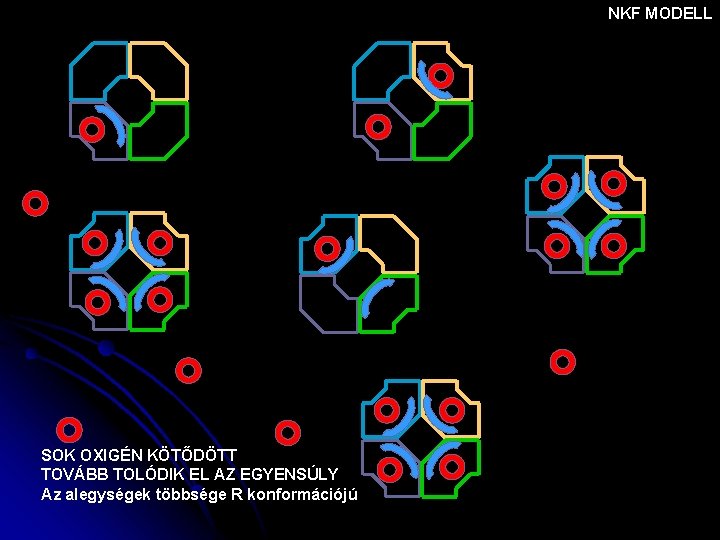
NKF MODELL SOK OXIGÉN KÖTŐDÖTT TOVÁBB TOLÓDIK EL AZ EGYENSÚLY Az alegységek többsége R konformációjú


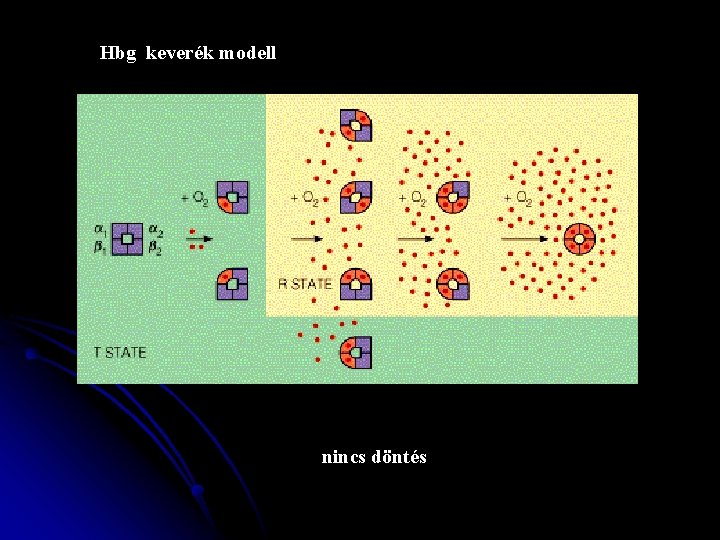
Hbg keverék modell nincs döntés

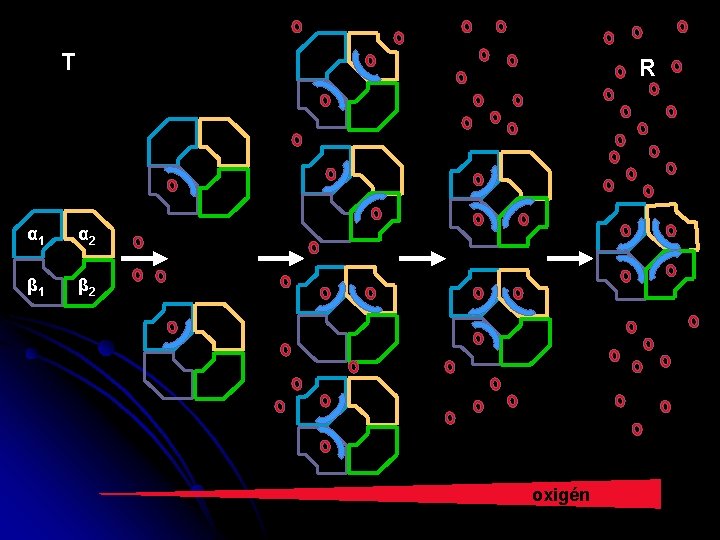
T R α 1 α 2 β 1 β 2 oxigén

Oxigén transzport emlősökben


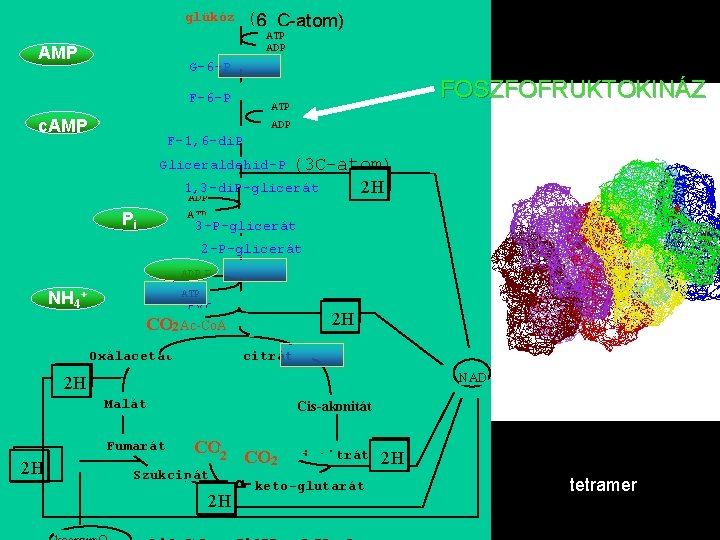
glükóz (6 C-atom) ATP ADP AMP G-6 -P FOSZFOFRUKTOKINÁZ F-6 -P ATP Mg 2+ c. AMP ADP F-1, 6 -di. P Gliceraldehid-P (3 C-atom) 1, 3 -di. P-glicerát 2 H ADP Pi 2 H ATP 3 -P-glicerát 2 -P-glicerát ADP PEP NH 4+ PEP ATP Pyr CO 2 Ac-Co. A Oxálacetát 2 H 2 H 2 H citrát NAD 2 H Malát 2 H 2 H NAD Cis-akonitát Fumarát CO 2 Szukcinát 2 H 2 H i-citrát 2 H a- keto-glutarát 2 H tetramer


 Kulisszás mechanizmus
Kulisszás mechanizmus I typ diastolickej dysfunkcie
I typ diastolickej dysfunkcie Trh a trhový mechanizmus
Trh a trhový mechanizmus Tengelyesen és középpontosan szimmetrikus alakzatok
Tengelyesen és középpontosan szimmetrikus alakzatok Kitinkutikula
Kitinkutikula Tükörkép szerkesztése
Tükörkép szerkesztése ősszáj
ősszáj Tengeri sün váz
Tengeri sün váz Sugaras szimmetria
Sugaras szimmetria Ewim modell
Ewim modell Sip modell
Sip modell Basis überbau modell
Basis überbau modell Strukturális modell
Strukturális modell Redisztributív
Redisztributív Trommsdorff-modell
Trommsdorff-modell Mazsolás puding modell
Mazsolás puding modell Polynomregression
Polynomregression Lalonde modell
Lalonde modell Anforderung ressourcen modell
Anforderung ressourcen modell Thomas kilmann modell
Thomas kilmann modell Behaviorismus
Behaviorismus Peplau model
Peplau model Kirkpatricks modell
Kirkpatricks modell V-modell xt projektassistent
V-modell xt projektassistent Boomerang modell unterricht
Boomerang modell unterricht Sunshine model leininger
Sunshine model leininger Termékhagyma modell
Termékhagyma modell Rosinen kuchen modell
Rosinen kuchen modell Kontinuum modell
Kontinuum modell Tcp/ip modell
Tcp/ip modell Dpsir modell
Dpsir modell Mrn document
Mrn document Erőforrás elemzés
Erőforrás elemzés Sharpe féle modell
Sharpe féle modell Tqm modell
Tqm modell Nkt 65§
Nkt 65§ Jupiter arlanda
Jupiter arlanda Forgóeszköz gazdálkodás
Forgóeszköz gazdálkodás Roman jakobson modell
Roman jakobson modell Health belief modell fallbeispiel
Health belief modell fallbeispiel Kirkpatricks modell
Kirkpatricks modell Abc stress management
Abc stress management Osi modell erklärung
Osi modell erklärung Ambiguitätstoleranz krappmann
Ambiguitätstoleranz krappmann Modell deklination
Modell deklination Vsepr modell
Vsepr modell