Physik GFS Die historische Entwicklung des Atommodells Von












- Slides: 14

Physik - GFS: Die historische Entwicklung des Atommodells Von Verena und Julia

Die Anfänge der Atomphysik Schon im antiken Griechenland Gedanken über den Aufbau und Ursprung aller Materie. 17. Jahrhundert: Atombegriff mit den Naturwissenschaften verunden Newton: Atome sind Träger von Anzeihungskräften Ende 18. Jahrhundert: Atomtheorie neu aufgegriffen Elemente verbinden sich nur in bestimmten ganzzahligen Verhältnissen zu Molekülen Dalton entwickelte erstes und einfachstes Atommodell

Das Rosinenteigmodell von Thomson 18. Dezember 1956 in Cheetham Hill geboren Mit 28 Jahren Professor am Cavendish-Laboratorium Bestimmte das Verhältnis der Elektronenladung zur Elektronenmasse –> eigentlicher Entdecker des Elektrons Weiterführung des Modells von Dalton

„Rosinen-Kuchen-Modell“ Elektronen müssen wegen der Stabilität regelmäßig angeordnet sein

Das Dynamidenmodell von Lenard: 1862 in Pressburg geboren In Budapest und Wien Naturwissenschaft studiert 1883 Studium in Heidelberg In Bonn Assistent von Heinrich Herz Hauptsächlich gewidmet den Unteruchungen über Kathodenstrahl

1892 Entwicklung der Entladungsröhre Atome müssen aus Bausteinen aufgebaut sein, die gleiche Masse und gleiche Fähigkeiten haben Elektronenstrahlen abzuschwächen Widerspruch bezüglich seiner Erkenntnisse Entwickelte Dynamidenmodell

Das Kern-Hülle-Modell von Rutherford Am 30. August 1871 in Neuseeland geboren Studium an Universität von Neuseeland und Cambridge Schüler von Thomson Arbeit über elektromagnetische Felder Entdeckte Alpha- und Beta-Strahlung Erklärte „das Wesen der Radioaktivität - Nobelpreis für Chemie 1906 Streuversuch mit Geiger und Marsden in Manchester

Unbekannt: Anordnung der Teilchen im Atom Goldfolie mit Alpha-Teilchen bestrahlt (Heliumionen) Radioaktiv; hinterlassen schwarze Flecken auf einem photographischen Film und helle Flecken auf einem Leuchtschirm Der Großteil der Geschosse durchdrang dir Goldfolie ohne Ablenkung

Nach unerwarteten Erkenntnissen neue Überlegung zum Atommodell Teilchen, die eine größere Masse haben als Alpha. Teilchen Muss trotz großer Masse sehr klein sein, sonst wäre es nicht möglich, dass die meisten Alpha-Teilchen geradlinig durch die Atome fliegen

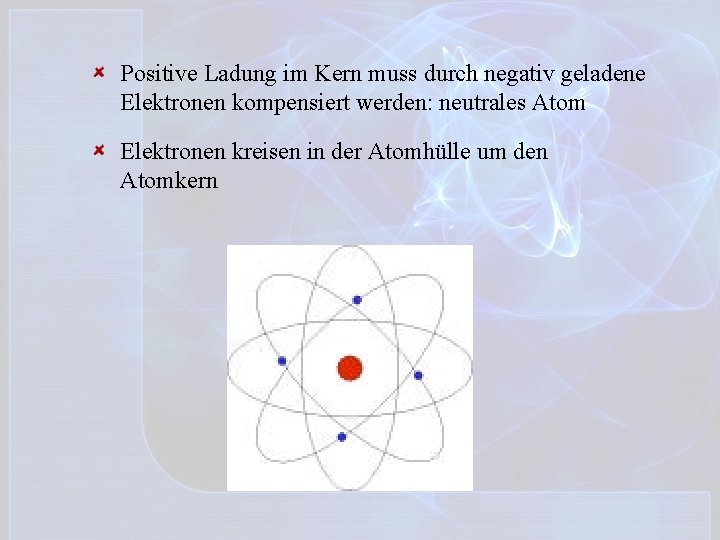
Positive Ladung im Kern muss durch negativ geladene Elektronen kompensiert werden: neutrales Atom Elektronen kreisen in der Atomhülle um den Atomkern

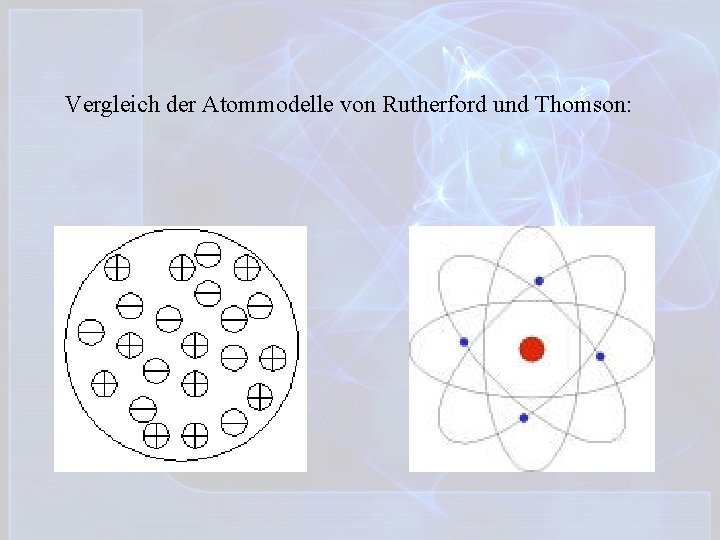
Vergleich der Atommodelle von Rutherford und Thomson:

Das Schalenmodell von Bohr Nach diesem Modell können keine stabilen Atome existieren 7. Oktober 1885 in Kopenhagen geboren Studierte in Kopenhagen Forschungsarbeiten über die Oberflächenspannung von Wasser und die Eigenschaften von Metallen Kernphysikstudium in Cambridge Elektronen existieren nur auf bestimmten Kreisbahnen In Manchester Arbeit mit Rutherford

Elektron besitzt für jede Bahn bestimmte Energie Springt Elektron von äußerer Bahn auf innere – das gibt Energie in Form definierter Strahlungsfrequenz (z. B. Linie im sichtbaren Spektrum) frei Springt Elektron von innere auf äußere Bahn – das braucht „portionierte“ Energiezufuhr von aussen

Verbesserte das Kern-Hülle-Modell von Rutherford Zusammenbruch eines Atoms durch Energieabgabe nicht möglich Erstmalige Erklärung des Linienspektrums eines Wasserstoffatoms