ACTUALITES DANS LA MALADIE DE CHARCOTMARIETOOTH Rencontres francochiliennes



























- Slides: 42

ACTUALITES DANS LA MALADIE DE CHARCOT-MARIE-TOOTH Rencontres franco-chiliennes de neurologie Valparaiso, 14 mars 2008 Dr Odile Dubourg Consultation de pathologie neuro-musculaire, GHPS, Paris, France

Introduction • La plus fréquente des maladies neuromusculaires héréditaires • Groupe de maladies très hétérogènes au plan génétique • Le phénotype clinique est relativement homogène • Les gènes en cause codent pour des protéines impliqués dans des fonctions cellulaires très diverses • La conséquence commune est une perte axonale longueurdépendante

La classification prend en compte… • Le mode de transmission • Les résultats de l’examen électroneuromyographique • Le gène muté

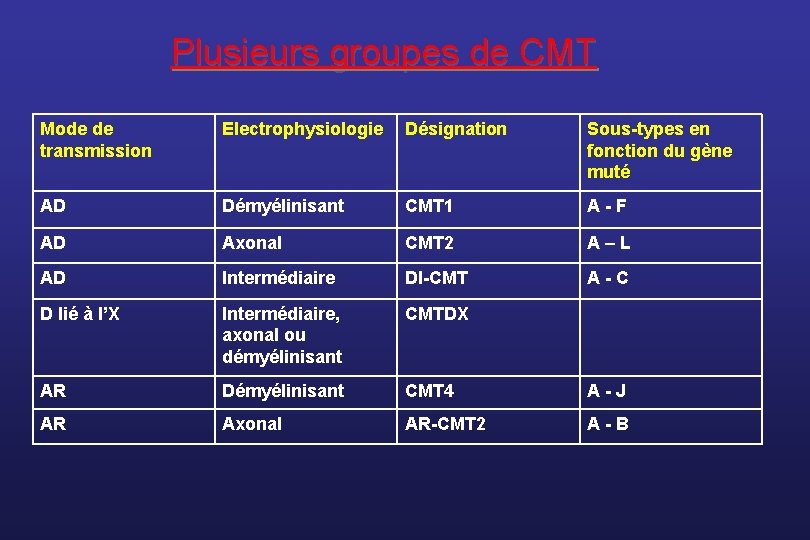
Plusieurs groupes de CMT Mode de transmission Electrophysiologie Désignation Sous-types en fonction du gène muté AD Démyélinisant CMT 1 A-F AD Axonal CMT 2 A–L AD Intermédiaire DI-CMT A-C D lié à l’X Intermédiaire, axonal ou démyélinisant CMTDX AR Démyélinisant CMT 4 A-J AR Axonal AR-CMT 2 A-B

Les difficultés de la classification • Certains gènes sont associés à des formes démyélinisantes, intermédiaires ou axonales • Certains gènes sont associés à des formes axonales sensitivo-motrices ou purement motrices • Certains gènes sont associés à un mode de transmission autosomique dominant ou autosomique récessif

Les CMT démyélinisants autosomiques dominants ou CMT 1

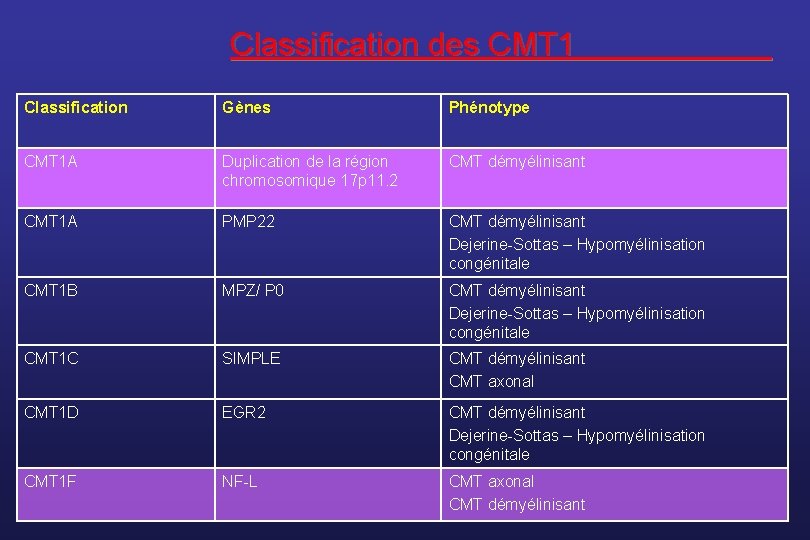
Classification des CMT 1 Classification Gènes Phénotype CMT 1 A Duplication de la région chromosomique 17 p 11. 2 CMT démyélinisant CMT 1 A PMP 22 CMT démyélinisant Dejerine-Sottas – Hypomyélinisation congénitale CMT 1 B MPZ/ P 0 CMT démyélinisant Dejerine-Sottas – Hypomyélinisation congénitale CMT 1 C SIMPLE CMT démyélinisant CMT axonal CMT 1 D EGR 2 CMT démyélinisant Dejerine-Sottas – Hypomyélinisation congénitale CMT 1 F NF-L CMT axonal CMT démyélinisant

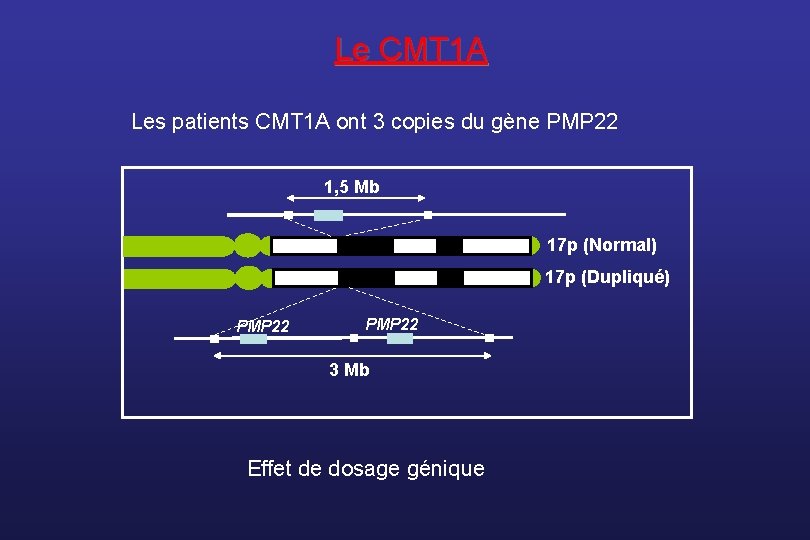
Le CMT 1 A Les patients CMT 1 A ont 3 copies du gène PMP 22 1, 5 Mb 17 p (Normal) 17 p (Dupliqué) PMP 22 3 Mb Effet de dosage génique

Modèle murin de CMT 1 A • Lignées de souris transgéniques C 22 (7 copies de PMP 22) (Huxley et al. , Hum Mol Genet, 1996) • Phénotype : motricité réduite, tremblement dès l’âge de un mois et demi chez la souris hétérozygote • Souris C 22 : < 20% des fibres Contrôles myélinisées à P 16 : > 80% (Robaglia-Schlupp et al. , Brain, 2002)

Effet de l’acide ascorbique sur les souris C 22 (Passage et al. , Nature Medecine, 2005) • Traitement à partir du 2ème mois avec une dose équivalente à 4 g pour un homme de 70 kg • Amélioration dès un mois de traitement sur : - mesures de coordination motrice (Rotarod) - mobilité (test de la poutre) - force musculaire (grip test) • Nerf sciatique (3 mois): remyélinisation • Diminution d’expression de PMP 22 chez souris traitées.

• Le premier essai thérapeutique dans la maladie de CMT Objectif : - Etudier les effets de l’acide ascorbique sur les symptômes de la maladie de Charcot-Marie-Tooth de type 1 A • Essai clinique de phase III • Schéma de l’étude : - Etude randomisée en double aveugle versus placebo sur 180 patients - Etude nationale multicentrique : Paris – Lyon – Marseille - 3 groupes (60/groupe) : placebo, AA 1 g/J, AA 3 g/J

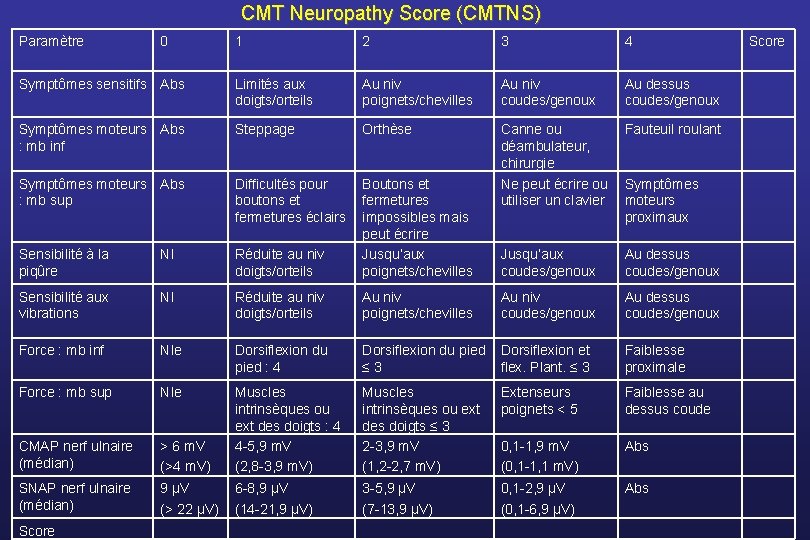
Critère principal de jugement CMT Neuropathy Score (Shy, Neurology 2005) • Score composite de 9 items • Fonctionnel (3 items), examen neurologique (4 items) et paramètres électrophysiologiques (2 items) • Echelle de 5 points [0 -4] • Score total entre 0 (asymptomatique) et 36 • Validée chez des patients CMT

CMT Neuropathy Score (CMTNS) Paramètre 1 2 3 4 Symptômes sensitifs Abs Limités aux doigts/orteils Au niv poignets/chevilles Au niv coudes/genoux Au dessus coudes/genoux Symptômes moteurs Abs : mb inf Steppage Orthèse Fauteuil roulant Symptômes moteurs Abs : mb sup Difficultés pour boutons et fermetures éclairs Sensibilité à la piqûre Nl Réduite au niv doigts/orteils Boutons et fermetures impossibles mais peut écrire Jusqu’aux poignets/chevilles Canne ou déambulateur, chirurgie Ne peut écrire ou utiliser un clavier Jusqu’aux coudes/genoux Au dessus coudes/genoux Sensibilité aux vibrations Nl Réduite au niv doigts/orteils Au niv poignets/chevilles Au niv coudes/genoux Au dessus coudes/genoux Force : mb inf Nle Dorsiflexion du pied : 4 Dorsiflexion du pied ≤ 3 Dorsiflexion et flex. Plant. ≤ 3 Faiblesse proximale Force : mb sup Nle Faiblesse au dessus coude > 6 m. V (>4 m. V) Muscles intrinsèques ou ext des doigts ≤ 3 2 -3, 9 m. V (1, 2 -2, 7 m. V) Extenseurs poignets < 5 CMAP nerf ulnaire (médian) Muscles intrinsèques ou ext des doigts : 4 4 -5, 9 m. V (2, 8 -3, 9 m. V) 0, 1 -1, 9 m. V (0, 1 -1, 1 m. V) Abs SNAP nerf ulnaire (médian) 9 µV (> 22 µV) 6 -8, 9 µV (14 -21, 9 µV) 3 -5, 9 µV (7 -13, 9 µV) 0, 1 -2, 9 µV (0, 1 -6, 9 µV) Abs Score 0 Symptômes moteurs proximaux Score

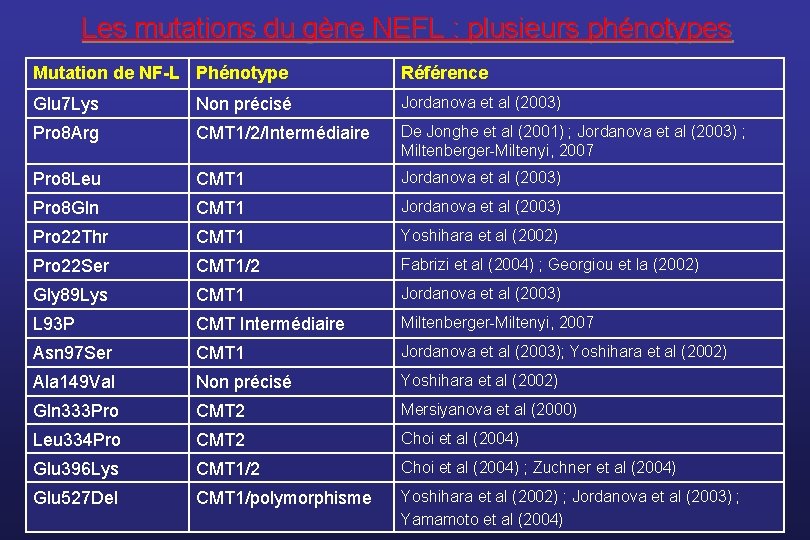
Le CMT 1 F/CMT 2 E • Le gène responsable a d’abord été identifié en 2000 dans une grande famille russe avec un CMT 2 (Mersiyanova et al, Am J Hum Genet); v âge début variable : enfance à 5ème décennie v évolution lente et progressive : CMT « classique » • Il code pour la protéine NF-L correspondant à la chaîne légère des neurofilaments ; • Par la suite, plusieurs familles ont été décrites avec un phénotype CMT 1 (Jordanova et al. , Brain, 2003); v âge de début précoce, toujours < 15 ans v parfois retard à la marche v correspond à un CMT sévère v fréquence : 2% des CMT

Les mutations du gène NEFL : plusieurs phénotypes Mutation de NF-L Phénotype Référence Glu 7 Lys Non précisé Jordanova et al (2003) Pro 8 Arg CMT 1/2/Intermédiaire De Jonghe et al (2001) ; Jordanova et al (2003) ; Miltenberger-Miltenyi, 2007 Pro 8 Leu CMT 1 Jordanova et al (2003) Pro 8 Gln CMT 1 Jordanova et al (2003) Pro 22 Thr CMT 1 Yoshihara et al (2002) Pro 22 Ser CMT 1/2 Fabrizi et al (2004) ; Georgiou et la (2002) Gly 89 Lys CMT 1 Jordanova et al (2003) L 93 P CMT Intermédiaire Miltenberger-Miltenyi, 2007 Asn 97 Ser CMT 1 Jordanova et al (2003); Yoshihara et al (2002) Ala 149 Val Non précisé Yoshihara et al (2002) Gln 333 Pro CMT 2 Mersiyanova et al (2000) Leu 334 Pro CMT 2 Choi et al (2004) Glu 396 Lys CMT 1/2 Choi et al (2004) ; Zuchner et al (2004) Glu 527 Del CMT 1/polymorphisme Yoshihara et al (2002) ; Jordanova et al (2003) ; Yamamoto et al (2004)

Les neurofilaments : constituants majeurs du cytosquelette axonal • Les neurofilaments font partie des filaments intermédiaires cytoplasmiques. • Ils sont formés par la copolymérisation de trois protéines : NF-L (62 k. D), NF-M (160 k. D) et NF-H (200 k. D). • Ils sont synthétisés dans le corps cellulaire et transportés dans l’axone. • Ils régulent le calibre axonal et la vitesse de conduction des nerfs périphériques. • Dans les GDR en culture, les protéines NF-L mutées : - perturbent l’assemblage et le transport axonal des neurofilaments - perturbent le transport des mitochondries vers les segments distaux de l’axone (Brownless et al. , Hum Mol Genet, 2002)

Les CMT axonaux autosomiques dominants ou CMT 2

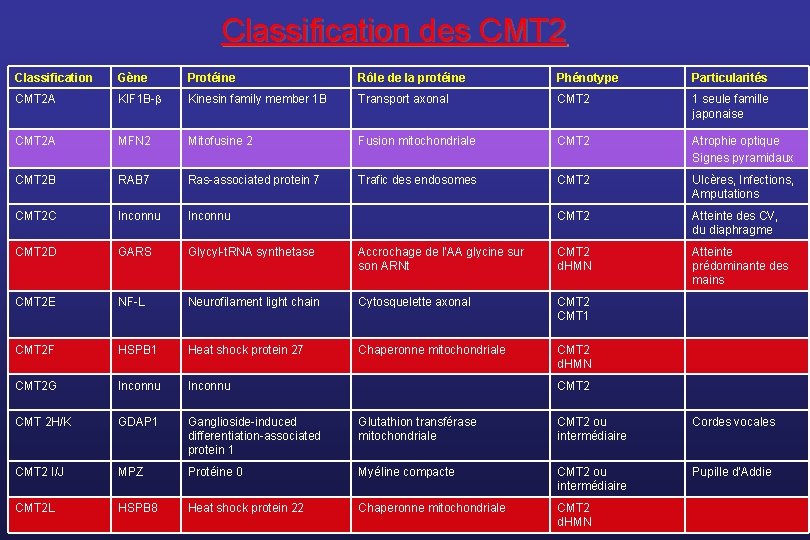
Le CMT 2 • La plupart des gènes ont été identifiés au cours des 5 dernières années • Une forme fréquente se dégage : le CMT 2 A et les mutations du gène MFN 2 • Plusieurs gènes sont associés à des phénotypes chevauchants entre CMT 2 et neuropathies motrices distales héréditaires • Certaines particularités phénotypiques permettent d’orienter l’analyse génétique

Classification des CMT 2 Classification Gène Protéine Rôle de la protéine Phénotype Particularités CMT 2 A KIF 1 B- Kinesin family member 1 B Transport axonal CMT 2 1 seule famille japonaise CMT 2 A MFN 2 Mitofusine 2 Fusion mitochondriale CMT 2 Atrophie optique Signes pyramidaux CMT 2 B RAB 7 Ras-associated protein 7 Trafic des endosomes CMT 2 Ulcères, Infections, Amputations CMT 2 C Inconnu CMT 2 Atteinte des CV, du diaphragme CMT 2 D GARS Glycyl-t. RNA synthetase Accrochage de l’AA glycine sur son ARNt CMT 2 d. HMN Atteinte prédominante des mains CMT 2 E NF-L Neurofilament light chain Cytosquelette axonal CMT 2 CMT 1 CMT 2 F HSPB 1 Heat shock protein 27 Chaperonne mitochondriale CMT 2 d. HMN CMT 2 G Inconnu CMT 2 H/K GDAP 1 Ganglioside-induced differentiation-associated protein 1 Glutathion transférase mitochondriale CMT 2 ou intermédiaire Cordes vocales CMT 2 I/J MPZ Protéine 0 Myéline compacte CMT 2 ou intermédiaire Pupille d’Addie CMT 2 L HSPB 8 Heat shock protein 22 Chaperonne mitochondriale CMT 2 d. HMN CMT 2

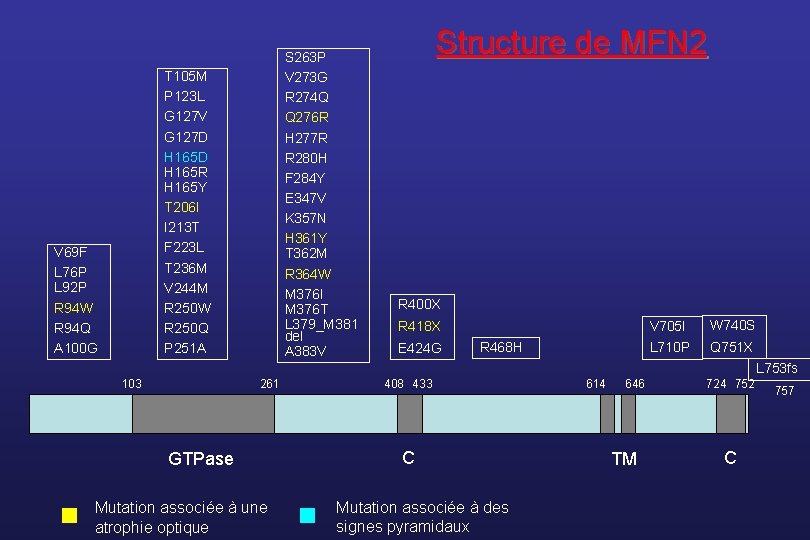
Le CMT 2 A • Le gène responsable est identifié en 2004 (Züchner et al, Nature Genet) dans 7 familles d’origine géographique diverse ; actuellement, 50 mutations décrites ; • Il code pour la protéine MFN 2 ; c’est une GTPase mitochondriale transmembranaire qui régule le réseau des mitochondries par fusion des mitochondries • Il représente la cause la plus fréquente de CMT 2 • La neuropathie peut-être associée : • à des signes pyramidaux (Zhu et al, Neurology, 2005) • à une atrophie optique (Züchner et al, Ann Neurol, 2006)

Mutations de MFN 2 : les grandes séries Référence Nb Patients Age de début Évolution Particularités Muglia et al JNNP 2008 10 1 – 5 décennie Variable Clinique et ENMG normaux chez une ♀ de 70 ans porteuse de la mutation Chung et al Brain 2006 26 1 – 50 ans Sévère (début < 10 ans) Atrophie optique (3) Hypoacousie (3) Voix rauque (2) 24% des familles CMT 2 testées Engelfried et al, BMC Med Genet 2006 6 Verhoeven et al Brain 2006 29 Kijima et al Hum Genet 2005 Lawson et al Neurology 2005 Bénigne à modérée (début > 10 ans) Enfance à 62 ans Non précisée _ 1 à 45 ans Sévérité du phénotype liée à l’âge de début 28% en FR Atrophie optique (3) Hypoacousie (1) 7/81 patients avec CMT 2 ou non classé ≤ 10 ans Non précisée _ 23 5 – 28 ans Non précisée _ 8% des individus testés 11% des familles CMT 2 testées 23% des familles CMT 2 testées

S 263 P V 273 G R 274 Q Q 276 R H 277 R R 280 H F 284 Y E 347 V K 357 N H 361 Y T 362 M R 364 W M 376 I M 376 T L 379_M 381 del A 383 V T 105 M P 123 L G 127 V G 127 D H 165 R H 165 Y T 206 I I 213 T F 223 L T 236 M V 244 M R 250 W R 250 Q P 251 A V 69 F L 76 P L 92 P R 94 W R 94 Q A 100 G Structure de MFN 2 R 400 X R 418 X E 424 G R 468 H V 705 I W 740 S L 710 P Q 751 X L 753 fs 103 261 GTPase Mutation associée à une atrophie optique 408 433 C Mutation associée à des signes pyramidaux 614 646 TM 724 752 C 757

Hypothèses physiopathologiques • Mutants MFN 2 dans des GDR en culture : agrégation des mitochondries dans les corps cellulaires et les portions proximales des axones • Altération de la mobilité des mitochondries • Taux d’ATP intracellulaire normal : pas de dysfonction de la chaîne respiratoire • La liaison des mitochondries à leur transporteurs pourrait être affectée • Ceci explique la susceptibilité des portions les plus distales de l’axone (Baloh et al, J Neuroscience, 2007)

Formes chevauchantes CMT 2/d. HMN : des formes rares

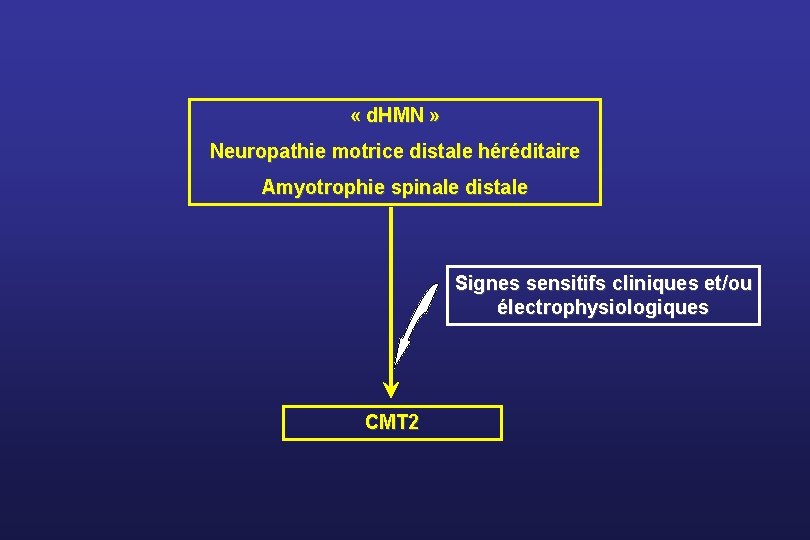
« d. HMN » Neuropathie motrice distale héréditaire Amyotrophie spinale distale Signes sensitifs cliniques et/ou électrophysiologiques CMT 2

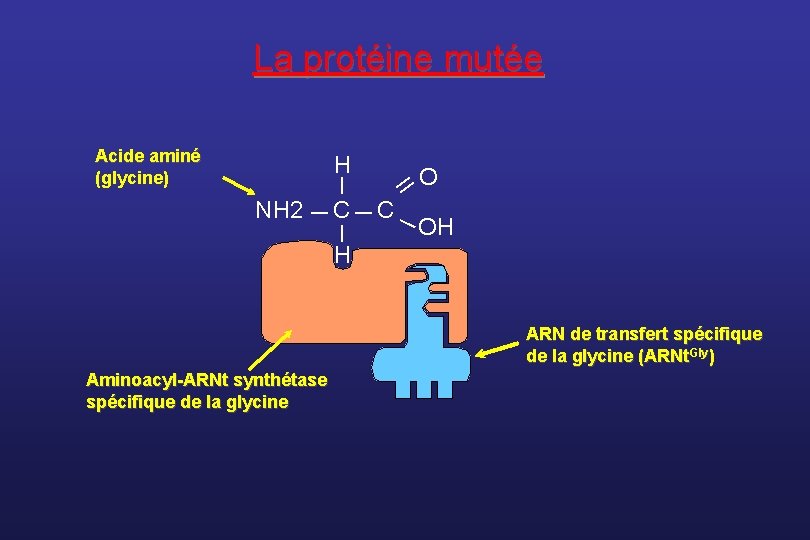
Le CMT 2 D • Il est localisé sur le chromosome 7 en 1996 • Le gène responsable est identifié en 2003 (Antonellis et al, Am J Hum Genet) • Il s’agit du gène GARS, codant pour la glycyl-ARNt synthétase, qui lie l’AA glycine à son ARN de transfert • 4 mutations faux sens ont été trouvées dans 5 familles v avec atteinte sensitivo-motrice : phénotype CMT 2 v ou atteinte motrice pure : phénotype d. HMN • Cette forme de CMT est caractérisée par v une atteinte inaugurale des mains (muscles 1 er IOD et thénariens) v une évolution très lente

La protéine mutée __ H _ Acide aminé (glycine) NH 2 _ C _ OH H ARN de transfert spécifique de la glycine (ARNt. Gly) Aminoacyl-ARNt synthétase spécifique de la glycine

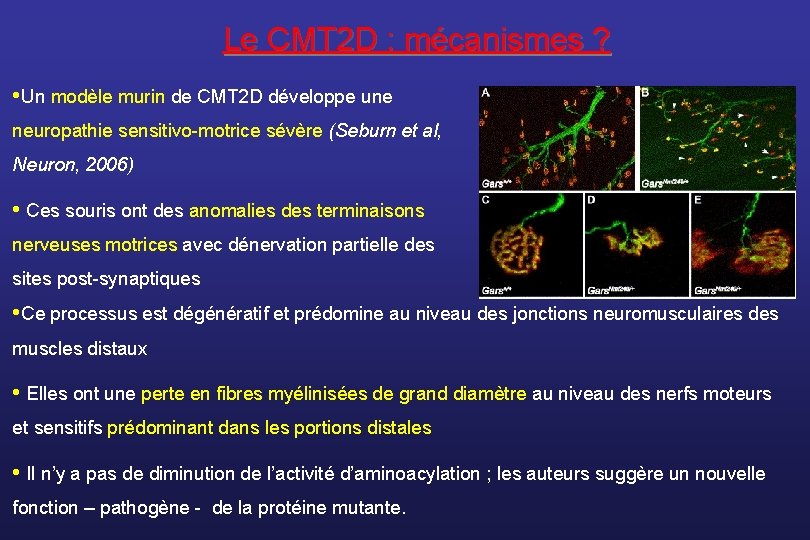
Le CMT 2 D : mécanismes ? • Un modèle murin de CMT 2 D développe une neuropathie sensitivo-motrice sévère (Seburn et al, Neuron, 2006) • Ces souris ont des anomalies des terminaisons nerveuses motrices avec dénervation partielle des sites post-synaptiques • Ce processus est dégénératif et prédomine au niveau des jonctions neuromusculaires des muscles distaux • Elles ont une perte en fibres myélinisées de grand diamètre au niveau des nerfs moteurs et sensitifs prédominant dans les portions distales • Il n’y a pas de diminution de l’activité d’aminoacylation ; les auteurs suggère un nouvelle fonction – pathogène - de la protéine mutante.

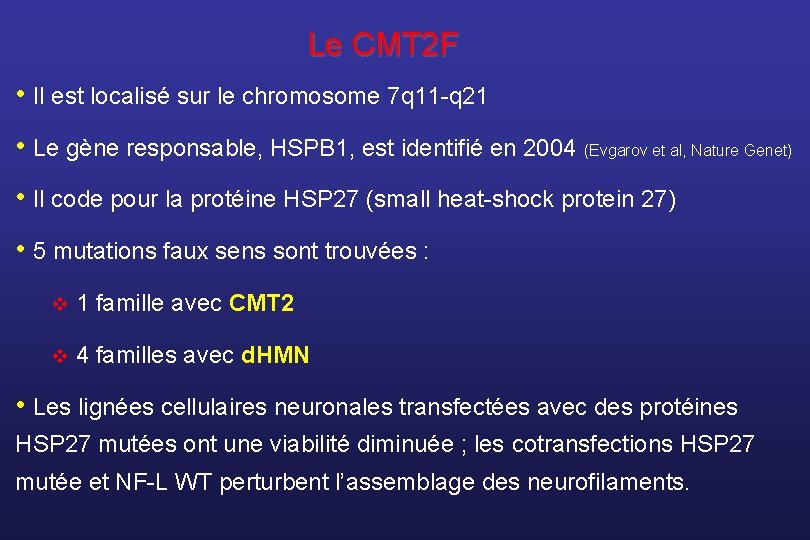
Le CMT 2 F • Il est localisé sur le chromosome 7 q 11 -q 21 • Le gène responsable, HSPB 1, est identifié en 2004 (Evgarov et al, Nature Genet) • Il code pour la protéine HSP 27 (small heat-shock protein 27) • 5 mutations faux sens sont trouvées : v 1 famille avec CMT 2 v 4 familles avec d. HMN • Les lignées cellulaires neuronales transfectées avec des protéines HSP 27 mutées ont une viabilité diminuée ; les cotransfections HSP 27 mutée et NF-L WT perturbent l’assemblage des neurofilaments.

Le CMT 2 L • Il est localisé sur le chromosome 12 q 24. 3 • Le gène responsable, HSPB 8, est identifié en 2004 (Irobi et al, Nature Genet) • Il code pour la protéine HSP 22 (small heat-shock protein 22) • 2 mutations décrites (2 familles d. HMN, 1 famille CMT 2) • En culture, les protéines HSP 22 mutées favorisent la formation d’agrégats cellulaires.

Les petites protéines heat-shock • Elles peuvent former des dimères, des hétérodimères ou des structures oligomériques plus complexes ; • Les mutations de HSP 22 et HSP 27 induisent des interactions anormalement augmentées avec la protéine WT et avec les autres protéines heat-shock ; • Ceci pourrait favoriser la formation d’agrégats intracellulaires • Et la dégénérescence axonale progressive. . . (Fontaine et al, FASEB Journal, 2006)

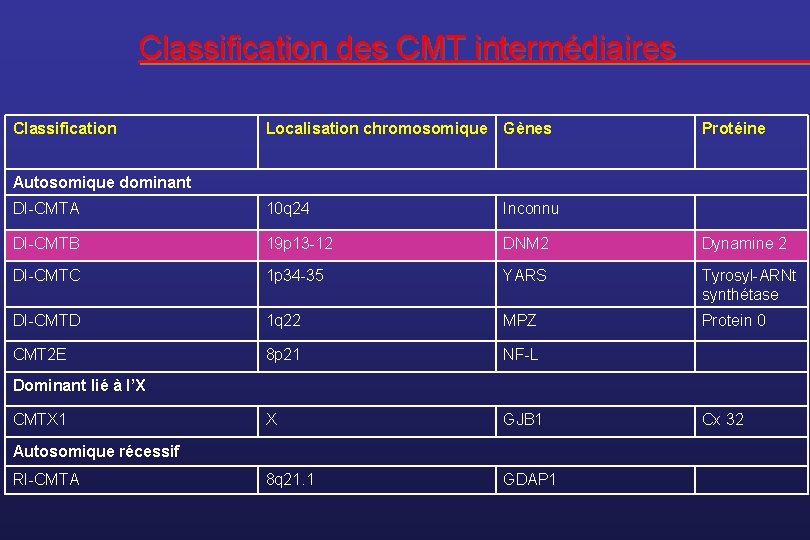
Les formes intermédiaires • Pendant longtemps, la notion de CMT intermédiaire a été associée au CMTDX, causé par les mutations de la Connexine 32. • Le concept tend à désigner maintenant les familles où le spectre des vitesses de conduction nerveuses est très étendu. • D’autres gènes peuvent être responsables de formes intermédiaires : DNM 2 v YARS v MPZ v NF-L v GDAP 1 v

Classification des CMT intermédiaires Classification Localisation chromosomique Gènes Protéine Autosomique dominant DI-CMTA 10 q 24 Inconnu DI-CMTB 19 p 13 -12 DNM 2 Dynamine 2 DI-CMTC 1 p 34 -35 YARS Tyrosyl-ARNt synthétase DI-CMTD 1 q 22 MPZ Protein 0 CMT 2 E 8 p 21 NF-L X GJB 1 8 q 21. 1 GDAP 1 Dominant lié à l’X CMTX 1 Autosomique récessif RI-CMTA Cx 32

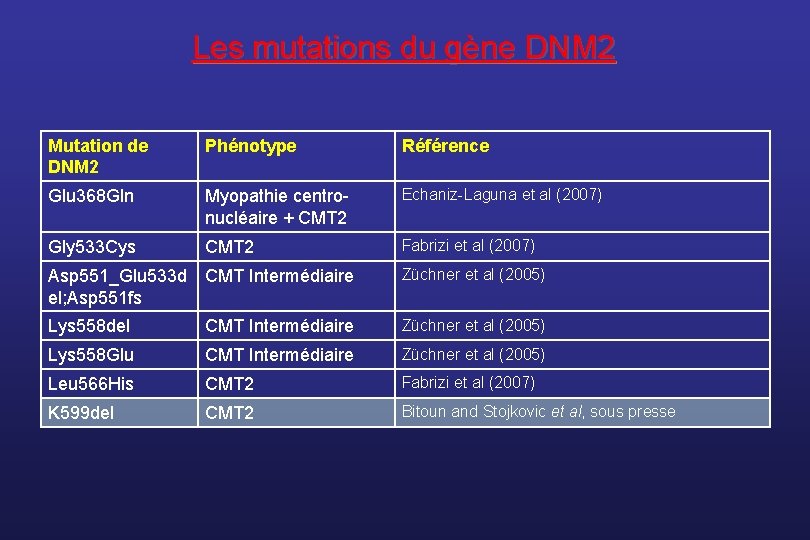
DI-CMTB • Initialement localisé sur le chromosome 19 ; • Le gène responsable, DNM 2, a été identifié en 2005 (Züchner et al, Nature Genet) dans 4 familles avec CMT intermédiaire (3) ou CMT 2 (1) • Il code pour une GTPase, la dynamine 2, associée aux microtubules et impliquée dans les phénomènes d’ endocytose et de mobilité cellulaire. • Dans des lignées cellulaires transfectées, les mutations de DNM 2 diminuent sa liaison aux membranes cellulaires • Les mutations du gène DNM 2, affectant un autre domaine de la protéine, sont également associées à des myopathies centronucléaires de transmission AD.

Les mutations du gène DNM 2 Mutation de DNM 2 Phénotype Référence Glu 368 Gln Myopathie centronucléaire + CMT 2 Echaniz-Laguna et al (2007) Gly 533 Cys CMT 2 Fabrizi et al (2007) Asp 551_Glu 533 d CMT Intermédiaire el; Asp 551 fs Züchner et al (2005) Lys 558 del CMT Intermédiaire Züchner et al (2005) Lys 558 Glu CMT Intermédiaire Züchner et al (2005) Leu 566 His CMT 2 Fabrizi et al (2007) K 599 del CMT 2 Bitoun and Stojkovic et al, sous presse

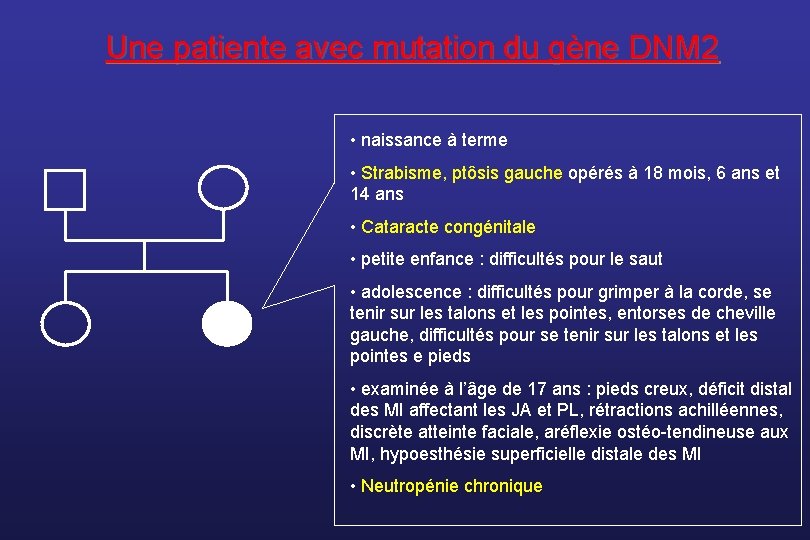
Une patiente avec mutation du gène DNM 2 • naissance à terme • Strabisme, ptôsis gauche opérés à 18 mois, 6 ans et 14 ans • Cataracte congénitale • petite enfance : difficultés pour le saut • adolescence : difficultés pour grimper à la corde, se tenir sur les talons et les pointes, entorses de cheville gauche, difficultés pour se tenir sur les talons et les pointes e pieds • examinée à l’âge de 17 ans : pieds creux, déficit distal des MI affectant les JA et PL, rétractions achilléennes, discrète atteinte faciale, aréflexie ostéo-tendineuse aux MI, hypoesthésie superficielle distale des MI • Neutropénie chronique

Un exemple de CMT autosomique récessif

Le gène GDAP 1 : autosomique récessif et vitesses de conduction variables CMT • Localisé en 1993 sur le chromosome 8 q 21 • Le gène GDAP 1 (ganglioside-induced differentiation-associated protein 1 gene) est découvert en 2002 dans des familles avec CMT de transmission autosomique récessive : - 4 familles tunisiennes avec CMT démyélinisant (Baxter et al, Nature Genet) - 3 familles espagnoles avec CMT axonal et atteinte des cordes vocales (Cuesta et al, Nature Genet) • Par la suite, la plupart des familles décrites ont un mode de transmission autosomique récessif (près de 30 mutations décrites) • Mais les vitesses de conduction sont variables, parfois intermédiaires

Le gène GDAP 1 : CMT sévère un • Age de début : avant 3 ans • Atteinte distale des quatre membres sévère, précoce (<10 ans) • Atteinte des muscles proximaux (prédominant aux MI) • Signes associés : v v atteinte diaphragmatique atteinte des cordes vocales (plutôt formes axonales ? ) diplégie faciale dysphagie • Perte de la marche chez l’adolescent ou l’adulte jeune • Quelques patients peuvent avoir une évolution plus lente

Le gène GDAP 1 : familles avec transmission autosomique dominante Quelques Claramunt et al, Am J Med Genet 2005 • Une mutation de novo dominante chez un patient sans antécédent familial et deux familles • Le phénotype est moins sévère que dans les formes autosomiques récessives : début vers l’âge de 20 ans, évolution lente, atteinte axonale Chung et al, J Hum Genet 2008 • Une famille coréenne de deux patients : début à 16 et 25 ans, évolution lente, atteinte axonale

Quel rôle joue la protéine ? • La protéine GDAP 1 est exprimée dans les neurones et les cellules de Schwann (Niemann et al, J Cell Biol 2005 ; Pedrola et al, Hum Mol Genet 2005) • Elle est ancrée sur la membrane externe des mitochondries • C’est un régulateur du réseau mitochondrial qui favorise la fission mitochondriale • Une bonne régulation du réseau mitochondrial et des évènements de fusion –fission apparaît indispensable au bon fonctionnement du nerf périphérique.

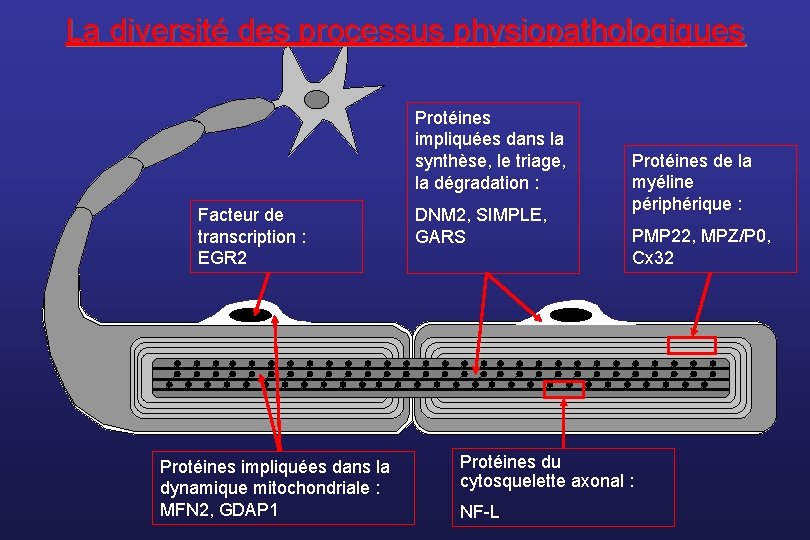
La diversité des processus physiopathologiques Protéines impliquées dans la synthèse, le triage, la dégradation : Facteur de transcription : EGR 2 Protéines impliquées dans la dynamique mitochondriale : MFN 2, GDAP 1 DNM 2, SIMPLE, GARS Protéines de la myéline périphérique : PMP 22, MPZ/P 0, Cx 32 Protéines du cytosquelette axonal : NF-L
 Rencontres du vietnam
Rencontres du vietnam Moriond qcd
Moriond qcd Couchée avec mes soeurs j'ai la tete rouge reponse
Couchée avec mes soeurs j'ai la tete rouge reponse Maladie d ollier
Maladie d ollier Carte d'addisonien
Carte d'addisonien Maladie cv
Maladie cv Jean bernard girodias
Jean bernard girodias La femme du prophète ayoub
La femme du prophète ayoub Maladie professionnelle coiffure allergie
Maladie professionnelle coiffure allergie Maladie de waldenstrom
Maladie de waldenstrom Takayachu
Takayachu Gougerot-sjögren symptômes
Gougerot-sjögren symptômes Maladie de horton
Maladie de horton Hypergastrinémie
Hypergastrinémie Ltcd maladie
Ltcd maladie La maladie de forestier
La maladie de forestier Maladie de biermer
Maladie de biermer Maladie auto immune connectivite
Maladie auto immune connectivite Maladie gelatineuse
Maladie gelatineuse Cinquième maladie
Cinquième maladie Nécrosectomie
Nécrosectomie Hémtocrite
Hémtocrite Maladie de wegener atteinte orl
Maladie de wegener atteinte orl Assurance maladie
Assurance maladie Tdr ventriculaire
Tdr ventriculaire Maladie serique
Maladie serique Maladie coronaire stable
Maladie coronaire stable Pierre hance
Pierre hance Rupture tendon quadricipital
Rupture tendon quadricipital Definition de maladie infantile
Definition de maladie infantile Maladie du pica
Maladie du pica Facio tronculaire
Facio tronculaire Enroulement des feuilles de tomates
Enroulement des feuilles de tomates Ostéomalacie
Ostéomalacie Syndrome de shag
Syndrome de shag Composition aire
Composition aire Exemple d'une conclusion
Exemple d'une conclusion Tornade dans un bocal
Tornade dans un bocal Trivselsleder dans
Trivselsleder dans Je suis dans la joie une joie immense
Je suis dans la joie une joie immense Pnjf
Pnjf Waiter customer dialogue
Waiter customer dialogue Comment faire une introduction dans une dissertation
Comment faire une introduction dans une dissertation