Versin Junio de 2019 FSICA GENERAL II Tema




































- Slides: 91

Versión: Junio de 2019

FÍSICA GENERAL II Tema 1: Termodinámica I Tema 2: Termodinámica II Tema 3: Campo eléctrico I Tema 4: Campo eléctrico II Tema 5: Corriente eléctrica Tema 6: Campo magnético I Tema 7: Campo magnético II Tema 8: Inducción electromagnética I Tema 1: Termodinámica I • Energía de sistemas de muchas partículas. Interpretación cinética clásica de la temperatura y la presión. Energía interna de un sistema. Calores específicos • Propiedades térmicas de la materia derivadas de su estructura molecular. Ecuaciones de estado y diagramas de fases. Calores latentes de cambio de estado Tema 10: Ondas mecánicas • Temperatura y equilibrio térmico. Principio cero de la termodinámica. Escalas de temperatura. Tema 11: Ecuaciones de Maxwell y ondas electromagnéticas • El calor como energía en tránsito. Mecanismos de transferencia de calor Tema 9: Corriente alterna Tema 12: Óptica Tema 13: Relatividad restringida Tema 14: Estructura de la materia

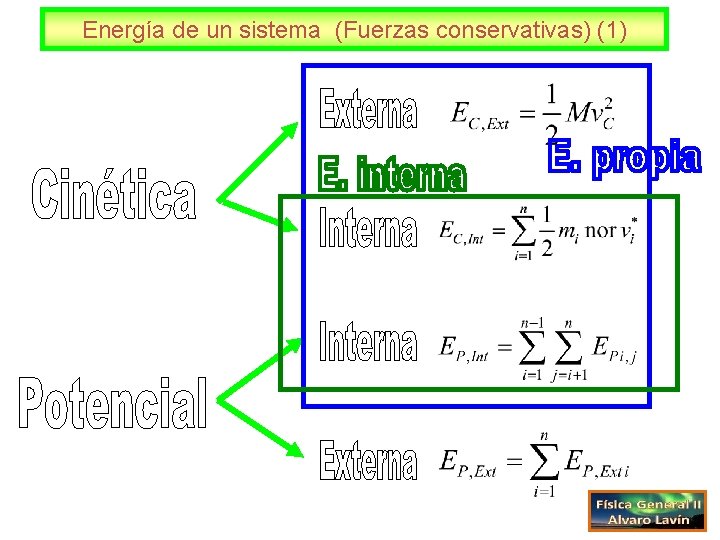
Energía de un sistema (Fuerzas conservativas) (1) 3

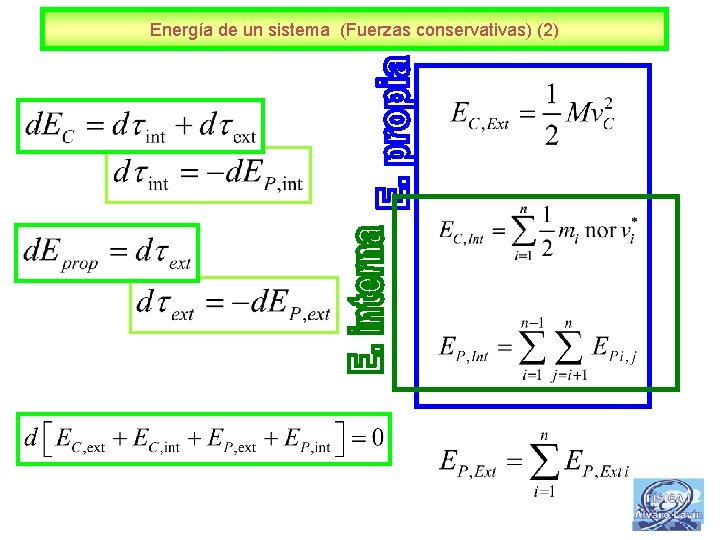
Energía de un sistema (Fuerzas conservativas) (2) 4

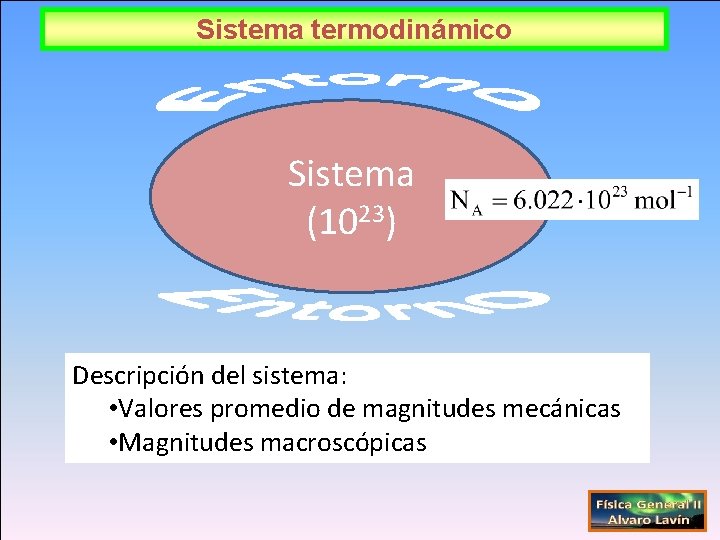
Sistema termodinámico Sistema (1023) Descripción del sistema: • Valores promedio de magnitudes mecánicas • Magnitudes macroscópicas

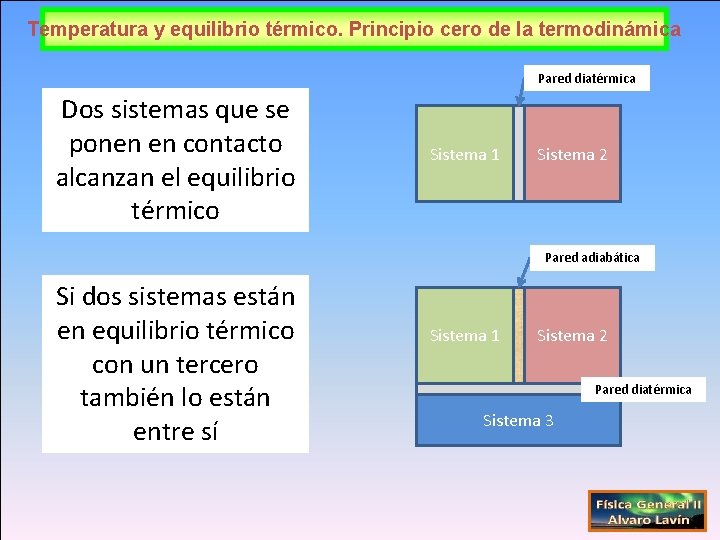
Temperatura y equilibrio térmico. Principio cero de la termodinámica Pared diatérmica Dos sistemas que se ponen en contacto alcanzan el equilibrio térmico Sistema 1 Sistema 2 Pared adiabática Si dos sistemas están en equilibrio térmico con un tercero también lo están entre sí Sistema 1 Sistema 2 Pared diatérmica Sistema 3

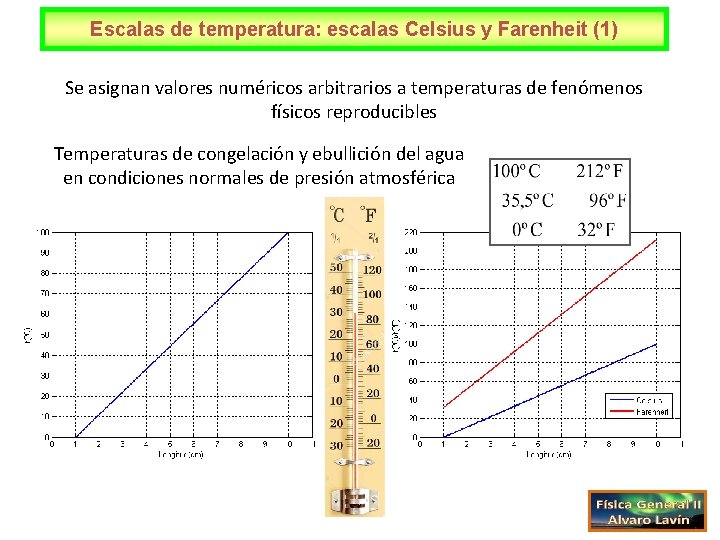
Escalas de temperatura: escalas Celsius y Farenheit (1) Se asignan valores numéricos arbitrarios a temperaturas de fenómenos físicos reproducibles Temperaturas de congelación y ebullición del agua en condiciones normales de presión atmosférica

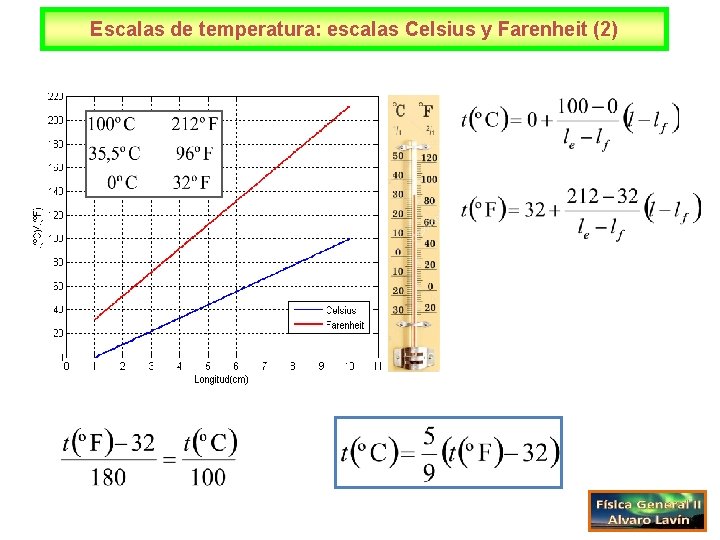
Escalas de temperatura: escalas Celsius y Farenheit (2)

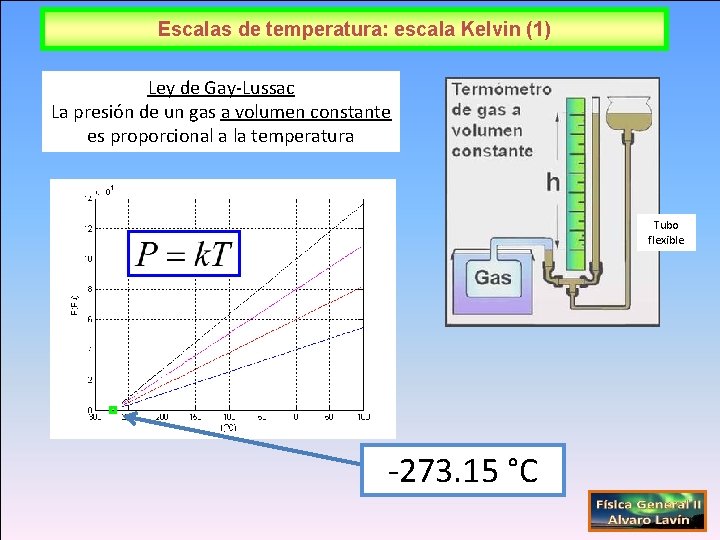
Escalas de temperatura: escala Kelvin (1) Ley de Gay-Lussac La presión de un gas a volumen constante es proporcional a la temperatura Tubo flexible -273. 15 °C

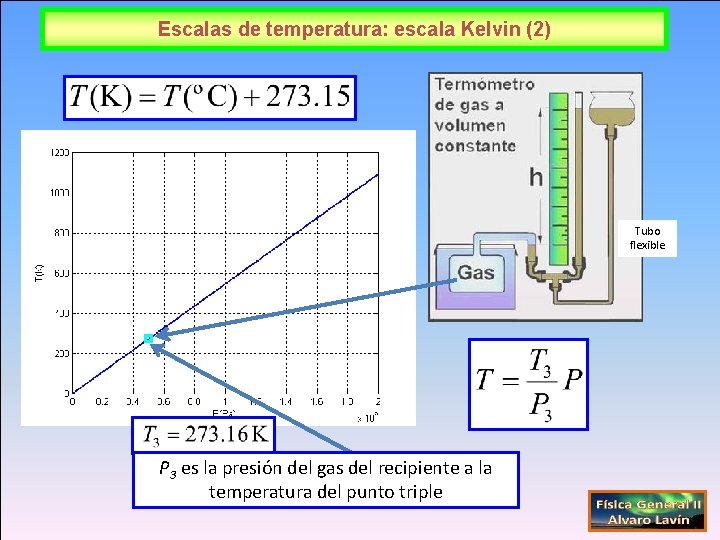
Escalas de temperatura: escala Kelvin (2) Tubo flexible P 3 es la presión del gas del recipiente a la temperatura del punto triple

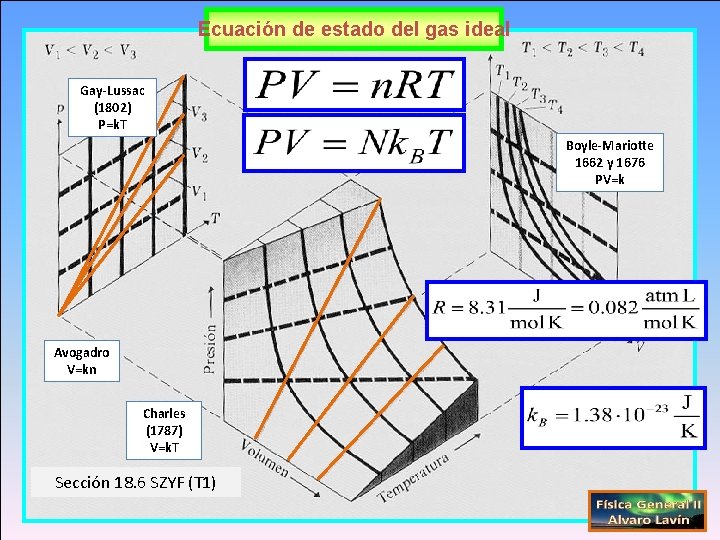
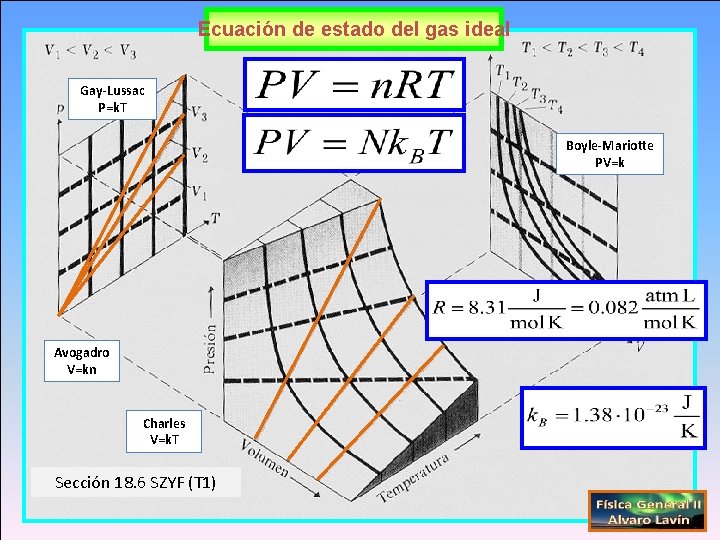
Ecuación de estado del gas ideal Gay-Lussac (1802) P=k. T Boyle-Mariotte 1662 y 1676 PV=k Avogadro V=kn Charles (1787) V=k. T Sección 18. 6 SZYF (T 1)

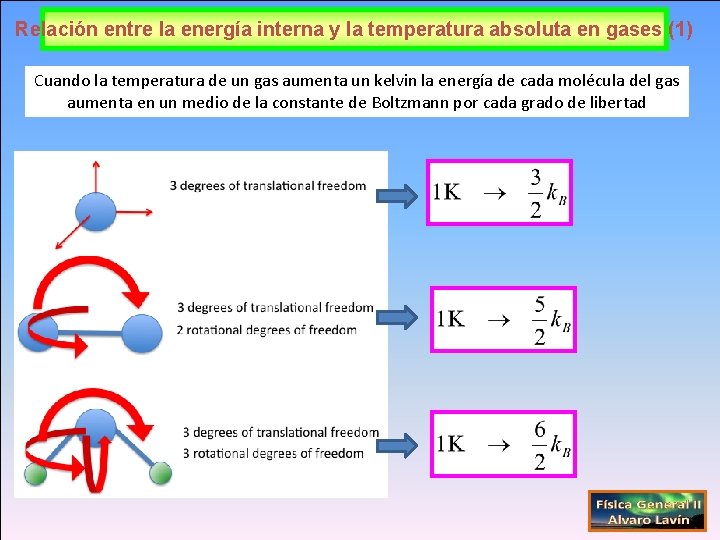
Relación entre la energía interna y la temperatura absoluta en gases (1) Cuando la temperatura de un gas aumenta un kelvin la energía de cada molécula del gas aumenta en un medio de la constante de Boltzmann por cada grado de libertad

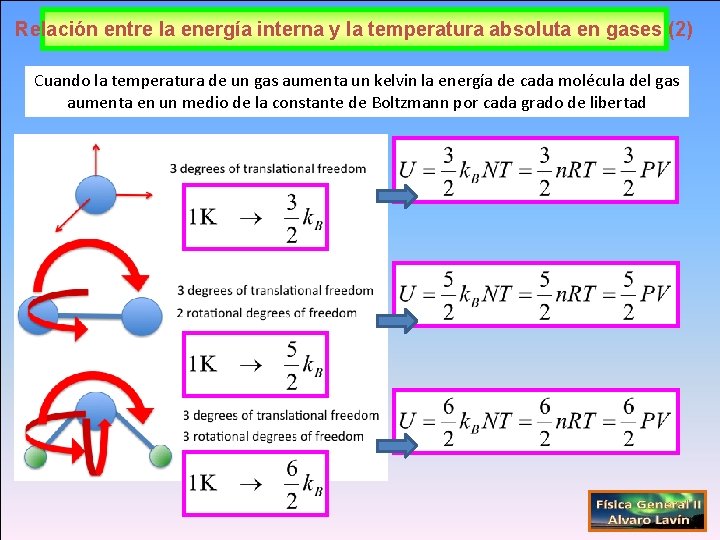
Relación entre la energía interna y la temperatura absoluta en gases (2) Cuando la temperatura de un gas aumenta un kelvin la energía de cada molécula del gas aumenta en un medio de la constante de Boltzmann por cada grado de libertad

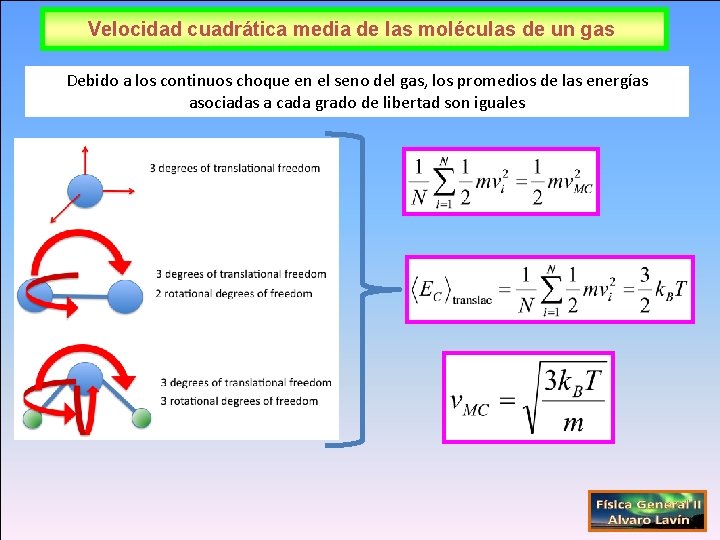
Velocidad cuadrática media de las moléculas de un gas Debido a los continuos choque en el seno del gas, los promedios de las energías asociadas a cada grado de libertad son iguales

Estime la velocidad de traslación media en m/s de las moléculas en un recipiente lleno de O 2 a temperatura de 462 K. (1 p) NA=6. 022 1023 k. B = 1. 38 10 -23 J/mol K ma. O=16 u =16 Da

Ecuación de estado del gas ideal. Teoría Cinética de los Gases (animaciones) http: //www. sc. ehu. es/sbweb/fisica/estadistica/gas. Ideal. html http: //en. wikipedia. org/wiki/Kinetic_theory

Ecuación de estado del gas ideal Gay-Lussac P=k. T Boyle-Mariotte PV=k Avogadro V=kn Charles V=k. T Sección 18. 6 SZYF (T 1)

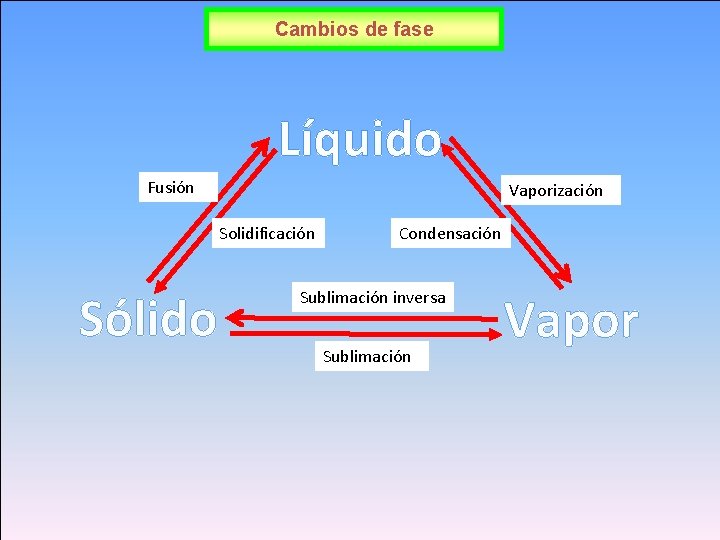
Cambios de fase Líquido Fusión Vaporización Solidificación Sólido Condensación Sublimación inversa Sublimación Vapor

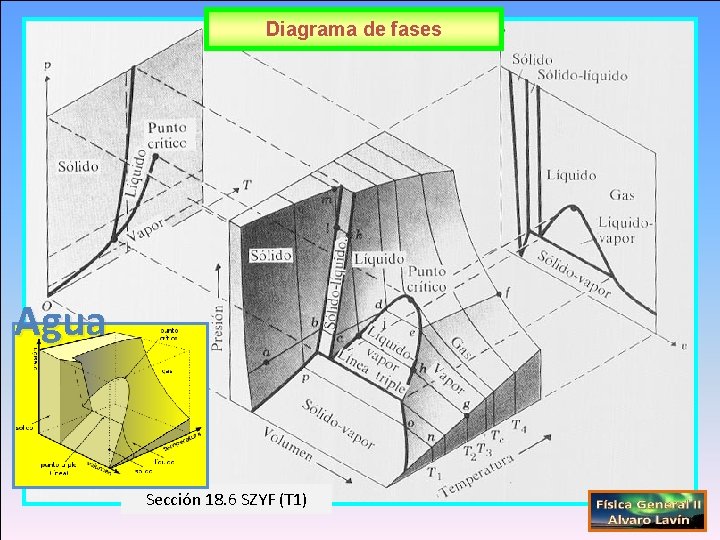
Diagrama de fases Agua Sección 18. 6 SZYF (T 1)

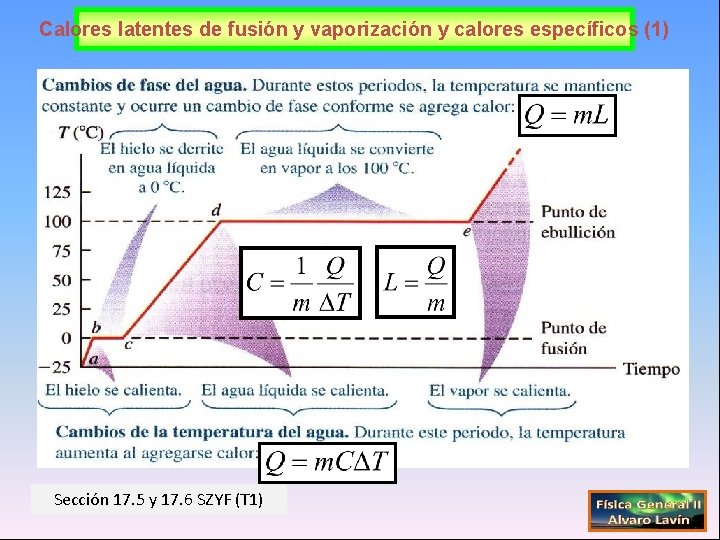
Calores latentes de fusión y vaporización y calores específicos (1) Sección 17. 5 y 17. 6 SZYF (T 1)

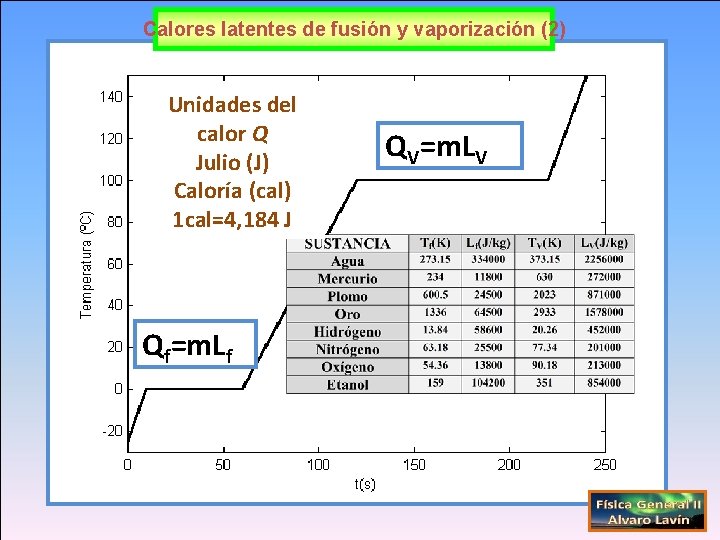
Calores latentes de fusión y vaporización (2) Unidades del calor Q Julio (J) Caloría (cal) 1 cal=4, 184 J Qf=m. Lf QV=m. LV

Temperatura final de una mezcla de hielo con agua (1) m 1 m 2

Temperatura final de una mezcla de hielo con agua (2) m 1 m 2 No puede ser la solución

Temperatura final de una mezcla de hielo con agua (3) m 1 m 2 Es la cantidad de hielo que se funde

Mecanismos de transferencia de calor Conducción Convección Radiación Sección 17. 7 SZYF (T 1) 25

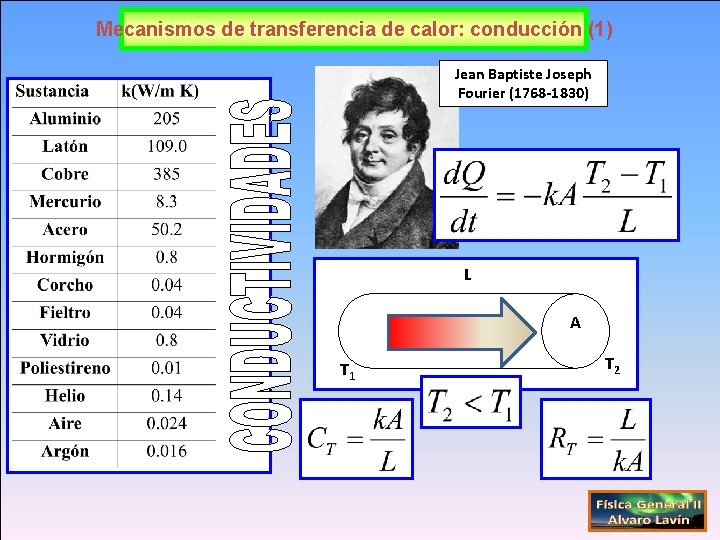
Mecanismos de transferencia de calor: conducción (1) Jean Baptiste Joseph Fourier (1768 -1830) L A T 1 T 2

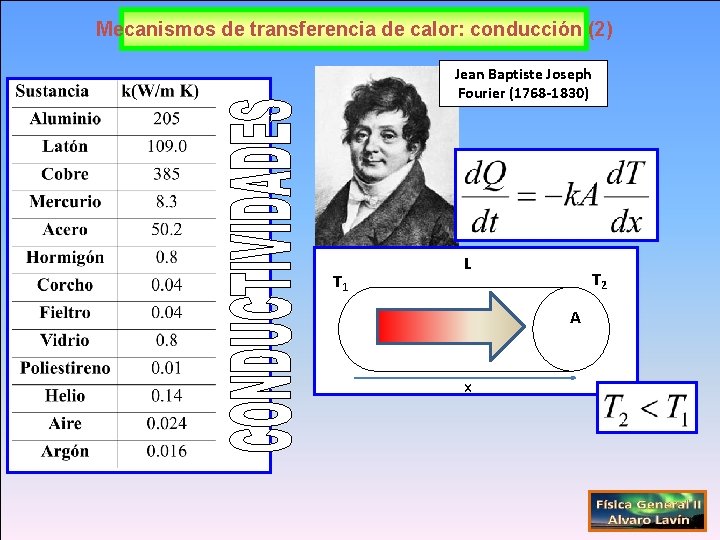
Mecanismos de transferencia de calor: conducción (2) Jean Baptiste Joseph Fourier (1768 -1830) T 1 L T 2 A x

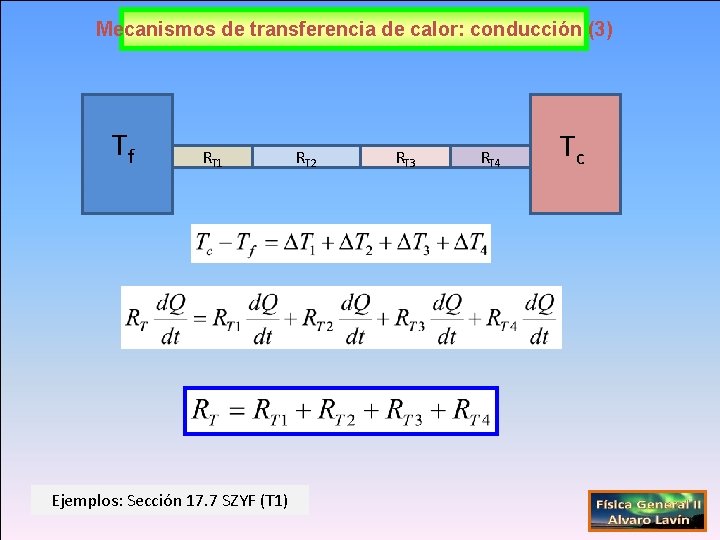
Mecanismos de transferencia de calor: conducción (3) Tf RT 1 Ejemplos: Sección 17. 7 SZYF (T 1) RT 2 RT 3 RT 4 Tc

Dos bloques cúbicos de diferentes materiales uniendo dos focos térmicos: flujo térmico y temperatura de la unión (1) 273 K 20 cm Al Ag Tu 373 K

Dos bloques cúbicos de diferentes materiales uniendo dos focos térmicos: flujo térmico y temperatura de la unión (2) 273 K 20 cm Al Ag Tu 373 K

Una barra de acero de 10 cm de longitud se suelda a una barra de cobre de 20 cm de longitud. Ambas tienen la misma sección cuadrada de 4 cm 2. El extremo libre de la barra de acero se mantiene a 100 °C poniéndolo en contacto con vapor de agua mientras que el extremo libre de la barra de cobre se mantiene a 0 °C poniéndolo en contacto con hielo. Calcule la temperatura en °C en la unión de estas dos resistencias térmicas y el calor por unidad de tiempo que las atraviesa en W. (kacero=50. 2 W/m K; kcobre=385 W/m K) Por estar las resistencias térmicas en serie el flujo de calor es el mismo en las dos… 100°C tu 0°C

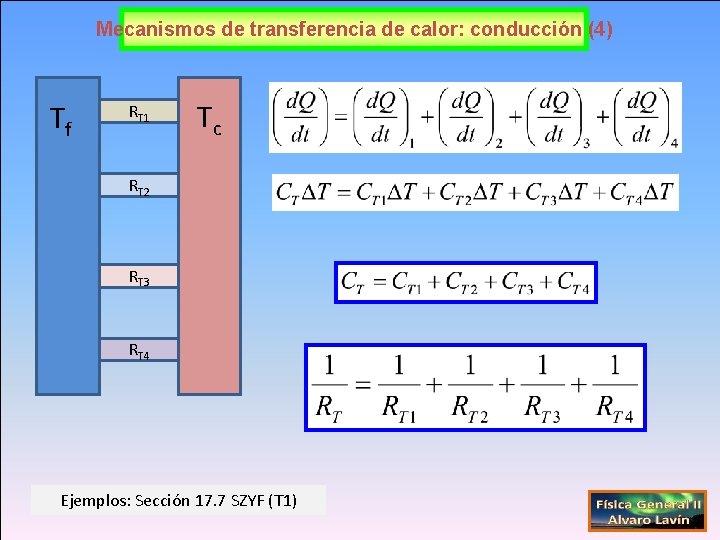
Mecanismos de transferencia de calor: conducción (4) Tf RT 1 Tc RT 2 RT 3 RT 4 Ejemplos: Sección 17. 7 SZYF (T 1)

Una nevera de camping de poliestireno con paredes de espesor 0. 03 m tiene forma de caja cúbica de dimensiones 30 x 30 cm de forma que su superficie es de 0. 54 m 2. Está llena con una mezcla de agua hielo y latas de cerveza a 0 °C, siendo la temperatura del aire que la rodea de 30 °C. Teniendo en cuenta que la conductividad térmica del poliestireno es 0. 01 Wm-1 K-1 y el calor latente de fusión del hielo es 3. 34 105 J/kg, calcule: • El flujo de calor que penetra en la nevera desde el exterior • La cantidad de hielo que se funde en 12 horas

Mecanismos de transferencia de calor Conducción Convección Radiación Sección 17. 7 SZYF (T 1) 34



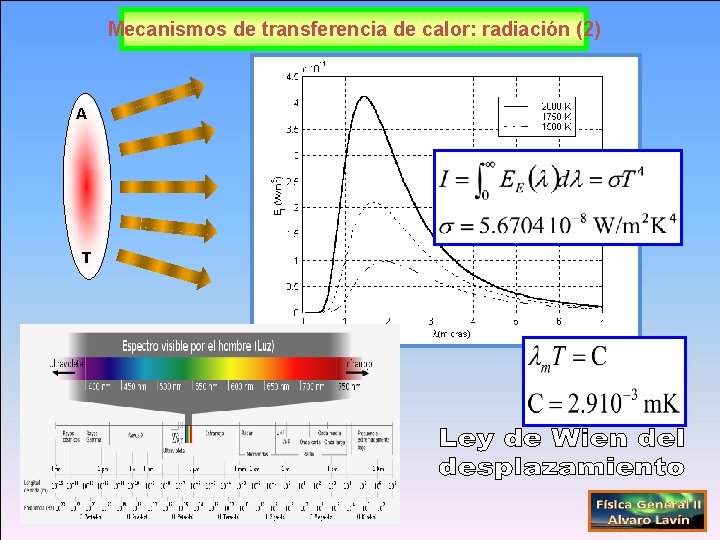
Mecanismos de transferencia de calor: radiación (0)

Mecanismos de transferencia de calor: radiación (1) A T

Mecanismos de transferencia de calor: radiación (2) A T

Mecanismos de transferencia de calor: radiación (3) TE TS


Calcule la pérdida de energía por unidad de tiempo en W que experimenta una persona desnuda en una habitación a 10 C debido al balance radiativo. Suponga que la superficie de la piel de la persona se comporta como un cuerpo negro de área 1. 4 m 2 y que su temperatura superficial es de 35 ºC, ligeramente inferior a su temperatura interna. [σ=5. 6704· 10 -8 W/(m 2· K 4)]

Mecanismos de transferencia de calor Conducción Convección Radiación Sección 17. 7 SZYF (T 1) 43

FÍSICA GENERAL II Tema 1: Termodinámica I Tema 2: Termodinámica II Tema 3: Campo eléctrico I Tema 4: Campo eléctrico II Tema 5: Corriente eléctrica Tema 6: Campo magnético I Tema 7: Campo magnético II Tema 8: Inducción electromagnética I Tema 9: Corriente alterna Tema 10: Ondas mecánicas Tema 11: Ecuaciones de Maxwell y ondas electromagnéticas Tema 12: Óptica Tema 13: Relatividad restringida Tema 14: Estructura de la materia Tema 2: Termodinámica II • Calor y trabajo en sistemas termodinámicos. Variación de la energía interna. Primer principio de la termodinámica • Transformaciones en sistemas termodinámicos. Ciclos termodinámicos. Variaciones de energía interna y entalpía. Aplicación a gases ideales • Máquinas térmicas. Motores y frigoríficos. Rendimiento y eficiencia. • Segundo principio de la termodinámica. Reversibilidad de los procesos termodinámicos • Ciclo de Carnot. Eficiencia máxima de las máquinas térmicas. • Entropía en procesos termodinámicos

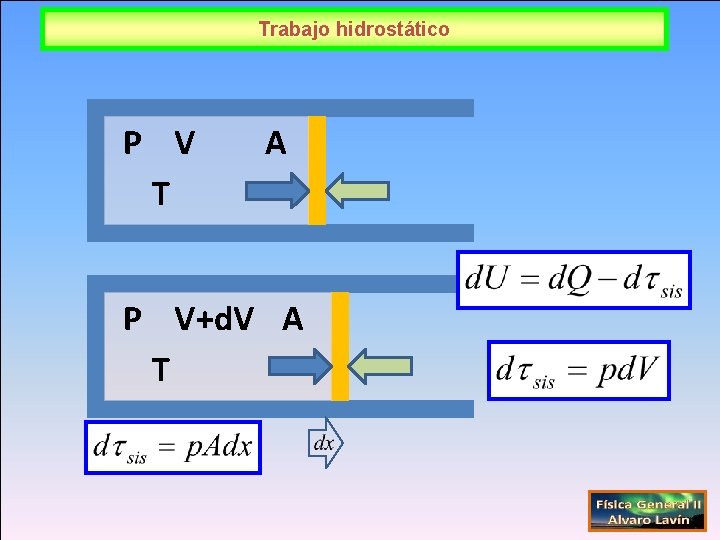
Trabajo hidrostático P V T A P V+d. V A T

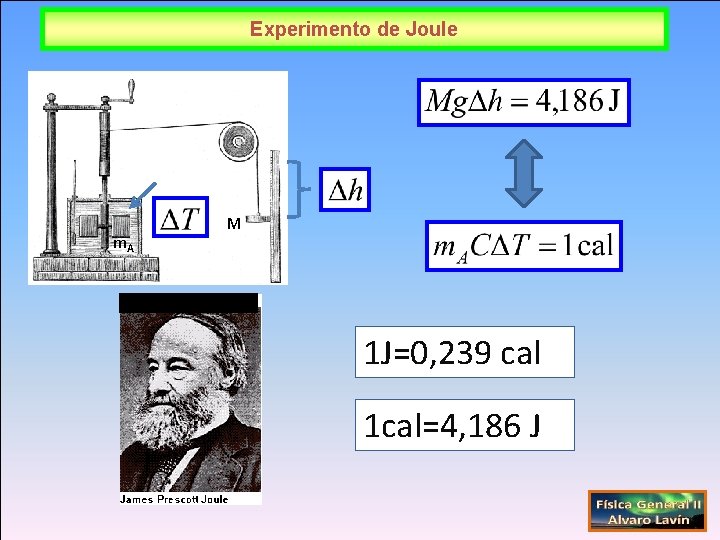
Conservación de la energía: Primer Principio de la Termodinámica Q>0 1 cal=4, 186 J 1 J=0, 239 cal Sistema James Prescott Joule (1818 -1889) Q<0 Julius Robert von Mayer (1814 -1878)

Experimento de Joule m. A M 1 J=0, 239 cal 1 cal=4, 186 J

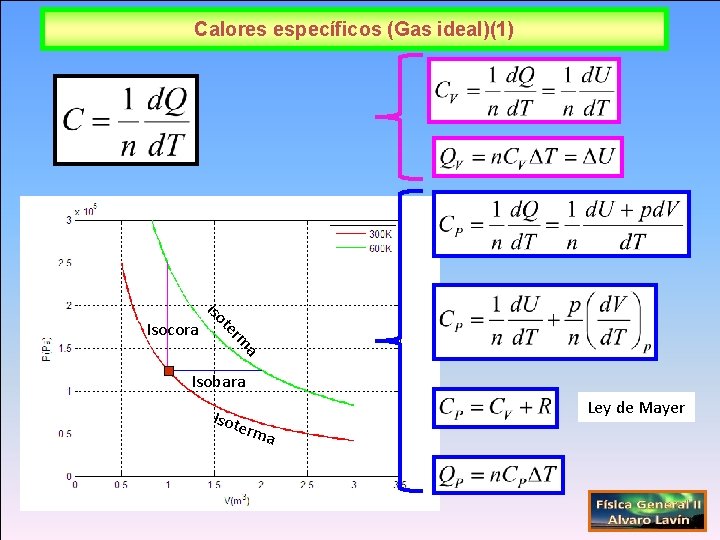
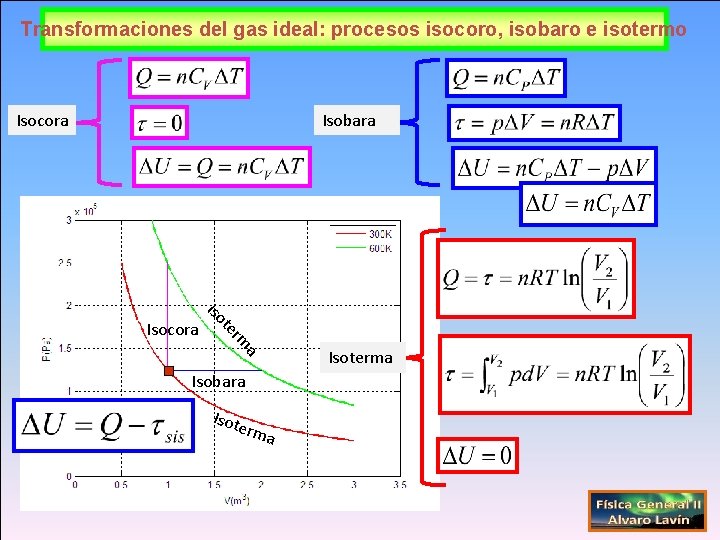
Calores específicos (Gas ideal)(1) a rm te Isocora Isobara Ley de Mayer Isot erm a

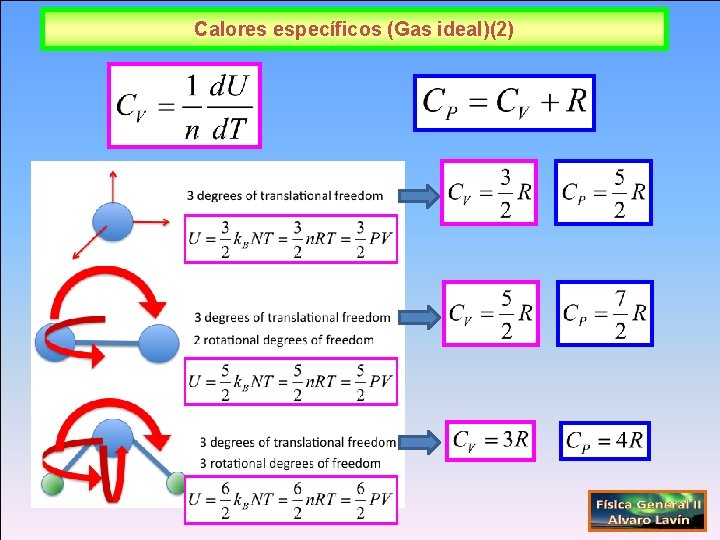
Calores específicos (Gas ideal)(2)

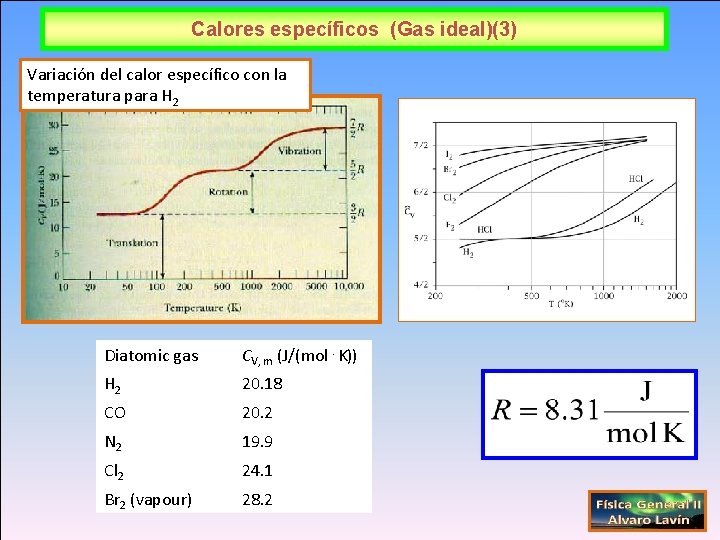
Calores específicos (Gas ideal)(3) Variación del calor específico con la temperatura para H 2 Diatomic gas CV, m (J/(mol⋅K)) H 2 20. 18 CO 20. 2 N 2 19. 9 Cl 2 24. 1 Br 2 (vapour) 28. 2

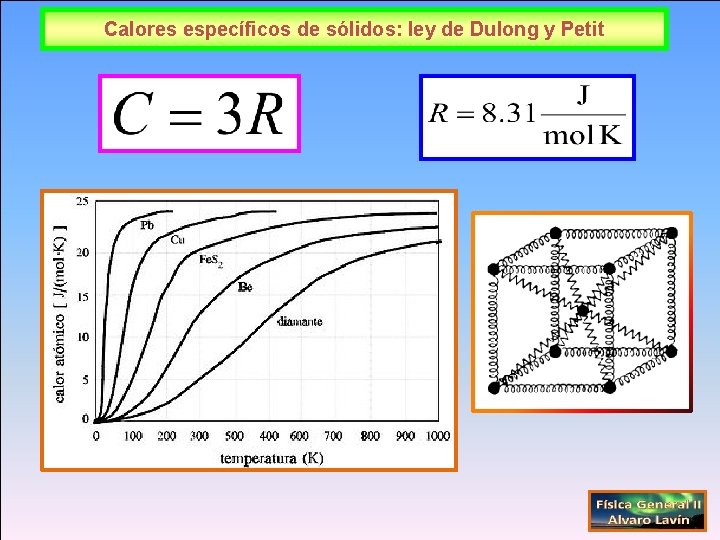
Calores específicos de sólidos: ley de Dulong y Petit

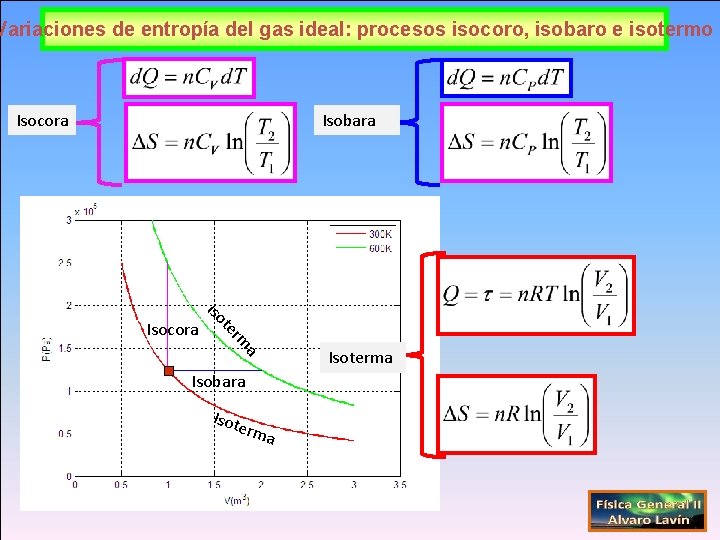
Transformaciones del gas ideal: procesos isocoro, isobaro e isotermo Isocora Isobara a rm te Isocora Isoterma Isobara Isot erm a

Un gas ideal diatómico experimenta una transformación isocora. El gas tiene 0. 04 moles y está encerrado en un recipiente de 2 L en el que la presión es de 1 atm. El recipiente se pone en contacto con un foco térmico de forma que el gas absorbe 200 J de calor. (R=0. 082 atm l/mol K=8. 31 J/mol K; 1 atm=101325 Pa) Calcule: El incremento de temperatura que experimenta el gas en K y su presión final en atm La variación de entropía del sistema por mol en J/K

Un gas ideal diatómico experimenta una expansión isobara reversible a presión de una atmósfera que le lleva de tener un volumen inicial de 1 L a un volumen final de 3 L. (R=0. 082 atm l/mol K=8. 31 J/mol K; 1 atm=101325 Pa; 1 L=10 -3 m 3 ) Calcule: Las variación de energía interna, el calor que intercambia el sistema con el entorno y el trabajo que realiza el sistema en J …expresando la presión en pascales y el volumen el m 3 se obtienen… La variación de entropía del sistema por mol en J/(K mol)

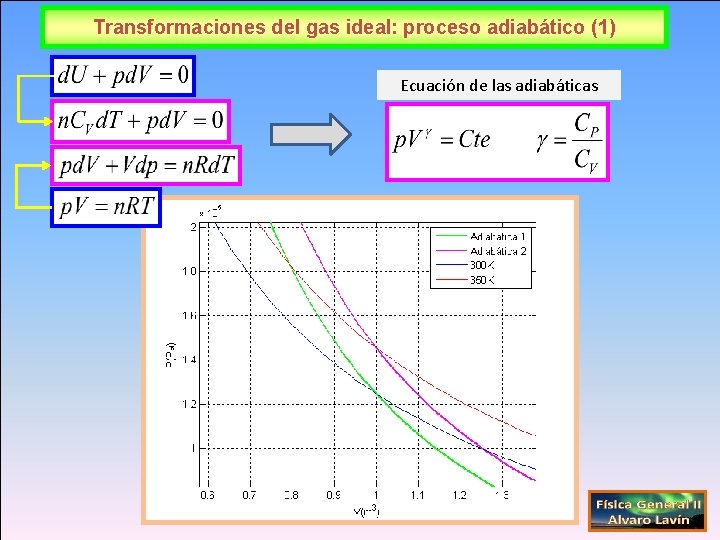
Transformaciones del gas ideal: proceso adiabático (1) Ecuación de las adiabáticas

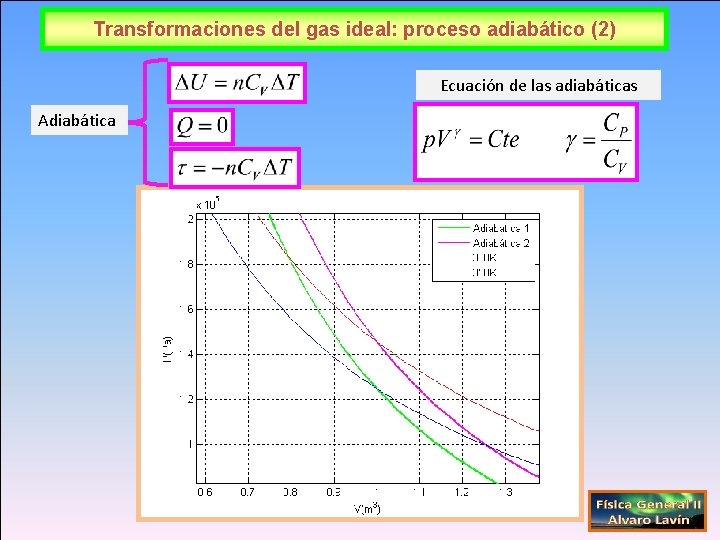
Transformaciones del gas ideal: proceso adiabático (2) Ecuación de las adiabáticas Adiabática

Las temperaturas iniciales y finales del sistema en K y el volumen final en litros El trabajo que realiza el sistema y la variación de energía interna en J.

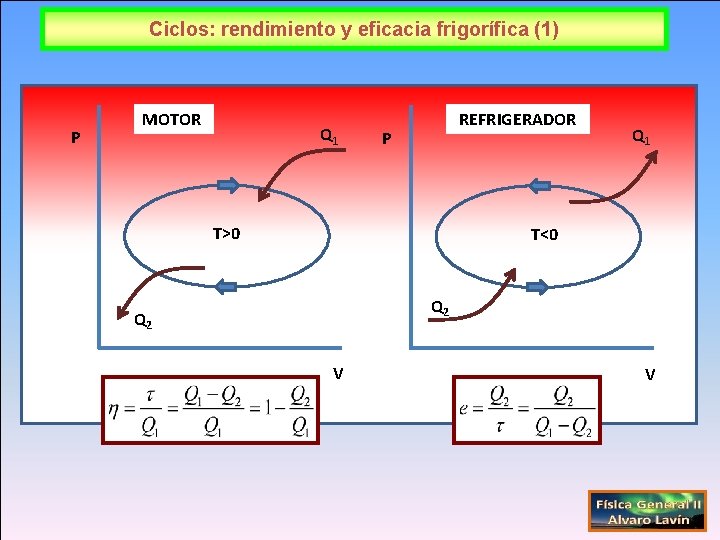
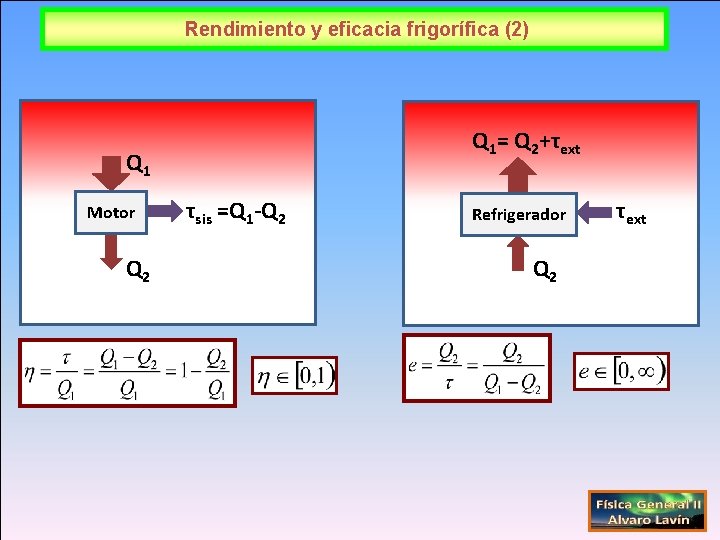
Ciclos: rendimiento y eficacia frigorífica (1) P MOTOR Q 1 REFRIGERADOR P T>0 Q 1 T<0 Q 2 V V

Rendimiento y eficacia frigorífica (2) Q 1= Q 2+τext Q 1 Motor Q 2 τsis =Q 1 -Q 2 Refrigerador Q 2 τext

Una máquina frigorífica ideal posee una eficiencia E=3; cuando funciona, realiza un trabajo por unidad de tiempo de 100 W. Se utiliza para enfriar una habitación de aproximadamente 27 m 3 en la que hay 1200 moles de aire cuyo comportamiento se aproxima al de un gas ideal diatómico. Calcule el flujo de calor HQ 2 que se extrae de la habitación en W cuando funciona este sistema de refrigeración y el tiempo en minutos que tarda la habitación en disminuir su temperatura 10 grados suponiendo que la transformación termodinámica que experimenta el aire de la habitación es isobara. En una máquina refrigeradora de eficiencia 3 se cumple: …donde HQ 2 es el calor extraído por unidad de tiempo del foco frio y W la potencia consumida por el motor Por tanto: Para calcular el tiempo que tarda la habitación en enfriarse utilizamos:

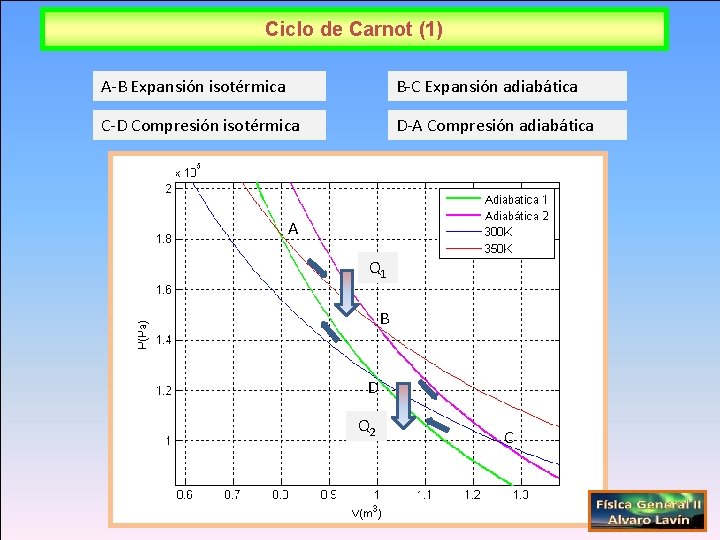
Ciclo de Carnot (1) A-B Expansión isotérmica B-C Expansión adiabática C-D Compresión isotérmica D-A Compresión adiabática A Q 1 B D Q 2 C

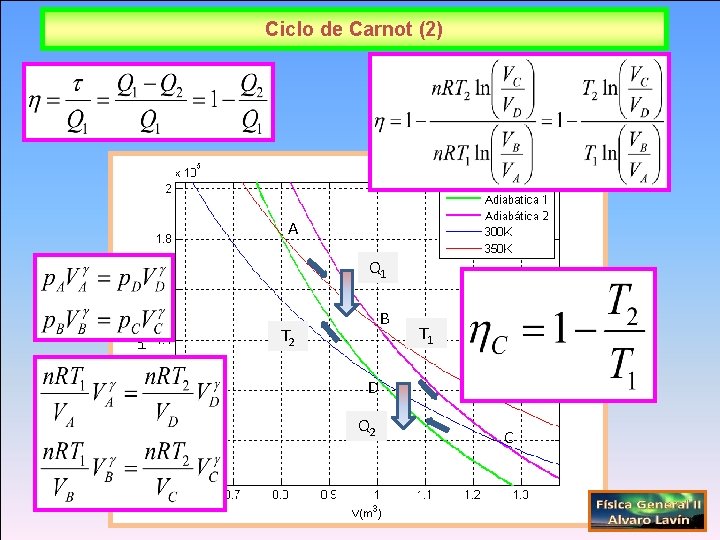
Ciclo de Carnot (2) A Q 1 B T 2 T 1 D Q 2 C

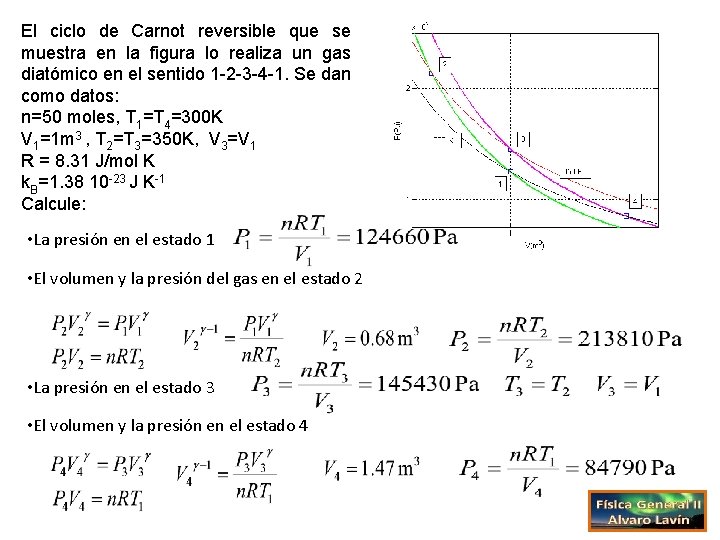
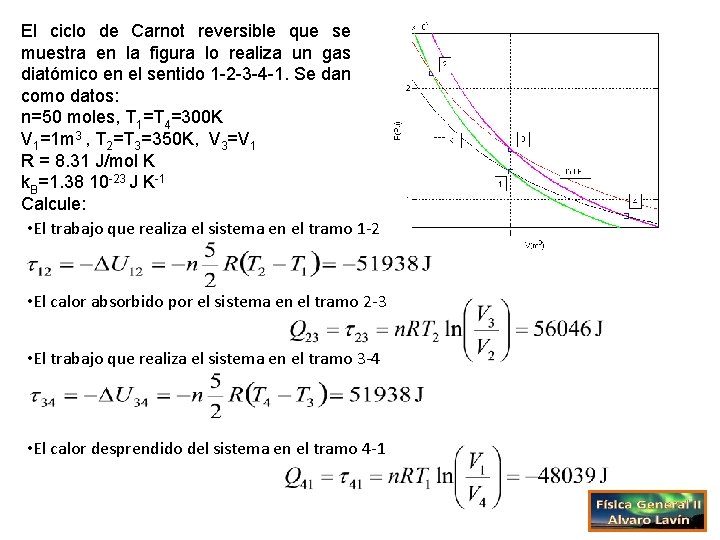
El ciclo de Carnot reversible que se muestra en la figura lo realiza un gas diatómico en el sentido 1 -2 -3 -4 -1. Se dan como datos: n=50 moles, T 1=T 4=300 K V 1=1 m 3 , T 2=T 3=350 K, V 3=V 1 R = 8. 31 J/mol K k. B=1. 38 10 -23 J K-1 Calcule: • La presión en el estado 1 • El volumen y la presión del gas en el estado 2 • La presión en el estado 3 • El volumen y la presión en el estado 4

El ciclo de Carnot reversible que se muestra en la figura lo realiza un gas diatómico en el sentido 1 -2 -3 -4 -1. Se dan como datos: n=50 moles, T 1=T 4=300 K V 1=1 m 3 , T 2=T 3=350 K, V 3=V 1 R = 8. 31 J/mol K k. B=1. 38 10 -23 J K-1 Calcule: • El trabajo que realiza el sistema en el tramo 1 -2 • El calor absorbido por el sistema en el tramo 2 -3 • El trabajo que realiza el sistema en el tramo 3 -4 • El calor desprendido del sistema en el tramo 4 -1

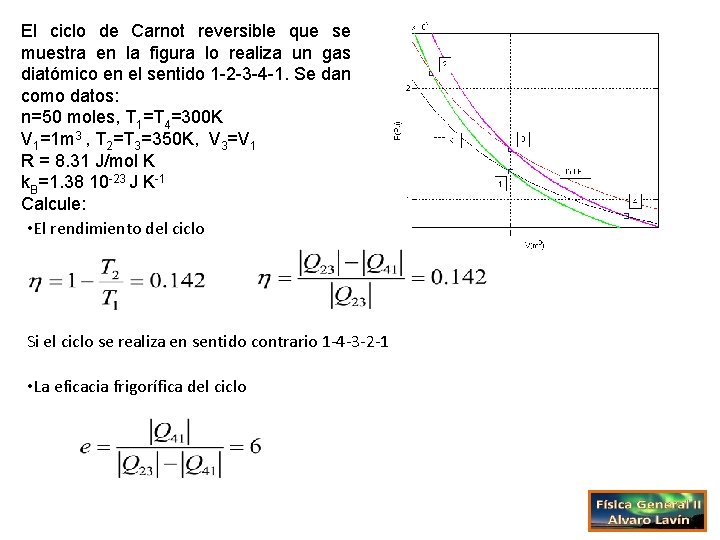
El ciclo de Carnot reversible que se muestra en la figura lo realiza un gas diatómico en el sentido 1 -2 -3 -4 -1. Se dan como datos: n=50 moles, T 1=T 4=300 K V 1=1 m 3 , T 2=T 3=350 K, V 3=V 1 R = 8. 31 J/mol K k. B=1. 38 10 -23 J K-1 Calcule: • El rendimiento del ciclo Si el ciclo se realiza en sentido contrario 1 -4 -3 -2 -1 • La eficacia frigorífica del ciclo

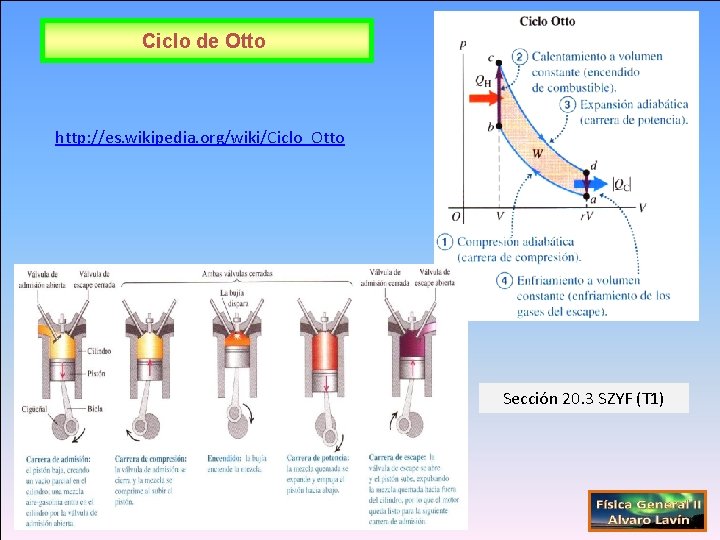
Ciclo de Otto http: //es. wikipedia. org/wiki/Ciclo_Otto Sección 20. 3 SZYF (T 1)

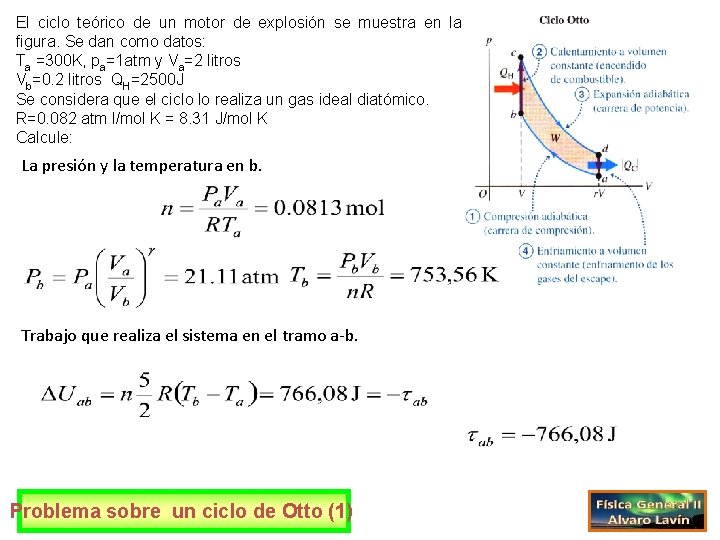
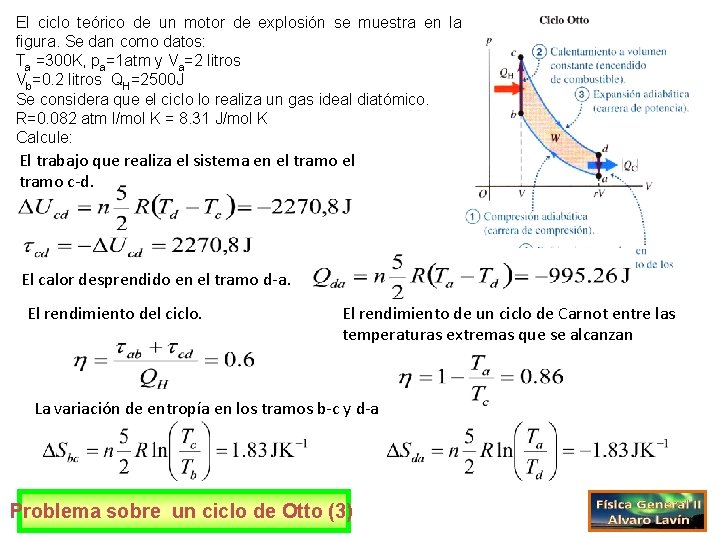
El ciclo teórico de un motor de explosión se muestra en la figura. Se dan como datos: Ta =300 K, pa=1 atm y Va=2 litros Vb=0. 2 litros QH=2500 J Se considera que el ciclo lo realiza un gas ideal diatómico. R=0. 082 atm l/mol K = 8. 31 J/mol K Calcule: La presión y la temperatura en b. Trabajo que realiza el sistema en el tramo a-b. Problema sobre un ciclo de Otto (1)

El ciclo teórico de un motor de explosión se muestra en la figura. Se dan como datos: Ta =300 K, pa=1 atm y Va=2 litros Vb=0. 2 litros QH=2500 J Se considera que el ciclo lo realiza un gas ideal diatómico. R=0. 082 atm l/mol K = 8. 31 J/mol K Calcule: La temperatura y la presión en c. La temperatura y la presión en d. Problema sobre un ciclo de Otto (2)

El ciclo teórico de un motor de explosión se muestra en la figura. Se dan como datos: Ta =300 K, pa=1 atm y Va=2 litros Vb=0. 2 litros QH=2500 J Se considera que el ciclo lo realiza un gas ideal diatómico. R=0. 082 atm l/mol K = 8. 31 J/mol K Calcule: El trabajo que realiza el sistema en el tramo c-d. El calor desprendido en el tramo d-a. El rendimiento del ciclo. El rendimiento de un ciclo de Carnot entre las temperaturas extremas que se alcanzan La variación de entropía en los tramos b-c y d-a Problema sobre un ciclo de Otto (3)

Respiración aeróbica Este proceso celular es realizado por el orgánulo mitocondrial (mitocondrias). Su ecuación general es la siguiente (respiración aeróbica): 2 C 6 H 12 O 6 + 6 O 2 6 CO 2 +6 H 2 O+ 38 ATP Se debe tener en cuenta que la equivalencia a 38 ATP se daría en condiciones óptimas, que de hecho son poco frecuentes. Los valores considerados más fieles a la realidad son de 34 a 36 ATP. 3 A study of synchronisation between the flagella of bull spermatozoa, with related observations David M. Woolley, Rachel F. Crockett, William D. I. Groom, Stuart G. Revell Journal of Experimental Biology 2009 212: 2215 -2223;

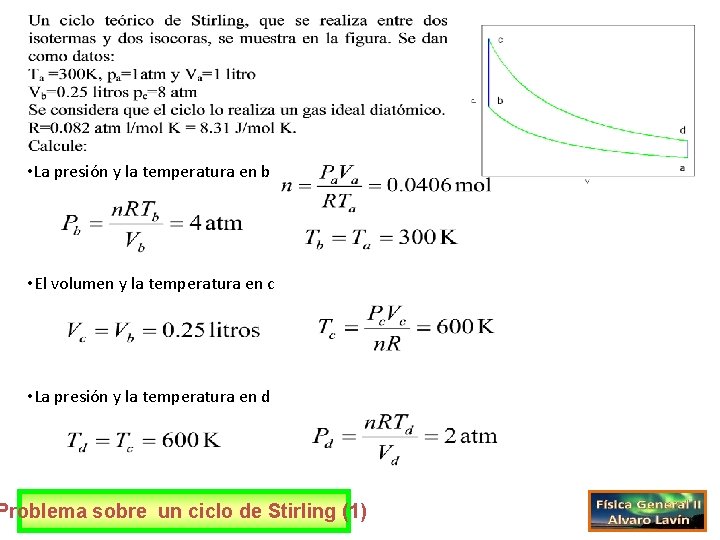
• La presión y la temperatura en b • El volumen y la temperatura en c • La presión y la temperatura en d Problema sobre un ciclo de Stirling (1)

• El calor intercambiado y el trabajo realizado en el tramo ab • La variación de energía interna y el calor intercambiado en el tramo bc • El calor intercambiado y el trabajo realizado en el tramo cd • La variación de energía interna y el calor intercambiado en el tramo da Problema sobre un ciclo de Stirling (2)

• El rendimiento del ciclo • Las variaciones de entropía en los tramos ab, bc, cd y da Problema sobre un ciclo de Stirling (3)

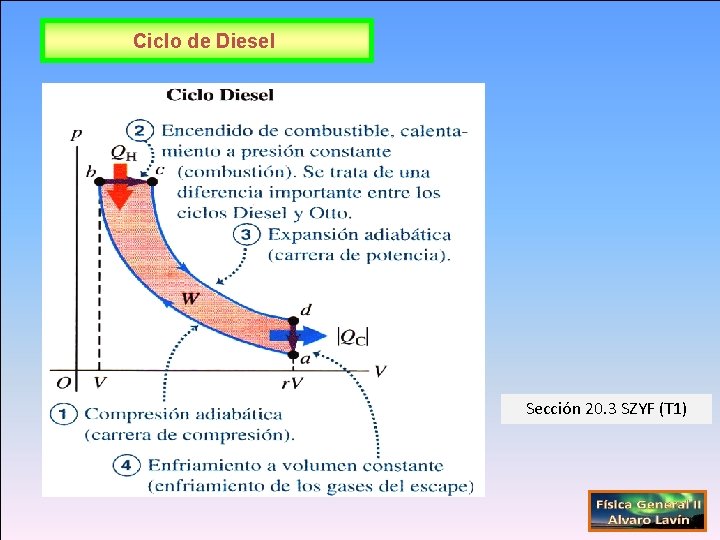
Ciclo de Diesel Sección 20. 3 SZYF (T 1)

El ciclo aproximado de un motor Diesel se muestra en la figura. Se dan como datos: Ta =300 K, pa=1 atm y Va=2 litros Tb=700 K Vb=0. 24 litros QH=3500 J Se considera que el ciclo lo realiza un gas ideal diatómico. R=0. 082 atm l/mol K = 8. 31 J/mol K Calcule: El trabajo y la variación de energía interna en el tramo a-b. La temperatura y el volumen en c. roblema (A) sobre un ciclo de Diesel (1)

El ciclo aproximado de un motor Diesel se muestra en la figura. Se dan como datos: Ta =300 K, pa=1 atm y Va=2 litros Tb=700 K Vb=0. 24 litros QH=3500 J Se considera que el ciclo lo realiza un gas ideal diatómico. R=0. 082 atm l/mol K = 8. 31 J/mol K Calcule: El trabajo y la variación de energía interna en el tramo b-c. La temperatura y la presión en d. Problema (A) sobre un ciclo de Diesel (2)

El ciclo aproximado de un motor Diesel se muestra en la figura. Se dan como datos: Ta =300 K, pa=1 atm y Va=2 litros Tb=700 K Vb=0. 24 litros QH=3500 J Se considera que el ciclo lo realiza un gas ideal diatómico. R=0. 082 atm l/mol K = 8. 31 J/mol K Calcule: El trabajo y la variación de energía interna en el tramo c-d. El calor desprendido en el tramo d-a. El rendimiento del ciclo. El rendimiento de un ciclo de Carnot entre las temperaturas extremas que se alcanzan La variación de entropía en los tramos b-c y d-a roblema (A) sobre un ciclo de Diesel (3)

El ciclo aproximado de un motor Diesel se muestra en la figura. Se dan como datos: Ta =300 K, pa=1 atm y Va=1 litro Vb=0. 1 litros QH=2000 J Se considera que el ciclo lo realiza un gas ideal diatómico. R=0. 082 atm l/mol K = 8. 31 J/mol K Calcule: La presión y la temperatura en b. La temperatura y el volumen en c. roblema (B) sobre un ciclo de Diesel (1)

El ciclo aproximado de un motor Diesel se muestra en la figura. Se dan como datos: Ta =300 K, pa=1 atm y Va=1 litro Vb=0. 1 litros QH=2000 J Se considera que el ciclo lo realiza un gas ideal diatómico. R=0. 082 atm l/mol K = 8. 31 J/mol K Calcule: La temperatura y la presión en d. El trabajo y la variación de energía interna en el tramo a-b. El trabajo y la variación de energía interna en el tramo b-c. Problema (B) sobre un ciclo de Diesel (2)

El ciclo aproximado de un motor Diesel se muestra en la figura. Se dan como datos: Ta =300 K, pa=1 atm y Va=1 litros Vb=0. 1 litros QH=2000 J Se considera que el ciclo lo realiza un gas ideal diatómico. R=0. 082 atm l/mol K = 8. 31 J/mol K Calcule: El trabajo y la variación de energía interna en el tramo c-d. El calor desprendido y la variación de energía interna en el tramo d-a. El rendimiento del ciclo. La variación de entropía en los tramos b-c y d-a roblema (B) sobre un ciclo de Diesel (3)

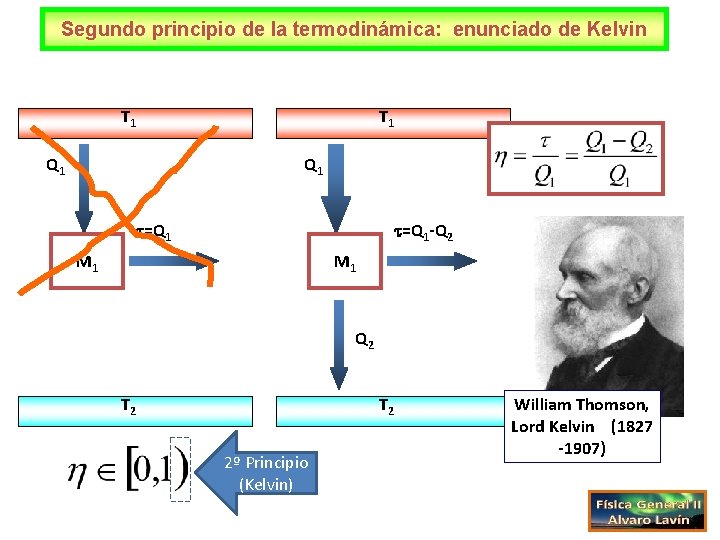
Segundo principio de la termodinámica: enunciado de Kelvin T 1 Q 1 =Q 1 -Q 2 M 1 Q 2 T 2 2º Principio (Kelvin) William Thomson, Lord Kelvin (1827 -1907)

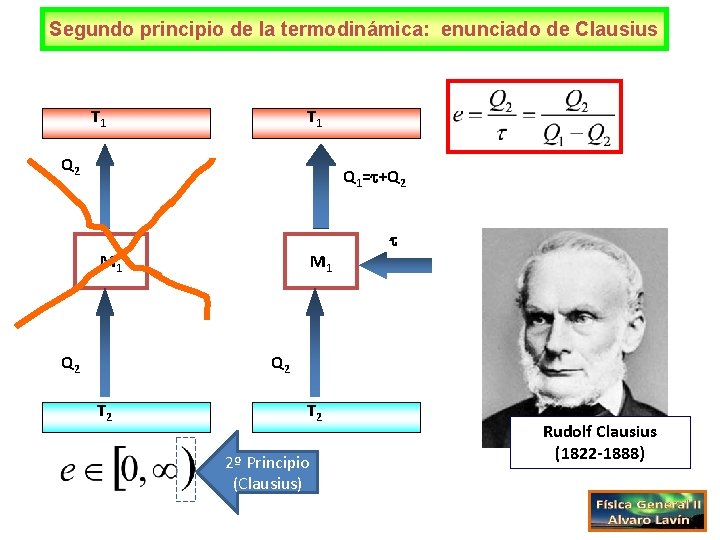
Segundo principio de la termodinámica: enunciado de Clausius T 1 Q 2 Q 1= +Q 2 M 1 Q 2 T 2 2º Principio (Clausius) Rudolf Clausius (1822 -1888)

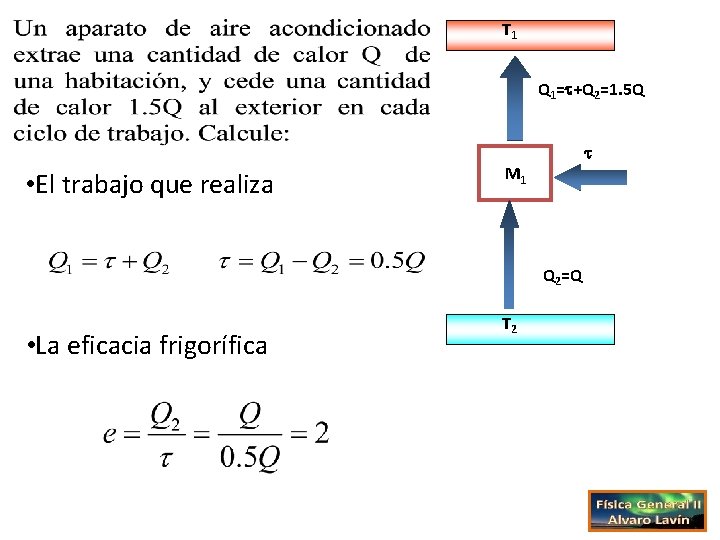
T 1 Q 1= +Q 2=1. 5 Q • El trabajo que realiza M 1 Q 2=Q • La eficacia frigorífica T 2

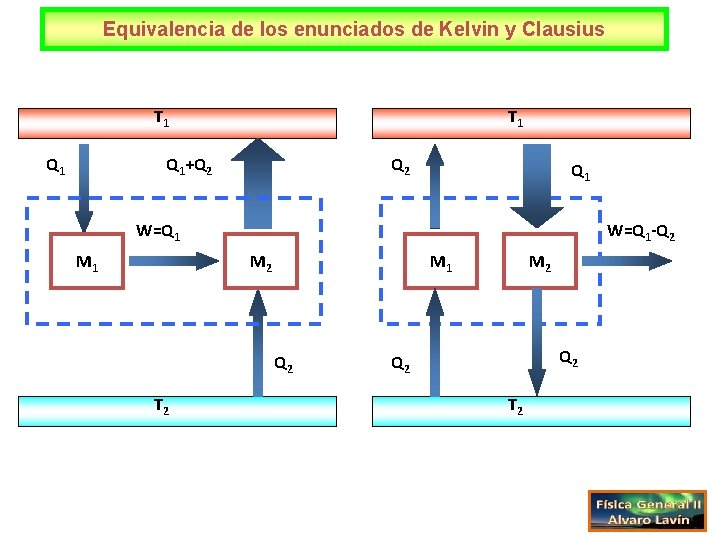
Equivalencia de los enunciados de Kelvin y Clausius T 1 Q 1+Q 2 Q 1 W=Q 1 M 1 W=Q 1 -Q 2 M 1 Q 2 T 2 M 2 Q 2 T 2

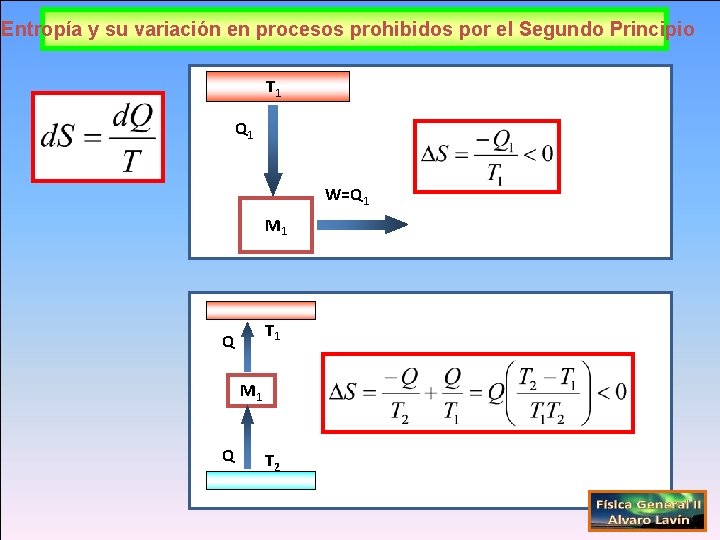
Entropía y su variación en procesos prohibidos por el Segundo Principio T 1 Q 1 W=Q 1 M 1 T 1 Q M 1 Q T 2

Entropía y Segundo Principio de la Termodinámica Si se incluyen todos los sistemas que participan en un proceso la entropía permanece constante o aumenta No puede haber un proceso en el que la entropía del universo disminuya

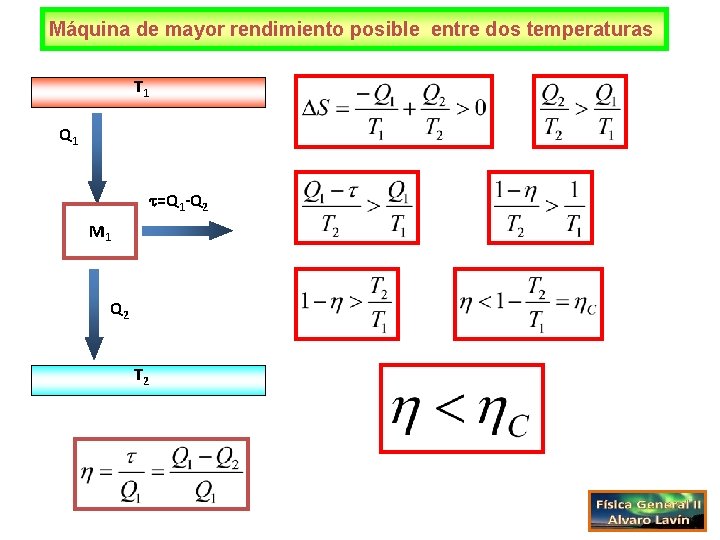
Máquina de mayor rendimiento posible entre dos temperaturas T 1 Q 1 =Q 1 -Q 2 M 1 Q 2 T 2

Variaciones de entropía del gas ideal: procesos isocoro, isobaro e isotermo Isocora Isobara a rm te Isocora Isoterma Isobara Isot erm a

• La temperatura final de la mezcla en K. • El incremento de entropía del universo.

• La temperatura final de la mezcla • La variación de entropía del hielo al fundirse • La variación de entropía de los 100 g de hielo fundido al pasar de 0 °C a la temperatura final de la mezcla • La variación de entropía del universo • La variación de entropía de los 1000 g de agua líquida al pasar de 70 °C a la temperatura final de la mezcla

Publicaciones del Departamento de Física Aplicada: • PROBLEMAS DE FÍSICA, J. J. Scala, Sociedad de Amigos de la ETSII. (Capítulo 1: Termodinámica) Obras generales: • FISICA UNIVERSITARIA I y II, Sears, Zemansky, Young, Freedman, Ed. Addison. Wesley Capítulos 17 -20 (Tomo 1)