NOMENCLATURA y FORMULACIN en QUMICA INORGNICA Adaptado a






























- Slides: 46

NOMENCLATURA y FORMULACIÓN en QUÍMICA INORGÁNICA Adaptado a las normas de la IUPAC 2005

0. Introducción Valencia Es la capacidad que posee un elemento de combinarse con otro Electrovalencia: nº de electrones que puede ganar o ceder un átomo en la formación de un compuesto iónico Covalencia: nº de electrones que se pueden compartir en un enlace covalente

0. Introducción Número de oxidación de un átomo en un compuesto químico El número de oxidación de un átomo que forma parte de un compuesto químico es la carga aparente con la que dicho elemento está funcionando en ese compuesto o especie. Los estados de oxidación pueden ser positivos, negativos, cero, enteros y fraccionarios. El nº de oxidación no tiene porqué coincidir con la valencia de un elemento: CH 4: la valencia del C es IV; el nº oxidación es -4 CH 3 Cl: la valencia del C es IV; el nº oxidación es -2 CH 2 Cl 2: la valencia del C es IV; el nº oxidación es 0 CCl 4: la valencia del C es IV; el nº oxidación es +4

0. Introducción Las reglas de asignación del número de oxidación son: 1. El n. o. de todos los elementos libres es cero, en cualquiera de las formas en que se presenten: Ca , He, N 2 , H 2, O 2 P 4 , etc. 2. El n. o. de un ión simple coincide con su carga: Así, los n. o. del S 2–, Cl– y Zn 2+ son, respectivamente, – 2, – 1, +2 3. El n. o. del H en sus compuestos es +1, excepto en los hidruros metálicos, que es – 1 4. El n. o. del O en sus compuestos es – 2, excepto en los peróxidos, que es – 1 5. El n. o. de los metales alcalinos (Grupo 1) es siempre +1 6. El n. o. de los metales alcalinotérreos (Grupo 2) es siempre +2 7. La suma algebraica de los n. o. de los átomos de una molécula es cero, y si se trata de un ión , igual a la carga del ión

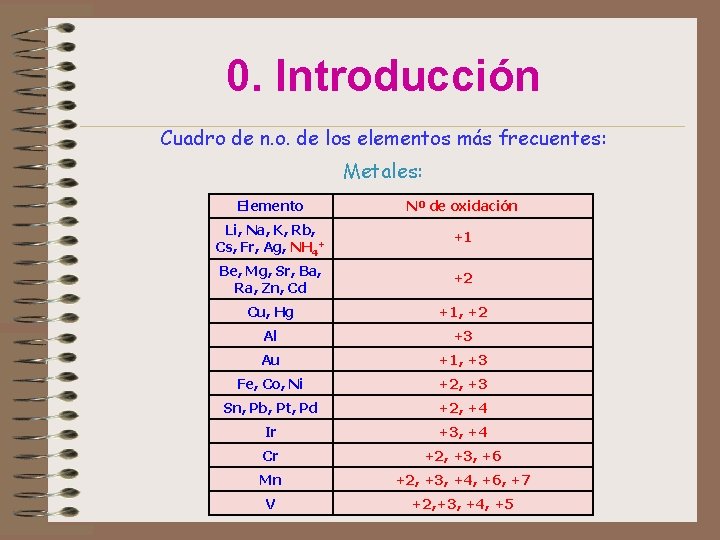
0. Introducción Cuadro de n. o. de los elementos más frecuentes: No metales: Elemento Nº de oxidación H -1; +1 F Cl, Br, I -1 -1; +1, +3, +5, +7 O S, Se, Te -2 -2; +2, +4, +6 N P As, Sb, Bi -3; +1, +2, +3, +4, +5 -3; +1, +3, +5 -3; +3, +5 B -3; +3 C Si -4; +2, +4 -4; +4

0. Introducción Cuadro de n. o. de los elementos más frecuentes: Metales: Elemento Nº de oxidación Li, Na, K, Rb, Cs, Fr, Ag, NH 4+ +1 Be, Mg, Sr, Ba, Ra, Zn, Cd +2 Cu, Hg +1, +2 Al +3 Au +1, +3 Fe, Co, Ni +2, +3 Sn, Pb, Pt, Pd +2, +4 Ir +3, +4 Cr +2, +3, +6 Mn +2, +3, +4, +6, +7 V +2, +3, +4, +5

0. Introducción Regla general de la formulación: En cualquier fórmula química se escribe en primer lugar los elementos situados a la izquierda de la T. P. (menos electronegativo), y en segundo lugar, los situados a la derecha (más electronegativos). Ej: Na. Cl y no Cl. Na. Orden de electronegatividad aplicada a la formulación:

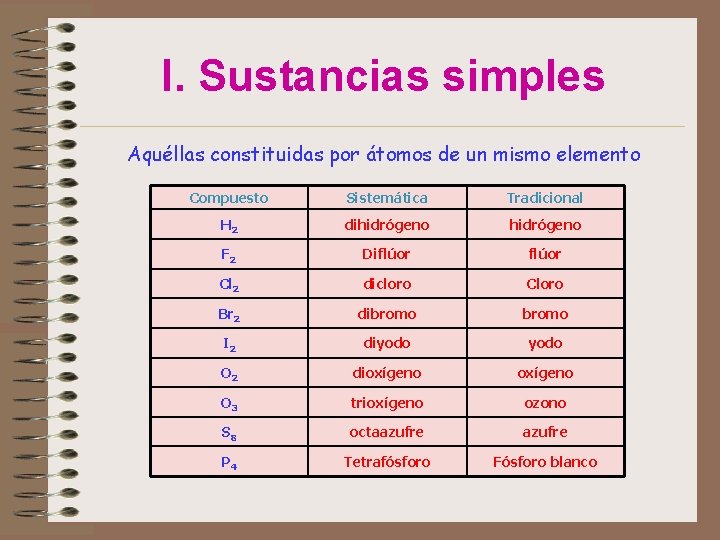
I. Sustancias simples Aquéllas constituidas por átomos de un mismo elemento • Los gases nobles son monoatómicos: He, Ne, Ar, Kr, Xe, Rn • Las moléculas de bastantes sustancias que en c. n. son gases, son diatómicas: N 2, F 2, O 2, … • Elementos que presentan estados alotrópicos (agrupaciones de distintos nº de átomos: S 8, O 3, P 4, … • Los metales, en las ecuaciones químicas, se representan simplemente mediante el símbolo: Cu, Sn, Fe, Ag, …

I. Sustancias simples Aquéllas constituidas por átomos de un mismo elemento Compuesto Sistemática Tradicional H 2 dihidrógeno F 2 Diflúor Cl 2 dicloro Cloro Br 2 dibromo I 2 diyodo O 2 dioxígeno O 3 trioxígeno ozono S 8 octaazufre P 4 Tetrafósforo Fósforo blanco

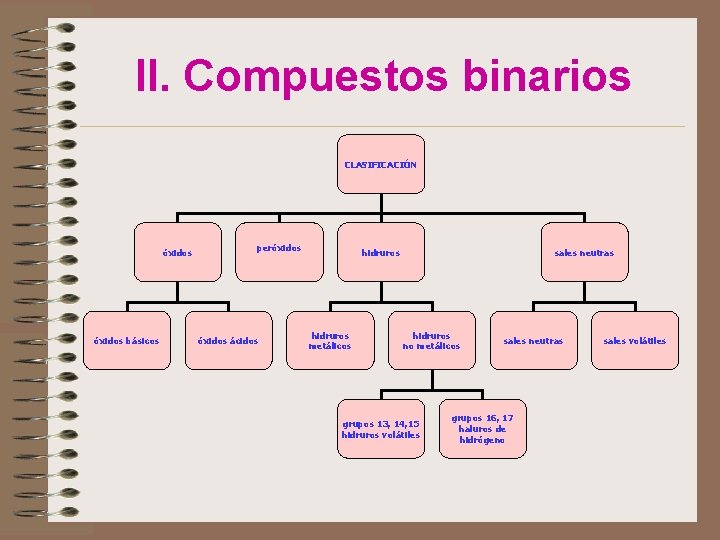
II. Compuestos binarios Están formados por dos elementos • Se escriben los elementos en un orden: primero el menos electronegativo y luego el más electronegativo • Se intercambian los n. o. , pero prescindiendo del signo • Siempre que sea posible se simplifica: Cu 2 S 2 Cu. S +3 -2 Al 2 O 3 • El compuesto se lee de derecha a izquierda Sistemas de nomenclaturas • De composición • De adición • De sustitución • Tradicional (el sistema más antiguo)

Nomenclatura de composición • • Está basada en la composición no en la estructura El tipo más simple es la estequiométrica En ella se indica la proporción de los constituyentes Esta proporción puede indicarse de varias formas: 1. Con prefijos multiplicativos (mono-, di-, tri-, …) 2. Utilizando nos de oxidación (Stock, mediante nos romanos) 3. Utilizando la carga de los iones

II. Compuestos binarios CLASIFICACIÓN óxidos básicos peróxidos ácidos hidruros metálicos sales neutras hidruros no metálicos grupos 13, 14, 15 hidruros volátiles sales neutras grupos 16, 17 haluros de hidrógeno sales volátiles

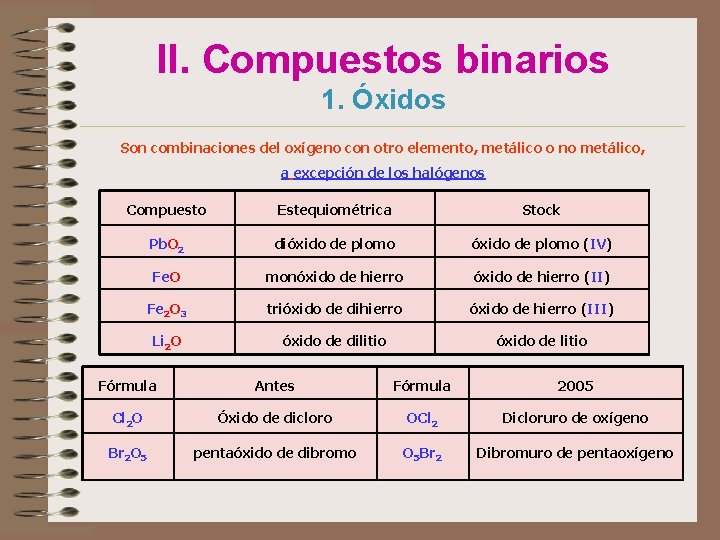
II. Compuestos binarios 1. Óxidos Son combinaciones del oxígeno con otro elemento, metálico o no metálico, a excepción de los halógenos Compuesto Estequiométrica Stock Pb. O 2 dióxido de plomo (IV) Fe. O monóxido de hierro (II) Fe 2 O 3 trióxido de dihierro óxido de hierro (III) Li 2 O óxido de dilitio óxido de litio Fórmula Antes Fórmula 2005 Cl 2 O Óxido de dicloro OCl 2 Dicloruro de oxígeno Br 2 O 5 pentaóxido de dibromo O 5 Br 2 Dibromuro de pentaoxígeno

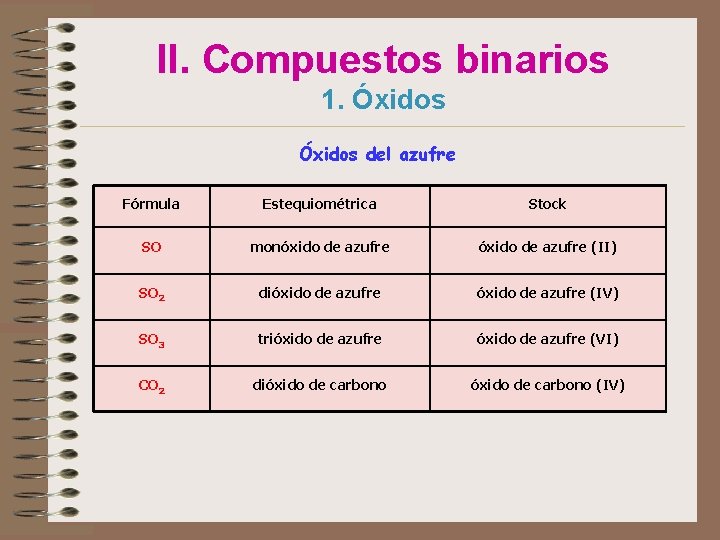
II. Compuestos binarios 1. Óxidos del azufre Fórmula Estequiométrica Stock SO monóxido de azufre (II) SO 2 dióxido de azufre (IV) SO 3 trióxido de azufre (VI) CO 2 dióxido de carbono (IV)

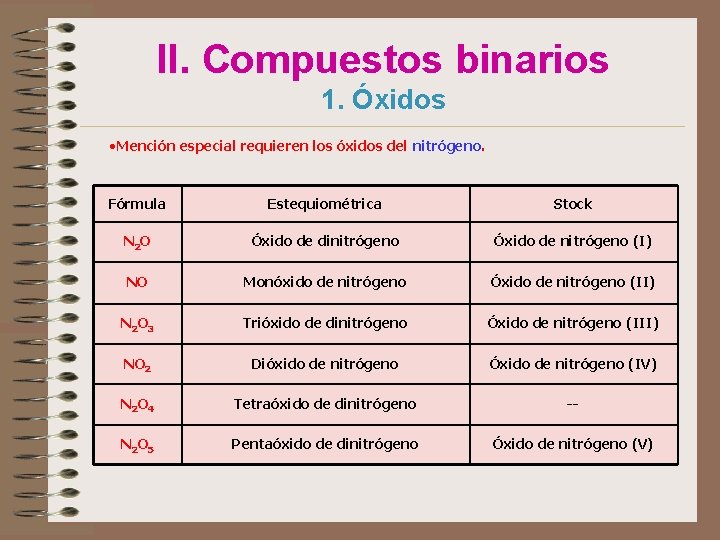
II. Compuestos binarios 1. Óxidos • Mención especial requieren los óxidos del nitrógeno. Fórmula Estequiométrica Stock N 2 O Óxido de dinitrógeno Óxido de nitrógeno (I) NO Monóxido de nitrógeno Óxido de nitrógeno (II) N 2 O 3 Trióxido de dinitrógeno Óxido de nitrógeno (III) NO 2 Dióxido de nitrógeno Óxido de nitrógeno (IV) N 2 O 4 Tetraóxido de dinitrógeno -- N 2 O 5 Pentaóxido de dinitrógeno Óxido de nitrógeno (V)

II. Compuestos binarios 2. Peróxidos Son combinaciones del oxígeno que contienen el grupo peroxo (-O-O-). En ellos el número de oxidación del oxígeno es -1 (O 2)2 La nomenclatura es igual que la de los óxidos. Cambiando en la de Stock la palabra óxido por peróxido Fórmula Estequiométrica Stock Cu. O 2 Dióxido de cobre Peróxido de cobre(II) Na 2 O 2 Dióxido de disodio Peróxido de sodio H 2 O 2 Dioxido de dihidrógeno Peróxido de hidrógeno Para el compuesto H 2 O 2 la IUPAC acepta el nombre común de agua oxigenada

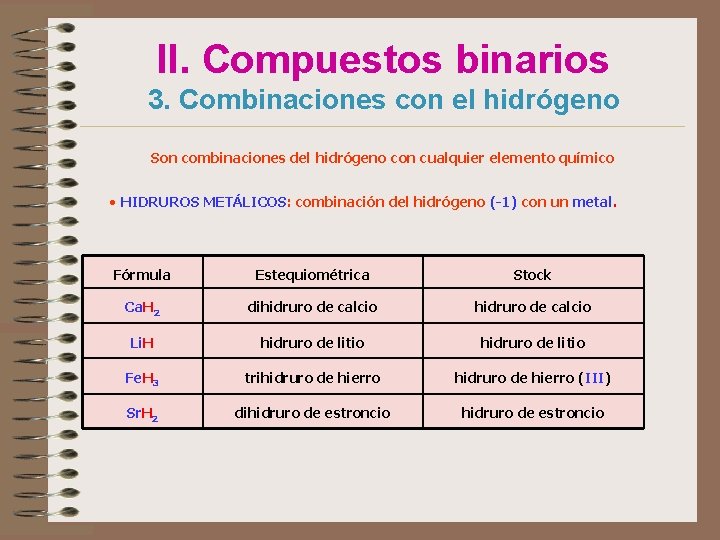
II. Compuestos binarios 3. Combinaciones con el hidrógeno Son combinaciones del hidrógeno con cualquier elemento químico • HIDRUROS METÁLICOS: combinación del hidrógeno (-1) con un metal. Fórmula Estequiométrica Stock Ca. H 2 dihidruro de calcio Li. H hidruro de litio Fe. H 3 trihidruro de hierro (III) Sr. H 2 dihidruro de estroncio

II. Compuestos binarios 3. Combinaciones con el hidrógeno • Combinaciones del hidrógeno (+1) con los no metales de los grupos 16 (nº oxidación -2) y 17(nº oxidación -1). • Estos compuestos en disolución acuosa tienen carácter ácido y se llaman ácidos hidrácidos Fórmula Estequiométrica En disolución acuosa HF Fluoruro de hidrógeno Ácido fluorhídrico HCl Cloruro de hidrógeno Ácido clorhídrico HBr Bromuro de hidrógeno Ácido bromhídrico HI Yoduro de hidrógeno Ácido yodhídrico H 2 S Sulfuro de dihidrógeno Ácido sulfhídrico H 2 Se Seleniuro de dihidrógeno Ácido selenhídrico

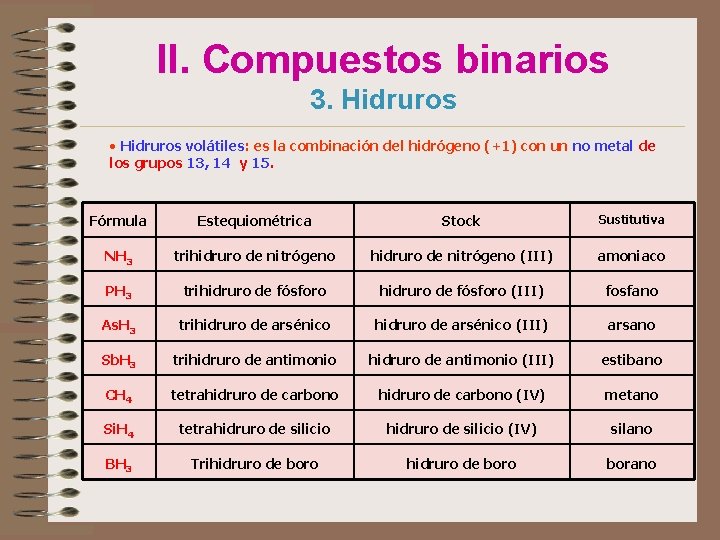
II. Compuestos binarios 3. Hidruros • Hidruros volátiles: es la combinación del hidrógeno (+1) con un no metal de los grupos 13, 14 y 15. Fórmula Estequiométrica Stock Sustitutiva NH 3 trihidruro de nitrógeno (III) amoniaco PH 3 trihidruro de fósforo (III) fosfano As. H 3 trihidruro de arsénico (III) arsano Sb. H 3 trihidruro de antimonio (III) estibano CH 4 tetrahidruro de carbono (IV) metano Si. H 4 tetrahidruro de silicio (IV) silano BH 3 Trihidruro de boro borano

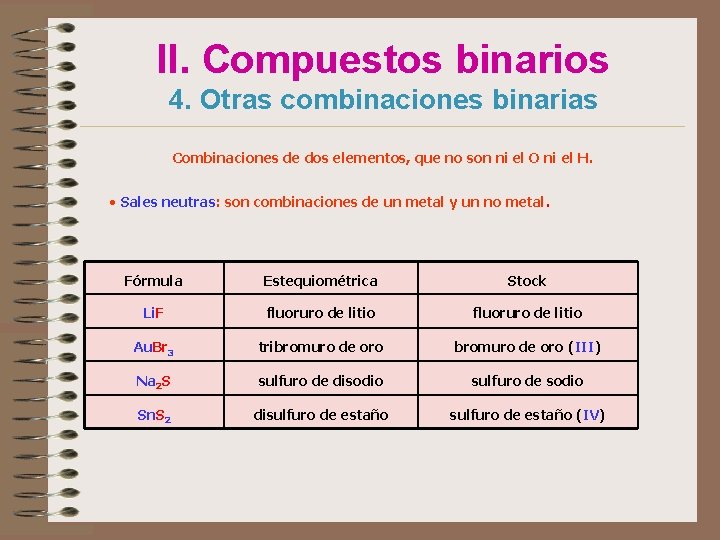
II. Compuestos binarios 4. Otras combinaciones binarias Combinaciones de dos elementos, que no son ni el O ni el H. • Sales neutras: son combinaciones de un metal y un no metal. Fórmula Estequiométrica Stock Li. F fluoruro de litio Au. Br 3 tribromuro de oro (III) Na 2 S sulfuro de disodio sulfuro de sodio Sn. S 2 disulfuro de estaño (IV)

II. Compuestos binarios 4. Otras combinaciones binarias • Combinaciones de dos no metales. El más electronegativo se pone a la derecha y es el que lleva la terminación -uro Fórmula Estequiométrica Stock Br. F 3 trifluoruro de bromo (III) Br. Cl cloruro de bromo (I) CCl 4 tetracloruro de carbono (IV) As 2 Se 3 triseleniuro de diarsénico seleniuro de arsénico (III)

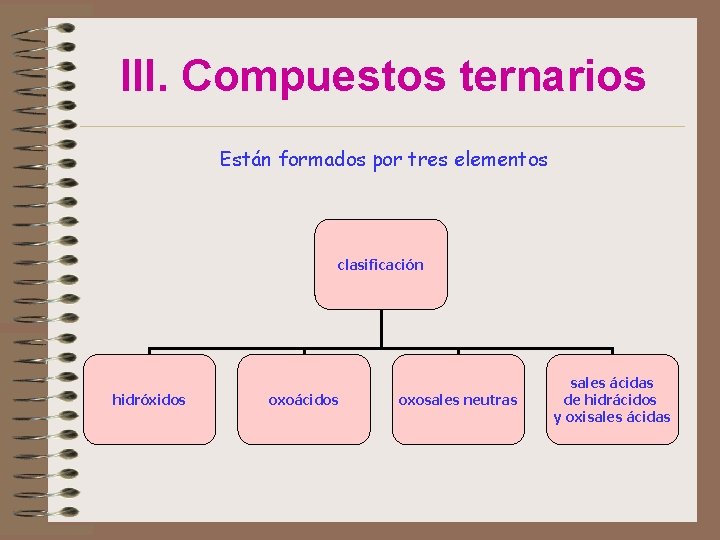
III. Compuestos ternarios Están formados por tres elementos clasificación hidróxidos oxoácidos oxosales neutras sales ácidas de hidrácidos y oxisales ácidas

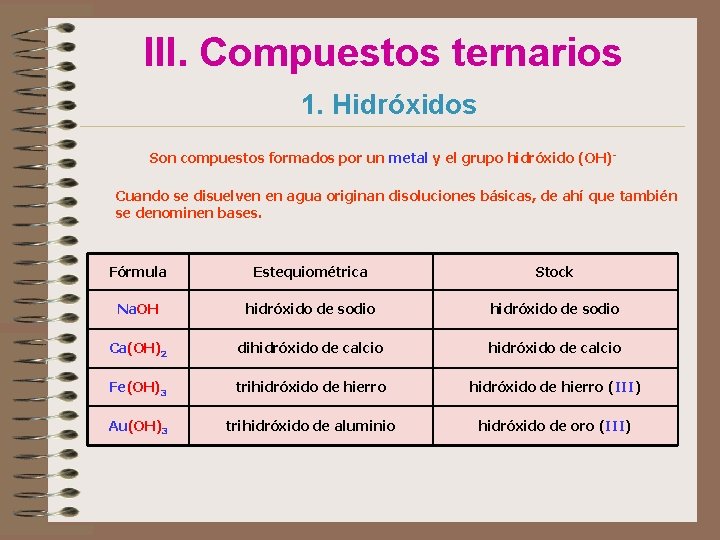
III. Compuestos ternarios 1. Hidróxidos Son compuestos formados por un metal y el grupo hidróxido (OH)Cuando se disuelven en agua originan disoluciones básicas, de ahí que también se denominen bases. Fórmula Estequiométrica Stock Na. OH hidróxido de sodio Ca(OH)2 dihidróxido de calcio Fe(OH)3 trihidróxido de hierro (III) Au(OH)3 trihidróxido de aluminio hidróxido de oro (III)

III. Compuestos ternarios 2. Oxoácidos Son compuestos formados por hidrógeno, no metal y oxígeno. • Su fórmula general es: Ha. Xb. Oc, donde X es un no metal o algún metal de transición con alto estado de oxidación. § Según las recomendaciones de la IUPAC de 2005, se pueden nombrar de tres formas diferentes: nomenclatura común o clásica, nomenclatura de adición y nomenclatura de hidrógeno

Prefijos y sufijos utilizados en la nomenclatura tradicional (clásica) • Consiste en añadir un sufijo al nombre del elemento según con el n. o. con el que actúe: Posibilidad de n. o. uno dos terminación -ico n. o. menor -oso n. o. mayor -ico n. o. menor hipo tres -oso n. o. intermedia -oso n. o. mayor -ico n. o. menor hipo cuatro -oso n. o. intermedio -ico n. o. mayor per -ico

III. Compuestos ternarios 2. Oxoácidos • Oxoácidos del grupo de los halógenos (Grupo 17): Cl, Br, I (+1, +3, +5, +7) • Cl 2 O + H 2 O HCl. O • Cl 2 O 3 + H 2 O HCl. O 2 • Cl 2 O 5 + H 2 O HCl. O 3 • Cl 2 O 7 + H 2 O HCl. O 4 Fórmula Tradicional HCl. O ácido hipocloroso HCl. O 2 ácido cloroso HCl. O 3 ácido clórico HCl. O 4 ácido perclórico

III. Compuestos ternarios 2. Oxoácidos • Oxoácidos del grupo de los anfígenos (Grupo 16) : S, Se, Te (+2, +4, +6) • SO + H 2 O H 2 SO 2 • SO 2 + H 2 O H 2 SO 3 • SO 3 + H 2 O H 2 SO 4 Fórmula Tradicional H 2 SO 2 ácido hiposulfuroso H 2 SO 3 ácido sulfuroso H 2 SO 4 ácido sulfúrico

III. Compuestos ternarios 2. Oxoácidos • Oxoácidos del grupo 15: N (+1, +3, +5), P (+1, +3, +5), As, Sb (+3, +5) • N 2 O + H 2 O HNO • N 2 O 3 + H 2 O HNO 2 • N 2 O 5 + H 2 O HNO 3 Fórmula Tradicional HNO ácido hiponitroso HNO 2 ácido nitroso HNO 3 ácido nítrico

III. Compuestos ternarios 2. Oxoácidos • Oxoácidos del grupo 15: N (+1, +3, +5), P (+1, +3, +5), As, Sb (+3, +5) El P, As y Sb pueden formar más de un oxoácido con el mismo n. o. • óxido + H 2 O oxoácido META • P 2 O 5 + H 2 O HPO 3 • óxido + 2 H 2 O oxoácido DI o PIRO • P 2 O 5 +2 H 2 O H 4 P 2 O 7 • Óxido + 3 H 2 O oxoácido (ORTO) • P 2 O 5 +3 H 2 O H 3 PO 4 Fórmula Tradicional HPO 3 ácido metafosfórico H 4 P 2 O 7 ácido difosfórico H 3 PO 4 ácido (orto)fosfórico

III. Compuestos ternarios 2. Oxoácidos • Oxoácidos del grupo 15: N (+1, +3, +5), P (+1, +3, +5), As, Sb (+3, +5) El P, As y Sb pueden formar más de un oxoácido con el mismo n. o. +1 +5 -2 • H P O 3 = H P O 3 +1 +5 -2 • H 3 PO 3+1 = H 3 PO 4 Fórmula Tradicional HPO 3 ácido metafosfórico H 4 P 2 O 7 ácido difosfórico H 3 PO 4 ácido (orto)fosfórico

III. Compuestos ternarios 2. Oxoácidos • Oxoácidos del grupo 14: C (+4), Si (+4) Mientras que el C sólo forma un oxoácido (que es inestable), el Si puede formar tres. • CO 2 + H 2 O H 2 CO 3 Fórmula Tradicional H 2 CO 3 ácido carbónico

III. Compuestos ternarios 2. Oxoácidos • Oxoácidos del grupo 14: C (+4), Si (+4) Mientras que el C sólo forma un oxoácido (que es inestable), el Si puede formar tres. • Si. O 2 + H 2 O H 2 Si. O 3 • H 2 Si. O 3 + H 2 O H 4 Si. O 4 • 2 H 4 Si. O 4 - H 2 O H 6 Si 2 O 7 Fórmula Tradicional H 2 Si. O 3 ácido metasilícico H 6 Si 2 O 7 ácido disilícico H 4 Si. O 4 ácido (orto)silícico

III. Compuestos ternarios 2. Oxoácidos • Oxoácidos del grupo 13: B (+3) No se formula el ácido dibórico; sí el tetrabórico, que excede a este nivel. • B 2 O 3 + H 2 O HBO 2 • HBO 2 + H 2 O H 3 BO 3 Fórmula Tradicional HBO 2 ácido metabórico H 3 BO 3 ácido (orto)bórico

III. Compuestos ternarios 2. Oxoácidos • Oxoácidos del manganeso: Mn (+4, +6, +7) Análogos serían los oxoácidos del tecnecio y del renio, que exceden a este nivel. • Mn. O 2 + H 2 O H 2 Mn. O 3 • Mn. O 3 + H 2 O H 2 Mn. O 4 • Mn 2 O 7 + H 2 O HMn. O 4 Fórmula Tradicional H 2 Mn. O 3 ácido manganoso H 2 Mn. O 4 ácido mangánico HMn. O 4 ácido permangánico

III. Compuestos ternarios 2. Oxoácidos • Oxoácidos del cromo: Cr (+6) Se obtienen los dos oxoácidos siguientes: • Cr. O 3 + H 2 O H 2 Cr. O 4 • 2 H 2 Cr. O 4 - H 2 O H 2 Cr 2 O 7 Fórmula Tradicional H 2 Cr. O 4 ácido crómico H 2 Cr 2 O 7 ácido dicrómico

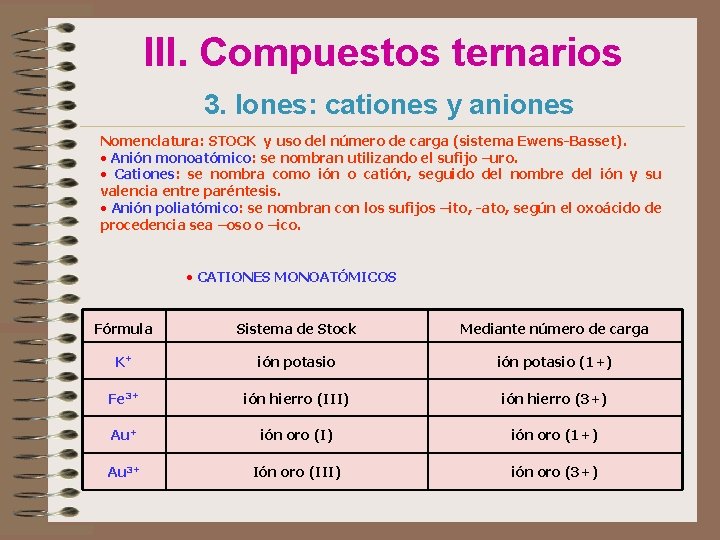
III. Compuestos ternarios 3. Iones: cationes y aniones Un átomo se transforma en un ión positivo (catión) si cede electrones y en ión negativo (anión) si gana electrones. En general: • los metales forman cationes • los no metales forman aniones monoatómico: formado por un solo átomo. Su carga coincide con su n. o. Ión poliatómicos: formado por varios átomos. La mayoría son aniones.

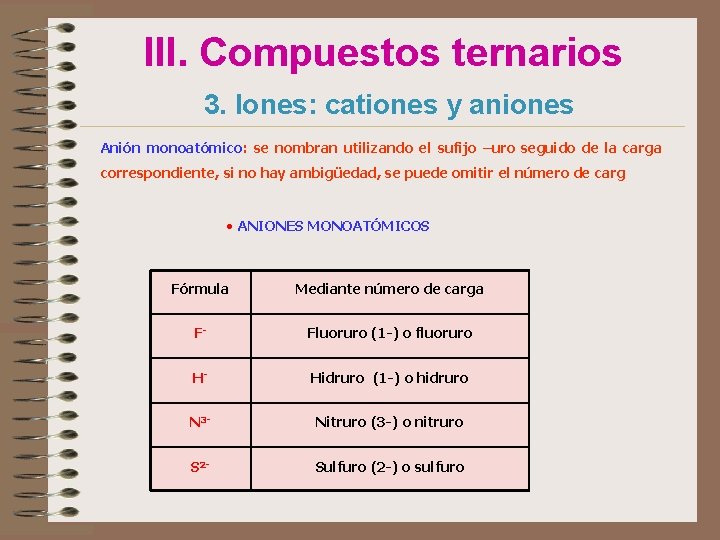
III. Compuestos ternarios 3. Iones: cationes y aniones Nomenclatura: STOCK y uso del número de carga (sistema Ewens-Basset). • Anión monoatómico: se nombran utilizando el sufijo –uro. • Cationes: se nombra como ión o catión, seguido del nombre del ión y su valencia entre paréntesis. • Anión poliatómico: se nombran con los sufijos –ito, -ato, según el oxoácido de procedencia sea –oso o –ico. • CATIONES MONOATÓMICOS Fórmula Sistema de Stock Mediante número de carga K+ ión potasio (1+) Fe 3+ ión hierro (III) ión hierro (3+) Au+ ión oro (I) ión oro (1+) Au 3+ Ión oro (III) ión oro (3+)

III. Compuestos ternarios 3. Iones: cationes y aniones Anión monoatómico: se nombran utilizando el sufijo –uro seguido de la carga correspondiente, si no hay ambigüedad, se puede omitir el número de carg • ANIONES MONOATÓMICOS Fórmula Mediante número de carga F- Fluoruro (1 -) o fluoruro H- Hidruro (1 -) o hidruro N 3 - Nitruro (3 -) o nitruro S 2 - Sulfuro (2 -) o sulfuro

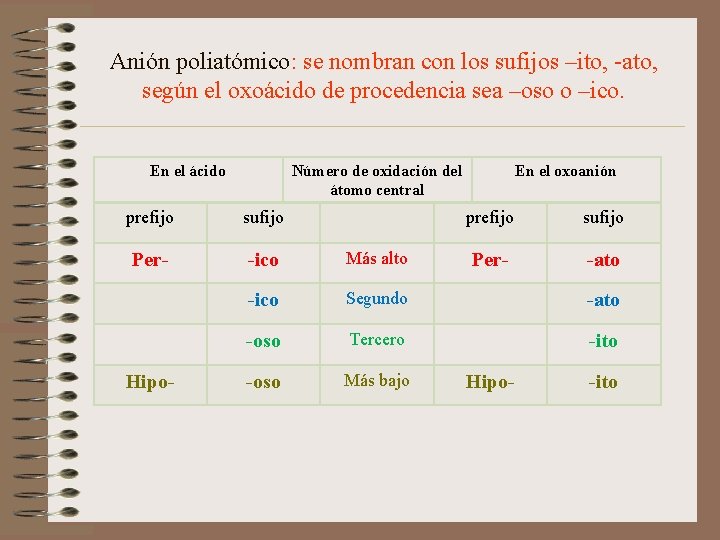
Anión poliatómico: se nombran con los sufijos –ito, -ato, según el oxoácido de procedencia sea –oso o –ico. En el ácido Número de oxidación del átomo central En el oxoanión prefijo sufijo Per- -ico Más alto -ico Segundo -ato -oso Tercero -ito -oso Más bajo Hipo- prefijo sufijo Per- -ato Hipo- -ito

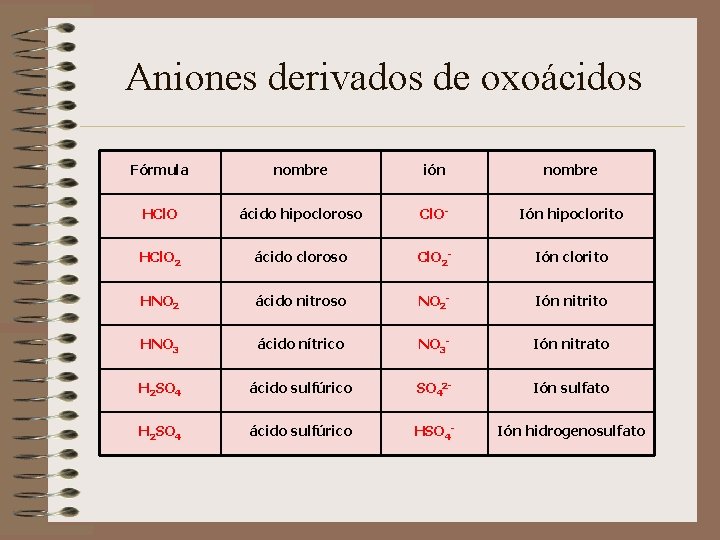
Aniones derivados de oxoácidos Fórmula nombre ión nombre HCl. O ácido hipocloroso Cl. O- Ión hipoclorito HCl. O 2 ácido cloroso Cl. O 2 - Ión clorito HNO 2 ácido nitroso NO 2 - Ión nitrito HNO 3 ácido nítrico NO 3 - Ión nitrato H 2 SO 4 ácido sulfúrico SO 42 - Ión sulfato H 2 SO 4 ácido sulfúrico HSO 4 - Ión hidrogenosulfato

III. Compuestos ternarios 4. Oxosales neutras Son compuestos derivados de un oxoácido, en el que se sustituyen los hidrógenos por un metal Están formados por un metal, no metal y oxígeno. Se obtienen por neutralización total de un oxoácido y un hidróxido: • oxoácido + hidróxido oxosal + agua • HNO 3 + Na. OH Na. NO 3 + H 2 O NOMENCLATURA • Nomenclatura común o clásica (tradicional): se nombra el oxoanión y tras la palabra “de” el nombre del catión (generalmente un metal) indicando entre paréntesis el número de oxidación si fuera necesario.

III. Compuestos ternarios 4. Oxosales neutras Son compuestos derivados de un oxoácido, en el que se sustituyen el (los) hidrógeno(s) por un metal(es). Están formados por un metal, no metal y oxígeno. Se obtien por neutralización total de un oxoácido y un hidróxido: Fórmula Mediante sistema de Stock Na. NO 3 nitrato de sodio Cd. SO 3 sulfato de cadmio Cu 3(PO 4)2 fosfato de cobre (II) Sn(NO 2)4 nitrito de estaño (IV)

III. Compuestos ternarios 5. Sales ácidas de hidrácidos Son sales ácidas que resultan de sustituir un H de un ácido hidrácido por un metal. Se recomienda la nomenclatura de STOCK Fórmula Mediante sistema de Stock Na. HS hidrógenosulfuro de sodio Cu(HS)2 hidrógenosulfuro de cobre (II)

IV. Oxisales ácidas • Oxosales ácidas: son sales que aún contienen H en su estructura. Derivan de la sustitución parcial de un ácido poliprótico por metales. • Utilizaremos la nomenclatura común o tradicional, en la que se nombra el anión y tras la palabra “de” se indica el nombre del catión indicando entre paréntesis la valencia

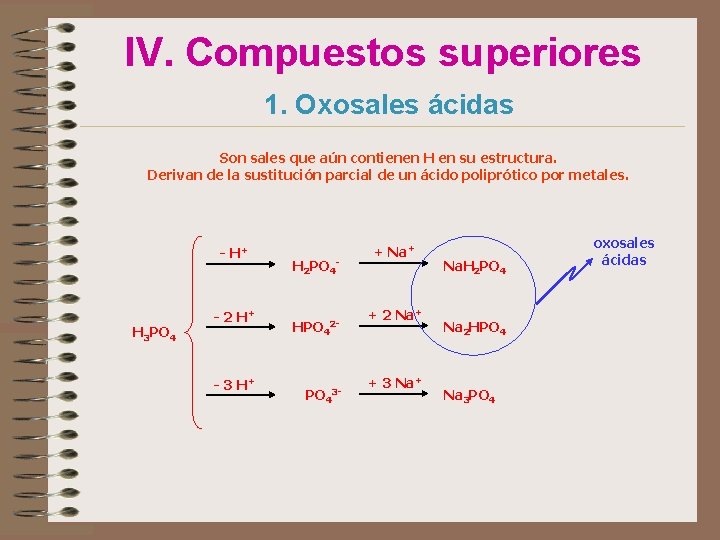
IV. Compuestos superiores 1. Oxosales ácidas Son sales que aún contienen H en su estructura. Derivan de la sustitución parcial de un ácido poliprótico por metales. - H+ H 3 PO 4 - 2 H+ - 3 H+ H 2 PO 4 - HPO 42 - PO 43 - + Na+ + 2 Na+ + 3 Na+ Na. H 2 PO 4 Na 2 HPO 4 Na 3 PO 4 oxosales ácidas

IV. Compuestos superiores 1. Oxosales ácidas Son sales que aún contienen H en su estructura. Derivan de la sustitución parcial de un ácido poliprótico por metales. La nomenclatura recomendada es la de STOCK Fórmula Mediante sistema de Stock Na 2 HPO 4 hidrógenofosfato de sodio Na. H 2 PO 4 dihidrógenofosfato de sodio KHCO 3 hidrógenocarbonato de potasio Cr(HSO 3)3 hidrógenosulfito de cromo (III)
 Compuestos ternarios
Compuestos ternarios Formulacin
Formulacin Formulacin
Formulacin Formulacin
Formulacin Formulacin
Formulacin K20 nomenclatura tradicional
K20 nomenclatura tradicional Calentamiento prolongado progresivo y adaptado
Calentamiento prolongado progresivo y adaptado Teclados adaptados
Teclados adaptados Monossacarídios
Monossacarídios Qumica
Qumica Qual a sentença verdadeira
Qual a sentença verdadeira Ion dipolo
Ion dipolo Aparelho de raios
Aparelho de raios Qumica
Qumica Hidrocarbonetos
Hidrocarbonetos Qumica
Qumica Qumica
Qumica Atomos de carbono
Atomos de carbono (ch3)3cch3 tipo de hidrocarburo
(ch3)3cch3 tipo de hidrocarburo Engenharia mecatronica unip
Engenharia mecatronica unip Epimeros
Epimeros Parametilbenzeno
Parametilbenzeno Poluição das águas
Poluição das águas Biologia
Biologia Qumica
Qumica Qumica
Qumica Qumica moderna
Qumica moderna Proust
Proust Qumica
Qumica Penumbra
Penumbra Pilha de daniell
Pilha de daniell Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica La química orgánica estudia
La química orgánica estudia Moléculas polares e apolares exemplos
Moléculas polares e apolares exemplos Ley de lavoisier laplace
Ley de lavoisier laplace Qumica
Qumica Qumica
Qumica Qumica
Qumica Hidrácidos
Hidrácidos Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Livresq
Livresq





































































