FORMULACIN Y NOMENCLATURA INORGNICA 1 INTRODUCCIN TERICA tomo











































- Slides: 71

FORMULACIÓN Y NOMENCLATURA INORGÁNICA 1

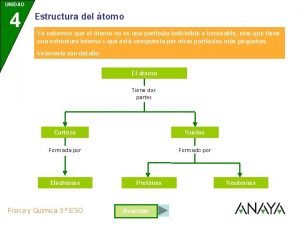
INTRODUCCIÓN TEÓRICA � Átomo: Es la unidad más pequeña de un elemento químico que mantiene su identidad o sus propiedades y que no es posible dividir mediante procesos químicos. � En el átomo distinguimos dos partes: el núcleo y la corteza. Ø El núcleo es la parte central del átomo y contiene partículas con carga positiva, los protones, y partículas que no poseen carga eléctrica, es decir son neutras, los neutrones. Ø La corteza atómica es la parte exterior del átomo. En ella se encuentran los electrones con carga negativa, éstos, ordenados en distintos niveles de energía, giran alrededor del núcleo. 2

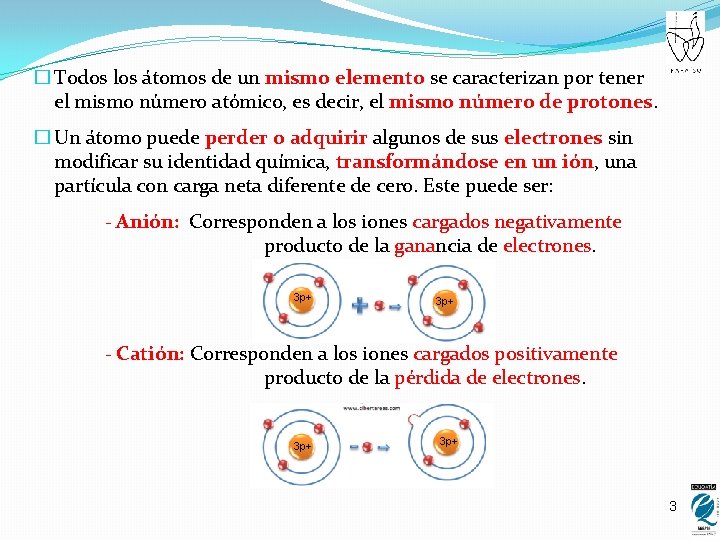
� Todos los átomos de un mismo elemento se caracterizan por tener el mismo número atómico, es decir, el mismo número de protones. � Un átomo puede perder o adquirir algunos de sus electrones sin modificar su identidad química, transformándose en un ión, una partícula con carga neta diferente de cero. Este puede ser: - Anión: Corresponden a los iones cargados negativamente producto de la ganancia de electrones. 3 p+ - Catión: Corresponden a los iones cargados positivamente producto de la pérdida de electrones. 3 p+ 3

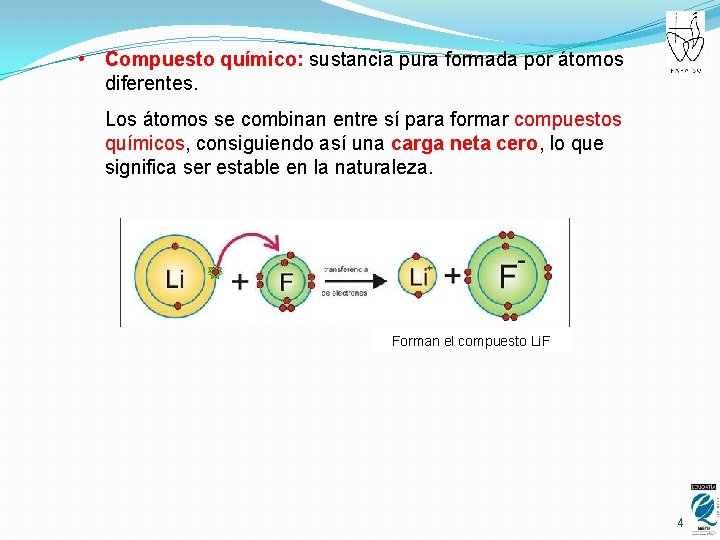
• Compuesto químico: sustancia pura formada por átomos diferentes. Los átomos se combinan entre sí para formar compuestos químicos, consiguiendo así una carga neta cero, lo que significa ser estable en la naturaleza. Forman el compuesto Li. F 4

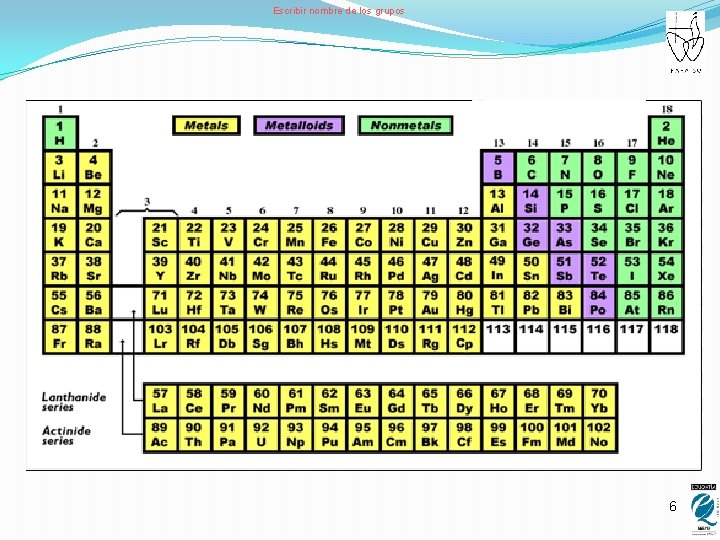
ORDENACIÓN DE LOS ÁTOMOS � Los átomos se ordenan en la tabla periódica o sistema periódico, colocados en orden creciente de su número atómico. � Cada elemento se representa con un símbolo que consta de una o dos letras (la primera siempre en mayúsculas) � Según sus propiedades, se dividen en: � Metales: buenos conductores del calor y de la electricidad. Forman cationes. � No metales: malos conductores del calor y de la electricidad. Forman aniones. � Semimetales: Se caracterizan por presentar un comportamiento intermedio entre los metales y los no metales. � En la tabla periódica se clasifican los elementos en grupos, que se corresponden con cada una de las columnas del sistema periódico, ya que todos los elementos que pertenecen a una columna tienen las mismas propiedades. 5

Escribir nombre de los grupos 6

� Valencia: representa la capacidad que posee un elemento para combinarse con otro, se coge de referencia el Hidrógeno cuya valencia es 1. • Estado de oxidación: es la carga eléctrica que aporta cada átomo en el compuesto y que sumadas debe ser igual a 0 (eléctricamente neutro) En metales esta carga es positiva (+), porque el metal tiene tendencia a perder electrones. En no metales es negativa (-), porque el no metal tiene tendencia a ganar electrones. En semimetales el signo (+, -), depende del elemento químico con el que se combine. Puede tener tendencia a ganar o perder electrones. 7

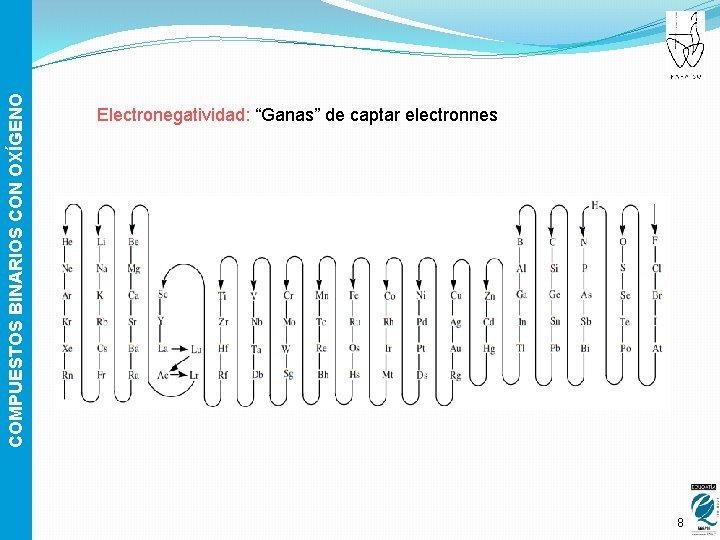
COMPUESTOS BINARIOS CON OXÍGENO Electronegatividad: “Ganas” de captar electronnes 8

FORMULACIÓN Y NOMENCLATURA EN QUÍMICA INORGÁNICA NORMAS PRÁCTICAS ELEMENTALES 1. En general, se escribe siempre en primer lugar el símbolo del elemento o grupo que actúe con estado de oxidación positivo y a continuación el que actúe con estado de oxidación negativo. Al nombrarlos se hace en orden inverso. Ejemplos: Na. Cl → cloruro de sodio Ca. CO 3 → carbonato de calcio 2. Los subíndices indican la cantidad de átomos/iones o la proporción de estos que participan en un compuesto. Ejemplos: H 2 O ; H 2 SO 4 3. Para nombrar un compuesto es necesario deducir los respectivos estados de oxidación con que actúan los elementos o grupos de elementos teniendo en cuenta que la carga neta de los compuestos es cero: Ejemplos: Na+ Cl - Na. Cl 9

4. Para trabajar con iones se debe tener en cuenta que su carga neta no es cero. Esta se indica en forma de superíndice con su signo (+ ó -). Nota: por convenio el signo siempre se escribe después del número y no al revés Ejemplo: CO 3 2 - ; Zn 2+ ; PO 4 3 - ; Cl – 5. Al formular un compuesto se intercambian los respectivas estados de oxidación o carga de un ion (en el caso de un ion negativo poliatómico) colocándolos en forma de subíndice (el subíndice 1 se omite): Ejemplo: Na+ Cl- → Na 1 Cl 1 → Na. Cl Al 3+ CO 3 2 - → Al 2(CO 3)3 6. Si se puede, se simplifican los subíndices, teniendo en cuenta que deben ser números enteros (excepto peróxidos): Ejemplo: S 6+ O 2 - → S 2 O 6 → SO 3 7. El último elemento del compuesto actúa con su estado de oxidación más pequeño y signo negativo. Ejemplo: Na 2 S 10

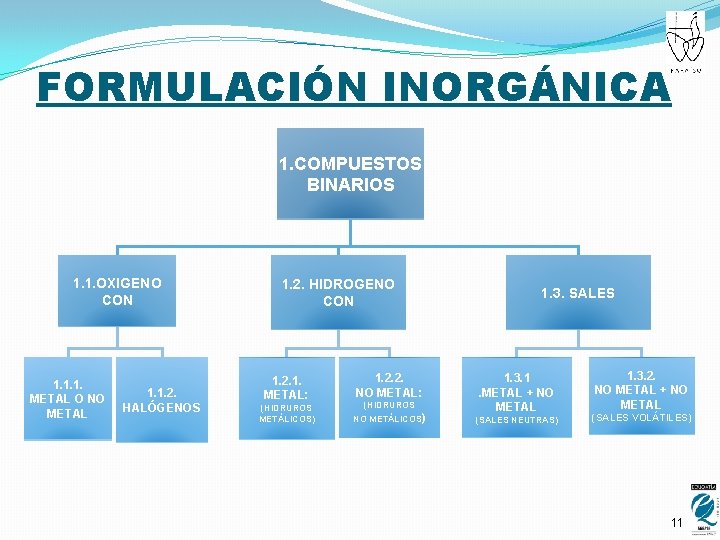
FORMULACIÓN INORGÁNICA 1. COMPUESTOS BINARIOS 1. 1. OXIGENO CON 1. 1. 1. METAL O NO METAL 1. 1. 2. HALÓGENOS 1. 2. HIDROGENO CON 1. 2. 1. METAL: 1. 2. 2. NO METAL: (HIDRUROS METÁLICOS) NO METÁLICOS) (HIDRUROS 1. 3. SALES 1. 3. 1. METAL + NO METAL (SALES NEUTRAS) 1. 3. 2. NO METAL + NO METAL (SALES VOLÁTILES) 11

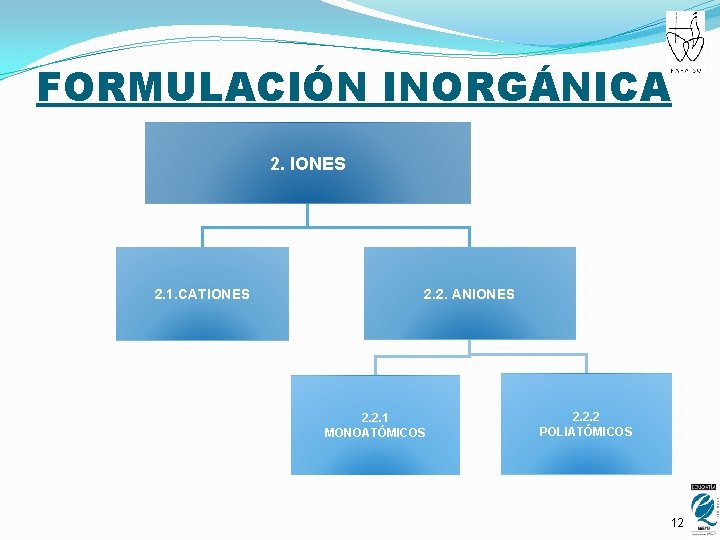
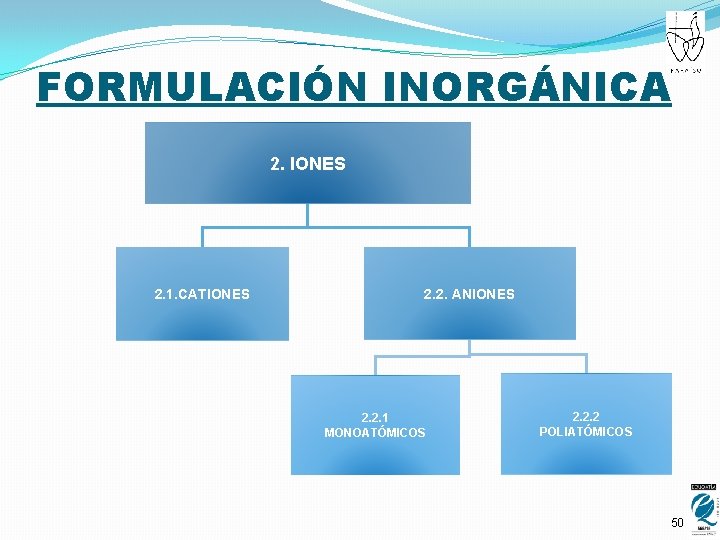
FORMULACIÓN INORGÁNICA 2. IONES 2. 1. CATIONES 2. 2. ANIONES 2. 2. 1 MONOATÓMICOS 2. 2. 2 POLIATÓMICOS 12

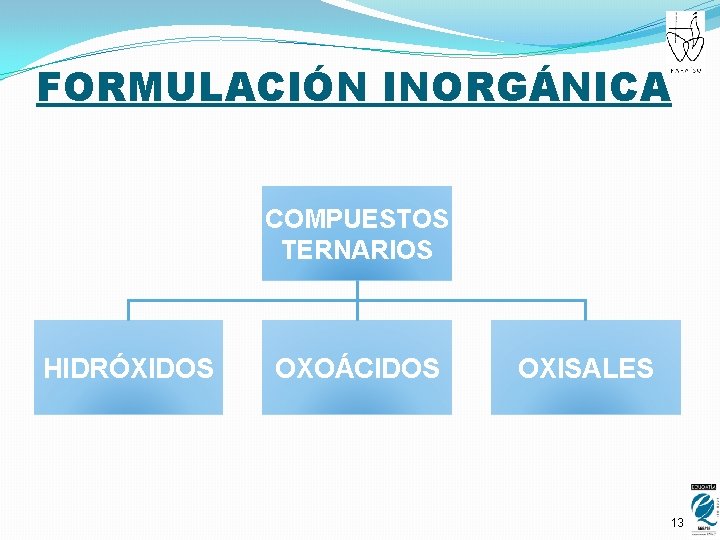
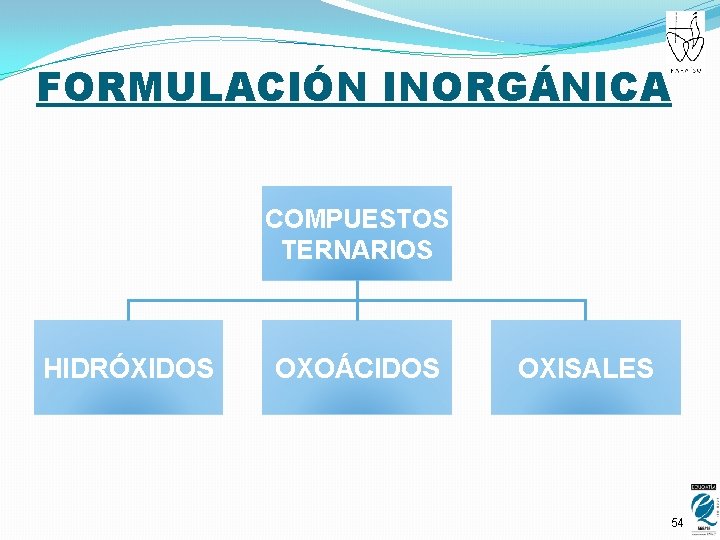
FORMULACIÓN INORGÁNICA COMPUESTOS TERNARIOS HIDRÓXIDOS OXOÁCIDOS OXISALES 13

COMPUESTOS BINARIOS 1. 1. OXÍGENO CON 14

COMPUESTOS BINARIOS CON OXÍGENO 1. 1. 1 METAL O NO METAL • En este apartado excluimos a los compuestos con halógenos. • Están formados por un metal o no metal + Oxígeno. • Según las electronegatividades el oxígeno se escribirá en última posición y siempre actúa con el estado de oxidación 2 -. � Para formularlos: 1. Se escriben colocando en primer lugar el símbolo del metal o no metal y a continuación el del Oxígeno 2. Escribimos los estados de oxidación de cada elemento 3. Se intercambian los estados de oxidación signo 4. Se simplifica si es posible. +4 Ejemplo: Pb O -2 Pb 2 O 4 Simplificamos Pb. O 2 15

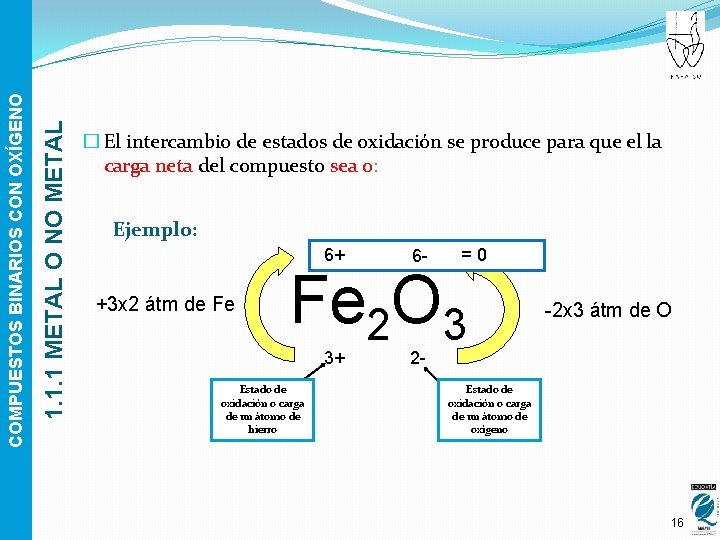
1. 1. 1 METAL O NO METAL COMPUESTOS BINARIOS CON OXÍGENO � El intercambio de estados de oxidación se produce para que el la carga neta del compuesto sea 0: Ejemplo: 6+ +3 x 2 átm de Fe 6 - =0 Fe 2 O 3 3+ Estado de oxidación o carga de un átomo de hierro -2 x 3 átm de O 2 - Estado de oxidación o carga de un átomo de oxígeno 16

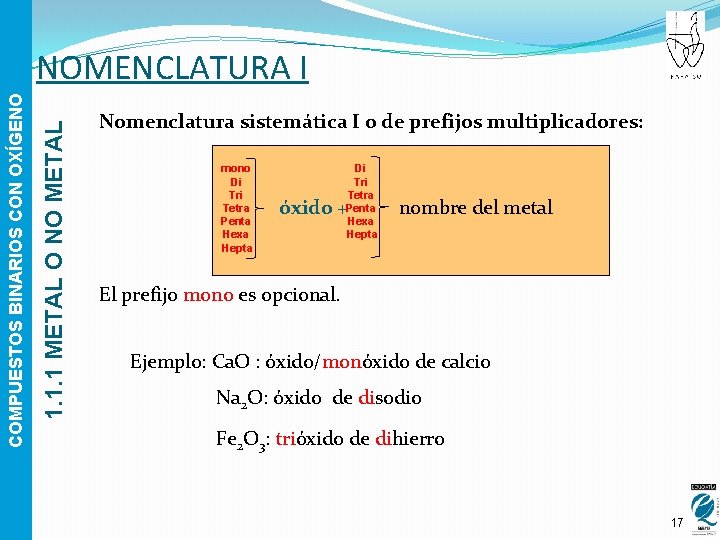
1. 1. 1 METAL O NO METAL COMPUESTOS BINARIOS CON OXÍGENO NOMENCLATURA I Nomenclatura sistemática I o de prefijos multiplicadores: mono Di Tri Tetra Penta Hexa Hepta óxido + nombre del metal El prefijo mono es opcional. Ejemplo: Ca. O : óxido/monóxido de calcio Na 2 O: óxido de disodio Fe 2 O 3: trióxido de dihierro 17

1. 1. 1 METAL O NO METAL COMPUESTOS BINARIOS CON OXÍGENO NOMENCLATURA II Nomenclatura sistemática II expresando números de oxidación: óxido de+ nombre del metal (estado de oxidación) El estado de oxidación se escribe en números romanos y entre paréntesis. Si el elemento tiene un solo estado de oxidación nunca se escribe Ejemplo: Fe 2 O 3 → óxido de hierro (III) Al 2 O 3 → óxido de aluminio. ¿Por qué sabemos que el estado de oxidación del hierro es 3+? El aluminio sólo tiene el estado de oxidación 3+. Por eso no hace falta indicarlo en el nombre 6+ 6 - Fe 2 O 3 ¿? 3+ 2 - =0

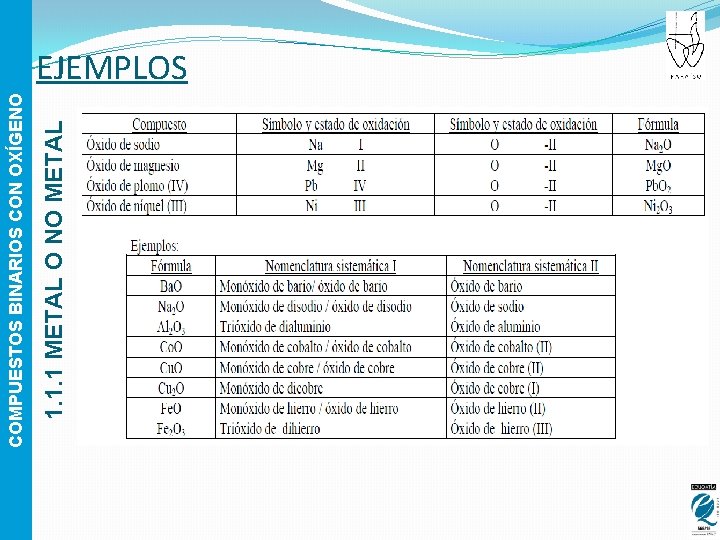
1. 1. 1 METAL O NO METAL COMPUESTOS BINARIOS CON OXÍGENO EJEMPLOS

COMPUESTOS BINARIOS CON OXÍGENO 1. 1. 2 HALÓGENOS Se cambia el orden debido a que los halógenos son más electronegativos que el Oxígeno 20

COMPUESTOS BINARIOS CON OXÍGENO 1. 1. 2 HALÓGENOS Para formularlos: � Están formados por Oxígeno y un elemento de la columna de los halógenos. O + HALÓGENO � Sin embargo, siguiendo las indicaciones de la IUPAC el oxígeno actuará con estado de oxidación 2+. � Los halógenos pueden actuar con cualquiera de sus estados de oxidación, siendo estos negativos 21

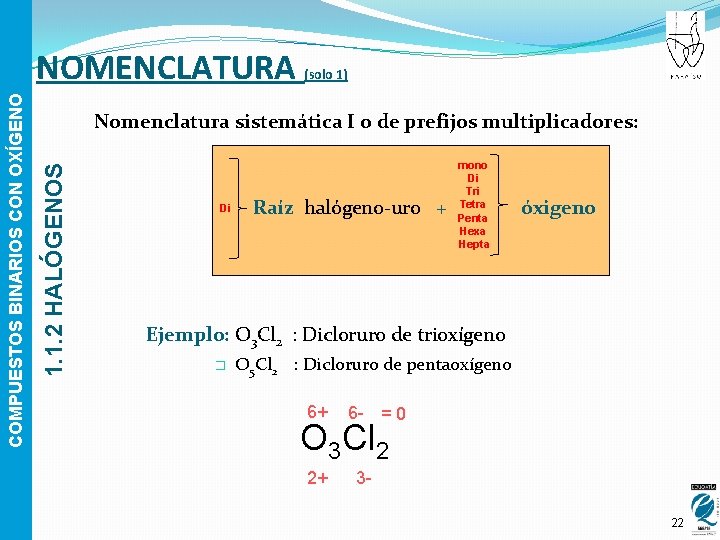
(solo 1) Nomenclatura sistemática I o de prefijos multiplicadores: 1. 1. 2 HALÓGENOS COMPUESTOS BINARIOS CON OXÍGENO NOMENCLATURA Di Raíz halógeno-uro + mono Di Tri Tetra Penta Hexa Hepta óxigeno Ejemplo: O 3 Cl 2 : Dicloruro de trioxígeno � O 5 Cl 2 : Dicloruro de pentaoxígeno 6+ 6 - = 0 O 3 Cl 2 2+ 322

1. COMPUESTOS BINARIOS 1. 2. COMBINACIONES BINARIAS DEL HIDRÓGENO 23

COMPUESTOS BINARIOS CON HIDRÓGENO 1. 2. 1. HIDRUROS METÁLICOS Para formularlos: � Están formados por un metal e Hidrógeno. � De acuerdo con las electronegatividades, se escriben Símbolo Metal + H � Intercambio de e. o. El Hidrógeno actúa con estado de oxidación -1 al ir en última posición. (El subíndice del hidrógeno siempre proviene del estado de oxidación del metal) Ejemplo: Na. H Al. H 3 24

Nomenclatura sistemática I o de prefijos multiplicadores: 1. 2. 1. HIDRUROS METÁLICOS COMPUESTOS BINARIOS CON HIDRÓGENO NOMENCLATURA I mono Di Tri Tetra Penta Hexa Hepta hidruro de + Nombre del metal Ejemplo: Li. H: hidruro de litio Ca. H 2: dihidruro de calcio Cr. H 6: hexahidruro de cromo 25

Nomenclatura sistemática II expresando números de oxidación: 1. 2. 1. HIDRUROS METÁLICOS COMPUESTOS BINARIOS CON HIDRÓGENO NOMENCLATURA II Hidruro de + nombre del metal (estado de oxidación) El estado de oxidación se escribe en números romanos y entre paréntesis. Si el elemento tiene un solo estado de oxidación nunca se escribe Ejemplo: Fe. H 2 → Hidruro de hierro (II) Al. H 3 → Hidruro de aluminio ¿Por qué sabemos que el estado de oxidación del hierro es 2+? El aluminio sólo tiene el estado de oxidación 3+. Por eso no hace falta indicarlo en el nombre 2+ 2 - =0 Fe. H 2 ¿? 2+ 1 - Fíjate que en los hidruros no se puede simplificar, por lo tanto, el subíndice del hidrógeno nos da el estado de oxidación del metal

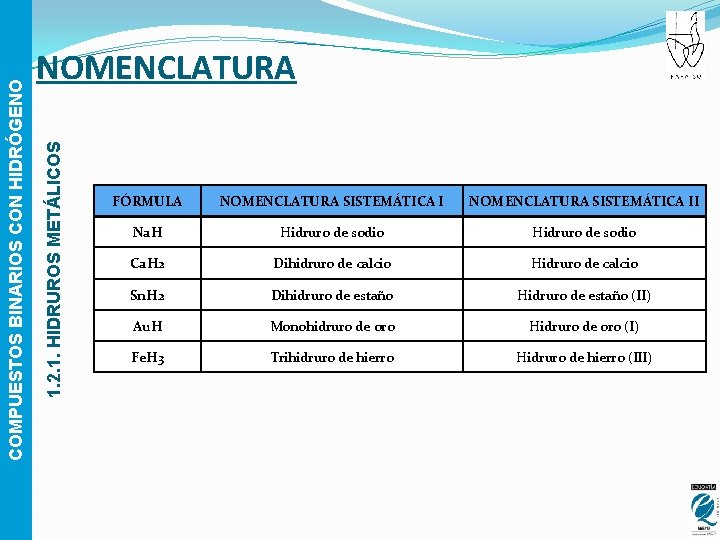
1. 2. 1. HIDRUROS METÁLICOS COMPUESTOS BINARIOS CON HIDRÓGENO NOMENCLATURA FÓRMULA NOMENCLATURA SISTEMÁTICA II Na. H Hidruro de sodio Ca. H 2 Dihidruro de calcio Hidruro de calcio Sn. H 2 Dihidruro de estaño Hidruro de estaño (II) Au. H Monohidruro de oro Hidruro de oro (I) Fe. H 3 Trihidruro de hierro Hidruro de hierro (III)

COMPUESTOS BINARIOS CON HIDRÓGENO HIDRUROS NO METÁLICOS De acuerdo con la posición del H en el diagrama de electronegatividades, necesitamos diferenciar cuando el hidrógeno se une a: - Elementos del grupo 13, 14 o 15. - Elementos de los grupos 16 y 17. 28

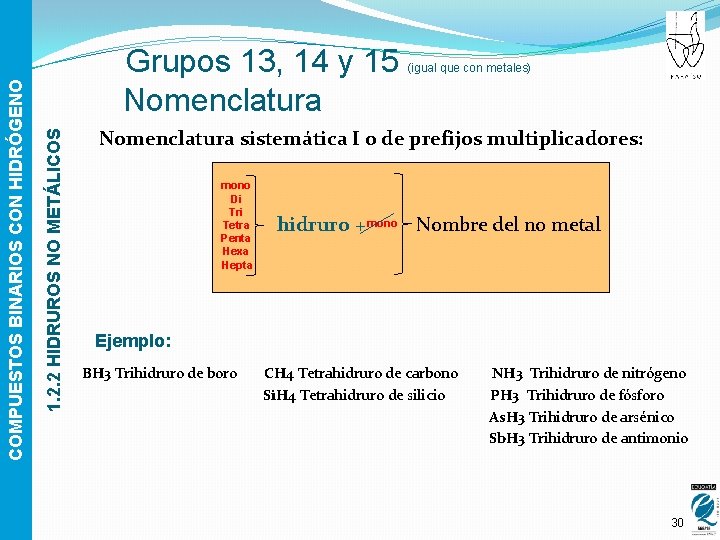
(igual que con metales) Para formularlos: 1. 2. 2 HIDRUROS NO METÁLICOS COMPUESTOS BINARIOS CON HIDRÓGENO Grupos 13, 14 y 15 � De acuerdo con las electronegatividades, se escriben Símbolo del no metal + H � Intercambio de e. o. El Hidrógeno actúa con estado de oxidación -1 al ir en última posición. (El subíndice del hidrógeno siempre proviene del estado de oxidación del metal) Ejemplo: NH 3 PH 3 As. H 3 29

1. 2. 2 HIDRUROS NO METÁLICOS COMPUESTOS BINARIOS CON HIDRÓGENO Grupos 13, 14 y 15 Nomenclatura (igual que con metales) Nomenclatura sistemática I o de prefijos multiplicadores: mono Di Tri Tetra Penta Hexa Hepta hidruro + mono Nombre del no metal Ejemplo: BH 3 Trihidruro de boro CH 4 Tetrahidruro de carbono Si. H 4 Tetrahidruro de silicio NH 3 Trihidruro de nitrógeno PH 3 Trihidruro de fósforo As. H 3 Trihidruro de arsénico Sb. H 3 Trihidruro de antimonio 30

Para formularlos: 1. 2. 2 HIDRUROS NO METÁLICOS COMPUESTOS BINARIOS CON HIDRÓGENO Grupos 16 y 17 � De acuerdo con las electronegatividades, se escriben H + No metal • • Intercambio de e. o. El Hidrógeno actúa con estado de oxidación +1 al ir en primera posición. El no metal actúa únicamente con su estado de oxidación menor y negativo. (El subíndice del hidrógeno siempre proviene del estado de oxidación del metal) Ejemplo: H 2 S HF HCl 31

1. 2. 2 HIDRUROS NO METÁLICOS COMPUESTOS BINARIOS CON HIDRÓGENO Grupos 16 y 17 Nomenclatura I Nomenclatura sistemática I o de prefijos multiplicadores: Se nombra en primer lugar la raíz del nombre del no metal con el sufijo –URO y a continuación “de (di)hidrógeno” Raíz del no metal –uro + de --di hidrógeno Ejemplo: Cl. H Cloruro de hidrógeno H 2 S Sulfuro de dihidrógeno 32

1. 2. 2 HIDRUROS NO METÁLICOS COMPUESTOS BINARIOS CON HIDRÓGENO Grupos 16 y 17 Nomenclatura II Nomenclatura tradicional (en disolución acuosa) Se nombran con la palabra “ácido” seguido de la raíz del nombre del no metal acabado en “ -hídrico”. Ácido + Raíz del no metal –hídrico Ejemplo: Cl. H Ácido clorhídrico H 2 S Ácido sulfhídrico 33

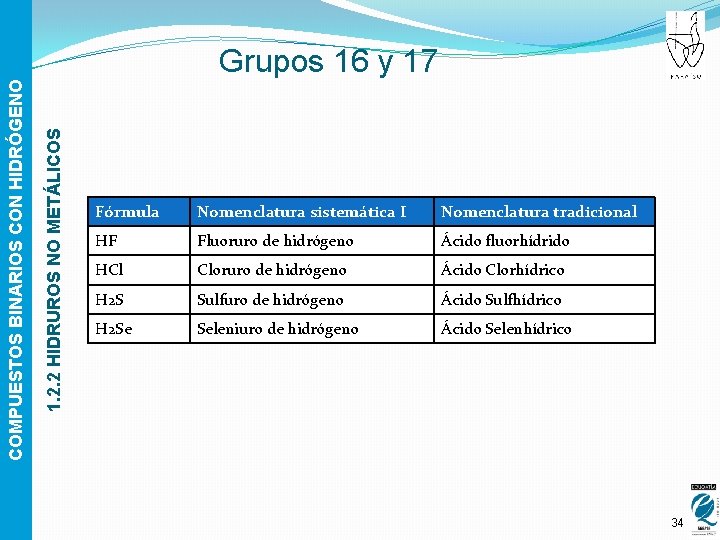
1. 2. 2 HIDRUROS NO METÁLICOS COMPUESTOS BINARIOS CON HIDRÓGENO Grupos 16 y 17 Fórmula Nomenclatura sistemática I Nomenclatura tradicional HF Fluoruro de hidrógeno Ácido fluorhídrido HCl Cloruro de hidrógeno Ácido Clorhídrico H 2 S Sulfuro de hidrógeno Ácido Sulfhídrico H 2 Se Seleniuro de hidrógeno Ácido Selenhídrico 34

1. 2. 2 HIDRUROS NO METÁLICOS COMPUESTOS BINARIOS CON HIDRÓGENO Todos los grupos de no metales Nomenclatura de sustitución Nombre del metal acabado en -ano Ejemplo: BH 3: Borano CH 4: Metano Si. H 3: Silano NH 3: Azano H 2 O: oxidano HF: Fluorano PH 3: Fosfano ……. . Nombres comunes Ejemplo: NH 3: Amoniaco H 2 O: Agua 35

COMPUESTOS BINARIOS SALES NEUTRAS 36

SALES NEUTRAS Para formularlos: � Están formadas por un metal + un no metal. Símbolo del metal + Símbolo del no metal • Se escriben colocando en primer lugar el símbolo del metal y a continuación el del no metal (que actúa siempre con su estado de oxidación más pequeño y en negativo) • Intercambio de estados de oxidación • Simplificar si es posible. Ejemplo: Na. Cl Fe 2 S 3 37

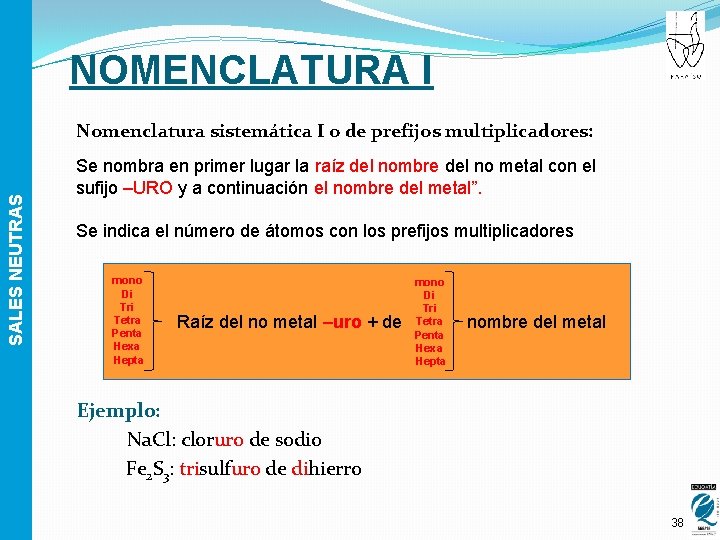
NOMENCLATURA I SALES NEUTRAS Nomenclatura sistemática I o de prefijos multiplicadores: Se nombra en primer lugar la raíz del nombre del no metal con el sufijo –URO y a continuación el nombre del metal”. Se indica el número de átomos con los prefijos multiplicadores mono Di Tri Tetra Penta Hexa Hepta Raíz del no metal –uro + de mono Di Tri Tetra Penta Hexa Hepta nombre del metal Ejemplo: Na. Cl: cloruro de sodio Fe 2 S 3: trisulfuro de dihierro 38

NOMENCLATURA II Nomenclatura sistemática II expresando números de oxidación: SALES NEUTRAS Raíz del no metal –uro de + nombre del metal (e. o. ) El estado de oxidación (e. o. ) se escribe en números romanos y entre paréntesis. Si el elemento tiene un solo estado de oxidación nunca se escribe Ejemplo: Na. Cl: cloruro de sodio Fe 2 S 3: sulfuro de hierro (III) 6+ 6 - = 0 Fe 2 S 3 3+ 2 -

SALES NEUTRAS Ejemplos Fórmula Nomenclatura sistemática II Li. F Fluoruro de litio Ca. F 2 Difluoruro de calcio Fluoruro de calcio Al. Cl 3 Tricloruro de aluminio Cu. Br 2 Dibromuro de cobre Bromuro de cobre (II) Cu 2 S Sulfuro de dicobre Sulfuro de cobre (I)

COMPUESTOS BINARIOS SALES VOLÁTILES 41

SALES VOLÁTILES � Están formadas por un NO metal + un NO metal. Símbolo del NO metal + Símbolo del NO metal menos electronegativo más electronegativo estado de oxidación positivo estado de oxidación negativo = el más pequeña en negativo • Intercambio de estados de oxidación • Simplificar si es posible. Ejemplo: Cl. Br Se. I 2 42

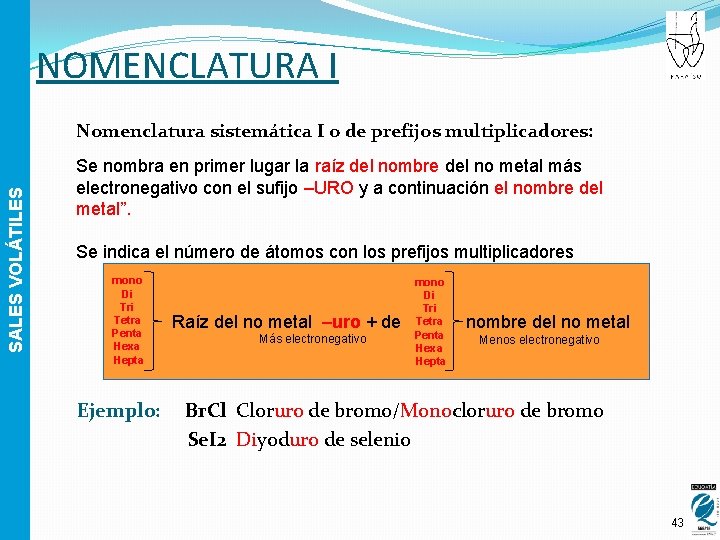
NOMENCLATURA I SALES VOLÁTILES Nomenclatura sistemática I o de prefijos multiplicadores: Se nombra en primer lugar la raíz del nombre del no metal más electronegativo con el sufijo –URO y a continuación el nombre del metal”. Se indica el número de átomos con los prefijos multiplicadores mono Di Tri Tetra Penta Hexa Hepta Ejemplo: Raíz del no metal –uro + de Más electronegativo mono Di Tri Tetra Penta Hexa Hepta nombre del no metal Menos electronegativo Br. Cl Cloruro de bromo/Monocloruro de bromo Se. I 2 Diyoduro de selenio 43

NOMENCLATURA II SALES VOLÁTILES Nomenclatura sistemática II expresando números de oxidación: Raíz del no metal –uro de + nombre del no metal (e. o. ) El estado de oxidación (e. o. ) se escribe en números romanos y entre paréntesis. Si el elemento tiene un solo estado de oxidación nunca se escribe Ejemplo: Br. Cl: cloruro de bromo (I) Se. I 2: yodurouro de selenio (II) 2+ 2 - = 0 Se. I 2 2+ 1 -

SALES VOLÁTILES Ejemplos Fórmula Nomenclatura sistemática II Br. F Monofluoruro de bromo Fluoruro de bromo (I) IBr 3 Tribromuro de yodo Bromuro de yodo (III) Br. F 3 Trifloruro de bromo Fluoruro de bromo (III) Br. Cl Monocloruro de bromo Cloruro de bromo (I) Se. I 2 Diyoduro de selenio Yoduro de selenio (II) CCl 4 Tetracloruro de carbono Cloruro de carbono (IV)

FORMULACIÓN INORGÁNICA COMPUESTOS TERNARIOS HIDRÓXIDOS OXOÁCIDOS OXISALES 46

HIDRÓXIDOS 47

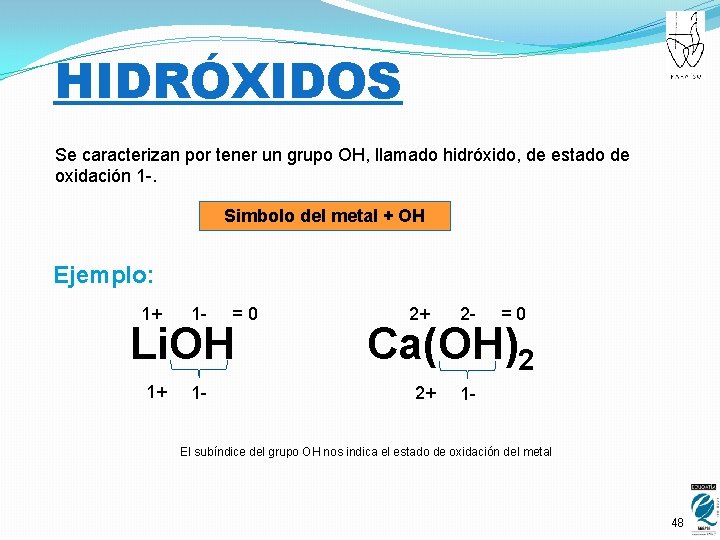
HIDRÓXIDOS Se caracterizan por tener un grupo OH, llamado hidróxido, de estado de oxidación 1 -. Simbolo del metal + OH Ejemplo: 1+ 1 - =0 Li. OH 1+ 1 - 2+ 2 - =0 Ca(OH)2 2+ 1 - El subíndice del grupo OH nos indica el estado de oxidación del metal 48

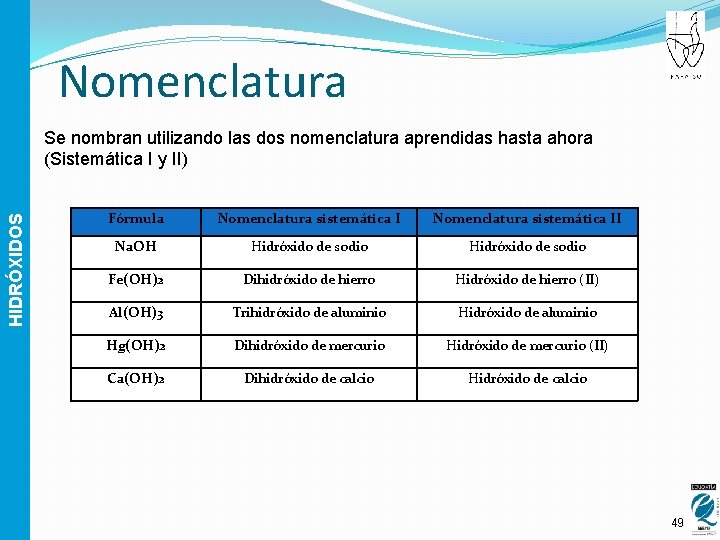
Nomenclatura HIDRÓXIDOS Se nombran utilizando las dos nomenclatura aprendidas hasta ahora (Sistemática I y II) Fórmula Nomenclatura sistemática II Na. OH Hidróxido de sodio Fe(OH)2 Dihidróxido de hierro Hidróxido de hierro (II) Al(OH)3 Trihidróxido de aluminio Hg(OH)2 Dihidróxido de mercurio Hidróxido de mercurio (II) Ca(OH)2 Dihidróxido de calcio Hidróxido de calcio 49

FORMULACIÓN INORGÁNICA 2. IONES 2. 1. CATIONES 2. 2. ANIONES 2. 2. 1 MONOATÓMICOS 2. 2. 2 POLIATÓMICOS 50

IONES Un ion es una especie química con carga eléctrica, positiva o negativa. CATIONES: Carga positiva ANIONES: Carga negativa Poliatómicos: formado por varios átomos 51

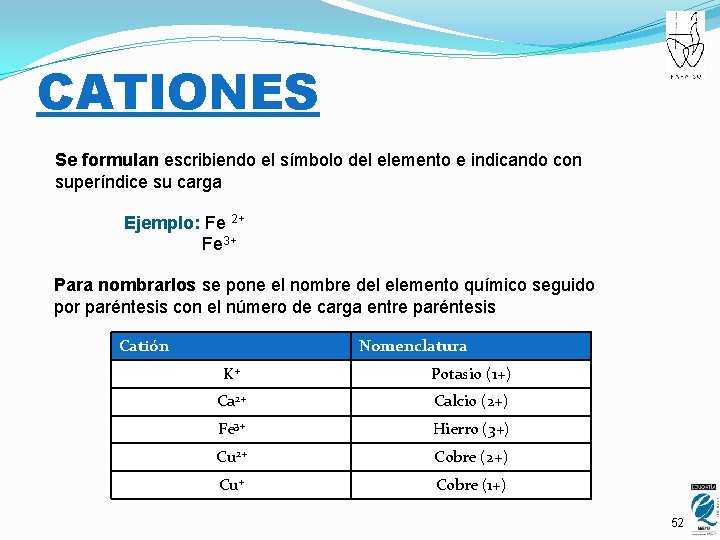
CATIONES Se formulan escribiendo el símbolo del elemento e indicando con superíndice su carga Ejemplo: Fe 2+ Fe 3+ Para nombrarlos se pone el nombre del elemento químico seguido por paréntesis con el número de carga entre paréntesis Catión Nomenclatura K+ Potasio (1+) Ca 2+ Calcio (2+) Fe 3+ Hierro (3+) Cu 2+ Cobre (2+) Cu+ Cobre (1+) 52

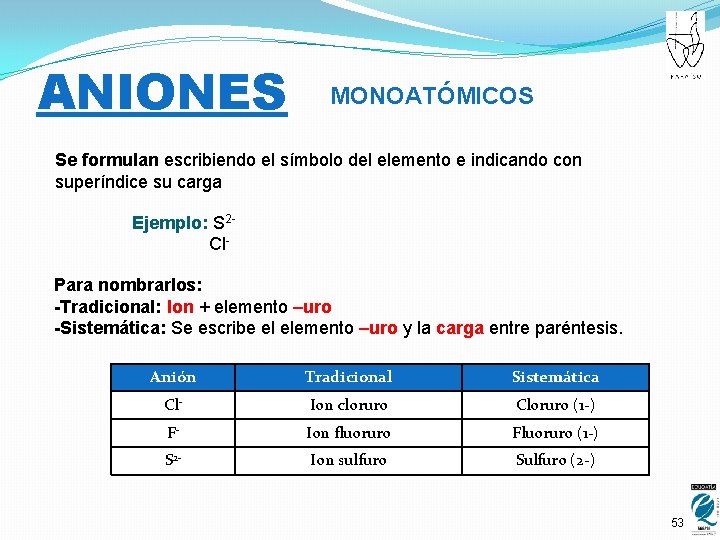
ANIONES MONOATÓMICOS Se formulan escribiendo el símbolo del elemento e indicando con superíndice su carga Ejemplo: S 2 Cl. Para nombrarlos: -Tradicional: Ion + elemento –uro -Sistemática: Se escribe el elemento –uro y la carga entre paréntesis. Anión Tradicional Sistemática Cl- Ion cloruro Cloruro (1 -) F- Ion fluoruro Fluoruro (1 -) S 2 - Ion sulfuro Sulfuro (2 -) 53

FORMULACIÓN INORGÁNICA COMPUESTOS TERNARIOS HIDRÓXIDOS OXOÁCIDOS OXISALES 54

OXOÁCIDOS � Son compuestos formados por oxígeno, hidrógeno y un no metal. Su fórmula general es: Hm. Xn. Oz H: símbolo del hidrógeno X: símbolo del no metal O: símbolo del oxígeno m, n y z: número de átomos de cada elemento en la molécula. � Provienen de la reacción: Óxido no metlálico + H 2 O = oxoácido 55

OXOÁCIDOS � Ejemplos: CO 2 + H 2 O = H 2 CO 3 SO 3 + H 2 O = H 2 SO 4 OCl 2 + H 2 O = H 2 Cl 2 O 2 = HCl. O O 3 I 2 + H 2 O = H 2 I 2 O 4 = HIO 2 56

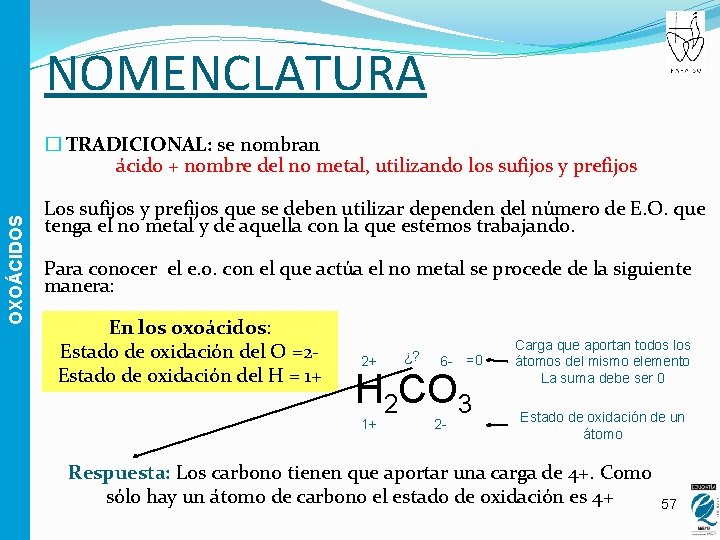
NOMENCLATURA OXOÁCIDOS � TRADICIONAL: se nombran ácido + nombre del no metal, utilizando los sufijos y prefijos Los sufijos y prefijos que se deben utilizar dependen del número de E. O. que tenga el no metal y de aquella con la que estemos trabajando. Para conocer el e. o. con el que actúa el no metal se procede de la siguiente manera: En los oxoácidos: Estado de oxidación del O =2 Estado de oxidación del H = 1+ 2+ ¿? 6 - =0 H 2 CO 3 1+ 2 - Carga que aportan todos los átomos del mismo elemento La suma debe ser 0 Estado de oxidación de un átomo Respuesta: Los carbono tienen que aportar una carga de 4+. Como sólo hay un átomo de carbono el estado de oxidación es 4+ 57

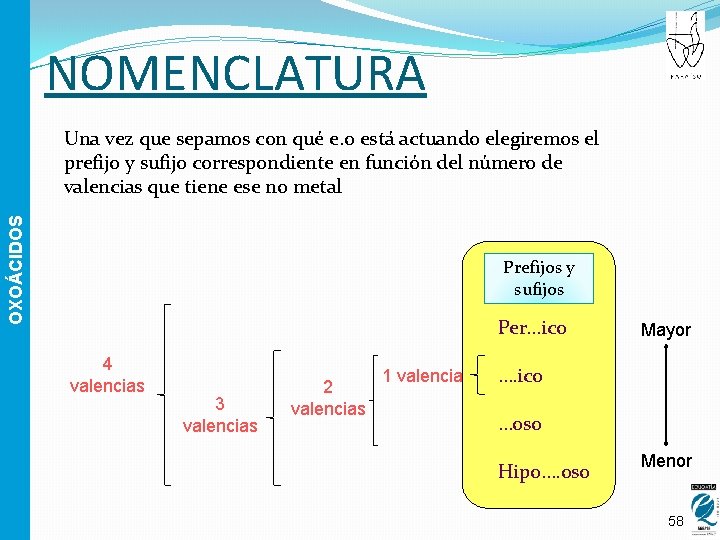
NOMENCLATURA OXOÁCIDOS Una vez que sepamos con qué e. o está actuando elegiremos el prefijo y sufijo correspondiente en función del número de valencias que tiene ese no metal Prefijos y sufijos Per…ico 4 valencias 3 valencias 2 valencias 1 valencia Mayor …. ico …oso Hipo…. oso Menor 58

NOMENCLATURA üSi el elemento tiene una única valencia: la terminación –ico OXOÁCIDOS Ejemplo: El Boro tiene una única valencia: 3 B 2 O 3 + H 2 O= H 2 B 2 O 4 HBO 2 Ácido bórico üSi el elemento tiene dos valencias: La mayor acaba en –ico La menor acaba en –oso Ejemplo: El Carbono tiene valencias 2 y 4 Val (4) CO 2 + H 2 O= H 2 CO 3 Ácido carbónico Val (2) CO + H 2 O= H 2 CO 2 Ácido carbonoso 59

NOMENCLATURA üSi el elemento tiene una tres valencias: OXOÁCIDOS La mayor: –ico La intermedia: –oso La menor : hipo-…. -oso Ejemplo: El azufre tiene valecia 2, 4 y 6 Val (6) SO 3 + H 2 O = H 2 SO 4 Ácido sulfúrico Val (4) SO 2 + H 2 O = H 2 SO 3 Ácido sulfuroso Val (2) SO + H 2 O = H 2 SO 2 Ácido hiposulfuroso 60

OXOÁCIDOS NOMENCLATURA üSi el elemento tiene una cuatro valencias: La menor: hipo-…-oso La siguiente más pequeña: -oso La siguiente: -ico La más grande: per-…-ico Ejemplo: El cloro tiene valecia 1, 3, 5 y 7 Val (7) O 7 Cl 2+ H 2 O = H 2 Cl 2 O 8 HCl. O 4 Ácido perclórico Val (5) O 5 Cl 2 + H 2 O = H 2 Cl 2 O 6 HCl. O 3 Ácido clórico Val (3) O 3 Cl 2 + H 2 O = H 2 Cl 2 O 4 H 2 Cl. O 2 Ácido cloroso Val (1) OCl 2 + H 2 O = H 2 Cl 2 O 2 HCl. O Ácido hipocloroso 61

OXOÁCIDOS NOMENCLATURA Algunos elementos toman su nombre del latín, son los que se detallan a continuación: N (3): nitroso N (5): nítrico S (2): hiposulfuroso S (4): sulfuroso S (6): sulfúrico Ácidos de importancia H 2 SO 4 HNO 3 H 2 CO 3 Ácido sulfúrico Ácido nítrico Ácido carbónico 62

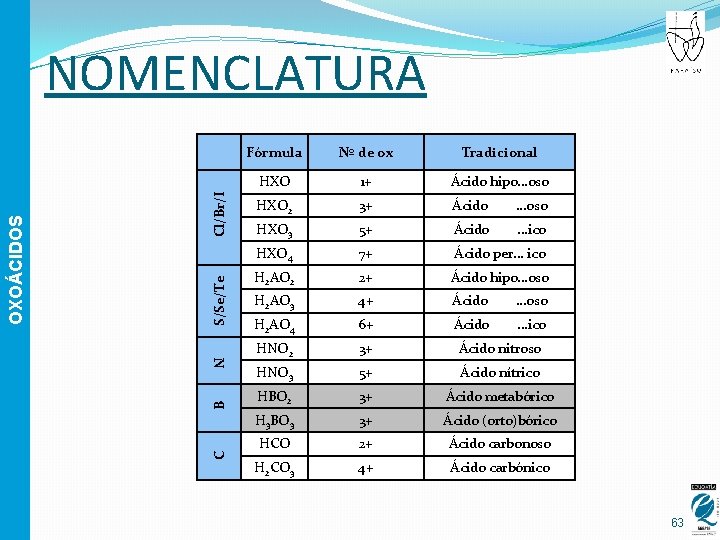
Cl/Br/I S/Se/Te B N C OXOÁCIDOS NOMENCLATURA Fórmula Nº de ox Tradicional HXO 1+ Ácido hipo. . . oso HXO 2 3+ Ácido . . . oso HXO 3 5+ Ácido . . . ico HXO 4 7+ Ácido per. . . ico H 2 AO 2 2+ Ácido hipo. . . oso H 2 AO 3 4+ Ácido . . . oso H 2 AO 4 6+ Ácido . . . ico HNO 2 3+ Ácido nitroso HNO 3 5+ Ácido nítrico HBO 2 3+ Ácido metabórico H 3 BO 3 3+ Ácido (orto)bórico HCO 2+ Ácido carbonoso H 2 CO 3 4+ Ácido carbónico 63

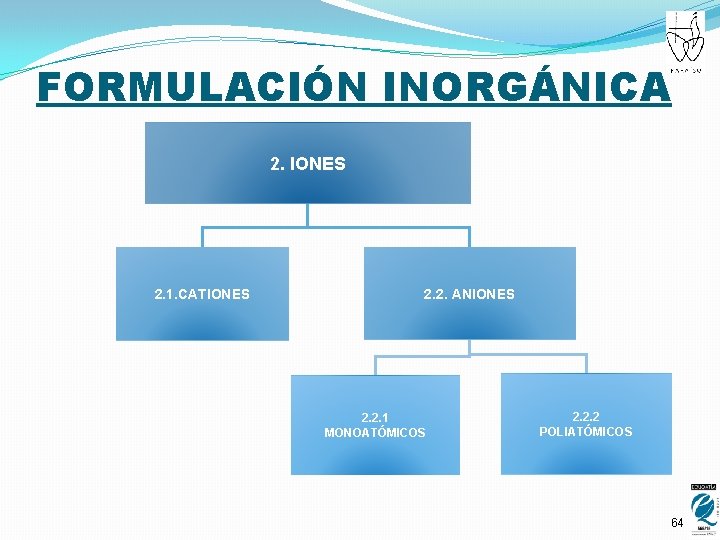
FORMULACIÓN INORGÁNICA 2. IONES 2. 1. CATIONES 2. 2. ANIONES 2. 2. 1 MONOATÓMICOS 2. 2. 2 POLIATÓMICOS 64

IONES POLIATÓMICOS Se forman a partir de los oxoácidos cuando pierden los hidrógenos: Por ejemplo, si al ácido sulfúrico H 2 SO 4 le quitamos sus 2 Hidrógenos (con sus correspondiente cargas positivas) nos queda SO 42 - 65

IONES POLIATÓMICOS NOMENCLATURA � TRADICIONAL: El ion se nombran según la terminación del ácido del que proceden. Hay que: Ø sustituir la palabra ácido por ion Ø cambiar el sufijo según la siguiente tabla. ÁCIDO IONES - ico -ato - oso - ito Ejemplos: Ácido perclórico HCl. O 4 Ión perclorato Cl. O 4Ácido clórico HCl. O 3 Ión clorato Cl. O 3Ácido cloroso H 2 Cl. O 2 Ión clorito Cl. O 2Ácido hipocloroso HCl. O Ión hipoclorito Cl. O- Para formularlos, obtén primero el ácido y después quita los hidrógenos 66

IONES POLIATÓMICOS NOMENCLATURA Iones de importancia Ión sulfato SO 42 Ión sulfito SO 32 Ión nitrato NO 3 Ión carbonato. CO 32 - 67

FORMULACIÓN INORGÁNICA COMPUESTOS TERNARIOS HIDRÓXIDOS OXOÁCIDOS OXISALES 68

OXISALES 69

OXISALES � Son compuestos que resultan de añadir un metal a un ión poliatómico Se escriben colocando el metal en primer lugar y el ión al final. Una vez colocados, se intercambian las valencias. Ejemplos: E. O del sulfato = 2 - H 2 SO 42 - Na+ Al 3+ Ca 2+ Na 2 SO 4 Al 2(SO 4)3 Ca 2(SO 4)2 = Ca. SO 4 70

OXISALES NOMENCLATURA � TRADICIONAL: La oxisales se nombran diciendo en primer lugar el nombre del anión y después el metal indicando con números romanos la valencia con la que actúa Ejemplos : Na 2 SO 4 : sulfato de sodio Pt. SO 4: sulfato de platino (II) Pt(SO 4)2: sulfato de platino (IV) Cr. SO 4: sulfato de cromo (II) Cr 2(SO 4)3: sulfato de cromo (III) Cr(SO 4)3: sulfato de cromo (VI) Mn. SO 4 : sulfato de manganeso (II) Mn(SO 4)2 : sulfato de manganeso (IV) Mn(SO 4)3 : sulfato de manganeso (VI) Mn 2(SO 4)7 : sulfato de manganeso (VII) 71
 Terica
Terica Introduccin
Introduccin Peroxidos 3 eso
Peroxidos 3 eso Introduccin
Introduccin Formulacin
Formulacin Nomenclatura
Nomenclatura Formulacin
Formulacin Las 4 etapas de la filosofía
Las 4 etapas de la filosofía Formulacin
Formulacin Nomenclatura del oxigeno
Nomenclatura del oxigeno Introduccin
Introduccin Induccin
Induccin Introduccin
Introduccin Tomo fix
Tomo fix Leo primero tomo 1 primero basico
Leo primero tomo 1 primero basico Sejarah perjuangan sutan syahrir
Sejarah perjuangan sutan syahrir Standard screening tomohd
Standard screening tomohd Tomo gibanica
Tomo gibanica Tomo cerovšek
Tomo cerovšek Asumo riesgos y tomo la iniciativa
Asumo riesgos y tomo la iniciativa Tomo podstenšek
Tomo podstenšek Vocabulario de jugo
Vocabulario de jugo Esde tomo 2
Esde tomo 2 1 tomo
1 tomo Principi di chimica moderna - tomo a soluzioni
Principi di chimica moderna - tomo a soluzioni E+a galaxy
E+a galaxy Ajla tomo
Ajla tomo Partes del tomo
Partes del tomo Mensajes selectos tomo 1 pdf
Mensajes selectos tomo 1 pdf Codigo nacional de electricidad
Codigo nacional de electricidad Ves
Ves Tomo mano romanas veimare
Tomo mano romanas veimare Tömő utca onkológia
Tömő utca onkológia Cuáles son los cuatro niveles de la lengua
Cuáles son los cuatro niveles de la lengua Estructura del atomo
Estructura del atomo Principi di chimica moderna - tomo a soluzioni
Principi di chimica moderna - tomo a soluzioni Mientras cenaban jesus tomo
Mientras cenaban jesus tomo Nomenclatura del voleibol
Nomenclatura del voleibol Nomenclatura rs
Nomenclatura rs Convenciones diagrama de flujo
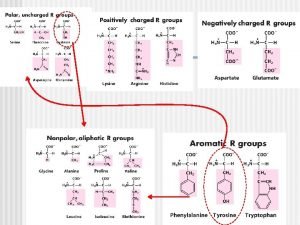
Convenciones diagrama de flujo Nomenclatura de peptidos
Nomenclatura de peptidos Velocidade
Velocidade Acido monoxoclorato
Acido monoxoclorato Nomenclatura catastral santa fe ejemplo
Nomenclatura catastral santa fe ejemplo Nomenclatura entidad relacion
Nomenclatura entidad relacion Nomenclatura de los anhidridos
Nomenclatura de los anhidridos Sales sencillas
Sales sencillas Oxosales
Oxosales Classificazione dei composti chimici mappa concettuale
Classificazione dei composti chimici mappa concettuale Anion monoatomico
Anion monoatomico Hidruros no metalicos
Hidruros no metalicos Acido fosoforoso
Acido fosoforoso Nomenclatura de redes
Nomenclatura de redes Alquinos reglas de nomenclatura
Alquinos reglas de nomenclatura Función sal
Función sal 1 2-diclorociclopentano
1 2-diclorociclopentano Isoenzima
Isoenzima Sistemática biologia
Sistemática biologia Los hidrocarburos están formados por:
Los hidrocarburos están formados por: Pbcl2 nomenclatura tradizionale
Pbcl2 nomenclatura tradizionale Cetonas nomenclatura
Cetonas nomenclatura Oxidoreductasas
Oxidoreductasas Semimetalli esempi
Semimetalli esempi Nomenclatura chetoni
Nomenclatura chetoni Refrigerante definicion
Refrigerante definicion Classificazione e nomenclatura dei composti riassunto
Classificazione e nomenclatura dei composti riassunto Posca fiorani chimica più soluzioni
Posca fiorani chimica più soluzioni Nomenclatura del hci
Nomenclatura del hci Idrossidi come si formano
Idrossidi come si formano H3c benceno
H3c benceno Filo clasificacion taxonomica
Filo clasificacion taxonomica Acido hidracido
Acido hidracido