FORMULACIN INORGNICA DEFINICIONES TILES I U P A











- Slides: 23

FORMULACIÓN INORGÁNICA

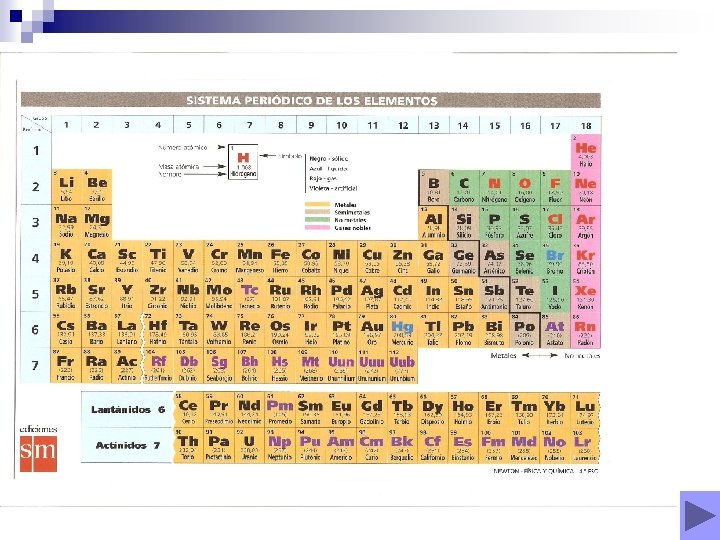
DEFINICIONES ÚTILES I. U. P. A. C. ( Unión Internacional de Química Pura y Aplicada) Organismo internacional que coordina las normas que permiten formular (formulación ) y nombrar (nomenclatura ) un compuesto químico. . NUMERO DE OXIDACIÓN Número de electrones que le faltan o le sobran al átomo del elemento para adquirir la estructura externa propia de los gases nobles. NOMENCLATURA Cómo nombramos los distintos compuestos . FÓRMULA QUÍMICA Representación escrita de una molécula o compuesto. EL SISTEMA PERIÓDICO



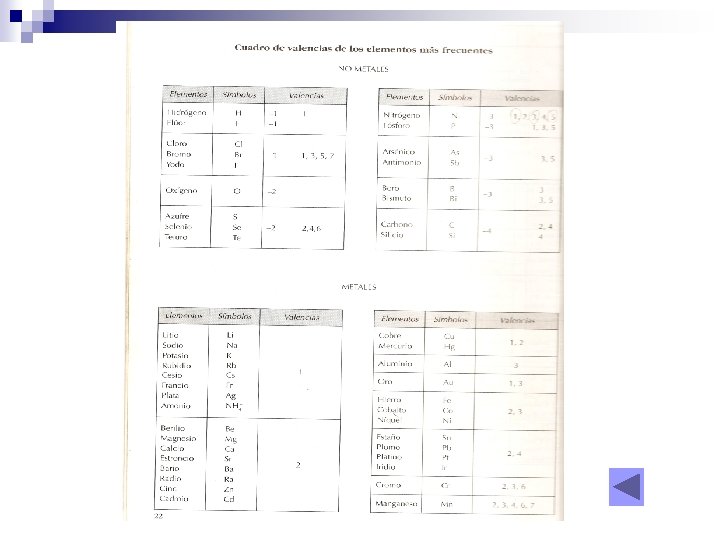
NOMENCLATURAS NOMENCLATURA SISTEMÁTICA Conocida como la de la I. U. P. A. C. Utiliza prefijos( di, tri, tetra, penta, …. . ). NOMENCLATURA DE STOCK Utiliza números romanos entre paréntesis. NOMENCLATURA TRADICIONAL Utiliza distintas terminaciones (hipo –oso oso, ico, per- ico, ) según la valencia usada.

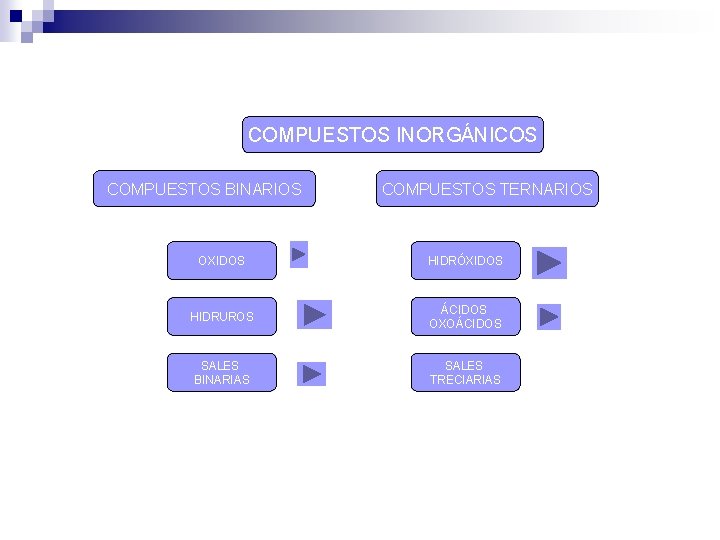
COMPUESTOS INORGÁNICOS COMPUESTOS BINARIOS COMPUESTOS TERNARIOS OXIDOS HIDRÓXIDOS HIDRUROS ÁCIDOS OXOÁCIDOS SALES BINARIAS SALES TRECIARIAS

ÓXIDOS Los óxidos son combinaciones de los elementos con el oxígeno. El nombre de estos compuestos siempre incluye la palabra óxido que puede estar precedida de prefijos numerales indicadores del número de átomos de oxígeno Óxidos no metálicos: combinación de un no metal con el oxígeno. Ejemplos: CO 2 ; SO 3 ; N 2 O 5 ; CO ; SO 2 ; NO 2 Fórmula general: X n. Om Óxidos metálicos: combinación de un metal con el oxígeno. Ejemplos: Fe 2 O 3 ; Li 2 O ; Ca. O ; Ag 2 O ; Al 2 O 3

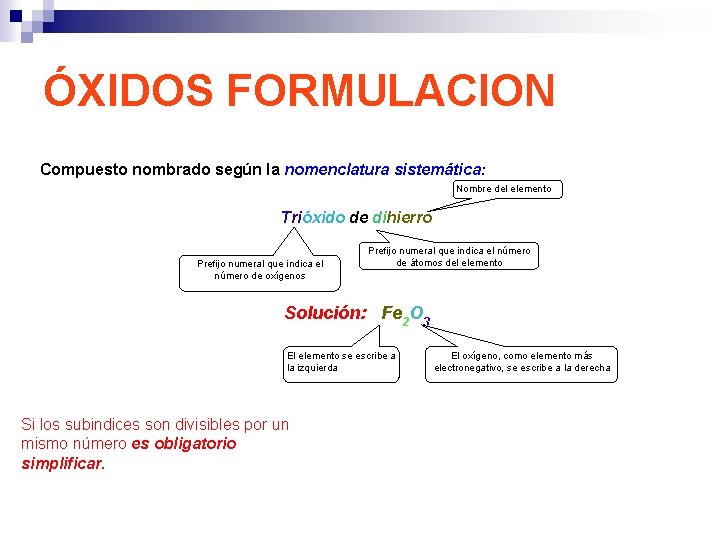
ÓXIDOS FORMULACION Compuesto nombrado según la nomenclatura sistemática: Nombre del elemento Trióxido de dihierro Prefijo numeral que indica el número de oxígenos Prefijo numeral que indica el número de átomos del elemento Solución: Fe 2 O 3 El elemento se escribe a la izquierda Si los subindices son divisibles por un mismo número es obligatorio simplificar. El oxígeno, como elemento más electronegativo, se escribe a la derecha

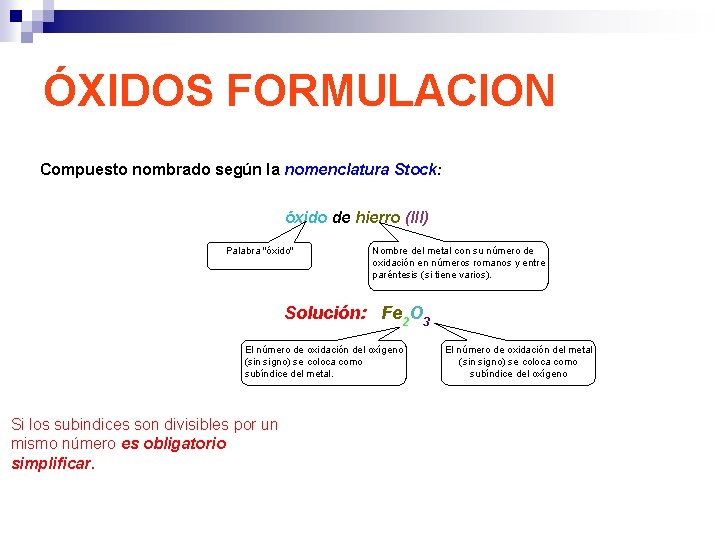
ÓXIDOS FORMULACION Compuesto nombrado según la nomenclatura Stock: óxido de hierro (III) Palabra "óxido" Nombre del metal con su número de oxidación en números romanos y entre paréntesis (si tiene varios). Solución: Fe 2 O 3 El número de oxidación del oxígeno (sin signo) se coloca como subíndice del metal. Si los subindices son divisibles por un mismo número es obligatorio simplificar. El número de oxidación del metal (sin signo) se coloca como subíndice del oxígeno

ÓXIDOS FORMULACION Compuesto nombrado cuando tiene un número de oxidación: óxido de calcio El calcio es un metal alcalino-térreo con número de oxidación fijo: +2 Solución: Ca 2 O 2 El número de oxidación del oxígeno (sin signo) se coloca como subíndice del calcio. Simplificar subindices El número de oxidación del metal (sin signo) se coloca como subíndice del oxígeno Ca. O

ÓXIDOS FORMULACION Cuando los elementos que se combinan con el oxígeno tienen estado de oxidación fijo (alcalinos, alcalino-térreos, Ag, Zn, Al. . . etc), está permitido omitir los prefijos numerales (nomenclatura sistemática) o el número de oxidación escrito entre paréntesis (nomenclatura de Stock) en el nombre del óxido correspondiente, ya que como forman un único compuesto no existe ninguna ambigüedad: Óxido de sodio, óxido de calcio, óxido de plata. . . etc. En estos casos se debe tener especial cuidado a la hora de escribir la fórmula, ya que se debe tener en cuenta el estado de oxidación del elemento y formular el óxido correspondiente cruzando, como subíndices, los correspondientes números de oxidación. Si los subíndices resultantes son divisibles por un mismo número es obligatorio simplificar.

ÓXIDOS Nomenclatura Si nos dan la fórmula El oxígeno tiene número de oxidación -2, y el número de oxidación del metal lo podemos deducir sabiendo que el compuesto es neutro. Si es siempre el mismo lo debemos conocer y no hace falta deducirlo. Mn. O 2 Nº de oxidación n La molécula tiene que ser neutra (-2) n+ 2*(-2)=0 n=4 Sistemática: Dióxido de Manganeso Stock: Óxido de Manganeso (IV) Tradicional: Óxido Manganoso RECUERDA cuando nombramos los óxidos vamos de derecha a izquierda y nunca al revés

ÓXIDOS Nomenclatura La IUPAC en las normas dictadas en el 2005, considera los halógenos mas electronegativos que el oxógeno. Según esto las combinaciones binarias de un halógeno con el oxígeno deben nombrarse como haluros y no como óxidos. OCl 2: dicloruro de oxígeno OCl 3: dicloruro de trioxógeno O 5 I 2: Diyoduro de pentaoxígeno

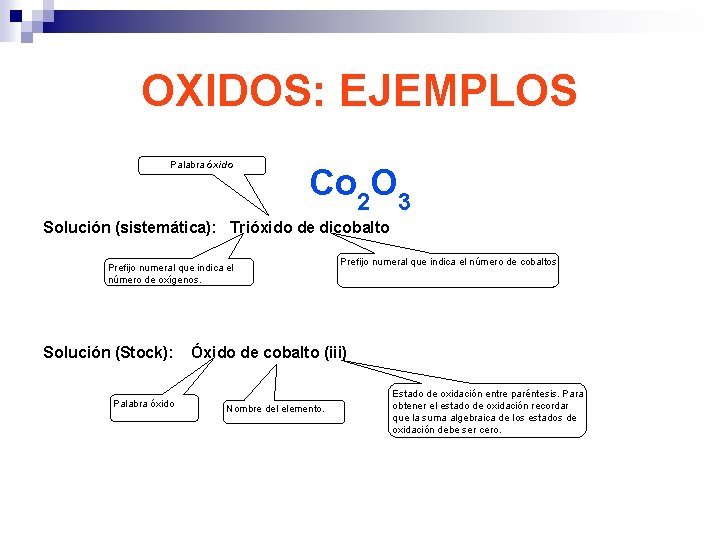
OXIDOS: EJEMPLOS Palabra óxido Co 2 O 3 Solución (sistemática): Trióxido de dicobalto Prefijo numeral que indica el número de oxígenos. Solución (Stock): Palabra óxido Prefijo numeral que indica el número de cobaltos Óxido de cobalto (iii) Nombre del elemento. Estado de oxidación entre paréntesis. Para obtener el estado de oxidación recordar que la suma algebraica de los estados de oxidación debe ser cero.

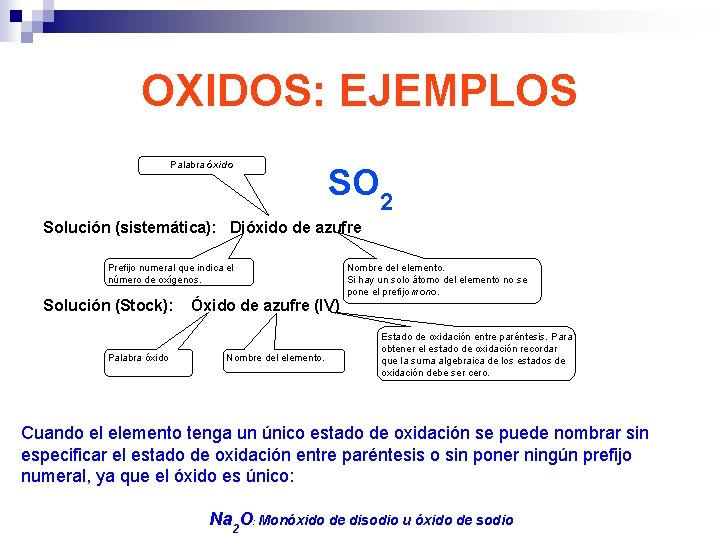
OXIDOS: EJEMPLOS Palabra óxido SO 2 Solución (sistemática): Dióxido de azufre Prefijo numeral que indica el número de oxígenos. Solución (Stock): Palabra óxido Óxido de azufre (IV) Nombre del elemento. Si hay un solo átomo del elemento no se pone el prefijo mono. Estado de oxidación entre paréntesis. Para obtener el estado de oxidación recordar que la suma algebraica de los estados de oxidación debe ser cero. Cuando el elemento tenga un único estado de oxidación se puede nombrar sin especificar el estado de oxidación entre paréntesis o sin poner ningún prefijo numeral, ya que el óxido es único: Na 2 O: Monóxido de disodio u óxido de sodio

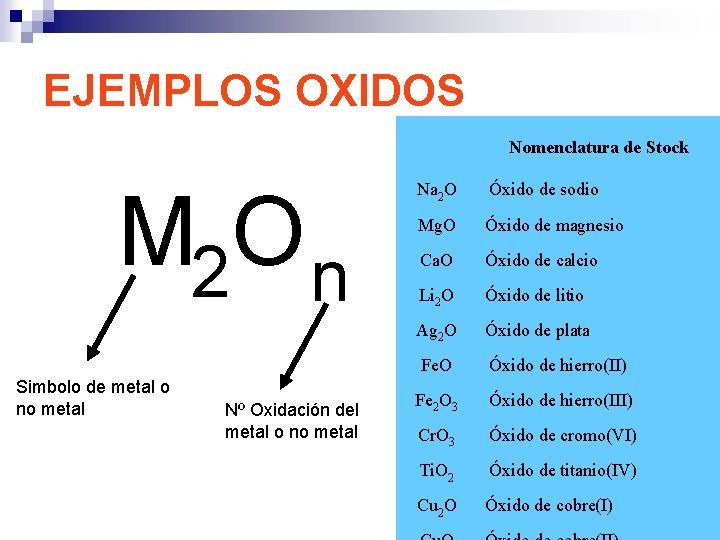
EJEMPLOS OXIDOS Nomenclatura de Stock M 2 O n Simbolo de metal o no metal Nº Oxidación del metal o no metal Na 2 O Óxido de sodio Mg. O Óxido de magnesio Ca. O Óxido de calcio Li 2 O Óxido de litio Ag 2 O Óxido de plata Fe. O Óxido de hierro(II) Fe 2 O 3 Óxido de hierro(III) Cr. O 3 Óxido de cromo(VI) Ti. O 2 Óxido de titanio(IV) Cu 2 O Óxido de cobre(I)

EJERCICIO OXIDOS EJERCICIOS OXIDOS Fórm ula Li 2 O Be. O Ca. O K 2 O Al 2 O 3 Fe. O Nombre Resultados y Óxido de rubidio soluciones Óxido de vanadio(III) Óxido de litio Óxido de cadmio Óxido de manganeso(IV) berilio Óxido de cromo(IV) Óxido de calcio Óxido de cesio FOR MUL A Rb 2 O V 2 O 3 Cd. O Óxido de cobalto(II) Óxido de potasio Óxido de cinc Óxido de berilio Óxido de cobre(II) Cr. O 2 Cs 2 O

PEROXIDOS Los peróxidos son combinaciones binarias de un metal (generalmente alcalino o alcalino-térreo) con el grupo O 22 -, grupo peróxido. El nombre de estos compuestos siempre incluye la palabra peróxido. Al agua oxigenada, o peróxido de hidrógeno, es el más conocido de esta clase de compuestos. El agua oxigenada se descompone con cierta facilidad dando oxígeno: 2 H 2 O 2 -----> 2 H 2 O + O 2 Ba. O 2 ; Ca. O 2 ; Li 2 O 2 ; Ag 2 O 2 ; Na 2 O 2; Hg 2 O 2 Fórmula general: X n. O 2 La fórmula es simplificable, siempre que se respete la agrupación (O 2)

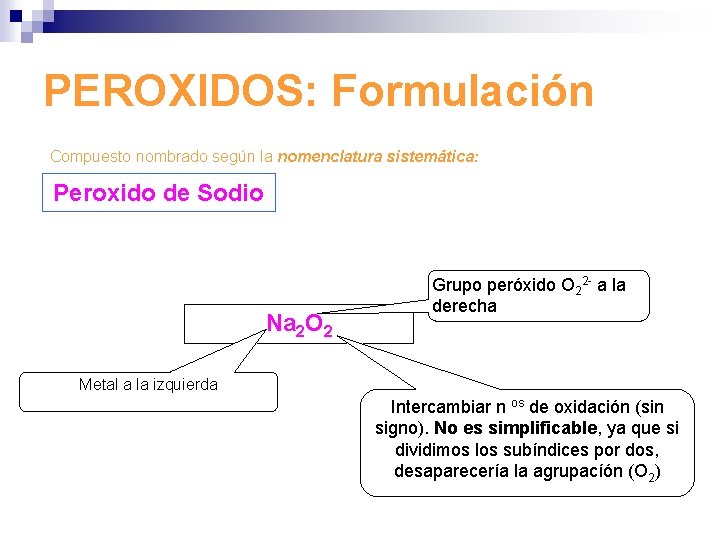
PEROXIDOS: Formulación Compuesto nombrado según la nomenclatura sistemática: Peroxido de Sodio Na 2 O 2 Grupo peróxido O 22 - a la derecha Metal a la izquierda Intercambiar n os de oxidación (sin signo). No es simplificable, ya que si dividimos los subíndices por dos, desaparecería la agrupacíón (O 2)

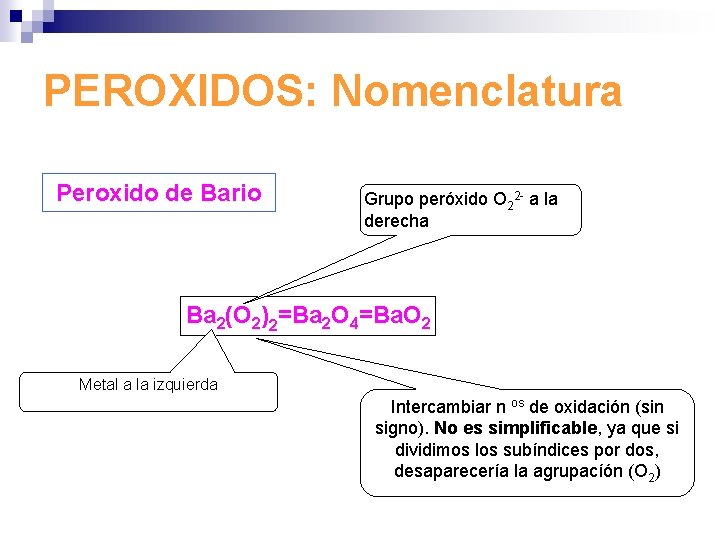
PEROXIDOS: Nomenclatura Peroxido de Bario Grupo peróxido O 22 - a la derecha Ba 2(O 2)2=Ba 2 O 4=Ba. O 2 Metal a la izquierda Intercambiar n os de oxidación (sin signo). No es simplificable, ya que si dividimos los subíndices por dos, desaparecería la agrupacíón (O 2)

PEROXIDOS: Formulación TRUCOS para formulas peroxidos: 1, - Formular el óxido: Na 2 O 2, -Añadir un oxígeno más = Na 2 O 2 Tener en cuenta que no se puede simplificar” si desaparece” el grupo (O 2)

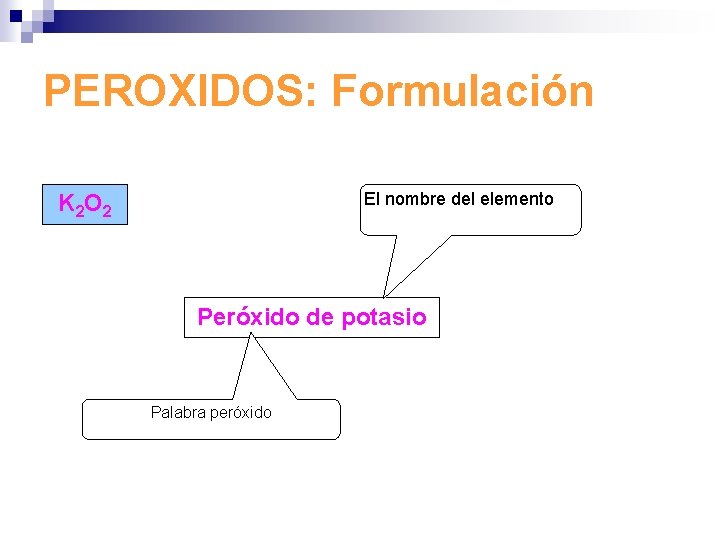
PEROXIDOS: Formulación El nombre del elemento K 2 O 2 Peróxido de potasio Palabra peróxido

PEROXIDOS Peróxido Nombre de Stock ¿Posible confusión? Na 2 O 2 Peróxido de sodio Si fuera un óxido se simplificarían los subíndices. Sería Na. O, pero el Na sólo tiene número de oxidación +1, no +2 como exigiría este compuesto. K 2 O 2 Peróxido de potasio Lo mismo que en el ejemplo anterior. Mg. O 2 Peróxido de magnesio Si fuera un óxido el magnesio tendría número de oxidación +4, pero no lo tiene pues su número de oxidación fijo es +2. Ca. O 2 Peróxido de calcio Lo mismo que en el ejemplo anterior Cu 2 O 2 Peróxido de cobre(I) Si fuera óxido de cobre(II) sería Cu. O, y si fuera óxido de cobre(I) sería Cu 2 O. Peróxido de cinc Si fuera un óxido el cinc tendría número de oxidación +4, pero no lo tiene pues su número de oxidación fijo es +2. Zn. O 2
 Hidruro de potasio
Hidruro de potasio Formulacin
Formulacin Oxoacidos
Oxoacidos Formulacin
Formulacin Matriz de analisis de involucrados
Matriz de analisis de involucrados Formulacin
Formulacin Arco doble formulas
Arco doble formulas Tres definiciones de concepto
Tres definiciones de concepto Estado de resultados de una empresa de servicios
Estado de resultados de una empresa de servicios Definiciones de sociologia
Definiciones de sociologia Definiciones básicas
Definiciones básicas Definiciones quimicas
Definiciones quimicas Definiciones leccion 1
Definiciones leccion 1 El ambiente
El ambiente Narrador de conocimiento limitado
Narrador de conocimiento limitado Conclusion del pensamiento critico
Conclusion del pensamiento critico Definiciones de emprender
Definiciones de emprender Definicion de salud vocacional
Definicion de salud vocacional Concepto de derecho internacional publico
Concepto de derecho internacional publico Definiciones conceptuales
Definiciones conceptuales Modelo del desafio
Modelo del desafio Resiliencia definiciones
Resiliencia definiciones Consecuencias del boom latinoamericano
Consecuencias del boom latinoamericano Definiciones de la verdad
Definiciones de la verdad











































