Nomenclatura Inorgnica Nomenclatura Qumica Es el sistema de


















- Slides: 29

Nomenclatura Inorgánica

Nomenclatura Química • Es el sistema de normas, comunes en todo el mundo, para denominar a los elementos y compuestos químicos. • El organismo encargado de dictar tales normas se llama Unión Internacional de Química Pura y Aplicada (IUPAC). • Para nombrar o formular compuestos es necesario conocer: el nombre del elemento y su estado de oxidación o valencia.

Valencia • Cada elemento químico tiene una capacidad de combinación, llamada valencia, designada por uno o más números. • Para obtener la valencia es necesario conocer la configuración electrónica del elemento, y por otra, atender al número de electrones de valencia.

Clasificación de los compuestos químicos 1. • Según el número de elementos: Compuestos binarios: Formados por 2 elementos, Ejemplo Na. Cl • Compuestos ternarios: Formados por 3 elementos, Ejemplo H 2 SO 4 • Compuestos cuaternarios: Formados por 4 o más elementos. Ejemplo Na. HCO 3 2. Considerando el tipo de elemento: se reconocen compuestos orgánicos (presentan átomos de carbono) e inorgánicos (no presentan átomos de carbono en general).

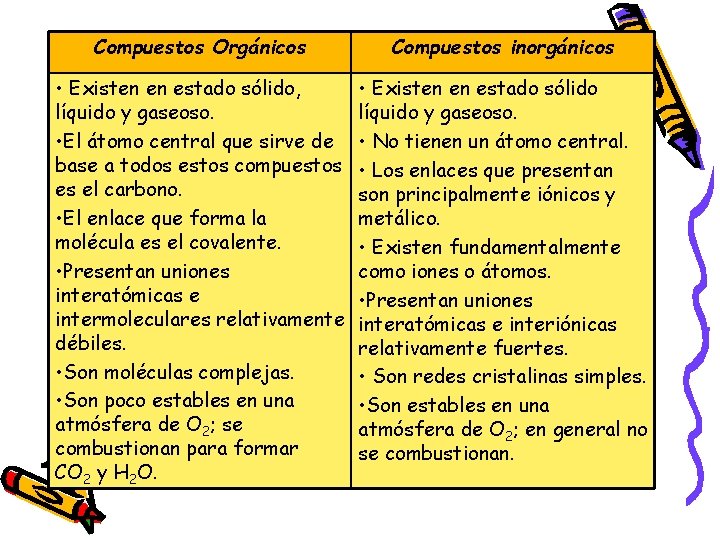
Compuestos Orgánicos Compuestos inorgánicos • Existen en estado sólido, líquido y gaseoso. • El átomo central que sirve de base a todos estos compuestos es el carbono. • El enlace que forma la molécula es el covalente. • Presentan uniones interatómicas e intermoleculares relativamente débiles. • Son moléculas complejas. • Son poco estables en una atmósfera de O 2; se combustionan para formar CO 2 y H 2 O. • Existen en estado sólido líquido y gaseoso. • No tienen un átomo central. • Los enlaces que presentan son principalmente iónicos y metálico. • Existen fundamentalmente como iones o átomos. • Presentan uniones interatómicas e interiónicas relativamente fuertes. • Son redes cristalinas simples. • Son estables en una atmósfera de O 2; en general no se combustionan.

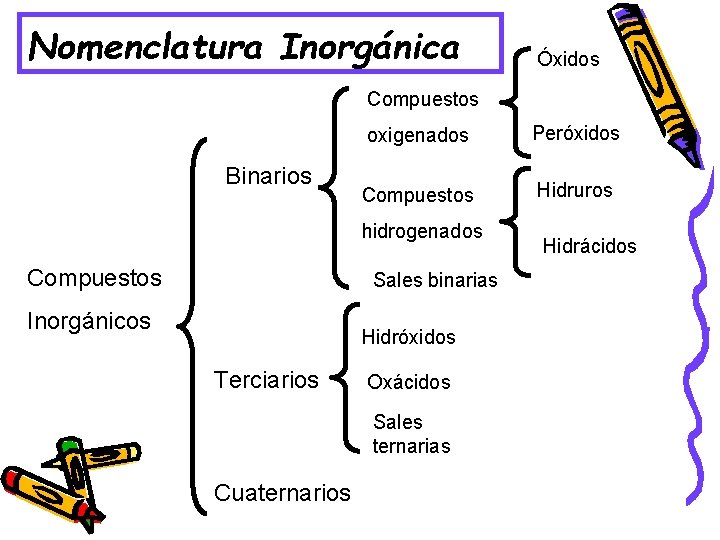
Nomenclatura Inorgánica Óxidos Compuestos Binarios oxigenados Peróxidos Compuestos Hidruros hidrogenados Compuestos Sales binarias Inorgánicos Hidróxidos Terciarios Oxácidos Sales ternarias Cuaternarios Hidrácidos

Compuestos binarios • Están formados por dos elementos, independientes de su cantidad de átomos. • Por ser de una estructura muy simple, los compuestos binarios inorgánicos son la materia prima para procesos industriales de mayor complejidad. • Los compuestos binarios más conocidos son los oxigenados, los hidrogenados y las sales binarias.

Nomenclatura de compuestos binarios • Los compuestos binarios se pueden nombrar de acuerdo a Nomenclatura Stock (IUPAC) o Tradicional.

Nomenclatura IUPAC, Stock o Funcional • Se escribe primero el tipo de compuesto y luego, el nombre del elemento menos electronegativo seguido de su estado de oxidación o valencia con número romano entre paréntesis. Si el elemento presenta un solo estado de oxidación o valencia se omite el numeral romano. • Recomendada para óxidos, hidruros, hidróxidos. _____de_____(v) Ejemplo: Ca. H 2 Hidruro de calcio Cu 2 O Óxido de cobre (I)

Nomenclatura Tradicional Consiste en escribir el tipo de compuesto utilizando prefijos y/o sufijos, según la cantidad de estados de oxidación o valencias que presente un metal o un no metal. Raíz Sufijo Au 2 O 3 óxido cuproso Cl 2 O anhídrido Hipocloroso Prefijo

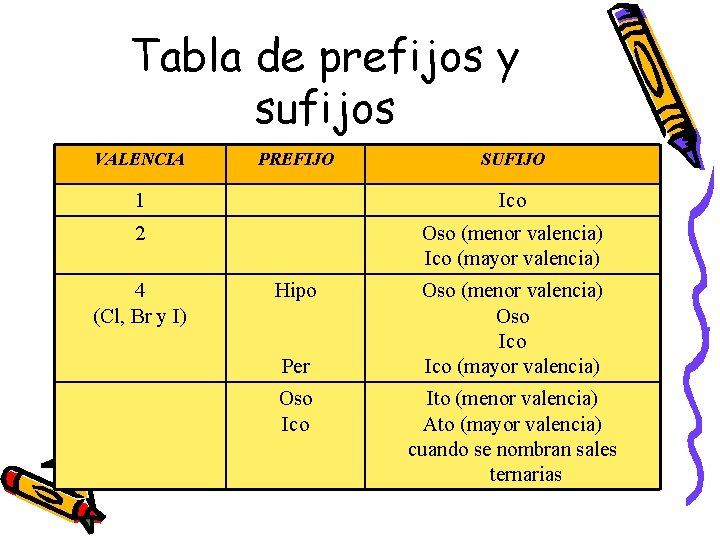
Tabla de prefijos y sufijos VALENCIA PREFIJO SUFIJO 1 Ico 2 Oso (menor valencia) Ico (mayor valencia) 4 (Cl, Br y I) Hipo Per Oso Ico Oso (menor valencia) Oso Ico (mayor valencia) Ito (menor valencia) Ato (mayor valencia) cuando se nombran sales ternarias

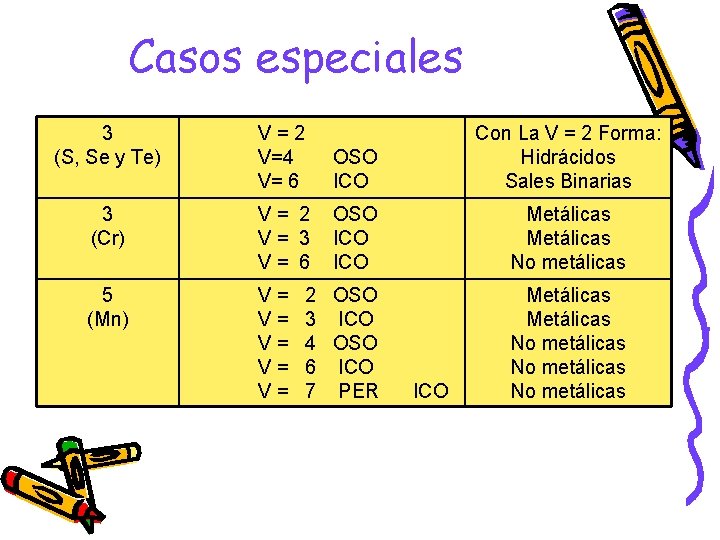
Casos especiales 3 (S, Se y Te) V=2 V=4 V= 6 OSO ICO Con La V = 2 Forma: Hidrácidos Sales Binarias 3 (Cr) V= 2 V= 3 V= 6 OSO ICO Metálicas No metálicas 5 (Mn) V= V= V= 2 OSO 3 ICO 4 OSO 6 ICO 7 PER Metálicas No metálicas ICO

Observaciones • Cuando se utiliza la nomenclatura tradicional para nombrar compuestos, existen algunos elementos que cambian su nombre por su raíz griega o latina correspondiente. ELEMENTO RAÍZ COBRE CUPRUM ORO AURUM PLATA ARGENTUM HIERRO FERRUM PLOMO PLUMBUM AZUFRE SULFURUM NITRÓGENO NITRUM ESTAÑO ESTAN

Nomenclatura Sistemática Indica el número de átomos de cada elemento con los prefijos mono, di, tri, tetra, penta, etc. Ejemplos: CO 2 P 2 O 5 As 2 O 3 CO Cl 2 O 7 SO 3 En general: X 2 O XO X 2 O 3 XO 2 X 2 O 5 XO 3 X 2 O 7 dióxido de carbono Pentaóxido de difosforo Trióxido de diarsénico Monóxido de carbono heptaóxido de dicloro Trióxido de azufre óxido de di …………… monóxido de ……………. trióxido de di…………. . dióxido de ……………. pentaóxido de di …………. . trióxido de ……………. heptaóxido de di ………….

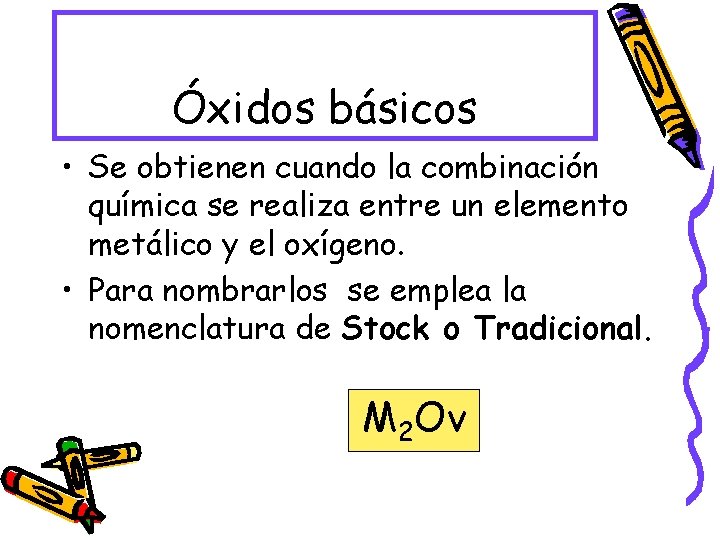
Óxidos básicos • Se obtienen cuando la combinación química se realiza entre un elemento metálico y el oxígeno. • Para nombrarlos se emplea la nomenclatura de Stock o Tradicional. M 2 Ov

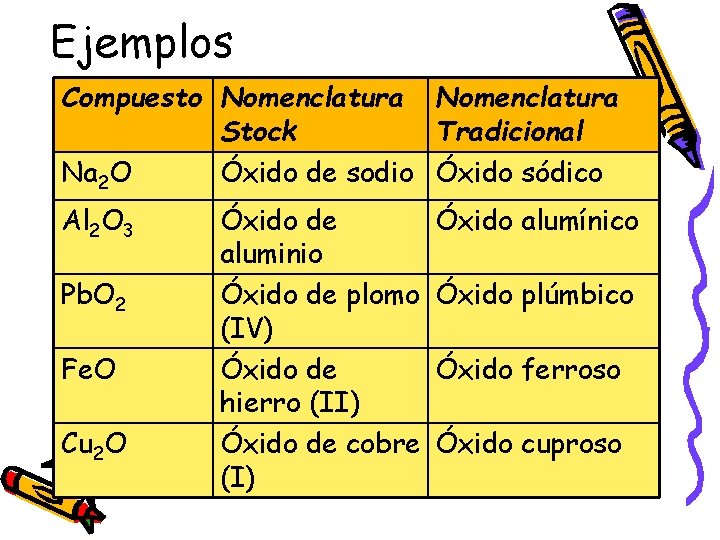
Ejemplos Compuesto Nomenclatura Stock Tradicional Na 2 O Óxido de sodio Óxido sódico Al 2 O 3 Pb. O 2 Fe. O Cu 2 O Óxido de aluminio Óxido de plomo (IV) Óxido de hierro (II) Óxido de cobre (I) Óxido alumínico Óxido plúmbico Óxido ferroso Óxido cuproso

Óxidos ácidos o Anhídridos • Se obtienen cuando la combinación química se realiza entre un elemento con carácter no metálico y el oxígeno. • Para nombrarlos se emplea la nomenclatura de Stock, Tradicional y sistemática, teniendo presente que cuando se les nombra en la nomenclatura tradicional la palabra óxido se cambia por anhídrido. NM 2 Ov

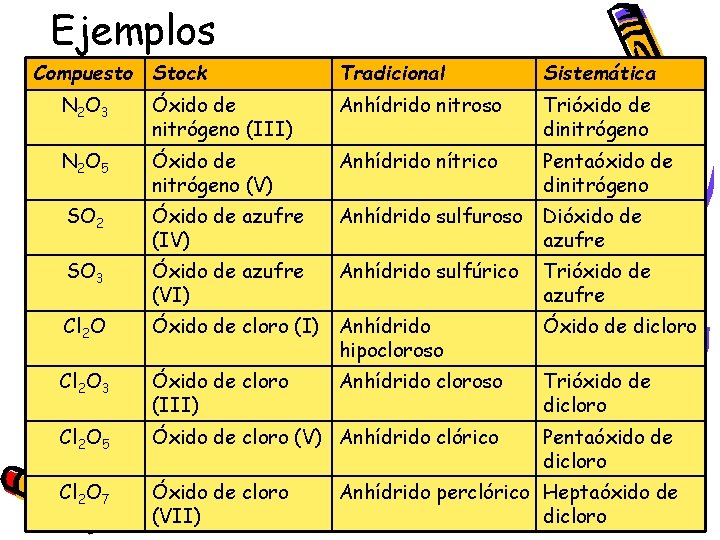
Ejemplos Compuesto Stock Tradicional Sistemática N 2 O 3 Óxido de nitrógeno (III) Anhídrido nitroso Trióxido de dinitrógeno N 2 O 5 Óxido de nitrógeno (V) Anhídrido nítrico Pentaóxido de dinitrógeno SO 2 Óxido de azufre (IV) Anhídrido sulfuroso Dióxido de azufre SO 3 Óxido de azufre (VI) Anhídrido sulfúrico Trióxido de azufre Cl 2 O Óxido de cloro (I) Anhídrido hipocloroso Óxido de dicloro Cl 2 O 3 Óxido de cloro (III) Trióxido de dicloro Cl 2 O 5 Óxido de cloro (V) Anhídrido clórico Cl 2 O 7 Óxido de cloro (VII) Anhídrido cloroso Pentaóxido de dicloro Anhídrido perclórico Heptaóxido de dicloro

Peróxidos Los peróxidos son combinaciones binarias de un metal principalmente del grupo I y IIA con un grupo peroxi O 22 -. M 2 O 2 v

Ejemplos • Na 2 O 2 • Ba. O 2 • Ag 2 O 2 peróxido de sodio peróxido de bario peróxido de plata

Hidruros metálicos • Compuestos formados por un elemento metálico y el hidrógeno. Se les nombra con la palabra hidruro siguiendo la nomenclatura Stock y tradicional. MHv

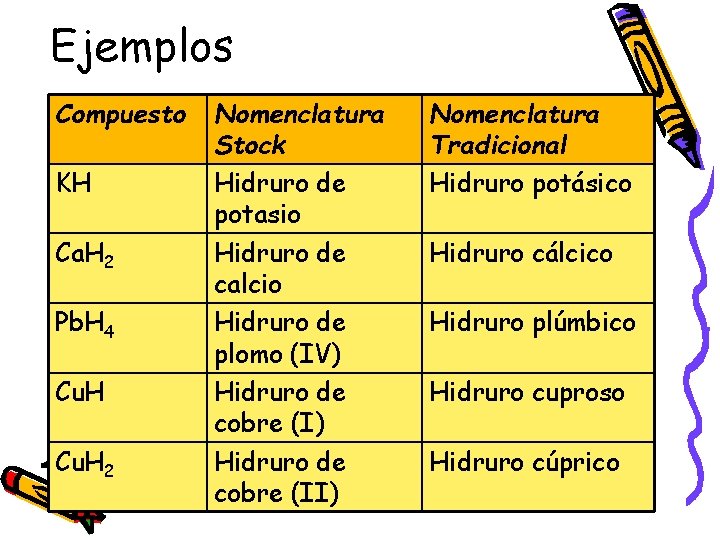
Ejemplos Compuesto KH Ca. H 2 Pb. H 4 Cu. H 2 Nomenclatura Stock Hidruro de potasio Hidruro de calcio Hidruro de plomo (IV) Hidruro de cobre (II) Nomenclatura Tradicional Hidruro potásico Hidruro cálcico Hidruro plúmbico Hidruro cuproso Hidruro cúprico

Hidrácidos o ácidos binarios • Están formados por la combinación del hidrógeno y un no metal, esencialmente del grupo VI y VIIA. • Estos elementos actúan con su valencia menor. Para nombrarlos se coloca la palabra ácido seguida del elemento que termina con la palabra hídrico. Hv. NM

Ejemplos Compuesto HCl H 2 S HF Nomenclatura Stock Cloruro de hidrógeno Sulfuro de hidrógeno Fluoruro de hidrógeno Nomenclatura Tradicional Ácido clorhídrico Ácido Sulfhídrico Ácido fluorhídrico

Compuestos hidrogenados covalentes • Están formados por un elemento no metálico del grupo V e hidrógeno.

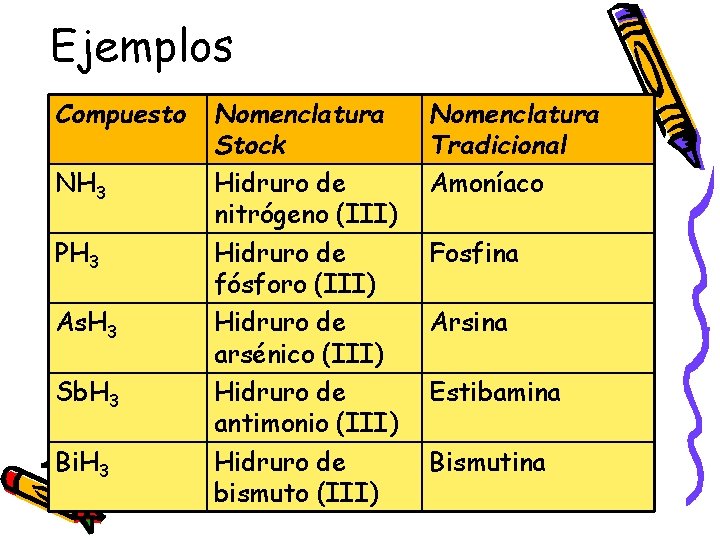
Ejemplos Compuesto NH 3 PH 3 As. H 3 Sb. H 3 Bi. H 3 Nomenclatura Stock Hidruro de nitrógeno (III) Hidruro de fósforo (III) Hidruro de arsénico (III) Hidruro de antimonio (III) Hidruro de bismuto (III) Nomenclatura Tradicional Amoníaco Fosfina Arsina Estibamina Bismutina

Sales binarias • • Son compuestos formados por un elemento metálico y otro elemento no metálico, del grupo VII, VI y VA. Para nombrarlos se utiliza el nombre del elemento no metálico con el sufijo uro, seguido del nombre del metal, de acuerdo a la valencia con que este actuando.

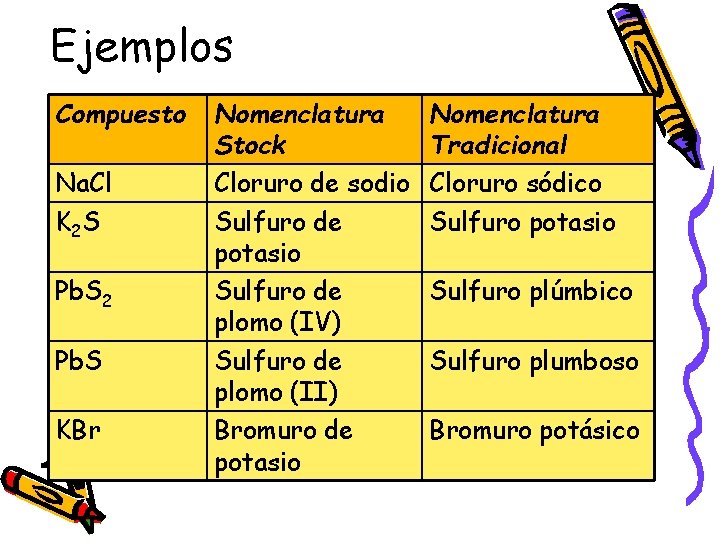
Ejemplos Compuesto Na. Cl K 2 S Pb. S 2 Pb. S KBr Nomenclatura Stock Cloruro de sodio Sulfuro de potasio Sulfuro de plomo (IV) Sulfuro de plomo (II) Bromuro de potasio Nomenclatura Tradicional Cloruro sódico Sulfuro potasio Sulfuro plúmbico Sulfuro plumboso Bromuro potásico

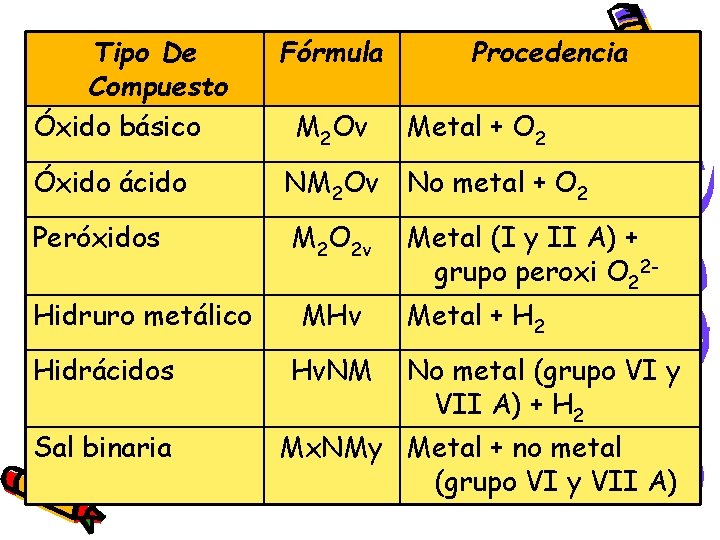
Tipo De Compuesto Óxido básico Fórmula Óxido ácido NM 2 Ov No metal + O 2 Peróxidos M 2 O 2 v Metal (I y II A) + grupo peroxi O 22 - Hidruro metálico Hidrácidos Sal binaria M 2 Ov MHv Hv. NM Procedencia Metal + O 2 Metal + H 2 No metal (grupo VI y VII A) + H 2 Mx. NMy Metal + no metal (grupo VI y VII A)
 Hidrácidos
Hidrácidos Qumica
Qumica Qumica
Qumica Clasificacion de compuesto inorganico
Clasificacion de compuesto inorganico Qumica
Qumica Celdas
Celdas Qumica
Qumica Qumica
Qumica Qumica
Qumica Tabla qumica
Tabla qumica Qumica
Qumica Qumica
Qumica Enxofre rombico e monoclinico diferença
Enxofre rombico e monoclinico diferença Aplicaciones del cloro
Aplicaciones del cloro Hidrocarbonetos
Hidrocarbonetos Qumica
Qumica Qumica
Qumica Qumica
Qumica Características de los alquinos
Características de los alquinos Epimeros
Epimeros Funcion quimica y grupo funcional
Funcion quimica y grupo funcional Qumica
Qumica Qumica
Qumica Carbono primario secundario y terciario
Carbono primario secundario y terciario As interações entre os íons produzem aglomerados
As interações entre os íons produzem aglomerados Cintica
Cintica Qumica
Qumica Qumica
Qumica Qumica moderna
Qumica moderna Qumica
Qumica





















































