Nomenclatura Inorgnica Javier Alvarez Qumica I Colegio Salesiano





















- Slides: 48

Nomenclatura Inorgánica Javier Alvarez Química I Colegio Salesiano Don Bosco

Estados de Oxidación §Cargas netas en los átomos §Iones -1 Cl §iones monoatómicos §Iones poliatómicos Cl. O-1 §Cationes Ca+2 §Aniones Cl-1

Iones y Moléculas Los iones son compuestos con una carga especifica. Mn. O 4 NO 3 NH 4+ La sumatoria de carga en una molécula es igual a CERO. KMn. O 4 H 2 SO 4 PCl 5

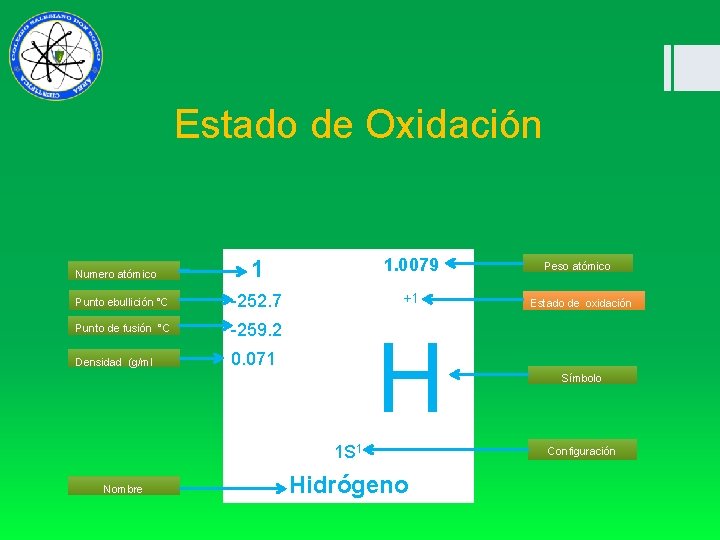
Estado de Oxidación 1. 0079 Peso atómico -252. 7 +1 Estado de oxidación Punto de fusión °C -259. 2 Densidad (g/ml 0. 071 H Símbolo Numero atómico 1 Punto ebullición °C 1 S 1 Nombre Hidrógeno Configuración

Moléculas m + olécula - + - Na Na. Cl + - KK 2 2 SO SO 4 4

Cálculo de estados de oxidación EO= n(E 1) + n(E 2) + n(E 3) …. . + n(Ex) EO= estado de oxidación n= número de moles de cada átomo (el sub-índice que lo acompaña) E= elemento

H 2 SO 4 EO= n(E 1) + n(E 2) + n(E 3) …. . + n(Ex) Por ser una molécula 0= 2(1) + 1(X) + 4(-2) X= 8 – 2 X= 6 R/ El estado de oxidación del azufre es igual a +6

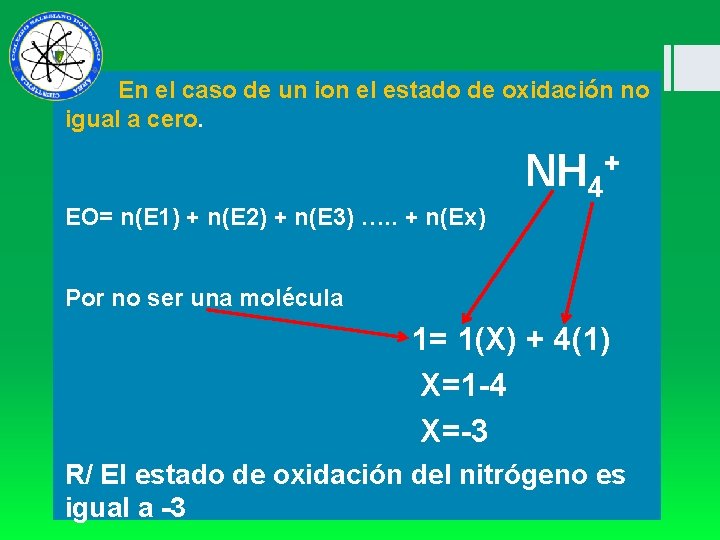
En el caso de un ion el estado de oxidación no igual a cero. NH 4+ EO= n(E 1) + n(E 2) + n(E 3) …. . + n(Ex) Por no ser una molécula 1= 1(X) + 4(1) X=1 -4 X=-3 R/ El estado de oxidación del nitrógeno es igual a -3

Calculando fórmulas moleculares S+6 O-2 S 2 O 6 SO 3 Fe+3 Cl-1 Fe. Cl 3

Calcule los Estados de Oxidación de : K 2 O = K=+1 O=-2 Fe. Cl 3 = Fe=+3 Cl=-1

Sistema dicotomico de nombramiento de compuestos químicos Nombre Genérico Óxido Cloruro Ácido Nombre especifico Perclórico De sodio Sulfúrico

Compuestos Simples Compuestos con un solo heteroatomo Monoatómicos Al(s) Metales Compuestos con dos heteroatomos Diatómicos Cl 2 No-metales

Compuestos Nombre Al Aluminio metálico Cu Cobre metálico Au Oro metálico K Potasio metálico S(rómbico) Azufre rómbico C(grafito) Carbono Grafito

Compuestos Nombre Cl 2 Cloro molecular S 2 Azufre molecular N 2 Nitrógeno molecular O 2 Oxígeno molecular O 3 Ozono

Sistemas de Nomenclatura §Sistema Clásico o Fundamental. §Sistema Estequiométrico §Sistema Stock

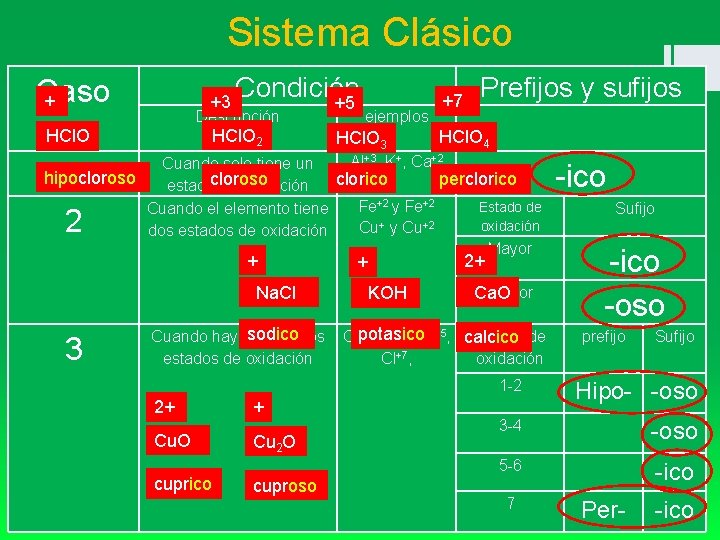
Sistema Clásico Caso + +3 Condición +5 Descripción HCl. O 2 HCl. O ejemplos HCl. O 3 +7 Prefijos y sufijos HCl. O 4 Al+3, K+, Ca+2 Cuando solo tiene un hipocloroso clorico cloroso perclorico estado de oxidación Fe+2 y Fe+2 Estado de Cuando el elemento tiene oxidación Cu+ y Cu+2 dos estados de oxidación Mayor 1 2 3 + + 2+ Na. Cl KOH Menor Ca. O sodico potasico Cuando hay más de dos Cl+1 , Cl+3, Cl+5, calcico Estado de estados de oxidación Cl+7, oxidación 1 -2 2+ + Cu. O Cu 2 O cuprico cuproso -ico Sufijo -ico -oso prefijo Sufijo Hipo- -oso 3 -4 -oso 5 -6 -ico 7 Per- -ico

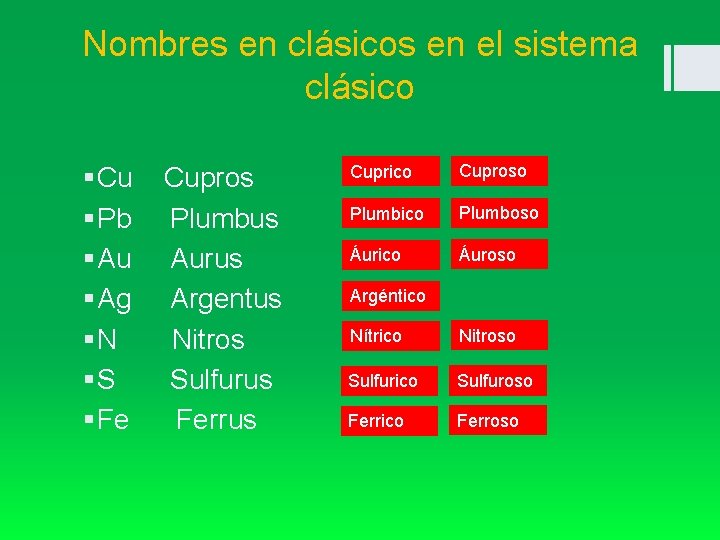
Nombres en clásicos en el sistema clásico § Cu Cupros § Pb Plumbus § Au Aurus § Ag Argentus § N Nitros § S Sulfurus § Fe Ferrus Cuprico Cuproso Plumbico Plumboso Áurico Áuroso Argéntico Nítrico Nitroso Sulfurico Sulfuroso Ferrico Ferroso

Sistema Estequiometrico §Prefijo de cantidad 1 = mono 1 = - Cl. O óxido monóxido 2 = di- Cl. O 2 dióxido 3 = tri- Cl. O 3 trióxido 4 = tetra- Cl. O 4 tetraóxido §El termino mono puede ser omitido

Sistema Stock § El estado de oxidación del elemento menos electropositivo es colocado entre paréntesis y con números romanos. +2 +3 Fe. O Fe 2 O 3 Oxido de hierro (II) Oxido de hierro (III) § Cuando este elemento tiene una sola posibilidad de estado de oxidación puede obviarse. +2 Ca. O Oxido de calcio (II) Oxido de calcio

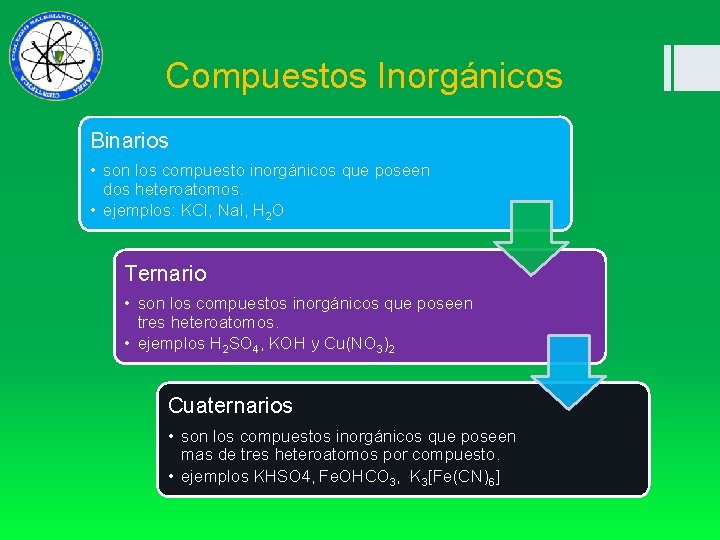
Compuestos Inorgánicos Binarios • son los compuesto inorgánicos que poseen dos heteroatomos. • ejemplos: KCl, Na. I, H 2 O Ternario • son los compuestos inorgánicos que poseen tres heteroatomos. • ejemplos H 2 SO 4, KOH y Cu(NO 3)2 Cuaternarios • son los compuestos inorgánicos que poseen mas de tres heteroatomos por compuesto. • ejemplos KHSO 4, Fe. OHCO 3, K 3[Fe(CN)6]

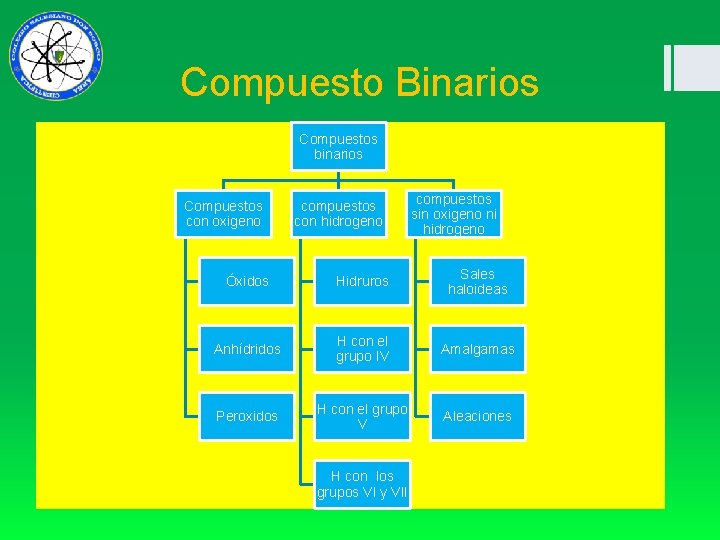
Compuesto Binarios Compuestos binarios Compuestos con oxigeno compuestos con hidrogeno compuestos sin oxigeno ni hidrogeno Óxidos Hidruros Sales haloideas Anhídridos H con el grupo IV Amalgamas Peroxidos H con el grupo V Aleaciones H con los grupos VI y VII

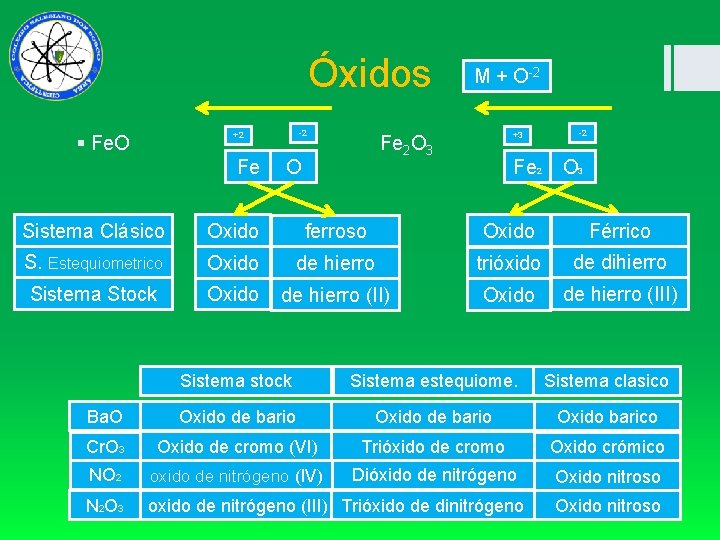
Óxidos +2 M + O-2 -2 -2 +3 § Fe. O Fe 2 O 3 Fe O Fe 2 O 3 Sistema Clásico Oxido ferroso Oxido Férrico S. Estequiometrico Oxido de hierro trióxido de dihierro Sistema Stock Oxido de hierro (II) Oxido de hierro (III) Sistema stock Sistema estequiome. Sistema clasico Ba. O Oxido de bario Oxido barico Cr. O 3 Oxido de cromo (VI) Trióxido de cromo Oxido crómico NO 2 oxido de nitrógeno (IV) Dióxido de nitrógeno Oxido nitroso N 2 O 3 oxido de nitrógeno (III) Trióxido de dinitrógeno Oxido nitroso

Anhídridos -2 +4 C Sistema Clásico S. Estequiometrico Sistema Stock S Carbónico Sistema clasico O 3 Anhídrido Sulfurico trióxido de azufre Oxido de azufre (VI) Dióxido de Carbono Oxido -2 +6 O 2 Anhídrido Nm + O-2 de carbono(IV) Sistema estequiome. Sistema stock SO Anhídrido hiposulfuroso Oxido de azufre (II) Se. O 3 Anhídrido selenico trióxido de selenio Oxido de selenio (VI) Si. O 2 Anhídrido silicico dióxido de silicio Oxido de silicio (IV) N 2 O 3 Anhídrido nitroso trióxido de dinitrogeno Oxido de nitrogeno (III)

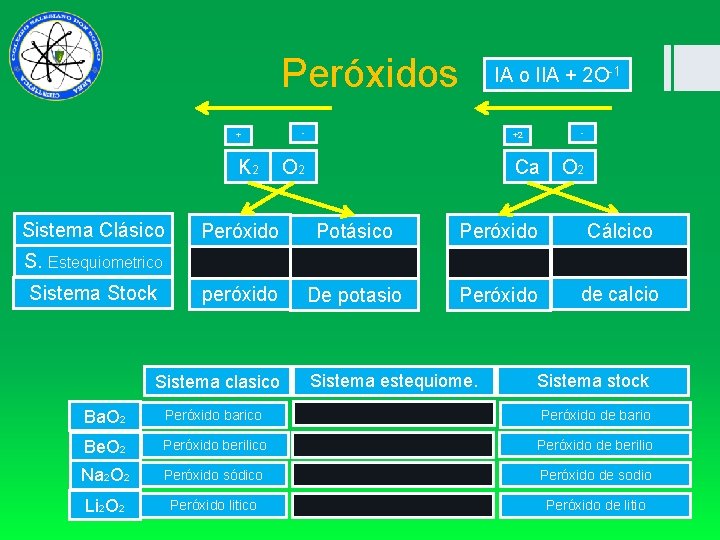
Peróxidos - + K 2 Sistema Clásico IA o IIA + 2 O-1 - +2 O 2 Ca O 2 Peróxido Potásico Peróxido Cálcico peróxido De potasio Peróxido de calcio S. Estequiometrico Sistema Stock Sistema clasico Sistema estequiome. Sistema stock Ba. O 2 Peróxido barico Peróxido de bario Be. O 2 Peróxido berilico Peróxido de berilio Na 2 O 2 Peróxido sódico Peróxido de sodio Li 2 O 2 Peróxido litico Peróxido de litio

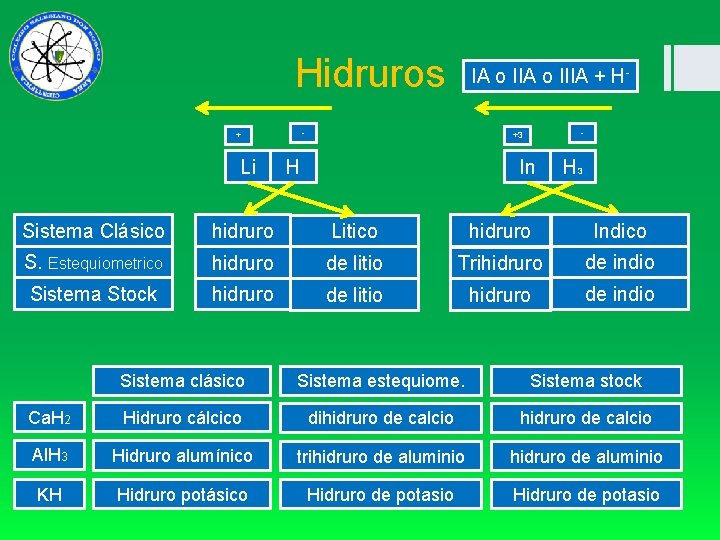
Hidruros IA o IIIA + H - + Li - +3 H - In H 3 Sistema Clásico hidruro Litico hidruro Indico S. Estequiometrico hidruro de litio Trihidruro de indio Sistema Stock hidruro de litio hidruro de indio Sistema clásico Sistema estequiome. Sistema stock Ca. H 2 Hidruro cálcico dihidruro de calcio Al. H 3 Hidruro alumínico trihidruro de aluminio KH Hidruro potásico Hidruro de potasio

H con el grupo IV A H = 2 + 2 C alcano H = 2 + 2 Si C o S + H+ Silanos CH 4 metano Si. H 4 metasilano C 2 H 6 etano Si 2 H 6 etasilano C 3 H 8 propano Si 3 H 8 propasilano C 4 H 10 butano Si 4 H 10 butasilano C 5 H 12 pentano Si 5 H 12 pentasilano

H con el grupo V A Nombre común NH 3 amoniaco PH 3 fosfina As. H 3 Arsina Sb. H 3 Estibina NH 4+ Ion amonio

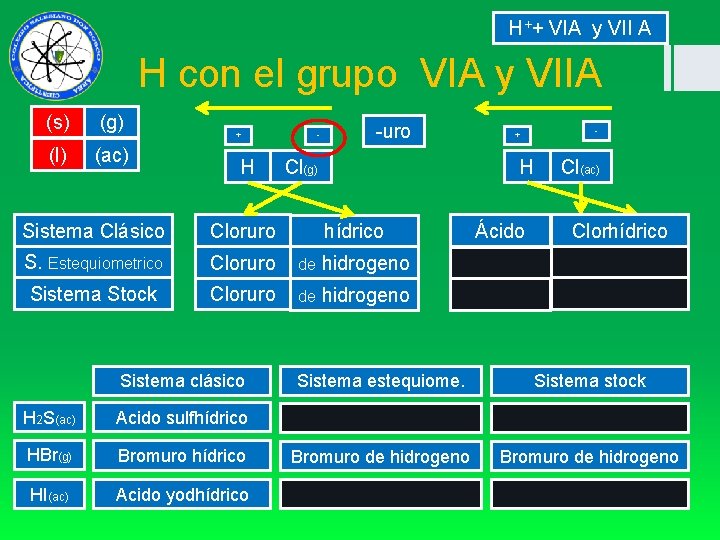
H++ VIA y VII A H con el grupo VIA y VIIA (s) (g) (l) (ac) + H - -uro Cl(g) H Sistema Clásico Cloruro hídrico S. Estequiometrico Cloruro de hidrogeno Sistema Stock Cloruro de hidrogeno Sistema clásico H 2 S(ac) Acido sulfhídrico HBr(g) Bromuro hídrico HI(ac) Acido yodhídrico - + Ácido Cl(ac) Clorhídrico Sistema estequiome. Sistema stock Bromuro de hidrogeno

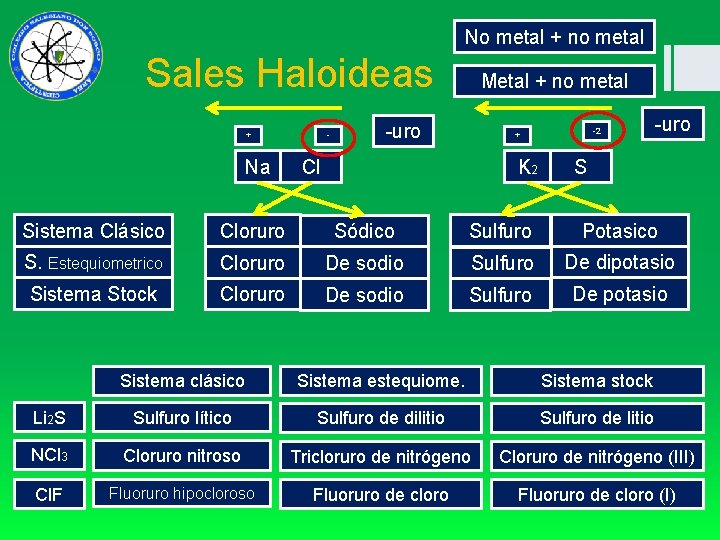
No metal + no metal Sales Haloideas + - Na Metal + no metal -uro -2 + Cl K 2 -uro S Sistema Clásico Cloruro Sódico Sulfuro Potasico S. Estequiometrico Cloruro De sodio Sulfuro De dipotasio Sistema Stock Cloruro De sodio Sulfuro De potasio Sistema clásico Sistema estequiome. Sistema stock Li 2 S Sulfuro lítico Sulfuro de dilitio Sulfuro de litio NCl 3 Cloruro nitroso Tricloruro de nitrógeno Cloruro de nitrógeno (III) Cl. F Fluoruro hipocloroso Fluoruro de cloro (I)

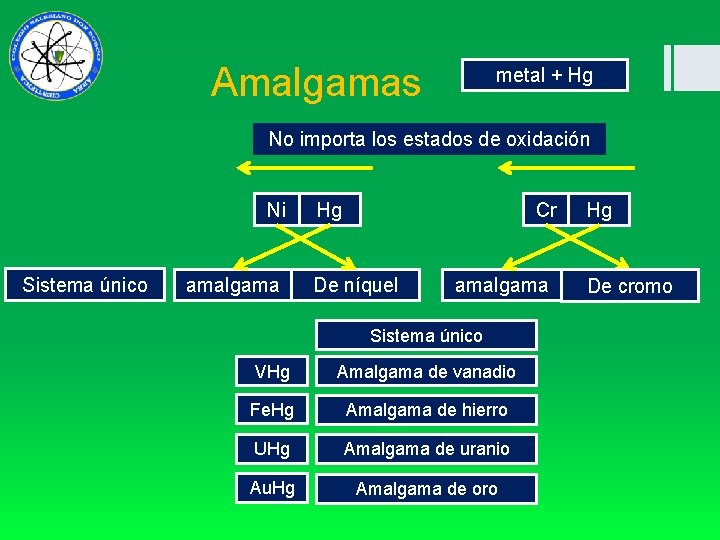
Amalgamas metal + Hg No importa los estados de oxidación Ni Sistema único amalgama Hg Cr De níquel amalgama Sistema único VHg Amalgama de vanadio Fe. Hg Amalgama de hierro UHg Amalgama de uranio Au. Hg Amalgama de oro Hg De cromo

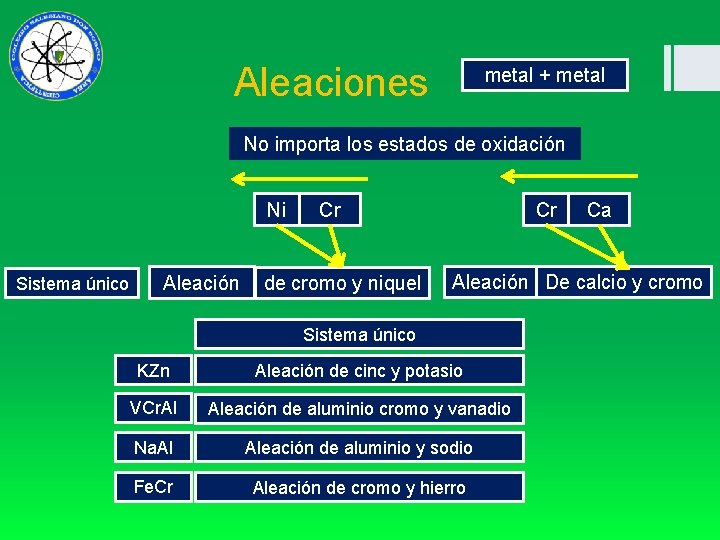
Aleaciones metal + metal No importa los estados de oxidación Ni Sistema único Cr Aleación de cromo y niquel Cr Ca Aleación De calcio y cromo Sistema único KZn Aleación de cinc y potasio VCr. Al Aleación de aluminio cromo y vanadio Na. Al Aleación de aluminio y sodio Fe. Cr Aleación de cromo y hierro

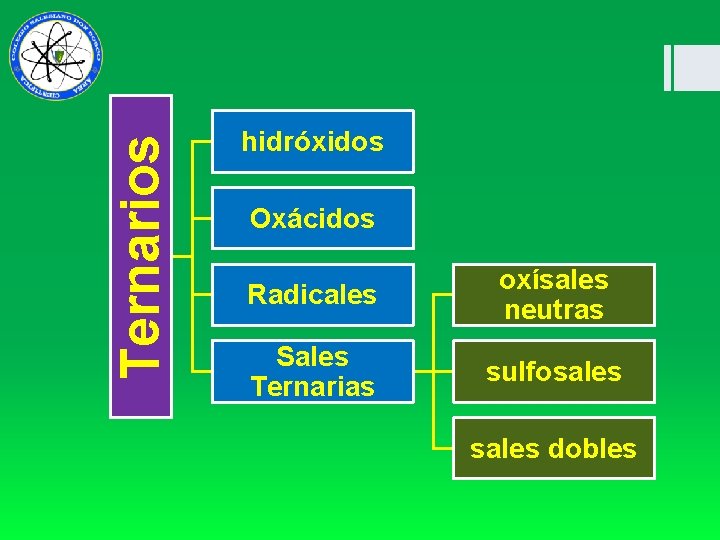
Ternarios hidróxidos Oxácidos Radicales oxísales neutras Sales Ternarias sulfosales dobles

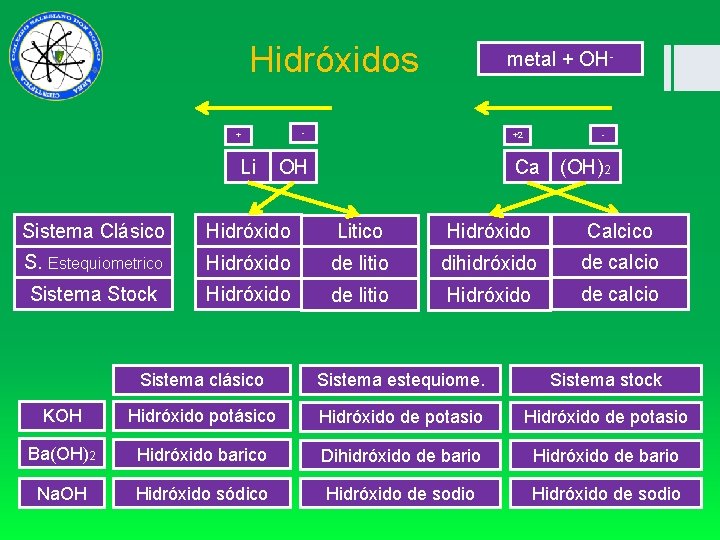
Hidróxidos - + Li metal + OH- - +2 OH Ca (OH)2 Sistema Clásico Hidróxido Litico Hidróxido Calcico S. Estequiometrico Hidróxido de litio dihidróxido de calcio Sistema Stock Hidróxido de litio Hidróxido de calcio Sistema clásico Sistema estequiome. Sistema stock KOH Hidróxido potásico Hidróxido de potasio Ba(OH)2 Hidróxido barico Dihidróxido de bario Hidróxido de bario Na. OH Hidróxido sódico Hidróxido de sodio

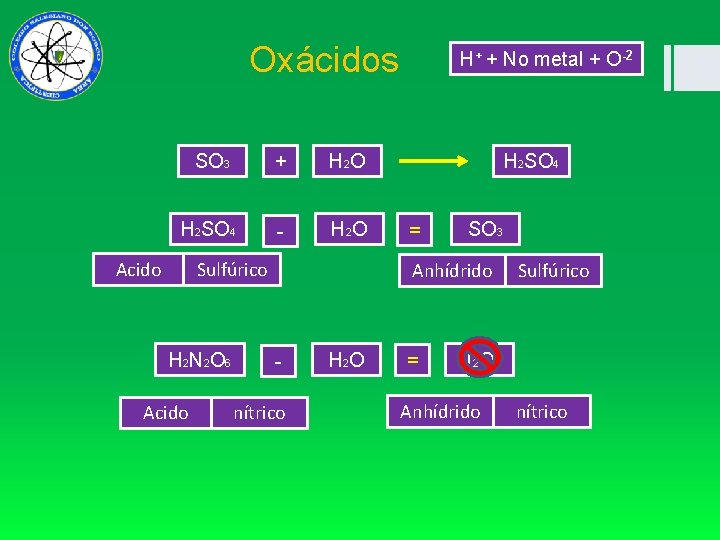
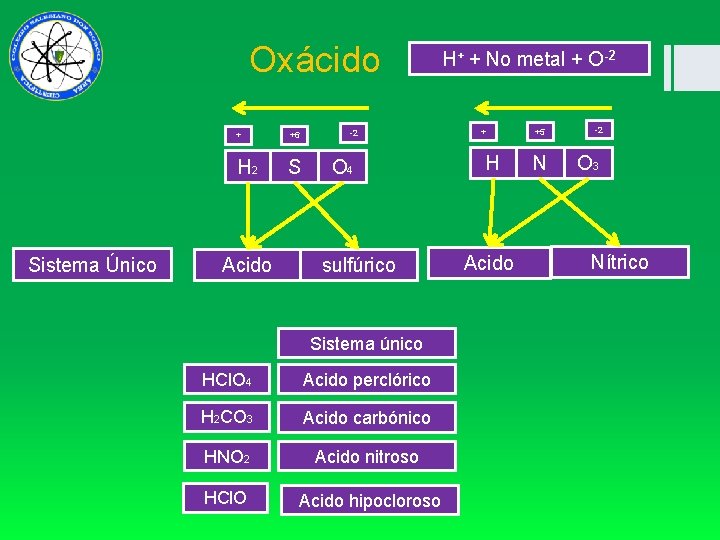
Oxácidos SO 3 + H 2 O H 2 SO 4 - H 2 O Acido Sulfúrico HHNO 2 N 2 O 36 Acido H+ + No metal + O-2 H 2 SO 4 = SO 3 Anhídrido nítrico H 2 O = Sulfúrico N 2 O 5 Anhídrido nítrico

Oxácido Sistema Único + +6 H 2 S Acido -2 O 4 sulfúrico Sistema único HCl. O 4 Acido perclórico H 2 CO 3 Acido carbónico HNO 2 Acido nitroso HCl. O Acido hipocloroso H+ + No metal + O-2 + H Acido +5 N -2 O 3 Nítrico

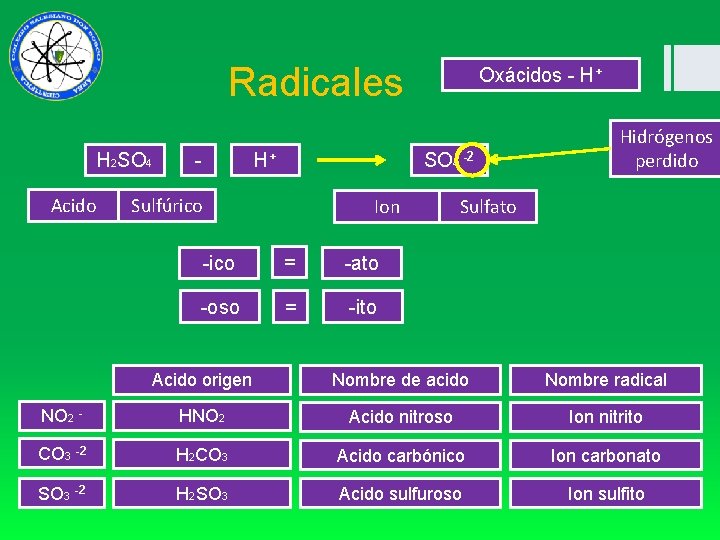
Radicales H 2 SO 4 Acido - H+ Oxácidos - H+ SO 4 -2 Sulfúrico Ion -ico = -ato -oso = -ito Hidrógenos perdido Sulfato Acido origen Nombre de acido Nombre radical NO 2 - HNO 2 Acido nitroso Ion nitrito CO 3 -2 H 2 CO 3 Acido carbónico Ion carbonato SO 3 -2 H 2 SO 3 Acido sulfuroso Ion sulfito

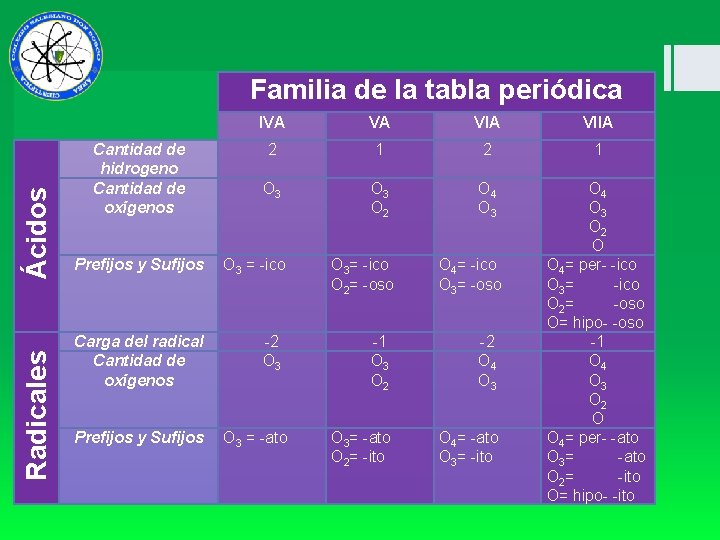
Radicales Ácidos Familia de la tabla periódica Cantidad de hidrogeno Cantidad de oxígenos IVA VA VIIA 2 1 O 3 O 2 O 4 O 3 O 2 O O 4= per- -ico O 3= -ico O 2= -oso O= hipo- -oso -1 O 4 O 3 O 2 O O 4= per- -ato O 3= -ato O 2= -ito O= hipo- -ito Prefijos y Sufijos O 3 = -ico Carga del radical Cantidad de oxígenos -2 O 3 Prefijos y Sufijos O 3 = -ato O 3= -ico O 2= -oso O 4= -ico O 3= -oso -1 O 3 O 2 -2 O 4 O 3= -ato O 2= -ito O 4= -ato O 3= -ito

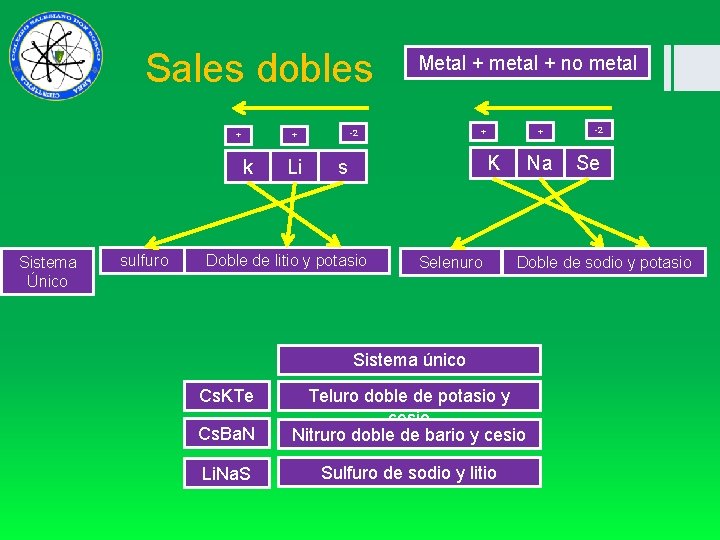
Sales dobles + Sistema Único sulfuro Li + -2 + k Metal + metal + no metal + K s Doble de litio y potasio Selenuro Na Se Doble de sodio y potasio Sistema único Cs. KTe -2 Cs. Ba. N Teluro doble de potasio y cesio Nitruro doble de bario y cesio Li. Na. S Sulfuro doble de sodio y litio Sulfuro de sodio y litio

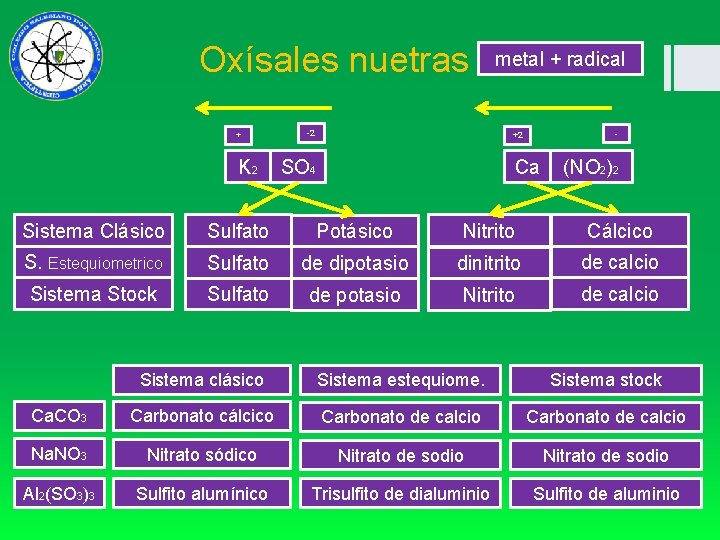
Oxísales nuetras + K 2 -2 metal + radical - +2 SO 4 Ca (NO 2)2 Sistema Clásico Sulfato Potásico Nitrito Cálcico S. Estequiometrico Sulfato de dipotasio dinitrito de calcio Sistema Stock Sulfato de potasio Nitrito de calcio Sistema clásico Sistema estequiome. Sistema stock Ca. CO 3 Carbonato cálcico Carbonato de calcio Na. NO 3 Nitrato sódico Nitrato de sodio Al 2(SO 3)3 Sulfito alumínico Trisulfito de dialuminio Sulfito de aluminio

sulfo, seleni y teluri sales Metal+ C + S o Se o Te O = S Se K 2 Te C Te Se O S 3333 Sistema Clásico sulfocarbonato Carbonato selenicarbonato teluricarbonato Potásico S. Estequiométrico sulfocarbonato Carbonato selenicarbonato teluricarbonato de dipotasio Sistema Stock sulfocarbonato selenicarbonato teluricarbonato Carbonato de potasio

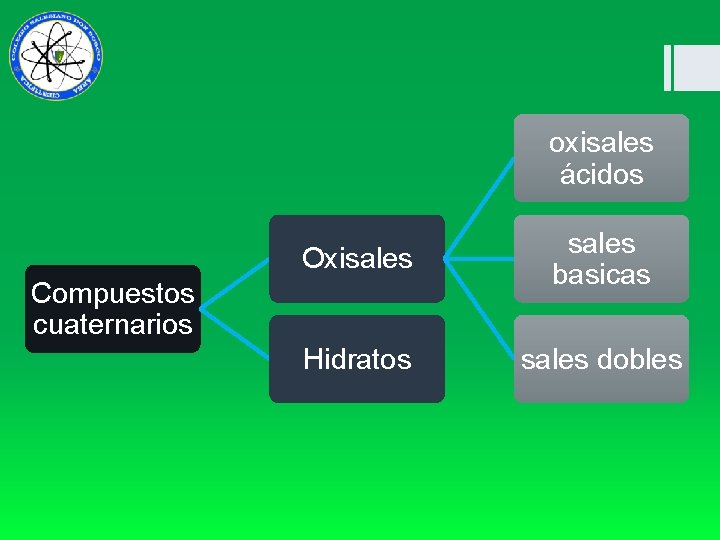
oxisales ácidos Oxisales basicas Hidratos sales dobles Compuestos cuaternarios

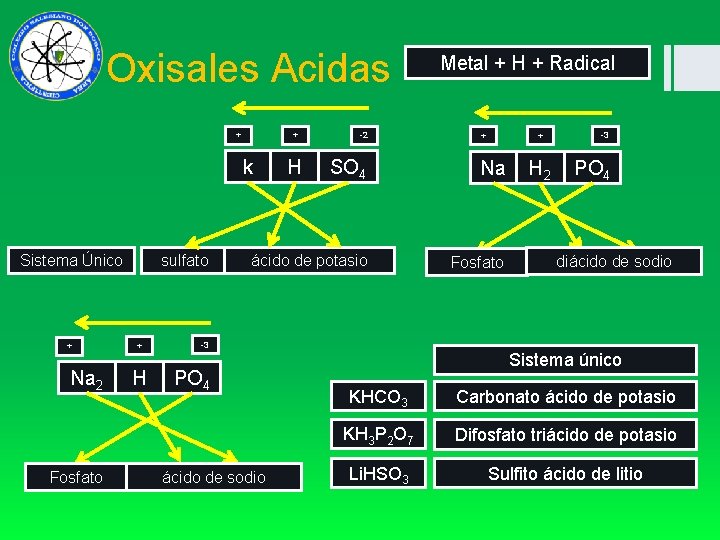
Oxisales Acidas + + k Sistema Único + Na 2 Fosfato sulfato + H H -2 SO 4 ácido de potasio Metal + H + Radical + + Na H 2 Fosfato -3 PO 4 diácido de sodio -3 PO 4 ácido de sodio Sistema único KHCO 3 Carbonato ácido de potasio KH 3 P 2 O 7 Difosfato triácido de potasio Li. HSO 3 Sulfito ácido de litio

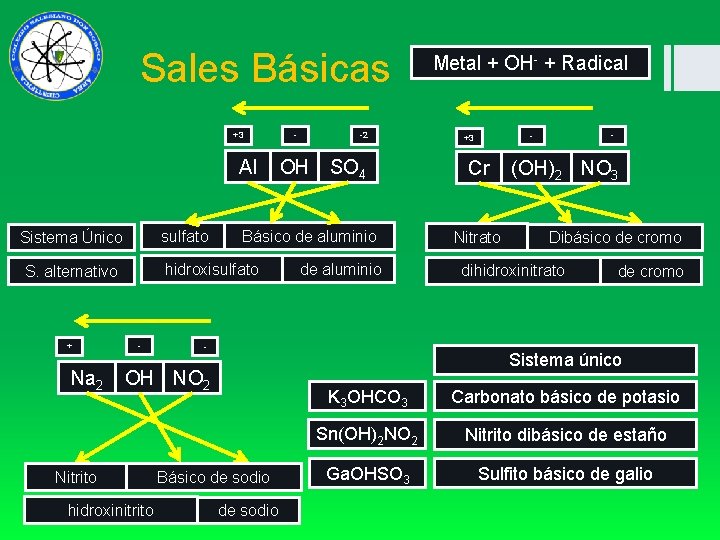
Sales Básicas +3 Al sulfato Sistema Único Na 2 Nitrito - -2 OH SO 4 Básico de aluminio hidroxisulfato S. alternativo + - de aluminio - - - +3 Cr Nitrato (OH)2 NO 3 Dibásico de cromo dihidroxinitrato de cromo Sistema único OH NO 2 Básico de sodio hidroxinitrito Metal + OH- + Radical de sodio K 3 OHCO 3 Carbonato básico de potasio Sn(OH)2 NO 2 Nitrito dibásico de estaño Ga. OHSO 3 Sulfito básico de galio

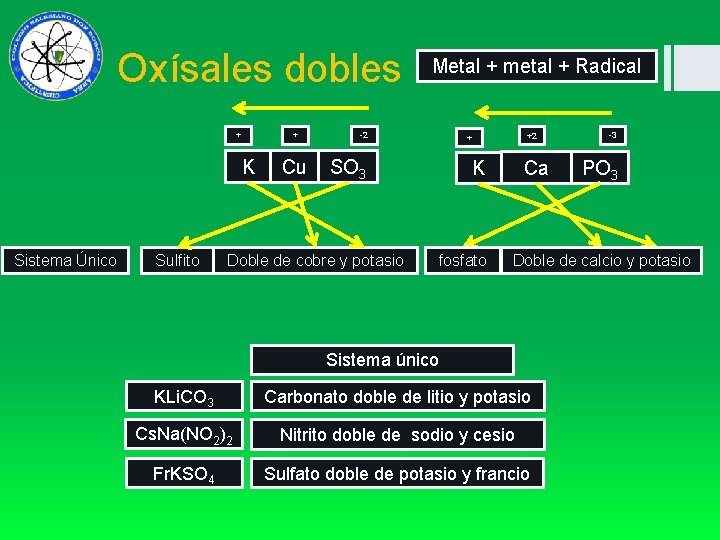
Oxísales dobles + + K Sistema Único Sulfito Cu Metal + metal + Radical -2 SO 3 Doble de cobre y potasio +2 + Ca K fosfato -3 PO 3 Doble de calcio y potasio Sistema único KLi. CO 3 Carbonato doble de litio y potasio Cs. Na(NO 2)2 Nitrito doble de sodio y cesio Fr. KSO 4 Sulfato doble de potasio y francio

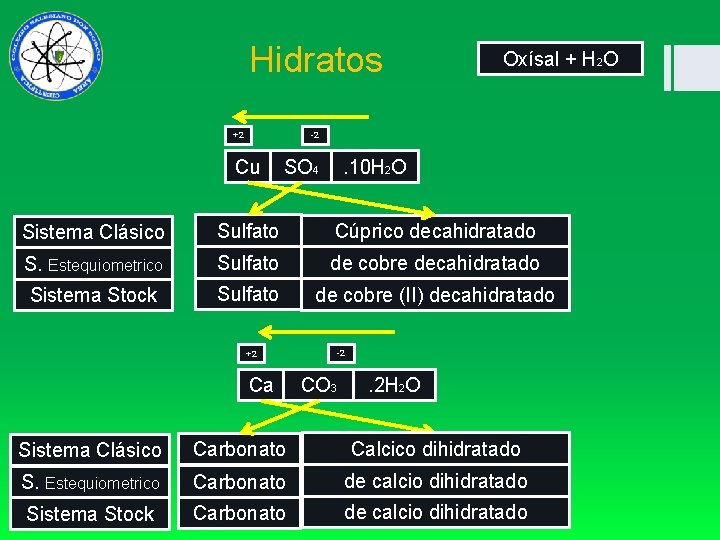
Hidratos +2 Oxísal + H 2 O -2 Cu SO 4 . 10 H 2 O Sistema Clásico Sulfato Cúprico decahidratado S. Estequiometrico Sulfato de cobre decahidratado Sistema Stock Sulfato de cobre (II) decahidratado -2 +2 Ca CO 3 . 2 H 2 O Sistema Clásico Carbonato Calcico dihidratado S. Estequiometrico Carbonato de calcio dihidratado Sistema Stock Carbonato de calcio dihidratado

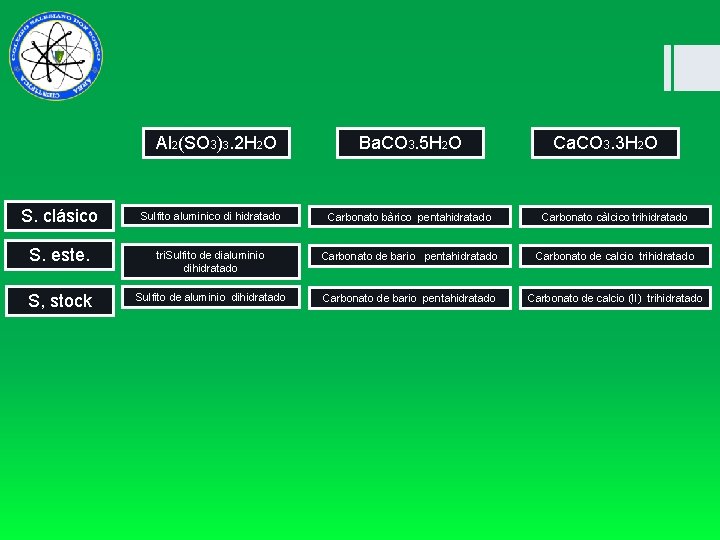
Al 2(SO 3)3. 2 H 2 O Ba. CO 3. 5 H 2 O Ca. CO 3. 3 H 2 O S. clásico Sulfito aluminico di hidratado Carbonato bàrico pentahidratado Carbonato càlcico trihidratado S. este. tri. Sulfito de dialuminio dihidratado Carbonato de bario pentahidratado Carbonato de calcio trihidratado S, stock Sulfito de aluminio dihidratado Carbonato de bario pentahidratado Carbonato de calcio (II) trihidratado


 Santo italiano de 15 años
Santo italiano de 15 años Colegio salesiano
Colegio salesiano Auhg nomenclatura
Auhg nomenclatura Aparato de golgi
Aparato de golgi Colegio san francisco javier
Colegio san francisco javier Oratorio salesiano san juan bosco
Oratorio salesiano san juan bosco Lider salesiano
Lider salesiano Salesiano melo
Salesiano melo Istituto sacro cuore napoli vomero
Istituto sacro cuore napoli vomero Humanismo salesiano
Humanismo salesiano Alonso alvarez de pineda
Alonso alvarez de pineda Glucopetidos
Glucopetidos Dra priscilla monterrey alvarez
Dra priscilla monterrey alvarez Claudia johana rodríguez
Claudia johana rodríguez Alonso alvarez de pineda route
Alonso alvarez de pineda route Rodrigo álvarez zenteno
Rodrigo álvarez zenteno Lissette alvarez cuellar
Lissette alvarez cuellar Jose antonio alvarez trillos
Jose antonio alvarez trillos Dr alejandra alvarez
Dr alejandra alvarez Alonso alvarez de pineda
Alonso alvarez de pineda David álvarez ochoa
David álvarez ochoa Alonso alvarez de pineda route
Alonso alvarez de pineda route Alfonso alvarez marcos
Alfonso alvarez marcos Carlos alvarez icann site: linkedin.com
Carlos alvarez icann site: linkedin.com Geni alvarez
Geni alvarez Alonso alvarez de pineda quotes
Alonso alvarez de pineda quotes Etapas del diseño curricular
Etapas del diseño curricular Angelica alvarez orlando
Angelica alvarez orlando Alejandra alvarez del castillo
Alejandra alvarez del castillo Us v alvarez
Us v alvarez Enrique alvarez rodrich
Enrique alvarez rodrich New clothes julia alvarez
New clothes julia alvarez Age of exploration vocab
Age of exploration vocab Maria teresa alvarez moreno
Maria teresa alvarez moreno Aaron alvarez
Aaron alvarez Hemos aprendido a volar
Hemos aprendido a volar Gabe alvarez stanford
Gabe alvarez stanford Hijos de sergio y estibaliz
Hijos de sergio y estibaliz Antojos by julia alvarez
Antojos by julia alvarez Kendall alvarez
Kendall alvarez Lizbeth alvarez
Lizbeth alvarez Why was alvarez allowed to attend the american school
Why was alvarez allowed to attend the american school Names/nombres discussion questions
Names/nombres discussion questions Entalpia
Entalpia Qumica
Qumica Qumica
Qumica Qumica
Qumica Mistura quimica
Mistura quimica Color 08062002
Color 08062002