EL TOMO UD 1 1 El tomo en











- Slides: 18

EL ÁTOMO UD 1

1. - El átomo en la antigüedad Los filósofos griegos discutieron mucho acerca de la naturaleza de la materia y concluyeron que el mundo era más simple de lo que parecía. Algunas de sus ideas de mayor relevancia fueron: En el siglo V a. C. , Leucipo sostenía que había un sólo tipo de materia y pensaba que si dividíamos la materia en partes cada vez más pequeñas, obtendríamos un trozo que no se podría cortar más. Demócrito llamó a estos trozos átomos ("sin división"). La filosofía atomista de Leucipo y Demócrito podía resumirse en: 1. - Los átomos son eternos, indivisibles, homogéneos e invisibles. 2. - Los átomos se diferencian en su forma y tamaño. 3. - Las propiedades de la materia varían según el agrupamiento de los átomos. Leucipo Demócrito

En el siglo IV a. C. , Empédocles postuló que la materia estaba formada por 4 elementos: tierra, aire, agua y fuego. Aristóteles, posteriormente, postuló que la materia estaba formada por esos 4 elementos pero niega la idea de átomo, hecho que se mantuvo hasta 2000 años después en el pensamiento de la humanidad.

2. - La teoría atómica de Dalton Durante muchos siglos, los alquimistas, precursores de la química moderna, experimentaban con toda clase de sustancias para obtener una sustancia imaginaria, “la piedra filosofal” que transformase cualquier metal en oro y que al beberla en infusión sirviese para rejuvenecer y conseguir la inmortalidad. En 1808, John Dalton, uno de los primeros científicos de la historia, publicó su teoría atómica, que retomaba las antiguas ideas de Leucipo y de Demócrito. Según la teoría de Dalton:

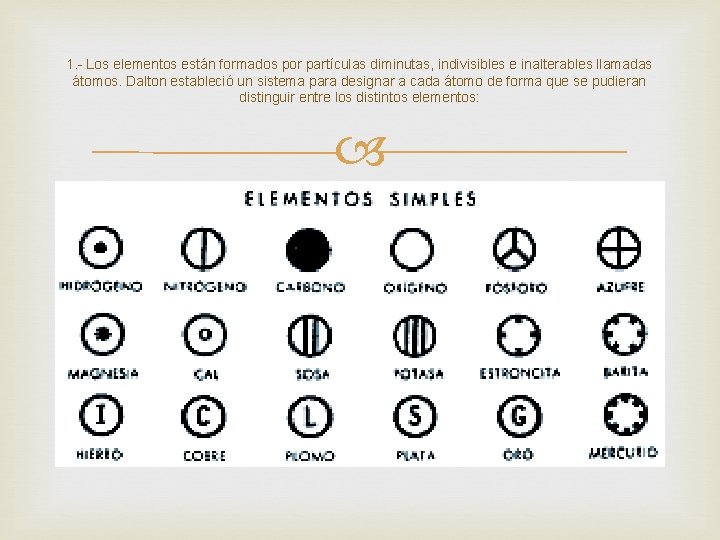
1. - Los elementos están formados por partículas diminutas, indivisibles e inalterables llamadas átomos. Dalton estableció un sistema para designar a cada átomo de forma que se pudieran distinguir entre los distintos elementos:

2. - Los átomos de un mismo elemento son todos iguales entre sí en masa, tamaño y en el resto de las propiedades físicas o químicas. Por el contrario, los átomos de elementos diferentes tienen distinta masa y propiedades.

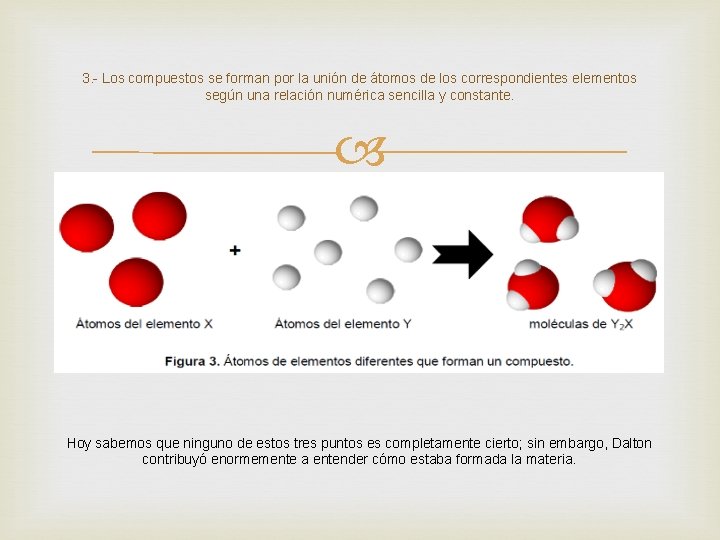
3. - Los compuestos se forman por la unión de átomos de los correspondientes elementos según una relación numérica sencilla y constante. Hoy sabemos que ninguno de estos tres puntos es completamente cierto; sin embargo, Dalton contribuyó enormemente a entender cómo estaba formada la materia.

De la teoría atómica de Dalton se pueden obtener las siguientes definiciones: - Un átomo es la partícula más pequeña de un elemento que conserva sus propiedades. - Un elemento es una sustancia pura que está formada por átomos iguales. - Un compuesto es una sustancia que está formada por átomos distintos combinados en una relación numérica sencilla y constante.

3. - El átomo es divisible Una vez aceptada la teoría atómica de la materia, los fenómenos de electrización y electrólisis pusieron de manifiesto, por un lado, la naturaleza eléctrica de la materia y, por otro, que el átomo era divisible; es decir, que estaba formado por otras partículas fundamentales más pequeñas.

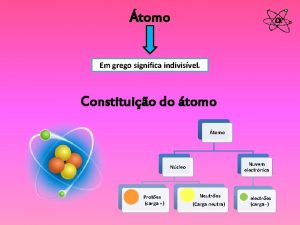
La materia es eléctricamente neutra, es decir, tiene la misma cantidad de cada tipo de carga. cuando adquiere carga, tanto positiva como negativa, es porque tiene más cantidad de un tipo que de otro. A finales del siglo XIX y principios del XX, una serie de experimentos permitieron identificar las partículas responsables de la carga negativa (el electrón) y de la carga positiva (el protón). Estos experimentos proporcionaron los datos siguientes sobre la estructura de la materia: - El átomo contiene partículas materiales subatómicas. - Los electrones tienen carga eléctrica negativa y masa. Cada electrón posee una carga eléctrica elemental. - Los protones tienen carga eléctrica positiva y mayor masa. - Como el átomo es eléctricamente neutro, hay que suponer que el número de cargas eléctricas negativas (electrones) es igual al número de cargas positivas (protones).

4. - Modelos atómicos En Ciencia, un modelo intenta explicar una teoría mediante una comparación. Un modelo será tanto más perfecto cuanto más claramente explique los hechos experimentales. El modelo es válido mientras explica lo que ocurre en los experimentos; en el momento en que falla, hay que modificarlo. Modelo atómico de Thomson Por ser tan pequeña la masa de los electrones, el físico inglés J. J. Thomson supuso, en 1904, que la mayor parte de la masa del átomo correspondía a la carga positiva, que, por tanto, debía ocupar la mayor parte del volumen atómico. Thomson imaginó el átomo como una especie de esfera positiva continua en la que se encuentran incrustados los electrones (como las pasas en un pudin).

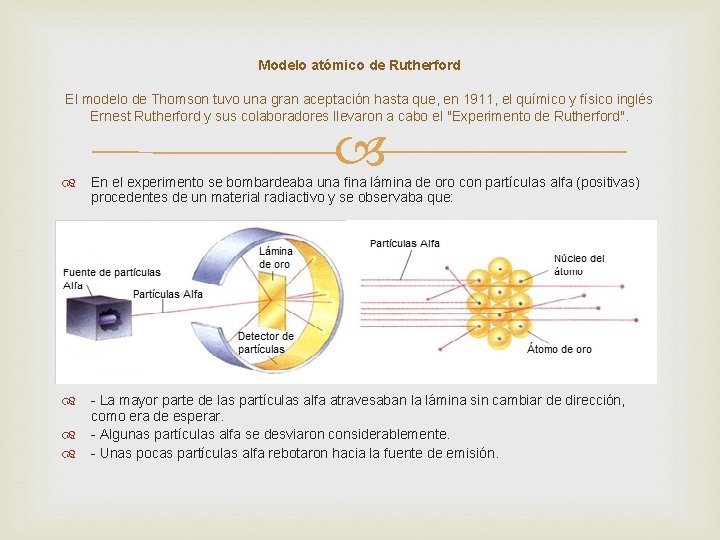
Modelo atómico de Rutherford El modelo de Thomson tuvo una gran aceptación hasta que, en 1911, el químico y físico inglés Ernest Rutherford y sus colaboradores llevaron a cabo el "Experimento de Rutherford". En el experimento se bombardeaba una fina lámina de oro con partículas alfa (positivas) procedentes de un material radiactivo y se observaba que: - La mayor parte de las partículas alfa atravesaban la lámina sin cambiar de dirección, como era de esperar. - Algunas partículas alfa se desviaron considerablemente. - Unas pocas partículas alfa rebotaron hacia la fuente de emisión.

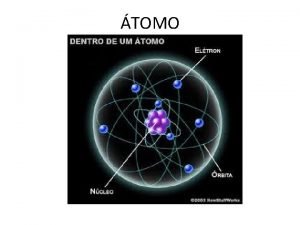
A partir de su experimento, Rutherford estableció las bases de su modelo atómico: - El átomo tiene un núcleo central en el que están concentradas la carga positiva y casi toda la masa. - La carga positiva de los protones del núcleo se encuentra compensada por la carga negativa de los electrones, que están fuera del núcleo. - El núcleo contiene, por tanto, protones en un número igual al de electrones del átomo. - Los electrones giran a mucha velocidad alrededor del núcleo y están separados de éste por una gran distancia. El modelo de Rutherford fue perfeccionado por el físico inglés J. Chadwick, al descubrir en 1932 unas partículas neutras que formaban parte del núcleo. Tenían masa semejante a la del protón, y por carecer de carga eléctrica, las llamó neutrones.

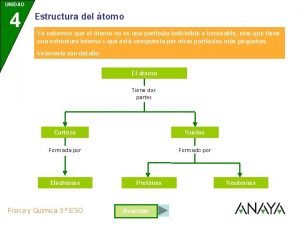
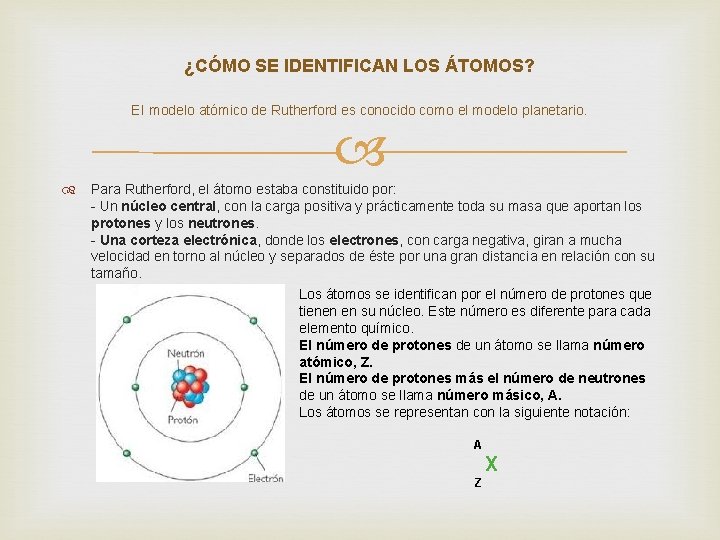
¿CÓMO SE IDENTIFICAN LOS ÁTOMOS? El modelo atómico de Rutherford es conocido como el modelo planetario. Para Rutherford, el átomo estaba constituido por: - Un núcleo central, con la carga positiva y prácticamente toda su masa que aportan los protones y los neutrones. - Una corteza electrónica, donde los electrones, con carga negativa, giran a mucha velocidad en torno al núcleo y separados de éste por una gran distancia en relación con su tamaño. Los átomos se identifican por el número de protones que tienen en su núcleo. Este número es diferente para cada elemento químico. El número de protones de un átomo se llama número atómico, Z. El número de protones más el número de neutrones de un átomo se llama número másico, A. Los átomos se representan con la siguiente notación: A X Z

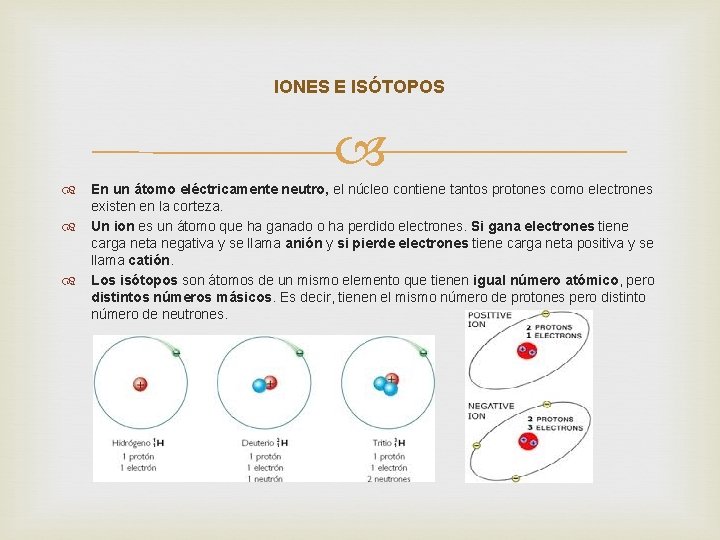
IONES E ISÓTOPOS En un átomo eléctricamente neutro, el núcleo contiene tantos protones como electrones existen en la corteza. Un ion es un átomo que ha ganado o ha perdido electrones. Si gana electrones tiene carga neta negativa y se llama anión y si pierde electrones tiene carga neta positiva y se llama catión. Los isótopos son átomos de un mismo elemento que tienen igual número atómico, pero distintos números másicos. Es decir, tienen el mismo número de protones pero distinto número de neutrones.

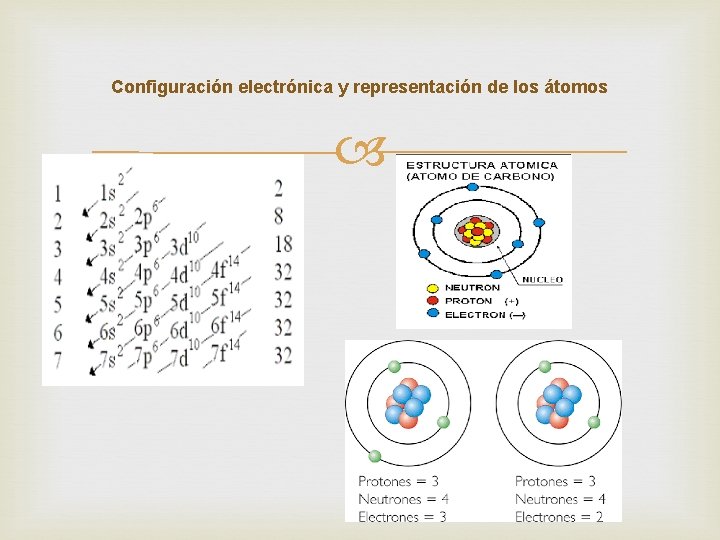
Nuevos hechos, nuevos modelos Hechos demostrados científicamente no podían ser explicados por el modelo de Rutherford. En 1913, Niels Bohr postula un nuevo modelo. Posteriormente, este modelo también sufrió modificaciones. En los nuevos modelos se establece que: - Los electrones se distribuyen alrededor del núcleo en niveles y subniveles de energía. - Cada nivel y subnivel admite un numero máximo de electrones. - La distribución por niveles de los electrones de un átomo de un elemento se conoce como configuración electrónica del elemento. En cada nivel caben 2 n 2 electrones, siendo n el número de nivel, de tal forma que: En n=1 caben 2 electrones. En n=2 caben 8 electrones. En n=3 caben 18 electrones. También en cada nivel existen subniveles, donde se reparten los electrones de cada nivel. Los átomos se dibujan siguiendo el modelo de Bohr, teniendo en cuenta los niveles energéticos.

Configuración electrónica y representación de los átomos

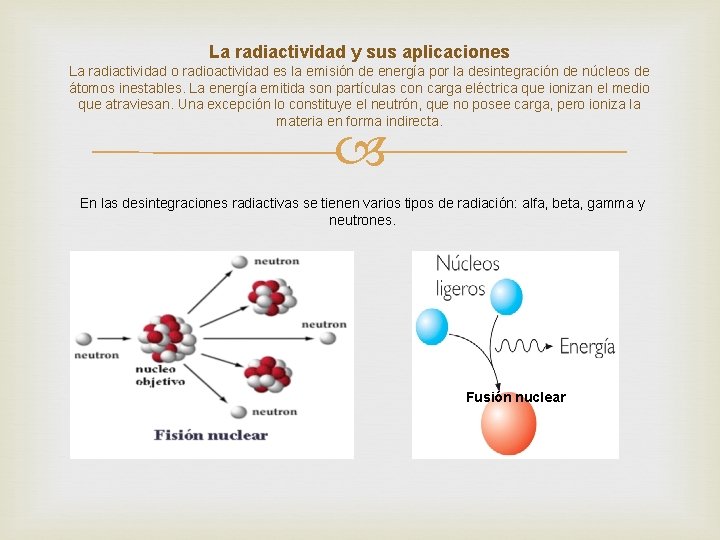
La radiactividad y sus aplicaciones La radiactividad o radioactividad es la emisión de energía por la desintegración de núcleos de átomos inestables. La energía emitida son partículas con carga eléctrica que ionizan el medio que atraviesan. Una excepción lo constituye el neutrón, que no posee carga, pero ioniza la materia en forma indirecta. En las desintegraciones radiactivas se tienen varios tipos de radiación: alfa, beta, gamma y neutrones. Fusión nuclear
 Tomo mano romanas veimare
Tomo mano romanas veimare Ajla tomo
Ajla tomo Tömő utca onkológia
Tömő utca onkológia Estructura del atomo
Estructura del atomo Principi di chimica moderna - tomo a soluzioni
Principi di chimica moderna - tomo a soluzioni Mientras cenaban jesus tomo el pan y pronuncio
Mientras cenaban jesus tomo el pan y pronuncio Leo primero tomo 1 primero basico
Leo primero tomo 1 primero basico Ejemplos de lengua superestandar estandar y subestandar
Ejemplos de lengua superestandar estandar y subestandar Perlawanan sutan syahrir
Perlawanan sutan syahrir Tomo hd
Tomo hd Tomi keber
Tomi keber Tomo cerovšek
Tomo cerovšek Asumo riesgos y tomo la iniciativa
Asumo riesgos y tomo la iniciativa Tomo el jugo en un a. cuchillo b. vaso c. plato
Tomo el jugo en un a. cuchillo b. vaso c. plato Tomo podstenšek
Tomo podstenšek Esde tomo ii
Esde tomo ii Codigo nacional de electricidad
Codigo nacional de electricidad 1 tomo
1 tomo Principi di chimica moderna - tomo a soluzioni
Principi di chimica moderna - tomo a soluzioni