Los gases y la teora cintico molecular Comprender




















- Slides: 30

Los gases y la teoría cinético molecular. Comprender cuales son los factores que determinan el comportamiento de los gases en la naturaleza.

¿Qué es un gas? ¿Donde los encontramos? ¿Tiene color u olor? ¿podemos sentir un gas con el tacto?

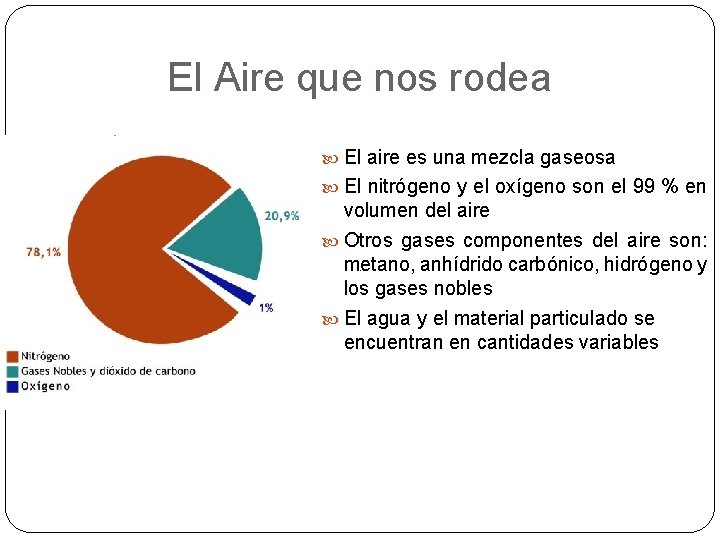
El Aire que nos rodea El aire es una mezcla gaseosa El nitrógeno y el oxígeno son el 99 % en volumen del aire Otros gases componentes del aire son: metano, anhídrido carbónico, hidrógeno y los gases nobles El agua y el material particulado se encuentran en cantidades variables



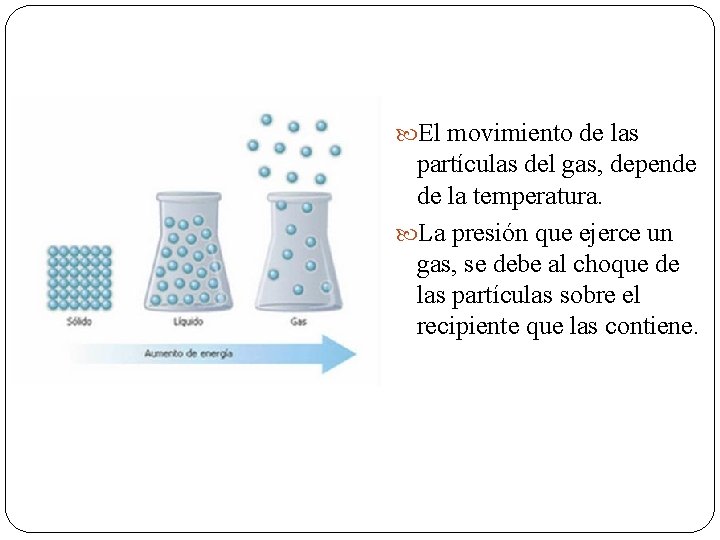
Teoría cinético molecular de los gases y el modelo corpuscular. La teoría cinético molecular intenta explicar el comportamiento de los gases a través del modelo corpuscular. Recordemos que un modelo, es una simplificación de los fenómenos de la naturaleza que facilitan nuestro entendimientos de estos. Que sabemos de los gases: Son materia (moléculas o átomos) Las partículas de gas tienen energía. ¿Cuál energía? La energía hace que las moléculas ocupen la mayor cantidad de espacio posible.

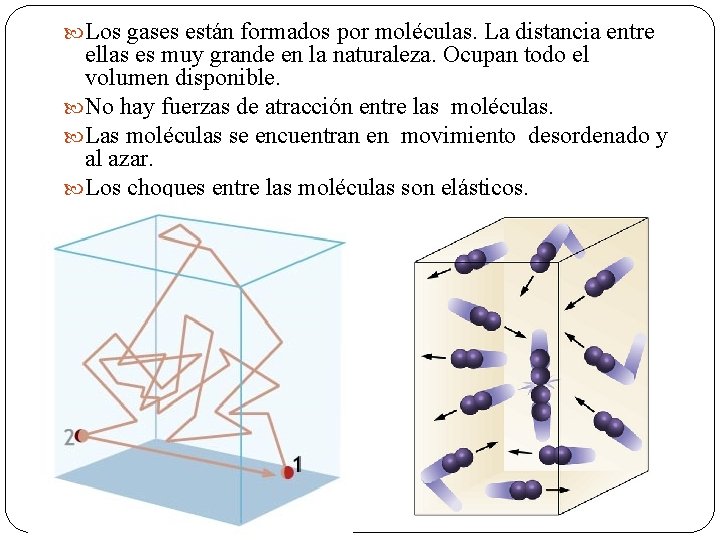
Los gases están formados por moléculas. La distancia entre ellas es muy grande en la naturaleza. Ocupan todo el volumen disponible. No hay fuerzas de atracción entre las moléculas. Las moléculas se encuentran en movimiento desordenado y al azar. Los choques entre las moléculas son elásticos.

El movimiento de las partículas del gas, depende de la temperatura. La presión que ejerce un gas, se debe al choque de las partículas sobre el recipiente que las contiene.

Entonces………. . ¿De que depende el comportamiento de los gases?

La temperatura. El tamaño del recipiente (volumen). Cantidad de gas.

Propiedades de los gases 1. Compresibilidad. 2. Expansibilidad. 3. Difusibilidad. 4. Resistencia.

1. Compresibilidad, disminución del volumen de un gas, puede ser por un aumento de presión o bien disminución de temperatura. Esta propiedad es mucho menor para los sólidos y los líquidos.

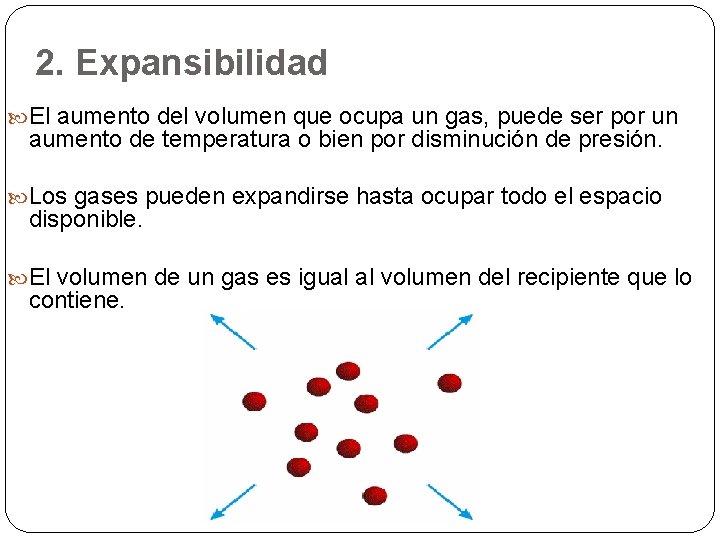
2. Expansibilidad El aumento del volumen que ocupa un gas, puede ser por un aumento de temperatura o bien por disminución de presión. Los gases pueden expandirse hasta ocupar todo el espacio disponible. El volumen de un gas es igual al volumen del recipiente que lo contiene.

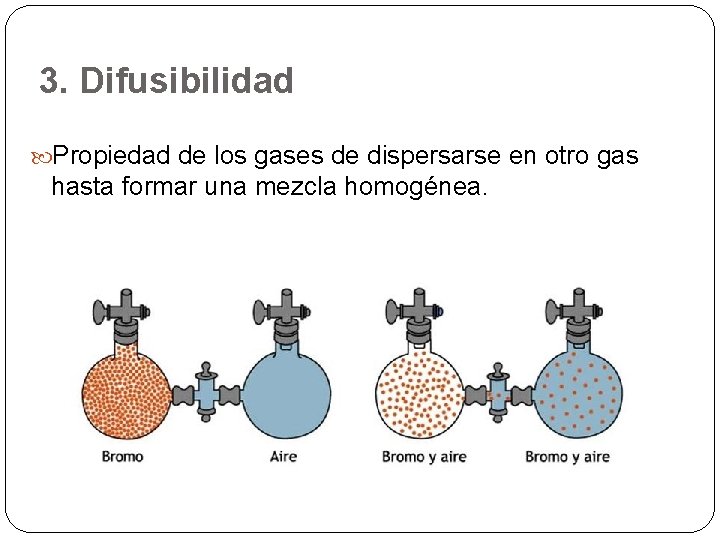
3. Difusibilidad Propiedad de los gases de dispersarse en otro gas hasta formar una mezcla homogénea.

4. Resistencia. Las partículas de gas chocan con los cuerpos en movimiento, lo que genera una fuerza llamada fuerza de roce.

Otras propiedades Densidad de los Gases: La densidad de un objeto se define como la masa del objeto dividido por el volumen.

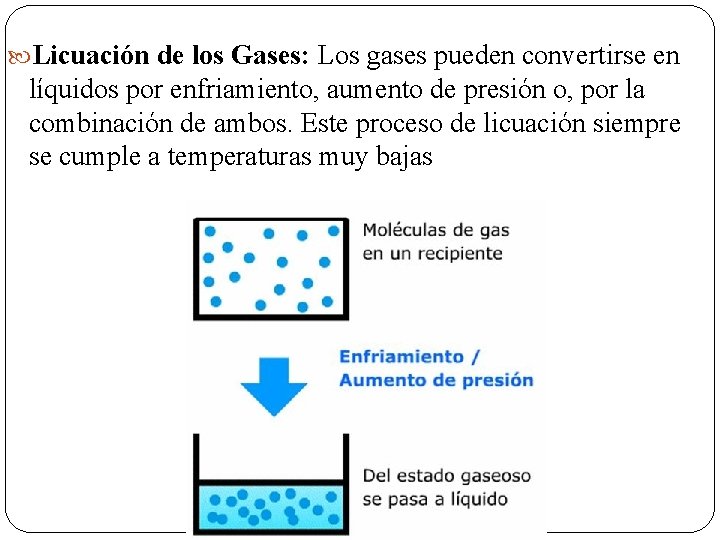
Licuación de los Gases: Los gases pueden convertirse en líquidos por enfriamiento, aumento de presión o, por la combinación de ambos. Este proceso de licuación siempre se cumple a temperaturas muy bajas

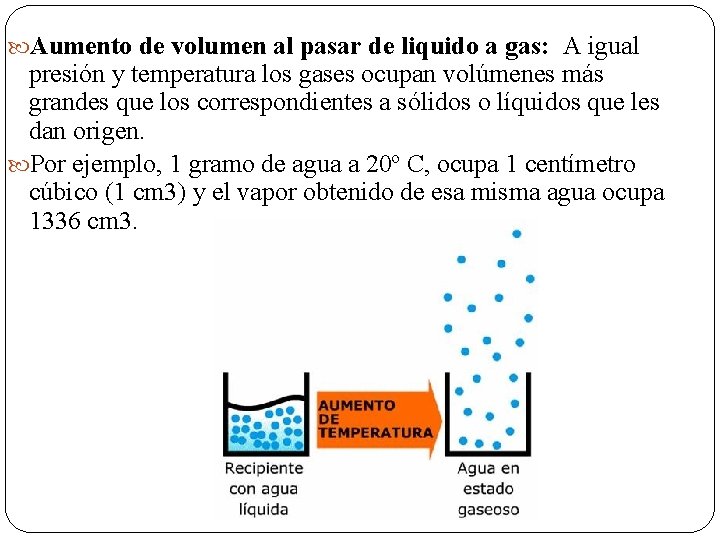
Aumento de volumen al pasar de liquido a gas: A igual presión y temperatura los gases ocupan volúmenes más grandes que los correspondientes a sólidos o líquidos que les dan origen. Por ejemplo, 1 gramo de agua a 20º C, ocupa 1 centímetro cúbico (1 cm 3) y el vapor obtenido de esa misma agua ocupa 1336 cm 3.

Sabias que………… En una olla a presión, se ahorra mas de la mitad de gas (energía que en una olla normal). Además, se demora la mitad de tiempo en prepararse los alimentos. Por ejemplo, los ricos frijoles, se demoran generalmente una hora, pero en la olla a presión, solo 30 minutos!!!!

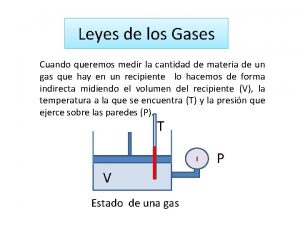
Leyes de los Gases Las cuatro variables que rigen el comportamiento de un gas son: Volumen (V) Temperatura (T) Cantidad de sustancia (n) Presión (P).

Volumen Es el espacio ocupado por la masa gaseosa. Es igual al volumen del recipiente que lo contiene.

Temperatura Esta asociada a la noción de frío o calor, pero son diferencias de energía. La temperatura expresa la energía cinética que presenta un cuerpo. Es decir, el movimiento de las partículas. La temperatura determina el flujo de calor. El calor siempre fluye del cuerpo de mayor temperatura hacia el de menor temperatura.

Presión Se define como fuerza (F) por unidad de superficie o área (A) Fuerza P = Área Checar Unidades de medida de presión (pdf)

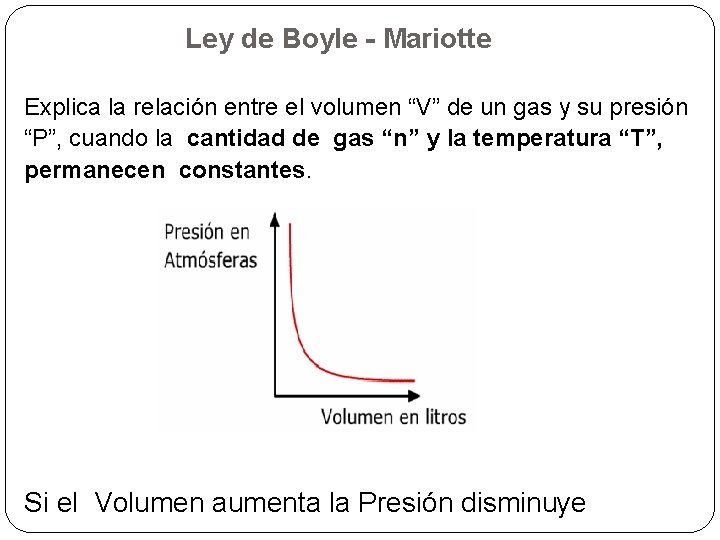
Ley de Boyle - Mariotte Explica la relación entre el volumen “V” de un gas y su presión “P”, cuando la cantidad de gas “n” y la temperatura “T”, permanecen constantes. Si el Volumen aumenta la Presión disminuye

Para una masa fija de gas, a temperatura constante, la presión es inversamente proporcional al volumen.

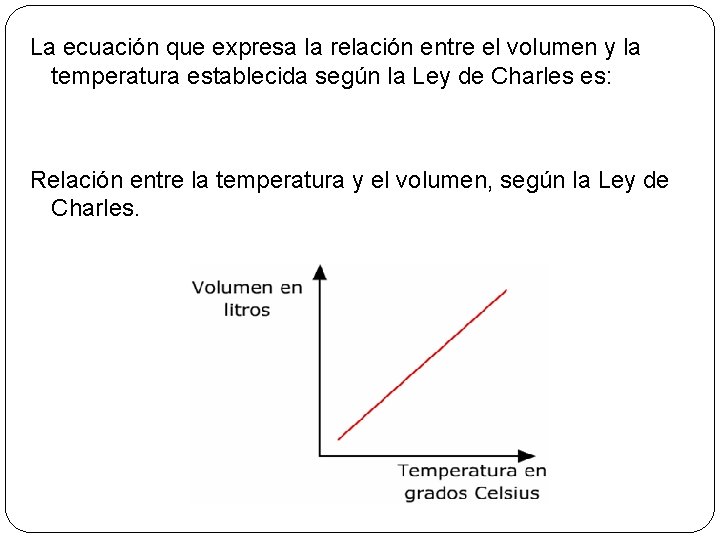
Ley de Charles Explica la relación entre el volumen de un gas y su temperatura (“n” y “P” constante). El volumen de un gas es directamente proporcional a su temperatura, cuando la presión que mantiene es constante. Cuando un recipiente es flexible se mantiene el volumen a presión constante, pero el aumento de temperatura conlleva a un


La ecuación que expresa la relación entre el volumen y la temperatura establecida según la Ley de Charles es: Relación entre la temperatura y el volumen, según la Ley de Charles.

Ley de Gay Lussac A volumen constante, la presión de una masa fija de gas es directamente proporcional a la temperatura absoluta. P aumenta junto con la T (a V y masa constante)

En resumen: Los gases están formados por partículas de forma dinámica, ocupando el máximo de espacio posible. Presentan varias propiedades, tales como la compresibilidad, expansibilidad, difusibilidad y resistencia. En las propiedades de los gases, juega un rol fundamental la temperatura, que le da energía a las moléculas y el volumen, que afecta la presión que ejerce un gas. Existen principalmente 3 leyes que explican el comportamiento de los gases.
 La teora
La teora Cintica
Cintica Modelo cinetico molecular
Modelo cinetico molecular Cintico
Cintico Cintico
Cintico Fisicalab.com
Fisicalab.com Kinetic molecular model of gases
Kinetic molecular model of gases Molecular theory of gases and liquids
Molecular theory of gases and liquids Los factores que afectan el comportamiento de los gases son
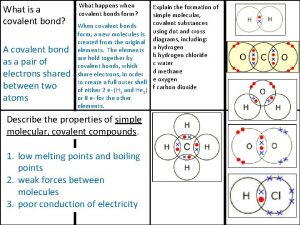
Los factores que afectan el comportamiento de los gases son Covalently bonded substances
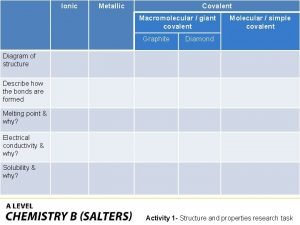
Covalently bonded substances Ionic covalent metallic
Ionic covalent metallic Giant molecular structure vs simple molecular structure
Giant molecular structure vs simple molecular structure Habito procure primero comprender y despues ser comprendido
Habito procure primero comprender y despues ser comprendido Comprender verb chart
Comprender verb chart Comprender present tense
Comprender present tense Los maestros enseñan las clases. in past tense
Los maestros enseñan las clases. in past tense Comprender y transformar la enseñanza
Comprender y transformar la enseñanza Objetivo de los textos instructivos
Objetivo de los textos instructivos Comprender lo que leemos
Comprender lo que leemos Cuatro respuestas autobiográficas
Cuatro respuestas autobiográficas Pretéri
Pretéri Comprender y transformar la enseñanza
Comprender y transformar la enseñanza Hiprbole
Hiprbole Trabajo neto ciclo de carnot
Trabajo neto ciclo de carnot Ley de gay lussac
Ley de gay lussac Es la clave para entender el comportamiento de un gas ideal
Es la clave para entender el comportamiento de un gas ideal Globo aerostatico ley de los gases
Globo aerostatico ley de los gases Constante r de los gases
Constante r de los gases Cuando
Cuando Ley combinada de los gases ideales
Ley combinada de los gases ideales Características de los gases nobles
Características de los gases nobles