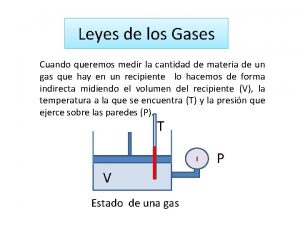
LEYES DE LOS GASES Gas ideal Idealizacin del



![Gráfica de la ley Boyle-Mariotte P [Pa] isoterma V [m 3] Gráfica de la ley Boyle-Mariotte P [Pa] isoterma V [m 3]](https://slidetodoc.com/presentation_image_h/a2a2a2df4c09fbb3400e5eb305bea163/image-4.jpg)

![Gráfica de la ley de Charles P [Pa] isobara V [m 3] Gráfica de la ley de Charles P [Pa] isobara V [m 3]](https://slidetodoc.com/presentation_image_h/a2a2a2df4c09fbb3400e5eb305bea163/image-6.jpg)
![Gráfica de la ley de Gay Lussac isocora P [Pa] V [m 3] Gráfica de la ley de Gay Lussac isocora P [Pa] V [m 3]](https://slidetodoc.com/presentation_image_h/a2a2a2df4c09fbb3400e5eb305bea163/image-8.jpg)

![P [Pa] 1 2 3 V [m 3] P [Pa] 1 2 3 V [m 3]](https://slidetodoc.com/presentation_image_h/a2a2a2df4c09fbb3400e5eb305bea163/image-10.jpg)

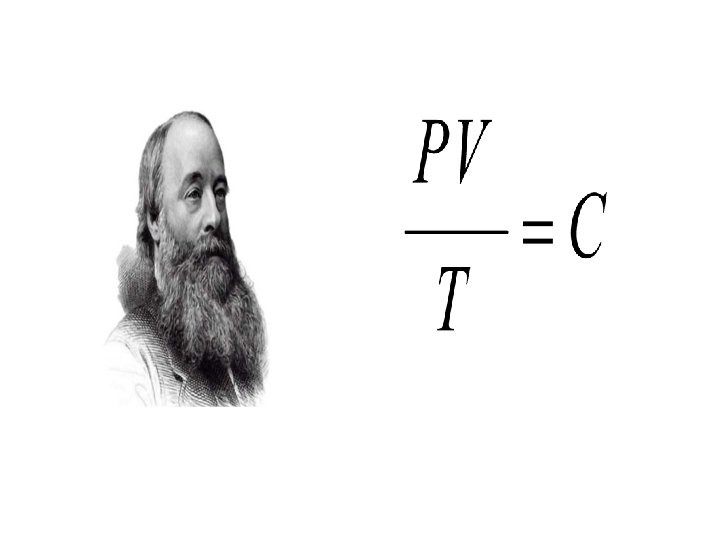




- Slides: 16

LEYES DE LOS GASES

Gas ideal • Idealización del comportamiento de los gases reales aunque en algunas condiciones de presión y temperatura es aceptable. • Un gas ideal es aquel que se comporta de acuerdo a las leyes de Robert Boyle-Mariotte, Jaques Charles, Gay Lussac, Joule y Amadeo Avogadro.

Ley de Boyle- Mariotte 1627 -1691 • Evolución reversible de un sistema termodinámico que transcurre a temperatura constante • Las isotermas de un gas ideal en un diagrama P-V, llamado diagrama de Clapeyron, son hipérbolas equiláteras, cuya ecuación es P • V = C.
![Gráfica de la ley BoyleMariotte P Pa isoterma V m 3 Gráfica de la ley Boyle-Mariotte P [Pa] isoterma V [m 3]](https://slidetodoc.com/presentation_image_h/a2a2a2df4c09fbb3400e5eb305bea163/image-4.jpg)
Gráfica de la ley Boyle-Mariotte P [Pa] isoterma V [m 3]

Ley de Jacques Alexander Charles 1746 -1823
![Gráfica de la ley de Charles P Pa isobara V m 3 Gráfica de la ley de Charles P [Pa] isobara V [m 3]](https://slidetodoc.com/presentation_image_h/a2a2a2df4c09fbb3400e5eb305bea163/image-6.jpg)
Gráfica de la ley de Charles P [Pa] isobara V [m 3]

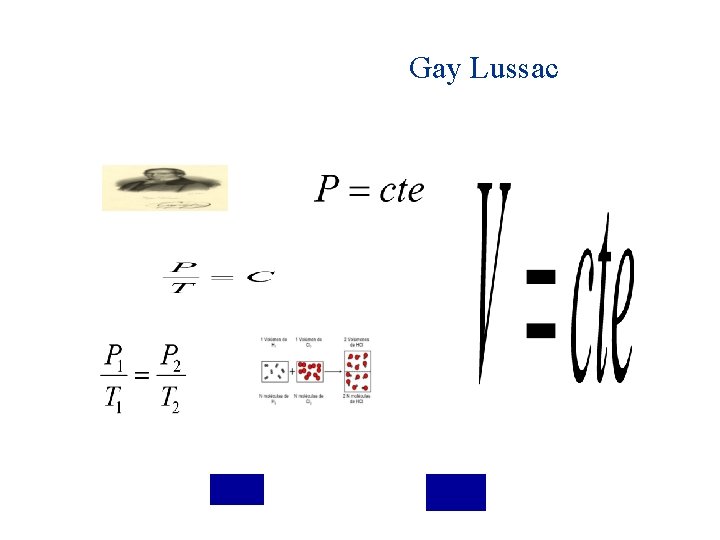
Ley de Louis Joseph Gay Lussac 1778 -1850
![Gráfica de la ley de Gay Lussac isocora P Pa V m 3 Gráfica de la ley de Gay Lussac isocora P [Pa] V [m 3]](https://slidetodoc.com/presentation_image_h/a2a2a2df4c09fbb3400e5eb305bea163/image-8.jpg)
Gráfica de la ley de Gay Lussac isocora P [Pa] V [m 3]

Ley de Amadeo Avogadro 1776 -1856 • Gases ideales a igual temperatura y presión ocuparán volúmenes iguales y tendrán igual número de moléculas. • NA= 6. 022 x 1023 = número de moléculas
![P Pa 1 2 3 V m 3 P [Pa] 1 2 3 V [m 3]](https://slidetodoc.com/presentation_image_h/a2a2a2df4c09fbb3400e5eb305bea163/image-10.jpg)
P [Pa] 1 2 3 V [m 3]

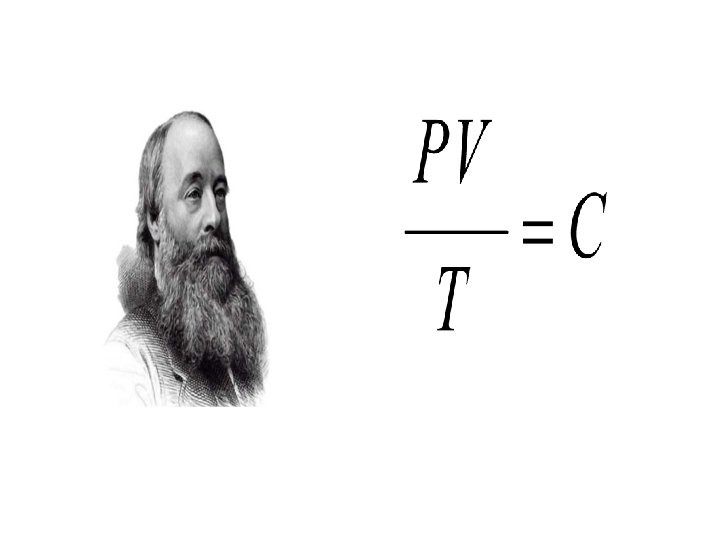

Ley del gas ideal Ř = constante universal de los gases Ř= 8. 3145 J / K mol Ř=0. 08205 Latm/Kmol

Ley de James Prescott Joule 1818 -1889 • La energía interna de los gases depende exclusivamente de la temperatura absoluta.

Ejemplo 1 2 kg de un gas efectúan un proceso partiendo de un estado inicial en el que la presión es 1 bar, el volumen 0. 2 m 3 y la temperatura 300 K; hasta su estado final en el que la presión es 4 bar y el volumen 0. 15 m 3. Encuentra Tfinal y R del gas.

Ejemplo 2 Un tanque contiene 138 g de oxígeno gaseoso (O 2) a 6 bar manométricos y 298 K, tiene una válvula de seguridad que abre cuando la presión alcanza los 10 bar man. a) ¿Cuál es el volumen del tanque? b) ¿A qué temperatura llegará el oxígeno cuando abra la válvula? Patm=1. 01 bar y Ru=8. 3145 J/Kmol
 Ley de charles
Ley de charles Formula de gases ideales
Formula de gases ideales P * v
P * v Postulados de la teoría cinética de los gases
Postulados de la teoría cinética de los gases Gases ideales
Gases ideales Derive ideal gas equation
Derive ideal gas equation An ideal gas is an imaginary gas
An ideal gas is an imaginary gas Gas law
Gas law Ideal gas vs perfect gas
Ideal gas vs perfect gas Difference between ideal gas and real gas
Difference between ideal gas and real gas Variables que condicionan el comportamiento de un gas
Variables que condicionan el comportamiento de un gas Kinetic molecular theory
Kinetic molecular theory Characteristics of ideal gases
Characteristics of ideal gases Ideal gases characteristics
Ideal gases characteristics Are ideal gases compressible
Are ideal gases compressible Thermodynamics of ideal gases
Thermodynamics of ideal gases Levitico
Levitico