Leyes y Propiedades de los Gases Propiedades de















- Slides: 28

Leyes y Propiedades de los Gases

Propiedades de los Gases Los Gases están formados por partículas. Difunden. Expanden. Tienen Volumen y Masa.

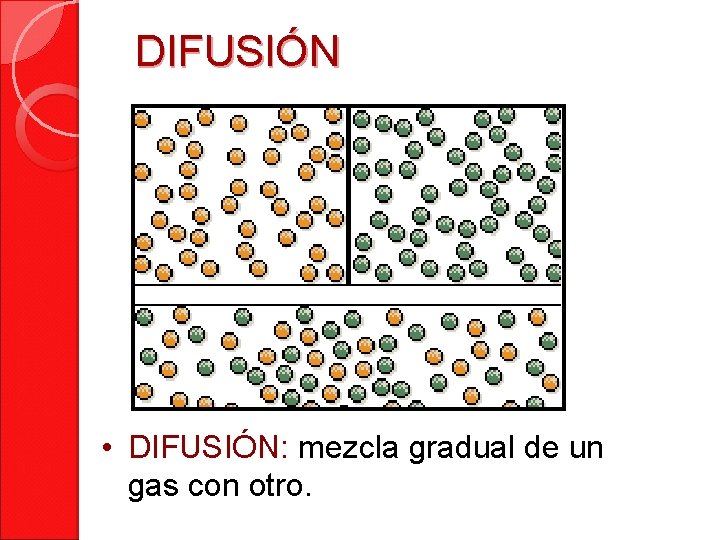
DIFUSIÓN • DIFUSIÓN: mezcla gradual de un gas con otro.

Otras propiedades. . . COMPRESIÓN: capacidad de una misma cantidad de sustancia para ocupar un espacio menor.

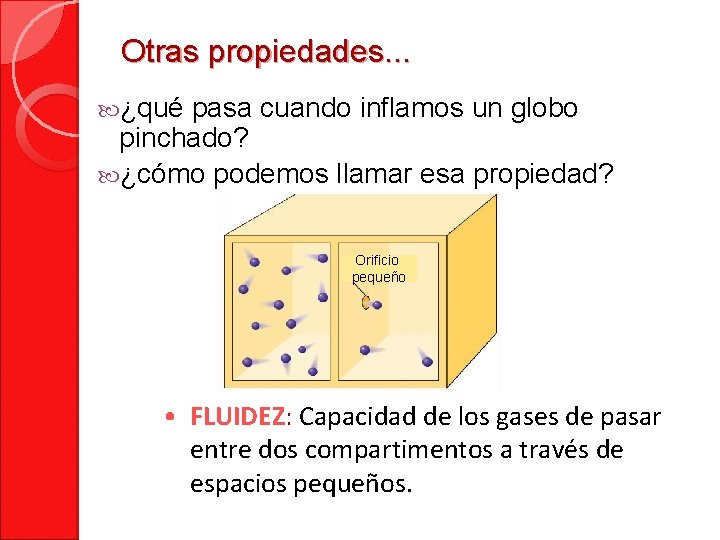
Otras propiedades. . . ¿qué pasa cuando inflamos un globo pinchado? ¿cómo podemos llamar esa propiedad? Orificio pequeño • FLUIDEZ: Capacidad de los gases de pasar entre dos compartimentos a través de espacios pequeños.

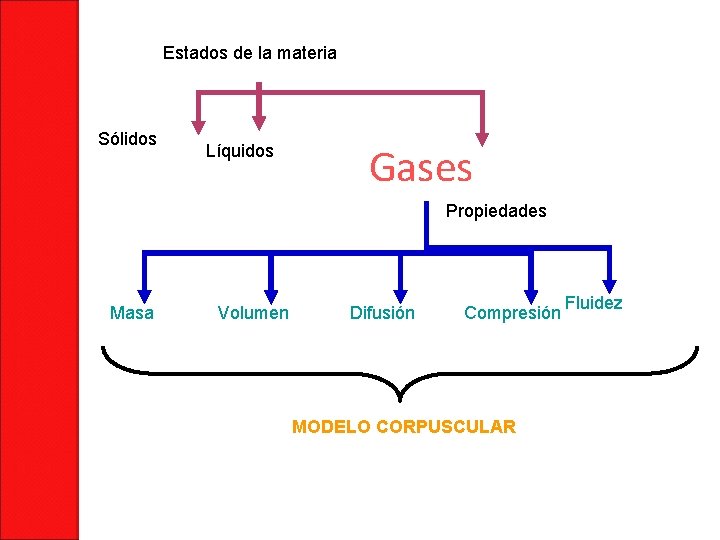
Estados de la materia Sólidos Líquidos Gases Propiedades Masa Volumen Difusión Compresión MODELO CORPUSCULAR Fluidez

Modelo Corpuscular y Teoría Cinética de los Gases

MODELO CORPUSCULAR. . . MODELO CORPUSCULAR: la materia es un conglomerado de partículas o moléculas, que se pueden encontrar en uno de estos tres estados Además, estas partículas están en un movimiento constante a lo que llamaremos Teoría Cinética.

Postulados de la Teoría Cinética de los Gases 1. Las moléculas están en rápido y continuo movimiento errático. 2. Los gases se componen de moléculas y la distancia promedio entre ellas es muy grande en comparación al volumen real que ocupan.

Postulados de la Teoría Cinética de los Gases No existen fuerzas de atracción o repulsión entre las moléculas que forman un gas. 4. Los choques entre las moléculas son perfectamente elásticos. 3.

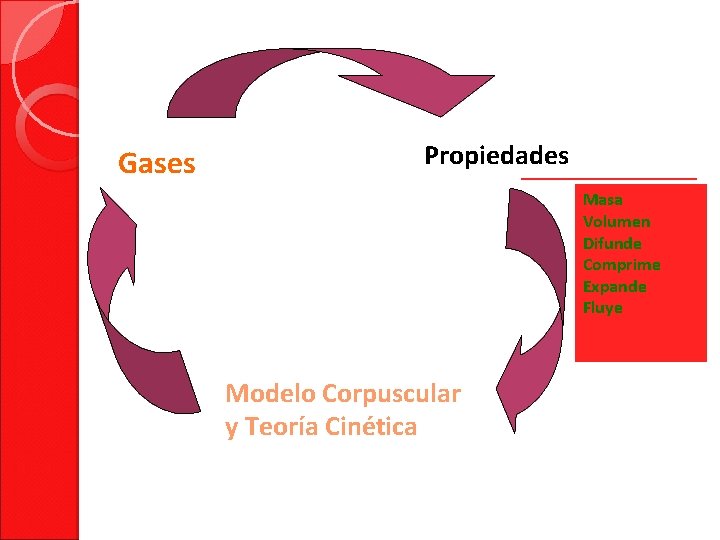
Gases Propiedades Masa Volumen Difunde Comprime Expande Fluye Modelo Corpuscular y Teoría Cinética

Temperatura y Presión de un Gas

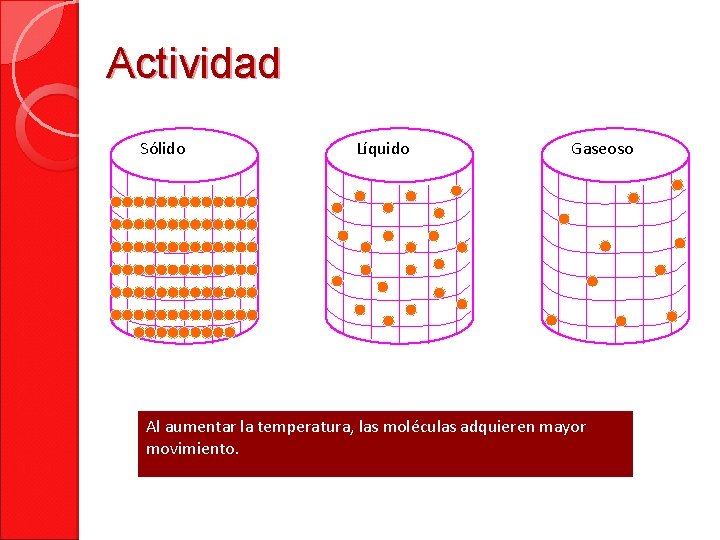
Actividad Sólido Líquido Gaseoso Al aumentar la temperatura, las moléculas adquieren mayor movimiento.

Temperatura La temperatura es la propiedad de un cuerpo de tener mas o menos calor. El calor es una forma de energía, que al afectar a las moléculas de una sustancia promueve el movimiento acelerado de las moléculas que la forman. La temperatura puede ser medida a través de distintas escalas como: Kelvin, Celsius o Fahrenheit

Presión

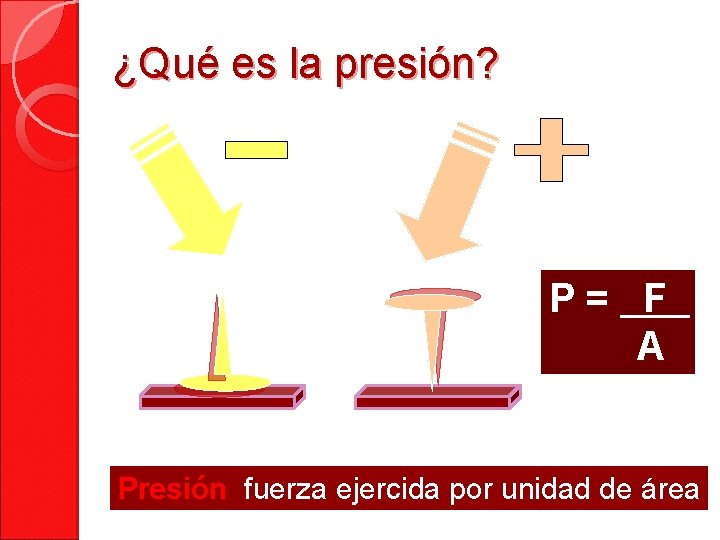
¿Qué es la presión? P= F A Presión fuerza ejercida por unidad de área

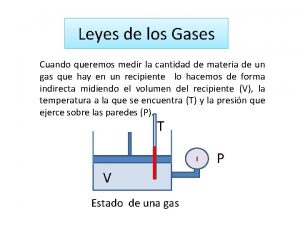
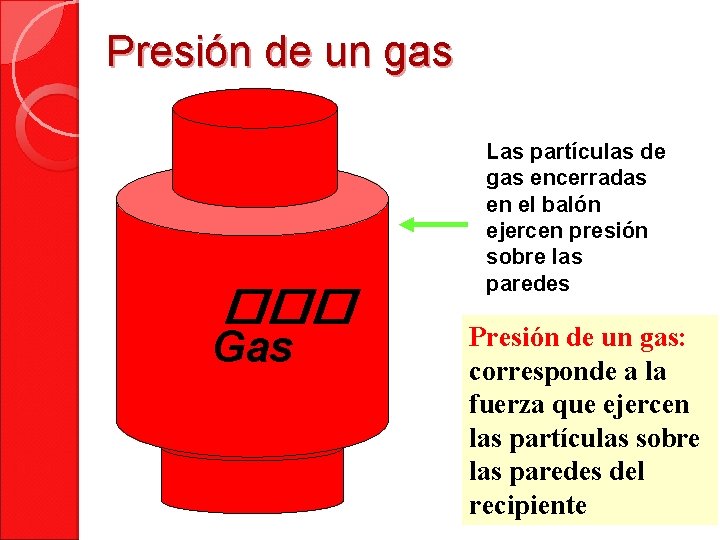
Presión de un gas ��� Gas Las partículas de gas encerradas en el balón ejercen presión sobre las paredes Presión de un gas: corresponde a la fuerza que ejercen las partículas sobre las paredes del recipiente

¿Que otros ejemplos conocen de gases que ejercen presión en el recipiente que las contiene?

LEYES DE LOS GASES Existen leyes que explican el comportamiento de los Gases, estas son: Ley de Avogadro Ley de Boyle Ley de Gay - Lussac Ley de Charles

Ley de Avogadro Ley de Boyle • El volumen es directamente proporcional a la cantidad de moléculas del gas: • • Si aumentamos la cantidad de gas, aumentará el volumen. • Si disminuimos la cantidad de gas, el volumen disminuye. • El volumen es inversamente proporcional a la presión, solo a temperatura constante: • • Si la presión aumenta, el volumen disminuye. • Si la presión disminuye, el volumen aumenta.

Ley de Charles • El volumen es directamente proporcional a la temperatura del gas: • • Si la temperatura aumenta, el volumen del gas aumenta. • Si la temperatura del gas disminuye, el volumen disminuye. Ley de Gay-Lussac • La presión del gas es directamente proporcional a su temperatura: • • Si aumentamos la temperatura, aumentará la presión. • Si disminuimos la temperatura, disminuirá la presión.

Enlaces químicos

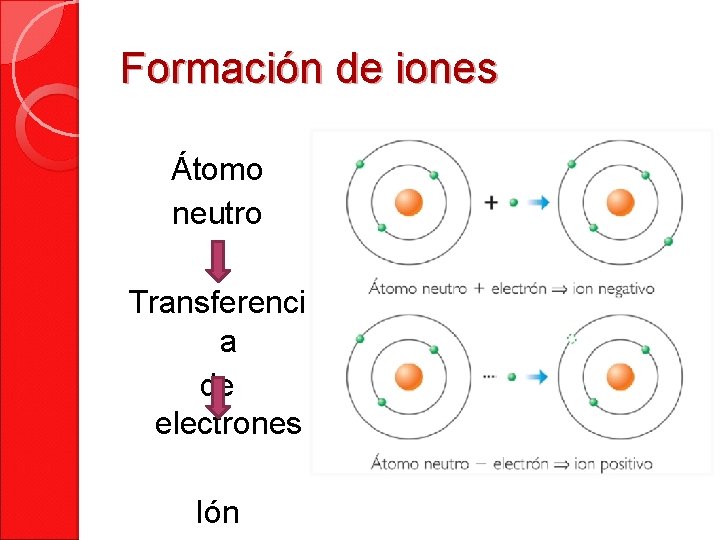
Formación de iones Átomo neutro Transferenci a de electrones Ión

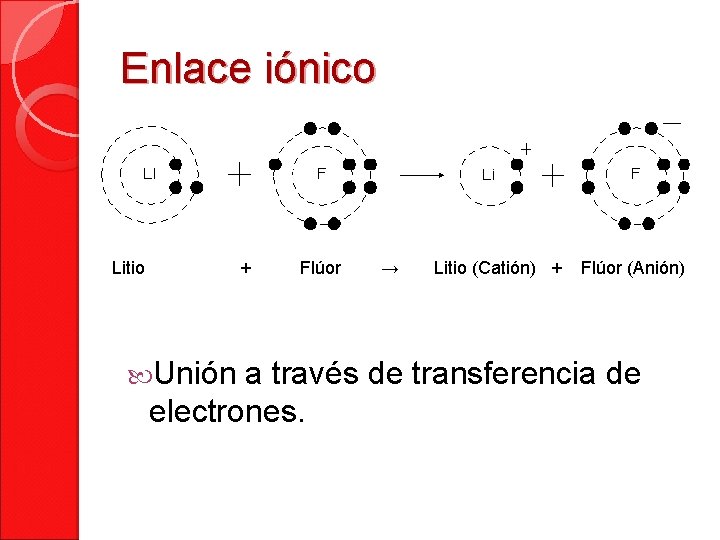
Enlace iónico Litio + Unión Flúor → Litio (Catión) + Flúor (Anión) a través de transferencia de electrones.

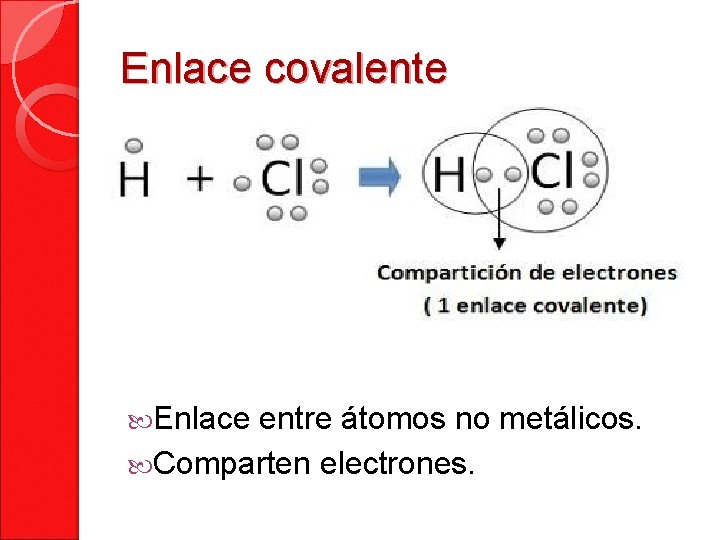
Enlace covalente Enlace entre átomos no metálicos. Comparten electrones.

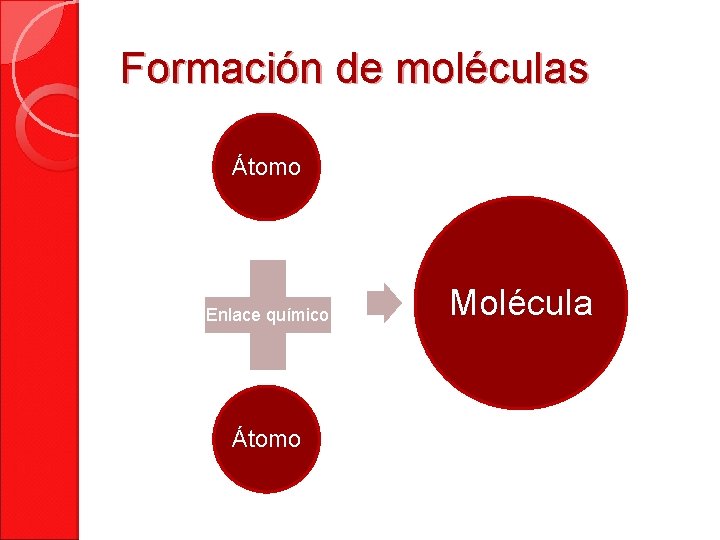
Formación de moléculas Átomo Enlace químico Átomo Molécula

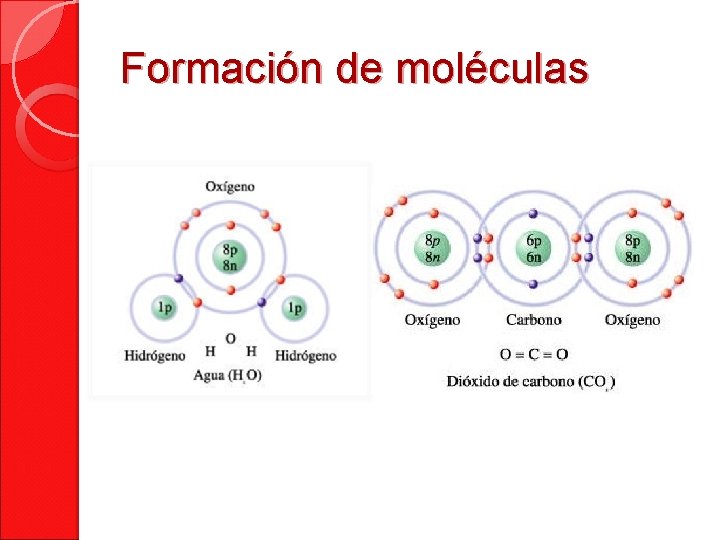
Formación de moléculas

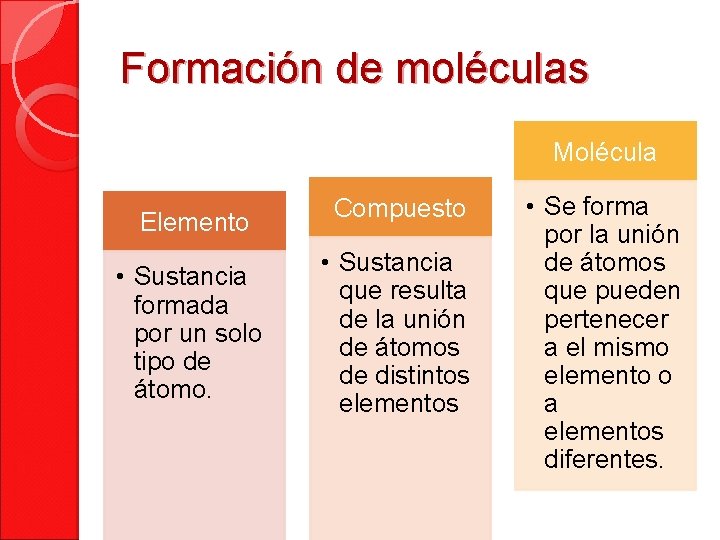
Formación de moléculas Molécula Elemento • Sustancia formada por un solo tipo de átomo. Compuesto • Sustancia que resulta de la unión de átomos de distintos elementos • Se forma por la unión de átomos que pueden pertenecer a el mismo elemento o a elementos diferentes.
 Cuando
Cuando Formula de gases ideales
Formula de gases ideales P * v = n * r * t
P * v = n * r * t Postulados de la teoría cinética de los gases
Postulados de la teoría cinética de los gases Ley de gas ideal
Ley de gas ideal Ley de los logaritmos y propiedades exponenciales
Ley de los logaritmos y propiedades exponenciales Cuales son las propiedades de los gases
Cuales son las propiedades de los gases Ley combinada de los gases
Ley combinada de los gases Los factores que afectan el comportamiento de un gas son
Los factores que afectan el comportamiento de un gas son Levitico 27:30-32
Levitico 27:30-32 Leyes de los logaritmos
Leyes de los logaritmos Ecuaciones exponenciales y logarítmicas
Ecuaciones exponenciales y logarítmicas Politica de los muiscas
Politica de los muiscas Ejemplos
Ejemplos Leyes de potencia ejemplos
Leyes de potencia ejemplos Leyes de los sacrificios
Leyes de los sacrificios Cambio de base logaritmo
Cambio de base logaritmo Propiedades en la multiplicacion
Propiedades en la multiplicacion Que es una ecuacion exponencial
Que es una ecuacion exponencial Trabajo neto ciclo de carnot
Trabajo neto ciclo de carnot Globo aerostatico ley de los gases
Globo aerostatico ley de los gases Constante r de los gases
Constante r de los gases Ley combinada de los gases formula
Ley combinada de los gases formula Características de los gases nobles
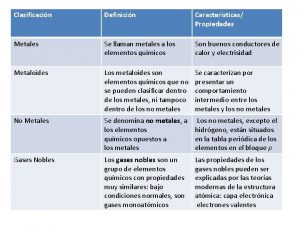
Características de los gases nobles Los gases nobles se caracterizan por
Los gases nobles se caracterizan por Pgas=patm+ph
Pgas=patm+ph Cuales son los gases nobles
Cuales son los gases nobles Características de los no metales
Características de los no metales Propiedades del xenón
Propiedades del xenón