Leyes de los Gases Cuando queremos medir la



- Slides: 14

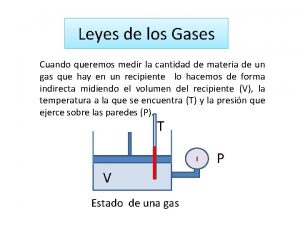
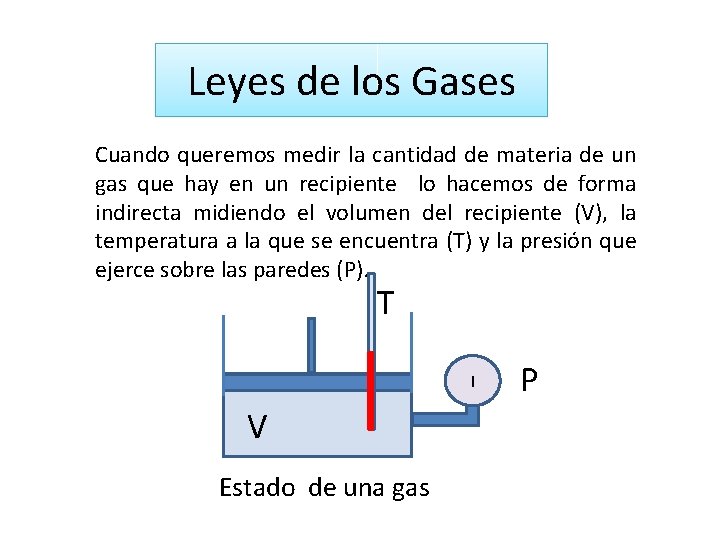
Leyes de los Gases Cuando queremos medir la cantidad de materia de un gas que hay en un recipiente lo hacemos de forma indirecta midiendo el volumen del recipiente (V), la temperatura a la que se encuentra (T) y la presión que ejerce sobre las paredes (P). T I V Estado de una gas P

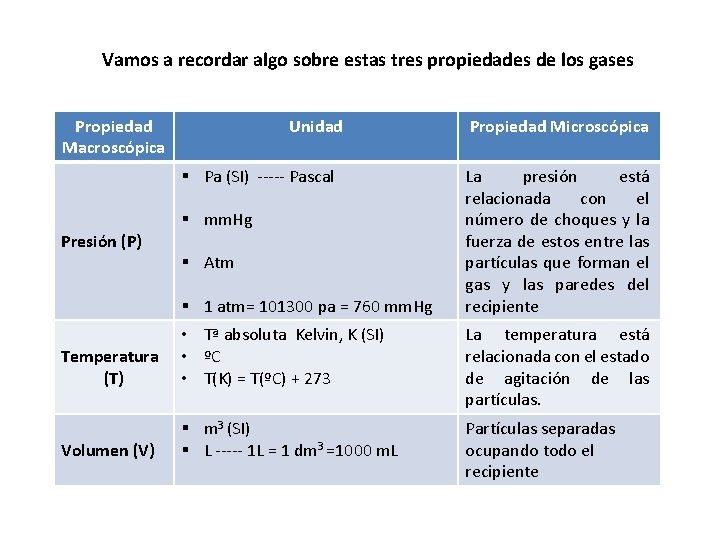
Vamos a recordar algo sobre estas tres propiedades de los gases Propiedad Macroscópica Unidad § Pa (SI) ----- Pascal Presión (P) § mm. Hg § Atm § 1 atm= 101300 pa = 760 mm. Hg Propiedad Microscópica La presión está relacionada con el número de choques y la fuerza de estos entre las partículas que forman el gas y las paredes del recipiente Temperatura (T) • Tª absoluta Kelvin, K (SI) • ºC • T(K) = T(ºC) + 273 La temperatura está relacionada con el estado de agitación de las partículas. Volumen (V) § m 3 (SI) § L ----- 1 L = 1 dm 3 =1000 m. L Partículas separadas ocupando todo el recipiente

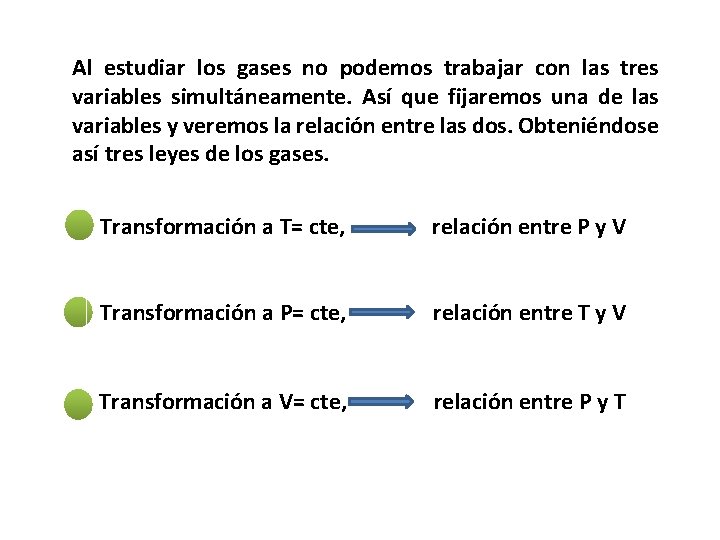
Al estudiar los gases no podemos trabajar con las tres variables simultáneamente. Así que fijaremos una de las variables y veremos la relación entre las dos. Obteniéndose así tres leyes de los gases. Transformación a T= cte, relación entre P y V Transformación a P= cte, relación entre T y V Transformación a V= cte, relación entre P y T

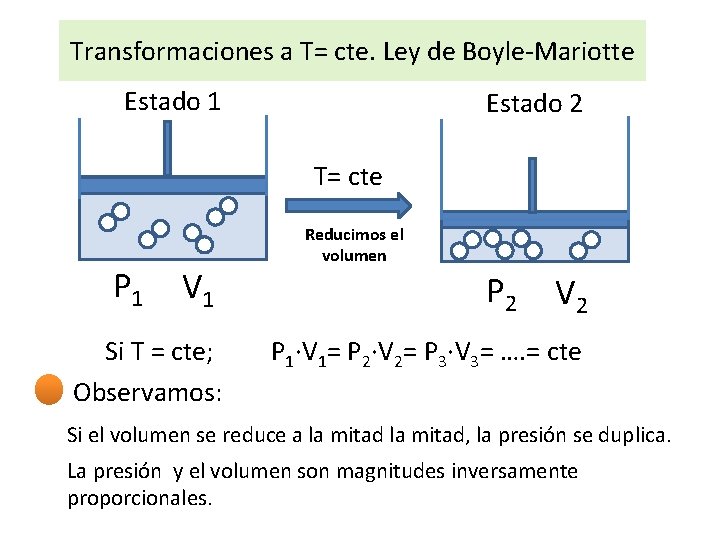
Transformaciones a T= cte. Ley de Boyle-Mariotte Estado 1 Estado 2 T= cte P 1 V 1 Si T = cte; Observamos: Reducimos el volumen P 2 V 2 P 1·V 1= P 2·V 2= P 3·V 3= …. = cte Si el volumen se reduce a la mitad, la presión se duplica. La presión y el volumen son magnitudes inversamente proporcionales.

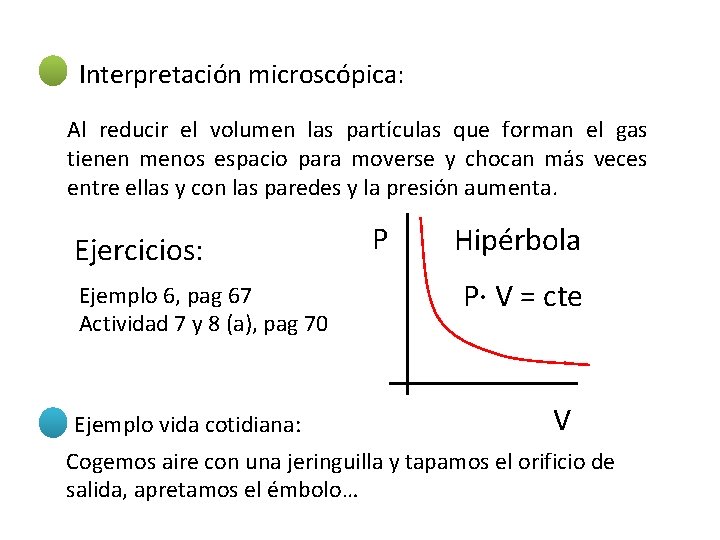
Interpretación microscópica: Al reducir el volumen las partículas que forman el gas tienen menos espacio para moverse y chocan más veces entre ellas y con las paredes y la presión aumenta. Ejercicios: Ejemplo 6, pag 67 Actividad 7 y 8 (a), pag 70 Ejemplo vida cotidiana: P Hipérbola P· V = cte V Cogemos aire con una jeringuilla y tapamos el orificio de salida, apretamos el émbolo…

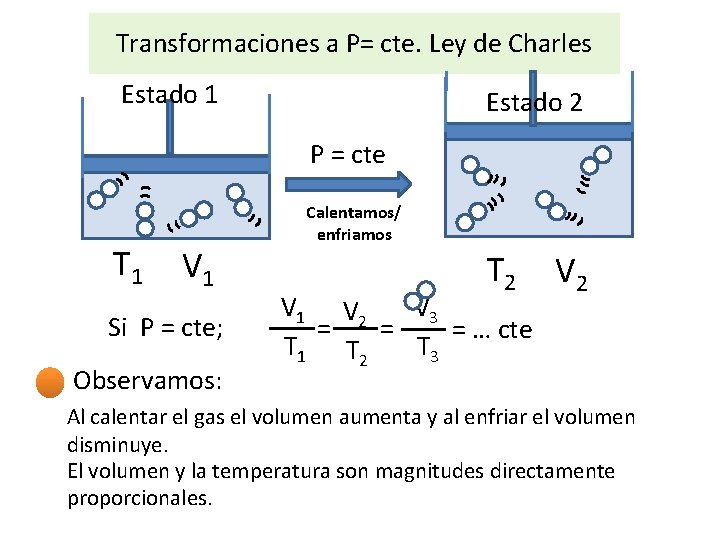
Transformaciones a P= cte. Ley de Charles Estado 1 Estado 2 P = cte T 1 V 1 Si P = cte; Observamos: Calentamos/ enfriamos T 2 V 1 V 2 V 3 = = = … cte T 1 T 2 T 3 V 2 Al calentar el gas el volumen aumenta y al enfriar el volumen disminuye. El volumen y la temperatura son magnitudes directamente proporcionales.

Interpretación microscópica: Al calentar el gas las partículas que lo forman se mueven más deprisa y chocan más veces y más fuerte entre ellas y con las paredes del recipiente y el volumen del recipiente aumenta. Ejercicios: V Ejemplo 7, pag 68 Ejemplo vida cotidiana: T Una rueda de bicicleta al sol, al calentarse el gas, el volumen aumenta….

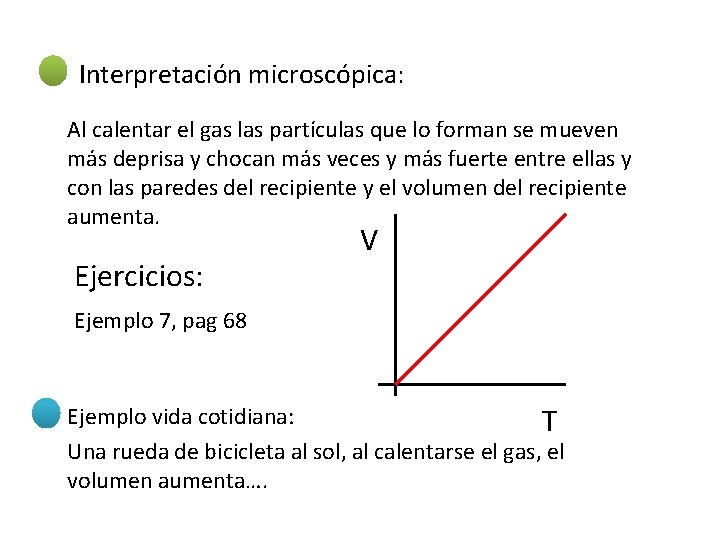
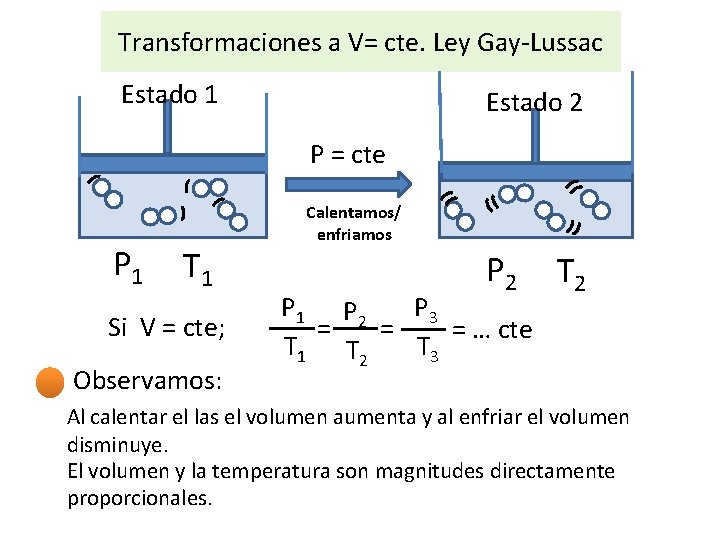
Transformaciones a V= cte. Ley Gay-Lussac Estado 1 Estado 2 P = cte P 1 T 1 Si V = cte; Observamos: Calentamos/ enfriamos P 2 P 1 P 2 P 3 = = = … cte T 1 T 2 T 3 T 2 Al calentar el las el volumen aumenta y al enfriar el volumen disminuye. El volumen y la temperatura son magnitudes directamente proporcionales.

Interpretación microscópica: Al calentar el gas las partículas que lo forman se mueven más deprisa y chocan más veces y más fuerte entre ellas y con las paredes del recipiente y la presión aumenta, porque el volumen es constante. Ejercicios: P 40, pag 85 43, pag 86 Ejemplo vida cotidiana: T Una olla a presión. Al calentar la olla la presión aumenta

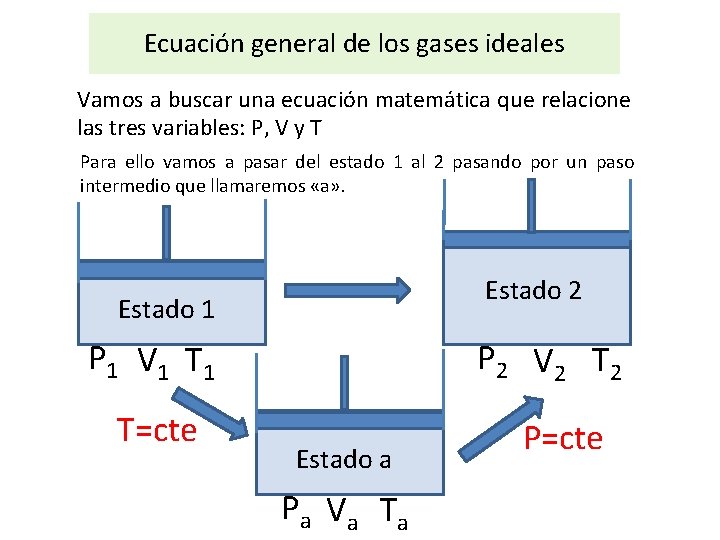
Ecuación general de los gases ideales Vamos a buscar una ecuación matemática que relacione las tres variables: P, V y T Para ello vamos a pasar del estado 1 al 2 pasando por un paso intermedio que llamaremos «a» . Estado 2 Estado 1 P 1 V 1 T=cte P 2 V 2 T 2 Estado a P a Va Ta P=cte

Ecuación general de los gases ideales Tenemos que plantear una serie de ecuaciones para obtener la ecuación general. Para encontrarla ten en cuenta las siguientes indicaciones: Etapa 1: Pasamos del estado 1 al «a» sabiendo que se cumple la ley de Boyle, una transformación a T = cte; T 1=Ta Etapa 2: Pasamos del estado «a» al 2 sabiendo que se cumple la ley de Charles, una transformación a P = cte; Pa=P 2 Así, obtenemos cuatro ecuaciones y trabajando con ellas convenientemente obtendremos la ecuación general de los gases ideales

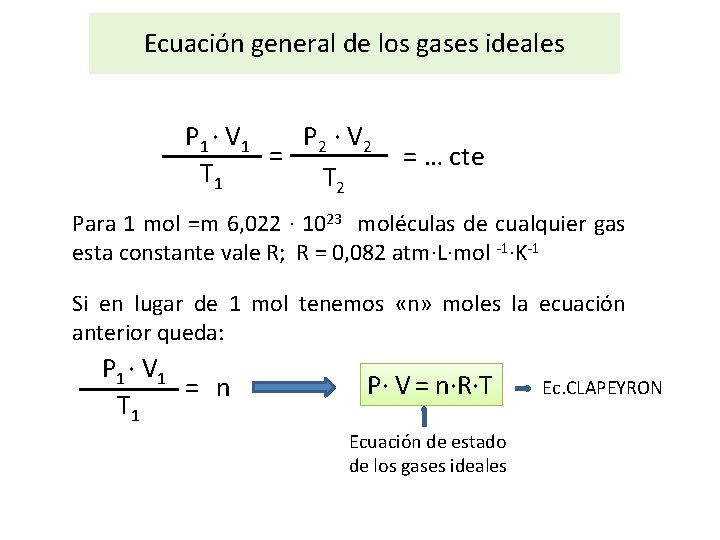
Ecuación general de los gases ideales P 1 · V 1 P 2 · V 2 = T 1 T 2 = … cte Para 1 mol =m 6, 022 · 1023 moléculas de cualquier gas esta constante vale R; R = 0, 082 atm·L·mol -1·K-1 Si en lugar de 1 mol tenemos «n» moles la ecuación anterior queda: P 1 · V 1 = n T 1 P· V = n·R·T Ecuación de estado de los gases ideales Ec. CLAPEYRON

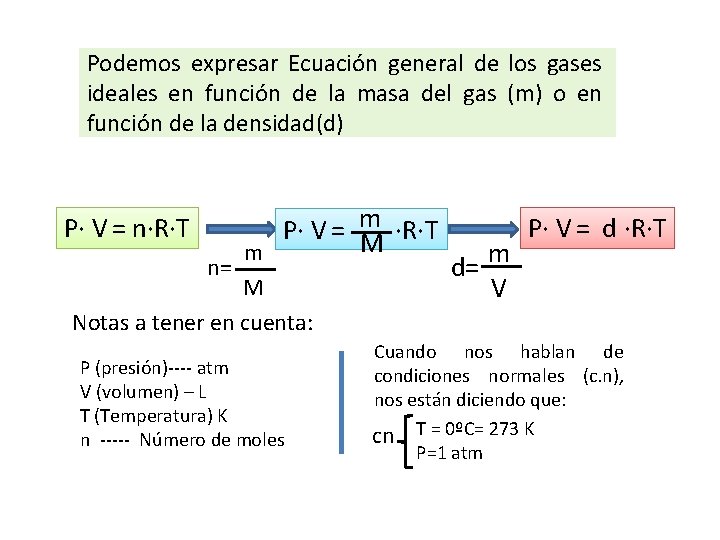
Podemos expresar Ecuación general de los gases ideales en función de la masa del gas (m) o en función de la densidad(d) P· V = n·R·T n= P· V = m ·R·T M m M Notas a tener en cuenta: P (presión)---- atm V (volumen) – L T (Temperatura) K n ----- Número de moles m d= V P· V = d ·R·T Cuando nos hablan de condiciones normales (c. n), nos están diciendo que: cn T = 0ºC= 273 K P=1 atm

Problemas que puedes hacer Actividad 1: Volumen molar Determina el volumen de 1 mol de gas (N 2) en c. n. y completa: 1 mol N 2= g= moléculas N 2 = L en c. n. Solución: 22, 4 L Observa que 1 mol de cualquier gas en c. n. siempre ocupa 22, 4 L Actividades del libro: Pag 71: 10, 11, 12, 13, , 14 Pag 83, 84, . . : 8, 13, 17, 18, 19, 21, 22
 Cuando cantamos cuando rezamos
Cuando cantamos cuando rezamos Ecuacion de los gases ideales
Ecuacion de los gases ideales Formula de gases ideales
Formula de gases ideales P * v
P * v Características de los gases nobles
Características de los gases nobles Características de los gases
Características de los gases Qué factores influyen en el comportamiento de un gas
Qué factores influyen en el comportamiento de un gas La prehistoria cuando empieza y cuando termina
La prehistoria cuando empieza y cuando termina Cargadas vienen y en el camino no se detienen
Cargadas vienen y en el camino no se detienen Cuando, cuando
Cuando, cuando Metas mapa mental de proyecto de nacion
Metas mapa mental de proyecto de nacion Golpe de espada es la alabanza
Golpe de espada es la alabanza Projeto de vida 6 ano atividades
Projeto de vida 6 ano atividades Una botella de ron canción scout
Una botella de ron canción scout Que queremos llegar a ser
Que queremos llegar a ser