P V n R T LEYES DE LOS





















- Slides: 27

P. V = n. R. T LEYES DE LOS GASES Profesora: Marianet Zerené

Objetivo • Describir las principales leyes de los gases. Realizar ejercicios para comprobar el cumplimiento de estas leyes. • ley de Boyle • Ley de Charles • Ley de Gay- Lussac • Ley de Avogadro • Ley General de los Gases

Recordemos las propiedades de los gases… 1. 2. 3. 4. Fluidez Difusión Compresión Resistencia

Leyes de los gases • El comportamiento físico de una muestra de gas puede describirse completamente con cuatro variables: - presión (P) - volumen (V) - temperatura (T) - cantidad (número de moles) de gas (n) • Las variables son interdependientes: Cualquiera de ellas puede calcularse, midiendo las otras tres.


PRESIÓN P = F A • Definición: es la fuerza perpendicular que se ejerce por unidad del área. • Unidades: [P]=[N]/[m 2]= Pa 1 Pa = N/m 2 • Otras unidades: • atm: 1 atm = 101 325 Pa • mm Hg: 760 mm Hg = 1 atm 6

VOLUMEN Es la cantidad de espacio que ocupa la materia en este caso un gas. 1000 ml 1 L 1 cm 3 1 ml 7

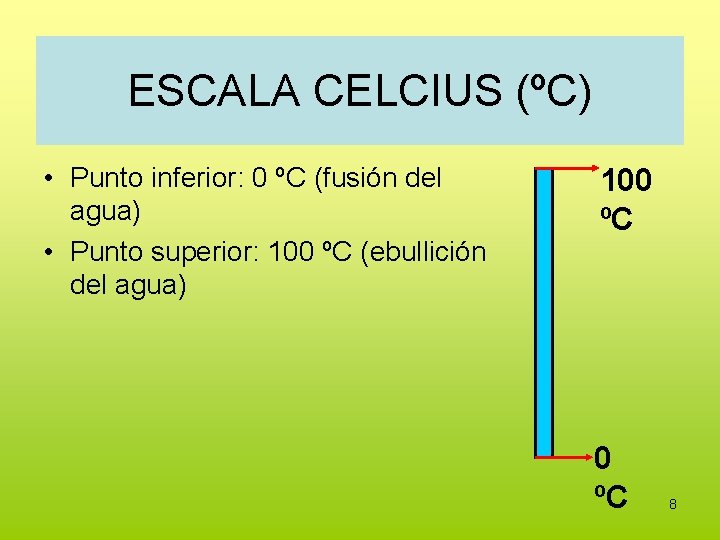
ESCALA CELCIUS (ºC) • Punto inferior: 0 ºC (fusión del agua) • Punto superior: 100 ºC (ebullición del agua) 100 ºC 8

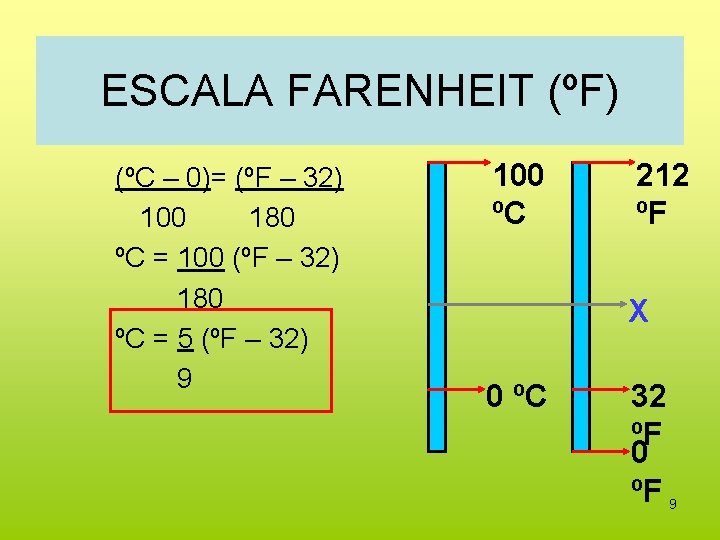
ESCALA FARENHEIT (ºF) (ºC – 0)= (ºF – 32) 100 180 ºC = 100 (ºF – 32) 180 ºC = 5 (ºF – 32) 9 100 ºC 212 ºF X 0 ºC 32 ºF 0 ºF 9

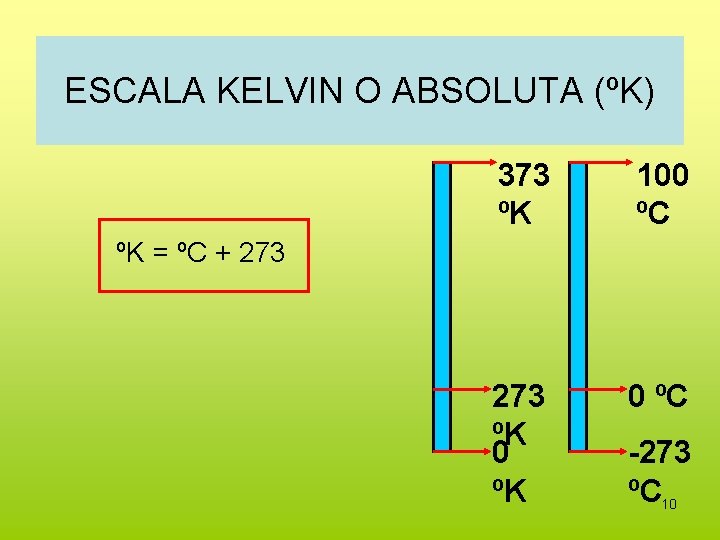
ESCALA KELVIN O ABSOLUTA (ºK) 373 ºK 100 ºC 273 ºK 0 ºC ºK = ºC + 273 -273 ºC 10

Ley de Boyle Para una masa fija de gas, a temperatura constante, la presión es inversamente proporcional al volumen. V a 1/P (a T cte) V = k 1/P P 1 • V 1 = P 2 • V 2

Ley de Charles Para una masa fija de gas, a presión constante, el volumen de un gas es directamente proporcional a la temperatura absoluta. V a T (a P cte) V = K • T

Ley de Gay Lussac A volumen constante, la presión de una masa fija de gas es directamente proporcional a la temperatura absoluta. P a T (a V y masa constante)

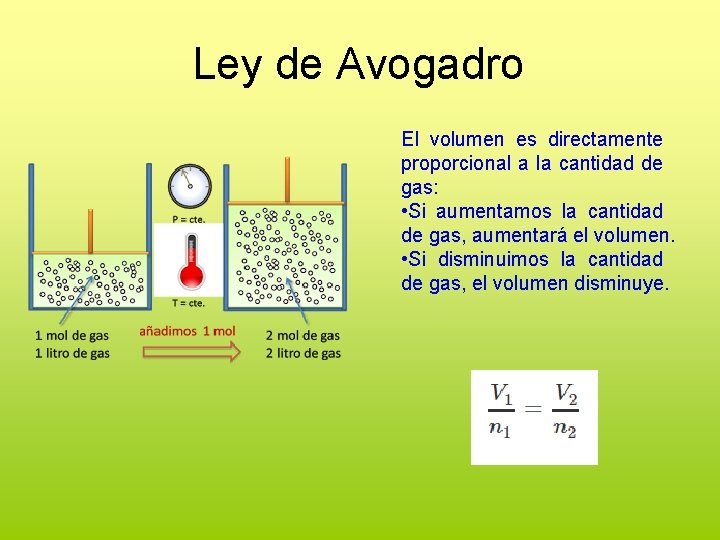
Ley de Avogadro El volumen es directamente proporcional a la cantidad de gas: • Si aumentamos la cantidad de gas, aumentará el volumen. • Si disminuimos la cantidad de gas, el volumen disminuye.

Ley general de los Gases • La Ley General de los Gases consiste en la unión de las siguientes leyes: Ley de Boyle: P 1 · V 1 = P 2 · V 2 • Ley de Gay-Lussac: P 1 / T 1 = P 2 / T 2 • Ley de Charles: V 1 / T 1 = V 2 / T 2 Todas ellas se condensan en la siguiente fórmula que es aplicable para una misma cantidad de gas: donde: P es la presión • V es el volumen • T es la temperatura absoluta (en grados Kelvin) • Si la cantidad de gas No es la misma (mol) la ley general queda como la ley ideal de los gases ideales: • Donde R = 0, 082 Atmx L / K x mol

Ahora resolvamos algunos ejercicios…

• 1. - El volumen del aire en los pulmones de una persona es de 615 m. L aproximadamente, a una presión de 760 mm. Hg. La inhalación ocurre cuando la presión de los pulmones desciende a 752 mm. Hg ¿A qué volumen se expanden los pulmones?

Datos Conversión de escalas V 1= 615 ml 0, 615 L P 1= 760 mm. Hg 1 Atm P 2= 752 mm. Hg 0, 98 Atm V 2= ? Ley de Boyle P 1 • V 1 = P 2 • V 2 1 Atm x 0, 615 L = 0, 98 Atm x V 2 0, 615 Atm x L = V 2 0, 98 Atm V 2= 0, 63 L

• 2. -Es peligroso que los envases de aerosoles se expongan al calor. Si una lata de fijador para el cabello a una presión de 4 atmósferas y a una temperatura ambiente de 27 °C se arroja al fuego y el envase alcanza los 402 °C ¿Cuál ser á su nueva presión?

Datos Conversión de escalas T 1= 27°C 300°K P 1= 4 Atm P 2= ? T 2= 402°C 675°K Ley de Gay-Lussac 4 Atm = P 2_ 300°K 675°K 0, 013 Atm x 675°K = P 2 °K P 2= 9 Atm

• 3. - Un alpinista inhala 500 m. L de aire a una temperatura de 10°C ¿Qué volumen ocupará el aire en sus pulmones si su temperatura corporal es de 37°C?

Datos Conversión de escalas V 1= 500 ml 0, 5 L T 1= 10°C 283°K V 2= ? T 2= 37°C 310°K Ley de Charles 0, 5 L = V 2_ 283°K 310°K 1, 76 x 10 -3 L x 310°K= V 2 °K V 2 = 0, 55 L

• 4. - Se libera una burbuja de 25 m. L del tanque de oxígeno de un buzo que se encuentra a una presión de 4 atmósferas y a una temperatura de 11°C. ¿Cuál es el volumen de la burbuja cuando ésta alcanza la superficie del océano, dónde la presión es de 1 atm y la temperatura es de 18 °C?

Datos Conversión de escalas V 1= 25 ml 0, 025 L P 1= 4 Atm T 1= 11°C 284°K 0, 025 L x 4 Atm = V 2 x 1 Atm V 2= ? 284°K 291°K P 2= 1 Atm 1 Atm T 2= 18°C 291°K 3, 52 x 10 -4 Lx. Atm= V 2 x 1 Atm 291°K Ley Combinada °K 3, 52 x 10 -4 Lx. Atm x 291°K = V 2 x 1 Atm °K 0, 10 Lx. Atm =V 2 1 Atm V 2= 0, 10 L

5. -Calcular el volumen de 6, 4 moles de un gas a 210ºC sometido a 3 atmósferas de presión. P · V = n · R · T Pasamos la temperatura a Kelvin: 210ºC = (210 + 273) ºK = 483ºK V = n · R · T / P V = 6, 4 moles · 0, 0821 · 483ºK / 3 atm. V = 84, 56 litros

• • • P · V = n · R · T Pasamos la temperatura a Kelvin: 210ºC = (210 + 273) ºK = 483ºK V = n · R · T / P V = 6, 4 moles · 0, 0821 · 483ºK / 3 atm. V = 84, 56 litros

Para expertos…. • 5. - Un globo aerostático de 750 m. L se infla con helio a 8 °C y a una presión de 8 atmósferas ¿Cuál es el nuevo volumen en litros del globo en la atmósfera a presión de 0. 20 atm y temperatura de 45°C? • 6. - Un aprendiz de Boyle encuentra que el aire atrapado en un tubo J, ocupa 24. 8 cm 3 a 1. 12 atm. Al adicionarle mercurio al tubo, aumenta la presión sobre el aire atrapado hasta 2. 64 atm. Considere que la temperatura es constante. Cual es el nuevo volumen del aire atrapado en Litros? . • 7. - Calcular el número de moles de un gas que tiene un volumen de 350 ml a 2, 3 atmósferas de presión y 100ºC.