Teora molecular de los gases Propiedades trmicas de



































- Slides: 39

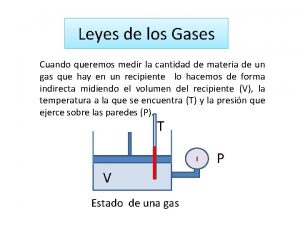
Teoría molecular de los gases.

Propiedades térmicas de la materia

Ecuación de los gases ideales en términos de la masa total del gas:

Variación de la presión con la altura

Relación presión altura.

Para tener en cuenta. El supuesto de temperatura constante no es realista , g disminuye un poco al aumentar la altura. Aun así se aproxima bastante a la realidad. La capacidad del cuerpo humano para absorber oxigeno de la atmosfera depende crucialmente de la presión atmosférica. La absorción disminuye abruptamente si la presión es menor que en unos 0, 6500000 pa , lo que corresponde a una altura sobre el nivel del mar de unos 4700 km. No hay asentamientos humanos a más de 6000 metros

Teoría cinética molecular de un gas

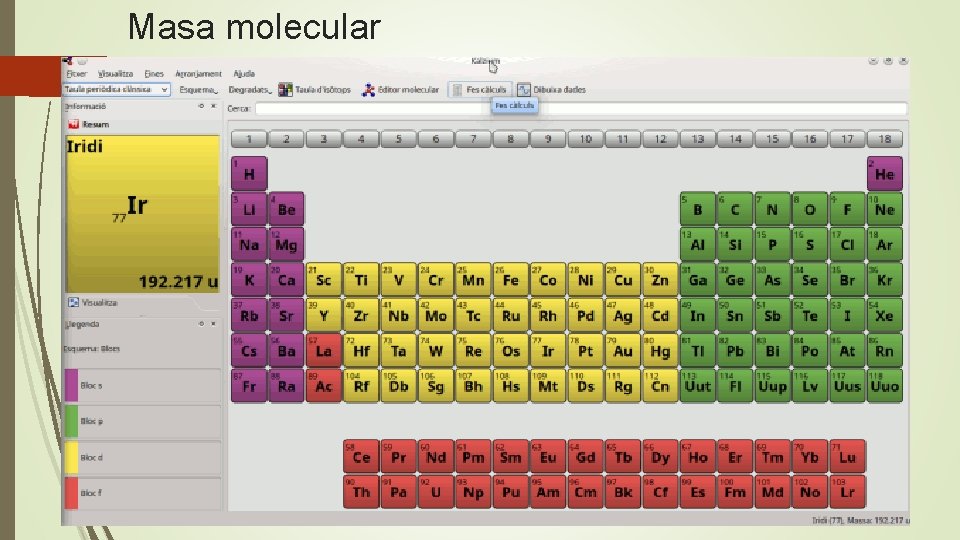
Masa molecular

Ejemplo de masa molecular relativa.

Relación masa molecular y unidades de masas atómica.

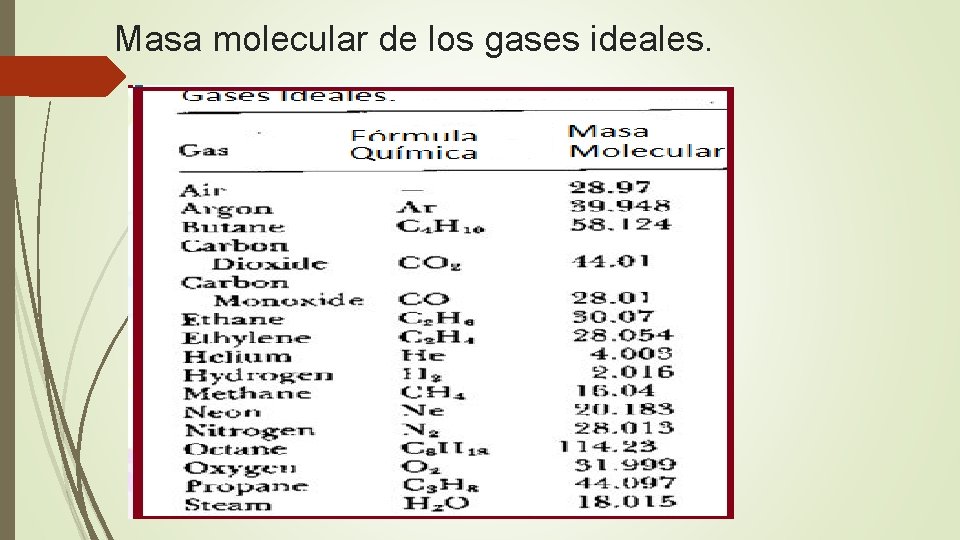
Masa molecular de los gases ideales.

En la teoría cinética Consideraciones teóricas: El recipiente que las contiene es de paredes rígidas Todas las moléculas tienen la misma masa Las moléculas son partículas puntuales Los movimientos obedecen a la mecánica clásica Todos los choques son elásticos La distribución es homogénea.

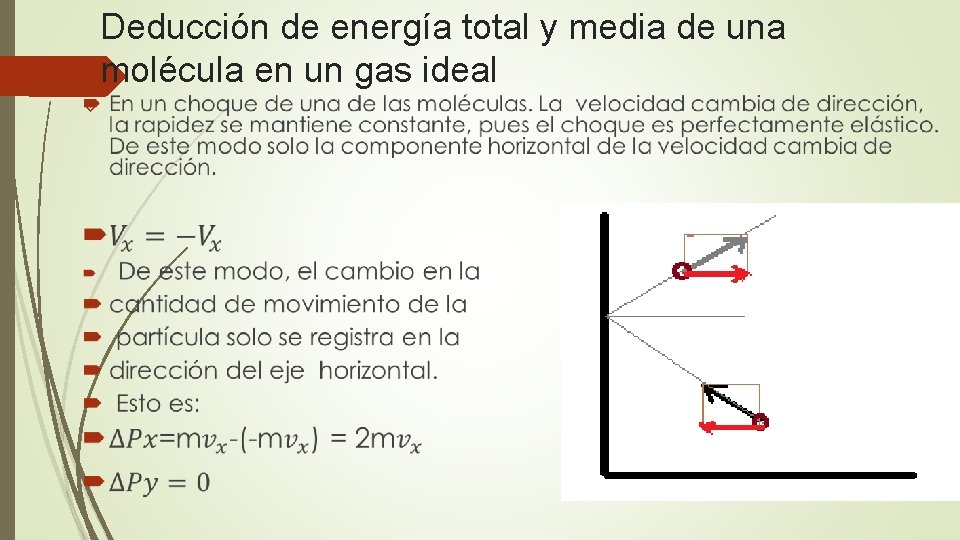
Deducción de energía total y media de una molécula en un gas ideal








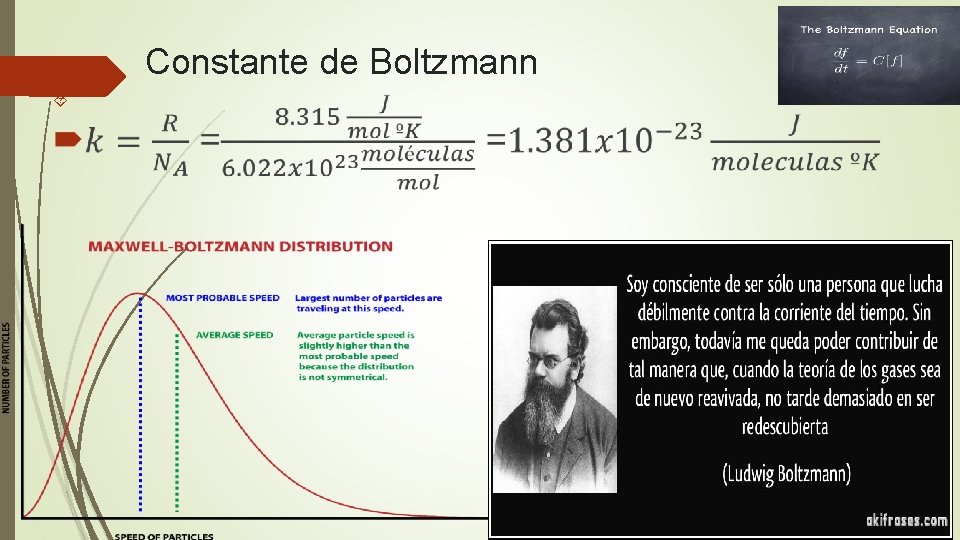
Constante de Boltzmann



Velocidades moleculares.

Choques entre moléculas Un modelo más realista es considerar las moléculas como una esfera rígidas de radio r ¿Con que frecuencia chocan con otras moléculas? ¿Cuánto viajan en promedio entre cada choque? Consideremos N moléculas esféricas con radio r en un volumen V. Supongamos que solo una se mueve, chocara con otra molécula cunado la distancia entre ellas sea 2 r. si consideramos un cilindro de radio 2 r , con su eje paralelo al de la velocidad de la molécula. La molécula chocara con cualquier otra cuyo centro este dentro de ese cilindro.




Capacidades caloríficas de los gases.



Resumen.


Preguntas para el análisis Teoría cinética molecular y presión (I) 1. Tenemos encerrado un gas en el interior de un globo a una temperatura de 25ºC. ¿A qué se debe la presión del gas en el interior del globo? a) La presión es debida a la cantidad de partículas del gas en el interior del globo. A más partículas, más presión tendrá, independientemente de la temperatura. b) La presión es debida al choque de una partícula de gas con otras partículas de gas. Más choques entre ellas, más presión. c) La presión es debida al choque de las partículas del gas con las paredes del globo.

2. ¿Cómo influye la temperatura en la presión que ejerce un gas? a) No hay ningún efecto de la temperatura sobre la presión que ejerce un gas. b) A mayor temperatura aumenta la energía cinética de vibración de las partículas pero la presión se mantiene constante. c) La presión disminuye la aumentar la temperatura. d) La presión aumenta al aumentar la temperatura. e) Ninguna de las otras afirmaciones es correcta -----Clave----- 1. (c) 2. (d)

Teoría cinética molecular y presión (II) Tenemos un gas encerrado en un recipiente. Si disminuimos el volumen del gas manteniendo constante la temperatura, las partículas chocan con (1)_____ (más / menos) frecuencia contra las paredes del recipiente que las contiene: (2)_____ (aumenta / disminuye) la presión sobre las paredes del recipiente Si enfriamos el gas manteniendo constante el volumen, (3)_____ (aumentará / disminuirá) la energía cinética media y las partículas del gas chocaran con menos (más / menos) intensidad contra las paredes: (4)_____ (aumenta / disminuye) la presión del recipiente que contiene el gas. aumenta disminuirá disminuye más Claves. Más , aumenta, disminuirá disminuye

Ejercicios de aplicación. 1. - Calcular la masa de una molécula de nitrógeno 2. - cuantos átomos de helio hay en 2 gramos de helio? 3. - Una gotita de mercurio tiene un radio de 0, 5 mm ¿Cuántos átomos de mercurio hay en la gotita? 4. - ¿Cuántas moléculas hay en 7 m. L de benceno ( densidad 0, 88 y masa molecular 78) 5. - Calcular la rapidez rms de una molécula de nitrógeno en el aire a 0ºC 6. - Una molécula de gas en la superficie de la tierra tiene una rapidez rms igual a la que posee un gas a 0ºC. Si la fuéramos a mover verticalmente hacia arriba sin chocar con otras moléculas ¿Qué tan alto llegaría?


 La teora
La teora Teoría cinetico molecular
Teoría cinetico molecular Termodinmica
Termodinmica Las características de los gases
Las características de los gases Kinetic theory for ideal gases
Kinetic theory for ideal gases Molecular theory of gases and liquids
Molecular theory of gases and liquids Variables que afectan a los gases
Variables que afectan a los gases Melting and boiling point of oxygen
Melting and boiling point of oxygen Giant molecular structure vs simple molecular structure
Giant molecular structure vs simple molecular structure Zinc oxide + nitric acid → zinc nitrate + water
Zinc oxide + nitric acid → zinc nitrate + water Esta compuesto
Esta compuesto Globo aerostatico ley de los gases
Globo aerostatico ley de los gases Gas ideal
Gas ideal Cuando
Cuando Ley combinada formula
Ley combinada formula Características de los gases nobles
Características de los gases nobles Los gases nobles se caracterizan por
Los gases nobles se caracterizan por Pgas=patm+ph
Pgas=patm+ph Formula de gases ideales
Formula de gases ideales Cuales son los gases nobles
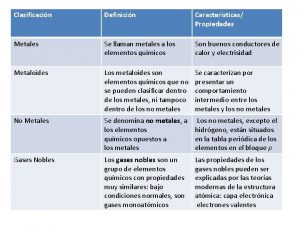
Cuales son los gases nobles Propiedades de los metaloides
Propiedades de los metaloides Propiedades del argon
Propiedades del argon Elementos gases
Elementos gases Tanque rigido
Tanque rigido Difusibilidad de los gases
Difusibilidad de los gases Los gases nobles se caracterizan por
Los gases nobles se caracterizan por Adiabatica
Adiabatica Constante de los gases ideales
Constante de los gases ideales Gas law formula
Gas law formula Un globo aerostatico de 750 ml se infla con helio a 8
Un globo aerostatico de 750 ml se infla con helio a 8 Postulados de la teoría cinética de los gases
Postulados de la teoría cinética de los gases Ley de gay lussac
Ley de gay lussac Constante universal de los gases
Constante universal de los gases Teoria cinetica de los gases
Teoria cinetica de los gases Gaseoso
Gaseoso Transdecalina
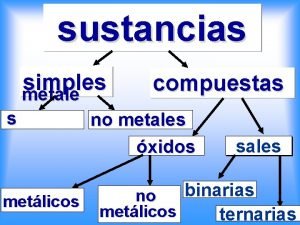
Transdecalina Grupos de materiales
Grupos de materiales Situación e intención comunicativa
Situación e intención comunicativa Cuadro comparativo de las propiedades periódicas
Cuadro comparativo de las propiedades periódicas Caracteristicas de los hidroxidos
Caracteristicas de los hidroxidos