Universidad Autnoma del Estado de Mxico Centro Universitario



























- Slides: 32

Universidad Autónoma del Estado de México Centro Universitario UAEM Ameca Licenciatura en Nutrición TEMA: GASES Y TEORÍA CINÉTICA MOLECULAR EN SISTEMAS BIOLÓGICOS Elaborado por: M. E. S. Narciso Campero Garnica Unidad de Aprendizaje: Fisicoquímica Créditos Institucionales: 8 OCTUBRE 2015

GUIÓN EXPLICATIVO PARA EL EMPLEO DEL PRESENTE MATERIAL La mayor parte de las transparencias ponen de relieve los temas principales de los contenidos en las “notas resumidas”. En tanto que las ayudas visuales sirven para ilustrar las exposiciones. Al comienzo de la sesión de trabajo, se entregará a los estudiantes los impresos de las transparencias que serán utilizadas.

OBJETIVOS • Describir las leyes de los gases ideales. • Definir condiciones estándar de temperatura y presión.

Estados de agregación Las sustancias en la naturaleza se presentan en tres estados de agregación: sólido, líquido y gaseoso

Propiedades de los gases

Sus partículas presentan grandes distancias entre sí.

Nula cohesión entre sus moléculas Carecen de forma y volumen definido

Llenan totalmente el recipiente que lo contiene Pueden comprimirse

Son menos densos que sólidos y líquidos

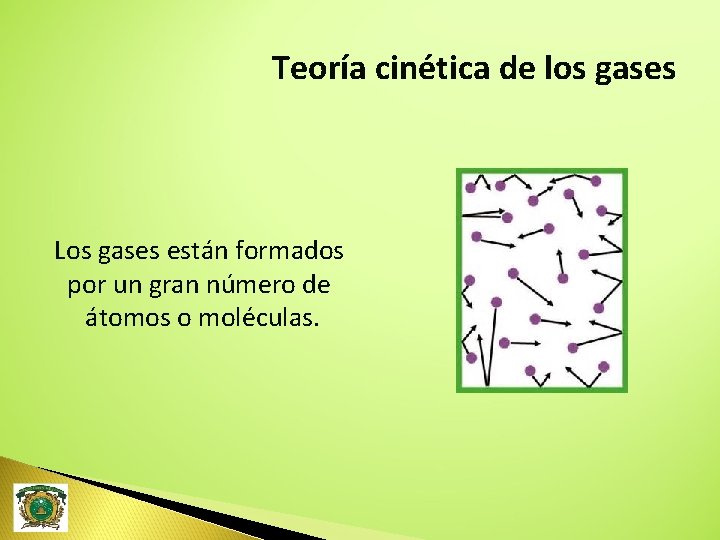
Teoría cinética de los gases Los gases están formados por un gran número de átomos o moléculas.

Las fuerzas de repulsión molecular son elevadas y las de cohesión nulas.

Las partículas de gas se mueven caóticamente, con gran rapidez y chocan entre si y también con las paredes del recipiente que las contiene, provocando presión.

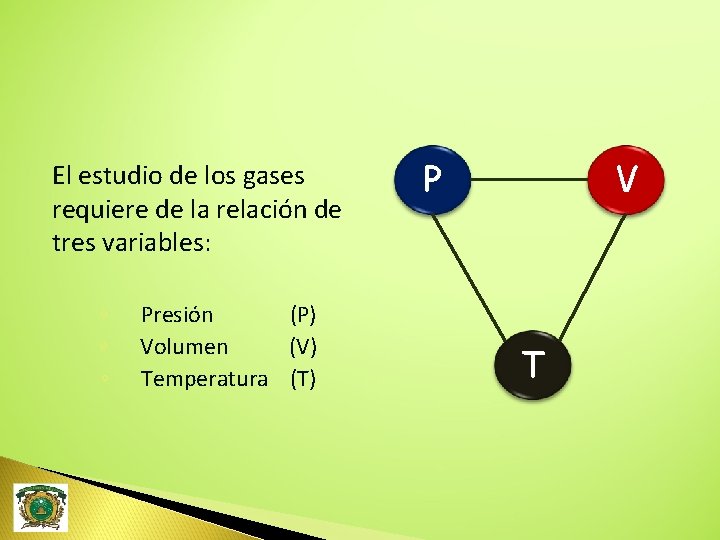
El estudio de los gases requiere de la relación de tres variables: ◦ ◦ ◦ Presión (P) Volumen (V) Temperatura (T) P V T

Presión Resultado de las colisiones de las moléculas contra las paredes del recipiente.

La unidad principal se llama Pascal (Pa). También puede medirse en atmósferas (atm), milímetros de mercurio (mm Hg). 1 atm = 760 mm. Hg 1 atm = 1. 013 x 105 Pa

Volumen Los gases llenan completamente el recipiente que los contiene, por lo tanto el volumen será igual al volumen del recipiente.

Sus unidades de medición son: metros cúbicos (m 3), centímetros cúbicos (cm 3), litros (l) y mililitros (ml).

Temperatura Se emplea la escala de temperatura absoluta o Kelvin (K). Si un gas alcanza la temperatura del cero absoluto (0 K = -273. 15 °C) sus partículas carecerán de movimiento, es decir, de energía cinética (Ec).

Gases ideales


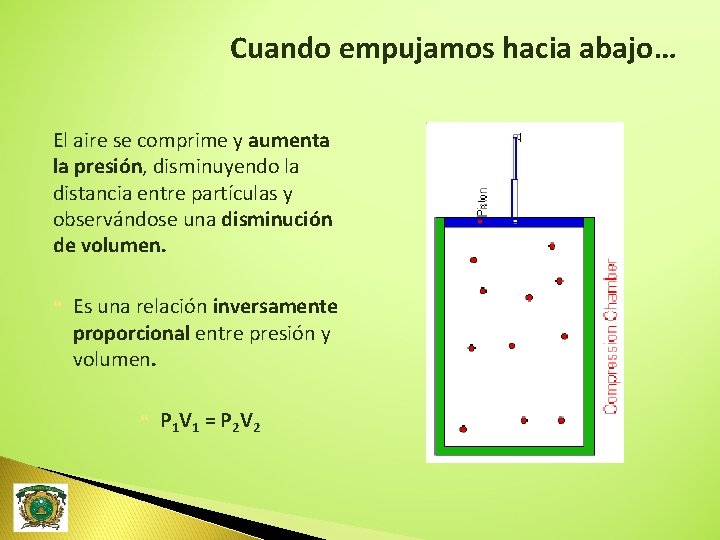
Ley de Boyle ¿ empujamos hacia abajo? ¿Empujamos hacia abajo?

Cuando empujamos hacia abajo… El aire se comprime y aumenta la presión, disminuyendo la distancia entre partículas y observándose una disminución de volumen. Es una relación inversamente proporcional entre presión y volumen. P 1 V 1 = P 2 V 2

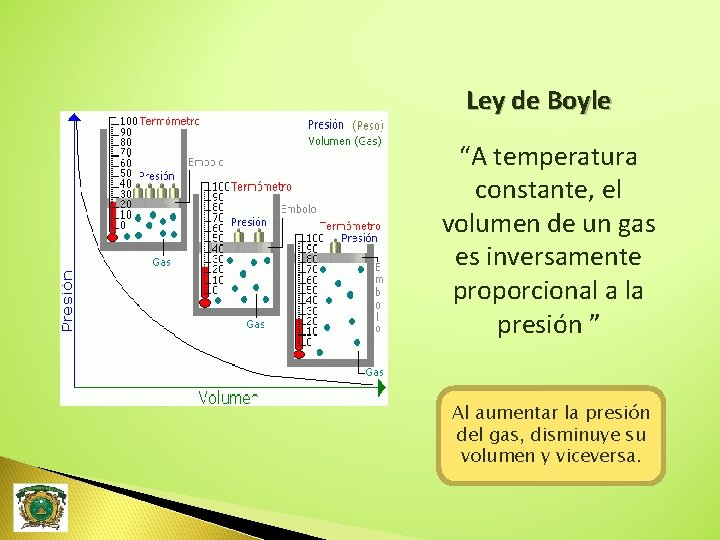
Ley de Boyle “A temperatura constante, el volumen de un gas es inversamente proporcional a la presión ” Al aumentar la presión del gas, disminuye su volumen y viceversa.

Ley de Charles

Ley de Charles “A presión constante, el volumen de un gas es directamente proporcional a su temperatura absoluta”. V 1 / T 1 = V 2 / T 2 Si aumenta la temperatura de un gas, aumenta la energía cinética de las moléculas o átomos de ese gas. Para mantener una presión constante, el volumen deberá aumentar, es decir que aumente la distancia entre átomos y moléculas.

Ley de Gay - Lussac

Ley de Gay - Lussac Relaciona directamente a la presión (P) con la temperatura (T). P 1 / T 1 = P 2 / T 2

Ecuación de los gases ideales Podemos expresar las leyes anteriores como una relación de proporcionalidad: Ley de Boyle: V∝ 1/P Ley de Charles: V∝T Ley de Avogadro: V∝n Podemos combinar estas tres relaciones para obtener una ley más general de los gases: V∝n. T/P

Si llamamos R a la constante de proporcionalidad, obtenemos: V=R(n. T/P) o PV=n. RT Esta ecuación se conoce como la ecuación de los gases ideales. Un gas ideal es un gas hipotético cuyo comportamiento de presión, volumen, y temperatura se describe por completo mediante la ecuación del gas ideal.

El termino R se conoce como la constante de los gases y las unidades dependen de las unidades de P, V, n y T, con T siempre en unidades de temperatura absoluta.

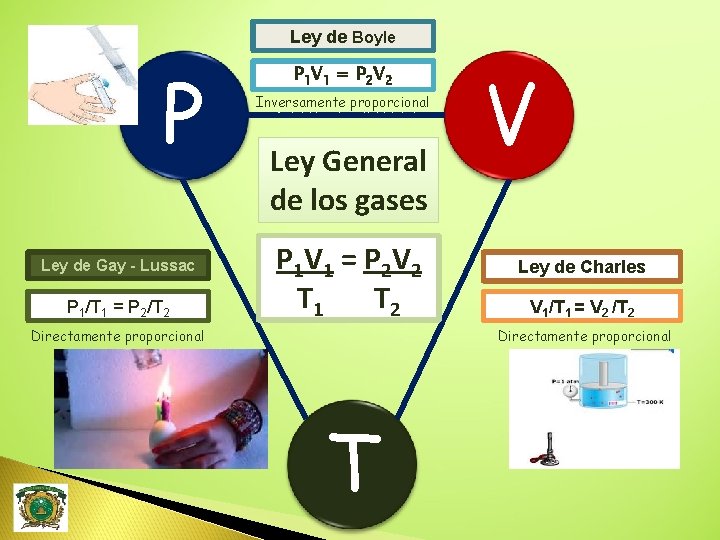
Ley de Boyle P Ley de Gay - Lussac P 1/T 1 = P 2/T 2 P 1 V 1 = P 2 V 2 Inversamente proporcional Ley General de los gases P 1 V 1 = P 2 V 2 T 1 T 2 Directamente proporcional V Ley de Charles V 1/T 1 = V 2 /T 2 Directamente proporcional T

BIBLIOGRAFÍA 1. Chang, R. “Fisicoquímica para las ciencias químicas y biológicas”. Mc. Graw Hill Interamericana. México. 2008. 2. Peñas Cano Jesús. “Leyes de los Gases” Disponible: http: //www. juntadeandalucia. es/averroes/recursos_informaticos/andared 02/leyes_gases/ 30 de septiembre 2015 3. “Gases”. Disponible: exa. unne. edu. ar/quimica/quimgeneral/UNIDADVGases. pdf · 30 de septiembre 2015 4. “Química General” Disponible: quimicageneral. tripod. com/files 2/tulo_5_gases. pdf · 1. 30 de septiembre 2015
 Estadio azteca mapa virtual
Estadio azteca mapa virtual Tudo para o estado nada contra o estado nada fora do estado
Tudo para o estado nada contra o estado nada fora do estado Centro universitario de azuero
Centro universitario de azuero Centro universitario mar de cortes
Centro universitario mar de cortes Centro universitario anglo mexicano
Centro universitario anglo mexicano Centro regional universitario de azuero
Centro regional universitario de azuero Uni ibmr
Uni ibmr Derecho administrativo ii uaemex
Derecho administrativo ii uaemex Uaem ecatepec costos
Uaem ecatepec costos Centro universitario uaem ecatepec
Centro universitario uaem ecatepec Centro zonal norte centro historico
Centro zonal norte centro historico Calidad del aprendizaje universitario
Calidad del aprendizaje universitario Himno universitario letra
Himno universitario letra Instituto universitario nacional del arte
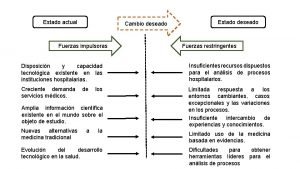
Instituto universitario nacional del arte Estado actual estado deseado
Estado actual estado deseado Maqueta del estado del agua
Maqueta del estado del agua Fase heuristica
Fase heuristica Pensionado universitario campus virtual
Pensionado universitario campus virtual Himno universidad gaudeamus igitur
Himno universidad gaudeamus igitur Foda de liderazgo
Foda de liderazgo Instituto universitario naval
Instituto universitario naval Puntajes universidades
Puntajes universidades Pensionado universitario nelson leon vizcarra
Pensionado universitario nelson leon vizcarra Jubilación docente universitario simultaneidad
Jubilación docente universitario simultaneidad Sistema educativo francese
Sistema educativo francese Ouvidoria do hospital universitário oswaldo cruz / upe
Ouvidoria do hospital universitário oswaldo cruz / upe Nucleo universitario rafael rangel
Nucleo universitario rafael rangel Universidad cecilio acosta enfermería
Universidad cecilio acosta enfermería Scienze della formazione portogruaro
Scienze della formazione portogruaro Analisis foda de un estudiante universitario
Analisis foda de un estudiante universitario Instituto universitario internacional de toluca
Instituto universitario internacional de toluca Sistema universitario italiano schema
Sistema universitario italiano schema Acceso universitario usfx 2019
Acceso universitario usfx 2019