Captulo 7 Gases Ideales INDICE Introduccin Diagrama Pv




















- Slides: 45

Capítulo 7 Gases Ideales

INDICE Introducción Diagrama P-v Polítropos 8. 1 Gases ideales 8. 2 Ley de Boyle - Mariotte 8. 3 Ley de Charles y Gay - Lusac 8. 4 Ley de Presión 8. 5 Ley General de Gases Ideales 8. 6 Polítropos 8. 7 Gases Reales - Factor de Compresibilidad Generalizado PROBLEMAS

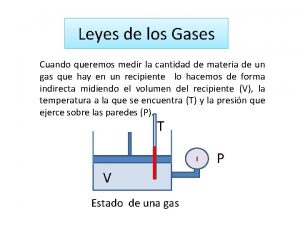
INTRODUCCION -Conoceremos sobre los gases y su comportamiento en procesos cotidianos e industriales Cuando se trabaja con gases solamente usaremos las fórmulas y no las Tablas de Vapor

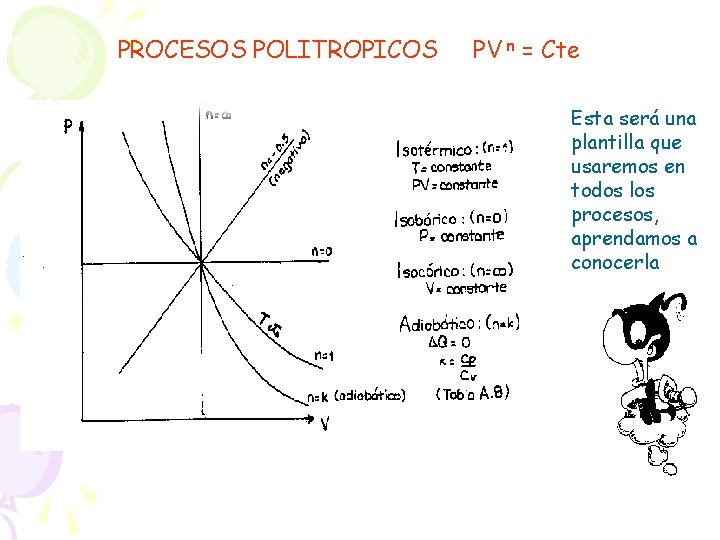
PROCESOS POLITROPICOS PV n = Cte Esta será una plantilla que usaremos en todos los procesos, aprendamos a conocerla

7. 1 GASES IDEALES Sustancia pura en estados tales que no existe interacción entre sus moléculas y se comportan de forma diferente que las sustancias puras (sólido, líquido, vapor) pero se mantienen en equilibrio con su fórmula p v = R T. Son aquellas que cumplen rigurosamente un conjunto de leyes experimentales dadas por Boyle y Mariotte y por Charles y Gay-Lusac.

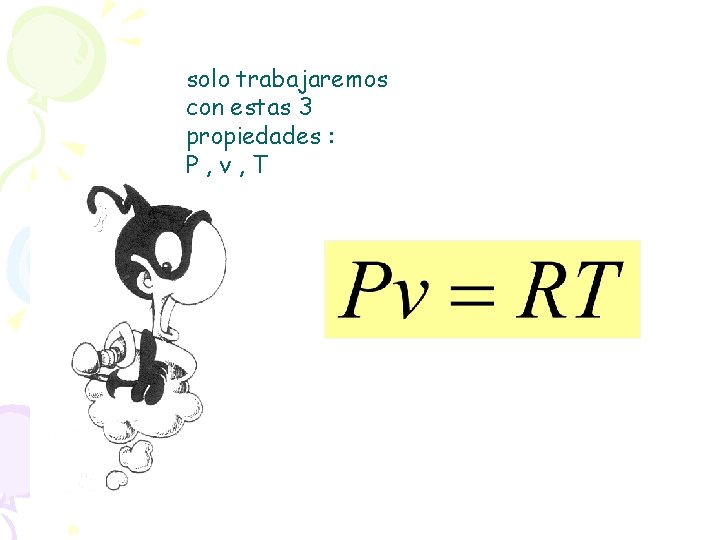
solo trabajaremos con estas 3 propiedades : P, v, T

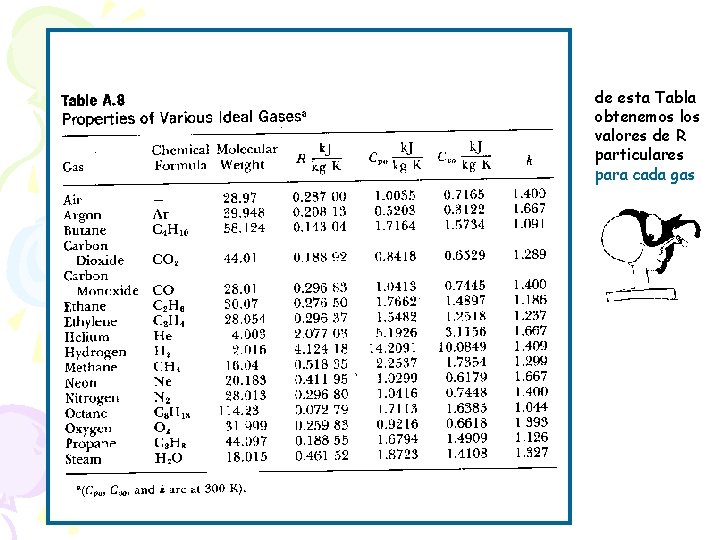
GAS IDEAL ( o gas perfecto): Cuando las moléculas están tan apartadas unas de otras que los movimientos de una no influyen en la de las otras. R : constante para cada gas. La encontramos tabulada en la Tabla A. 8 (pág 6)

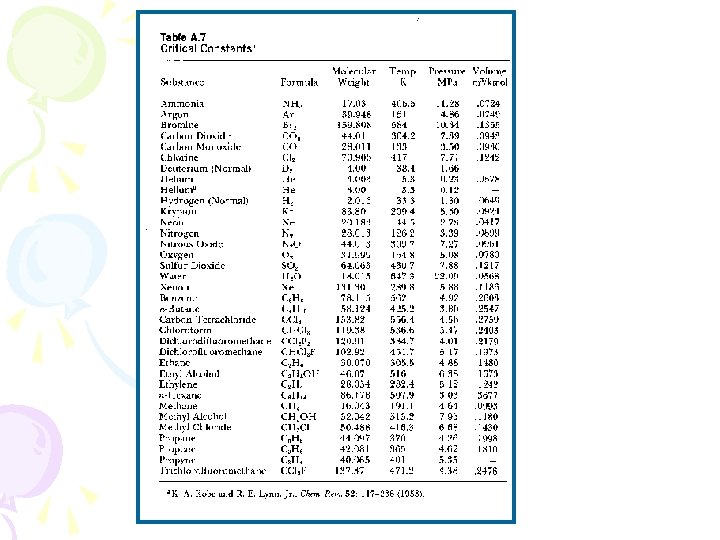
Constante Universal de los Gases: M = Tabla A. 7 ó A. 8 = kg/kmol Ejemplo : Calcular el R del aire de la Tabla A. 8 M = 28. 97 kg/kmol Rgas = 8. 314/28. 97 = 0. 287 k. J/kg K si sólo conocemos el peso molecular M, podemos obtener el R de cada gas con R/M

de esta Tabla obtenemos los valores de R particulares para cada gas

OTRAS LEYES IMPORTANTES Se han propuesto otras relaciones entre P, v y T para los gases, tales como las ecuaciones de : van der Waals Benedict Webb Rubin Beattie Bridgeman pero trabajaremos con la ley del gas ideal, puesto que es la más sencilla, conduce a toda clase de consecuencias precisas y porque se aproxima bastante a todos los gases reales con presiones no muy altas

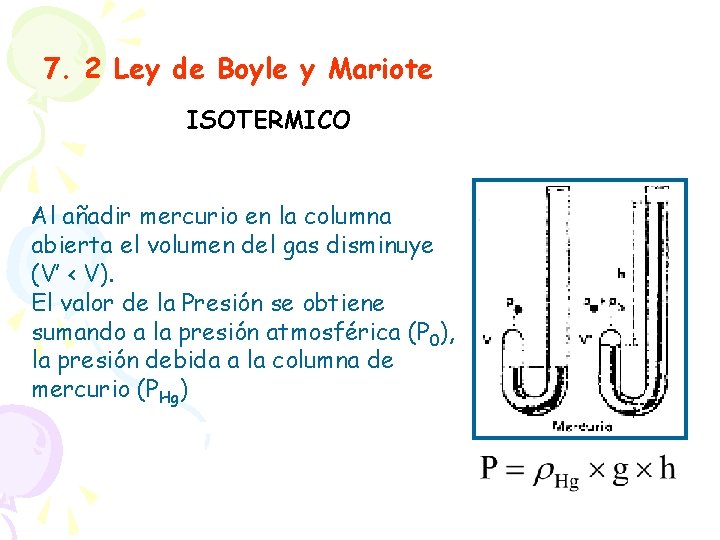
7. 2 Ley de Boyle y Mariote ISOTERMICO Al añadir mercurio en la columna abierta el volumen del gas disminuye (V’ < V). El valor de la Presión se obtiene sumando a la presión atmosférica (P 0), la presión debida a la columna de mercurio (PHg)

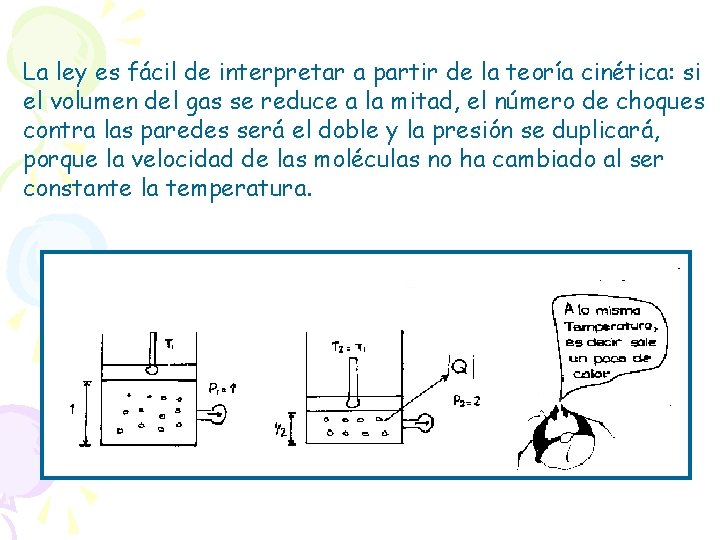
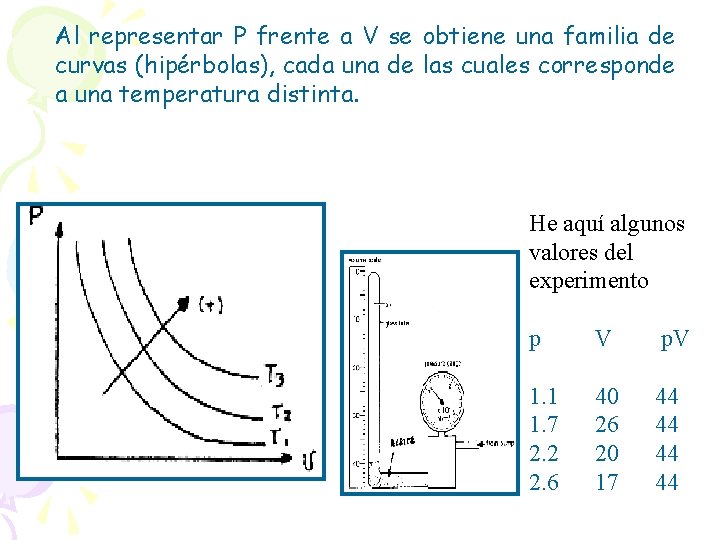
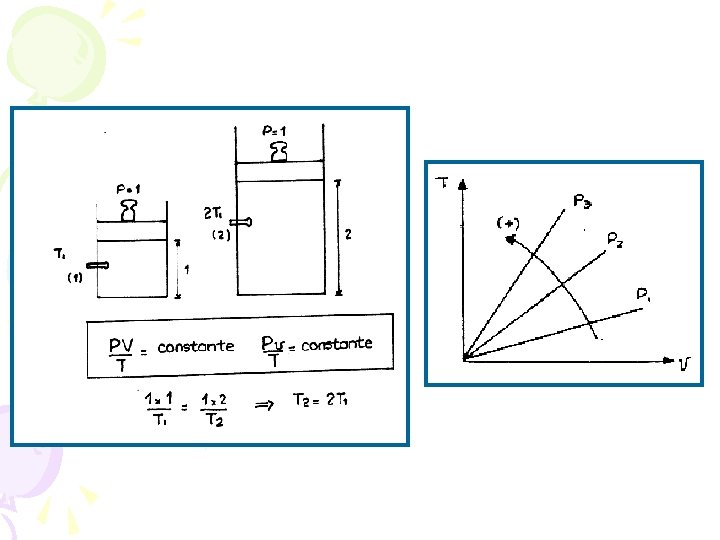
Supongamos que 1 y 2 representan valores distintos de Presión y Volumen para el gas que sufre un proceso: ISOTÉRMICO ( T = T 1 = T 2 = cte. ) En estas condiciones se verifica que: Si la temperatura se mantiene constante, la presión de un gas y su volumen son inversamente proporcionales. La ley es fácil de interpretar a partir de la teoría cinética: si el volumen del gas se reduce a la mitad, el número de choques contra las paredes será el doble y la presión se duplicará, porque la velocidad de las moléculas no ha cambiado al ser constante la temperatura.

La ley es fácil de interpretar a partir de la teoría cinética: si el volumen del gas se reduce a la mitad, el número de choques contra las paredes será el doble y la presión se duplicará, porque la velocidad de las moléculas no ha cambiado al ser constante la temperatura.

Al representar P frente a V se obtiene una familia de curvas (hipérbolas), cada una de las cuales corresponde a una temperatura distinta. He aquí algunos valores del experimento p V p. V 1. 1 1. 7 2. 2 2. 6 40 26 20 17 44 44

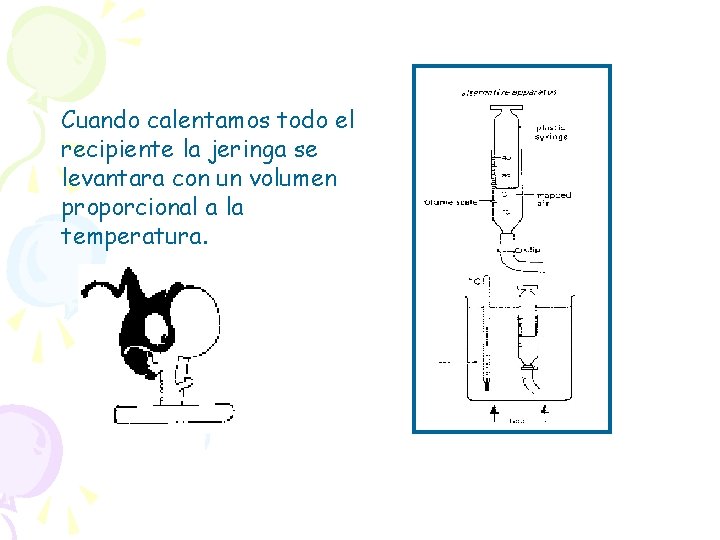
7. 3 Ley de Charles y Gay Lussac: ISOBARICO En esta ocasión el gas realiza un proceso: ISOBARICO (P 1 = P 2 = P = cte. ) Cuando la presión se mantiene constante, el volumen de un gas y su temperatura absoluta son directamente proporcionales. Si el volumen se duplica la presión debería reducirse a la mitad. Para que esta se mantenga constante, debe duplicarse también la temperatura.


Cuando calentamos todo el recipiente la jeringa se levantara con un volumen proporcional a la temperatura.

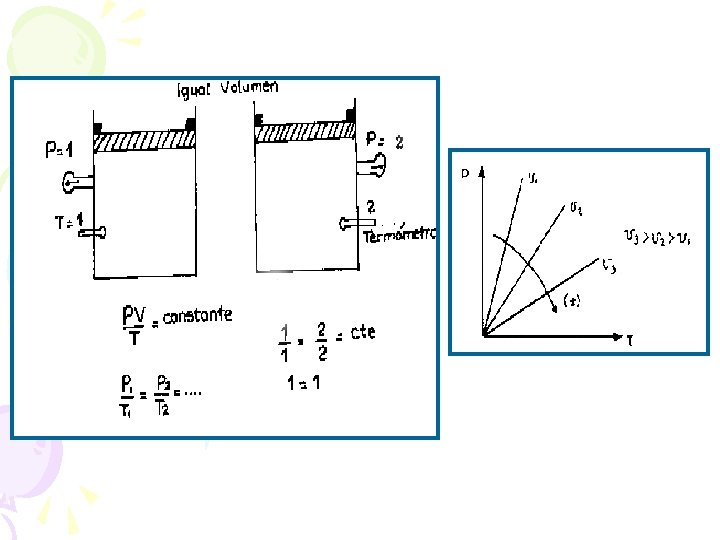
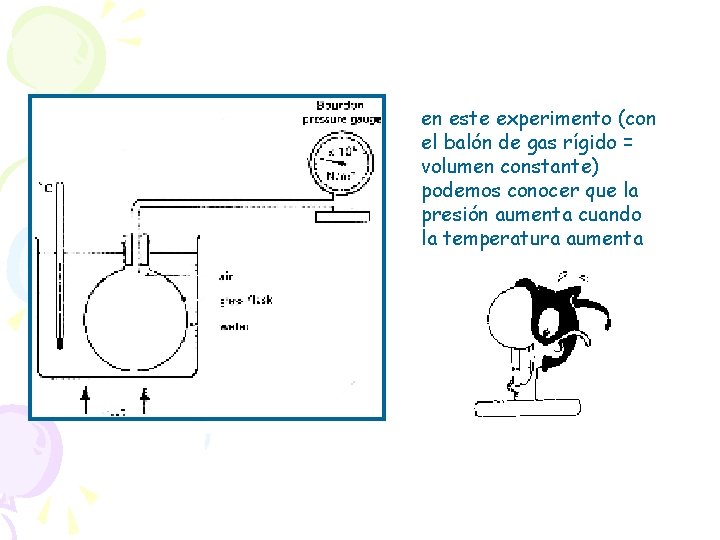
7. 4 Ley de Presiones: ISOCORICO Análogamente Si el volumen se mantiene constante, la presión de un gas y su temperatura absoluta son proporcionales Es decir se realiza un proceso: ISOCORICO ó ISOMETRICO (V 1 = V 2 = V = cte. ) se cumple:


en este experimento (con el balón de gas rígido = volumen constante) podemos conocer que la presión aumenta cuando la temperatura aumenta

CUIDADO !!. . si no trabajas en grados Kelvin los resultados son muy peligrosos y errados. .

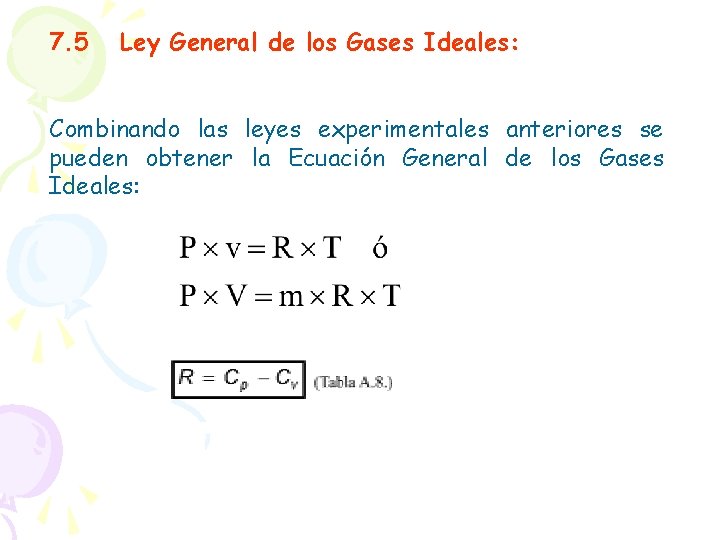
7. 5 Ley General de los Gases Ideales: Combinando las leyes experimentales anteriores se pueden obtener la Ecuación General de los Gases Ideales:

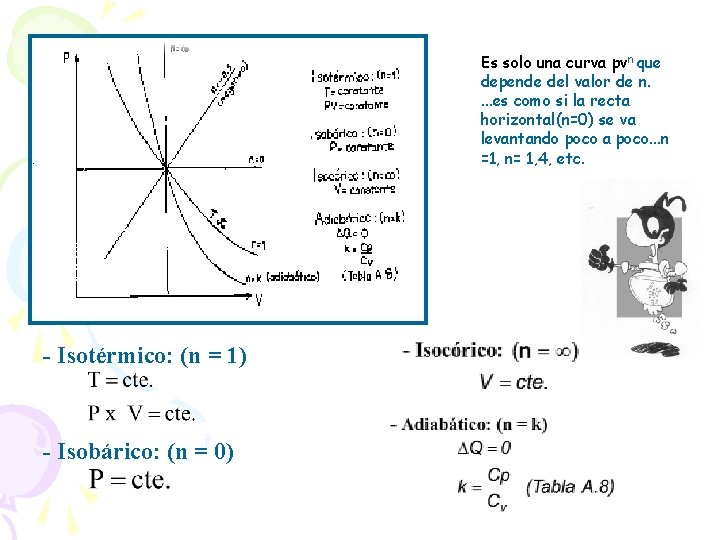
7. 6 POLITROPO: Es un cambio de estado que transcurre cuasiestáticamente y que satisface a un ce constante. Proceso Politrópico: Cuando los estados siguen una trayectoria de la forma. P x V n = cte, se deduce la siguiente igualdad. (Ecuación de Poisson)

Es solo una curva pvn que depende del valor de n. . es como si la recta horizontal(n=0) se va levantando poco a poco. . . n =1, n= 1, 4, etc. - Isotérmico: (n = 1) - Isobárico: (n = 0)

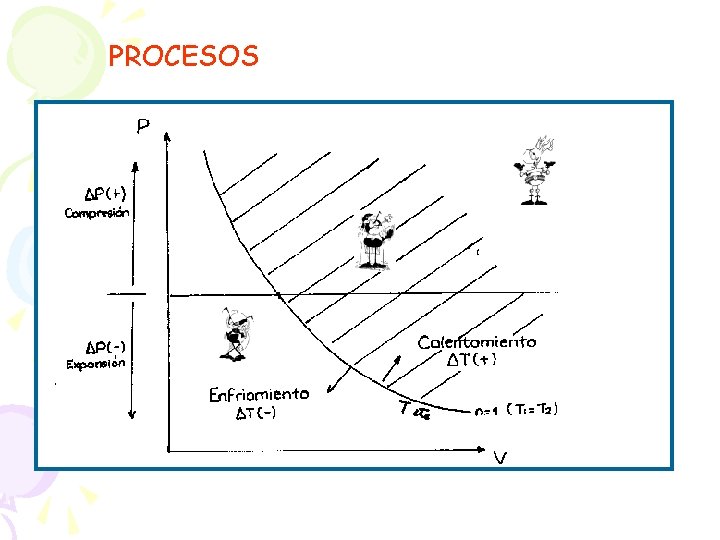
PROCESOS

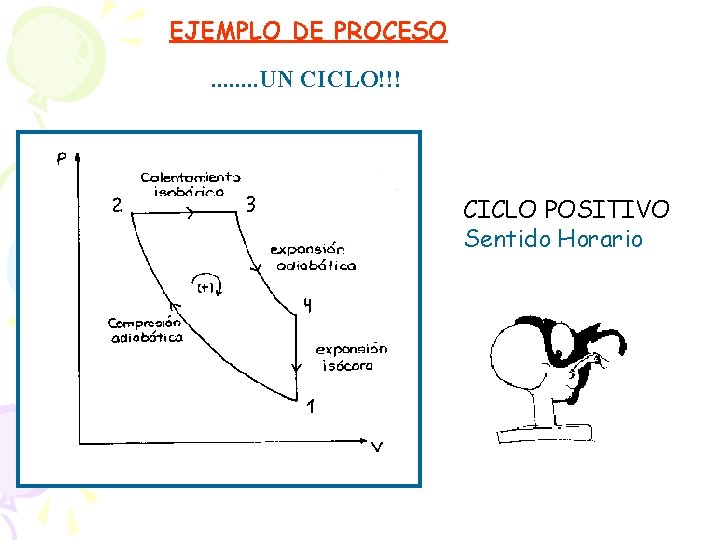
EJEMPLO DE PROCESO. . . . UN CICLO!!! CICLO POSITIVO Sentido Horario

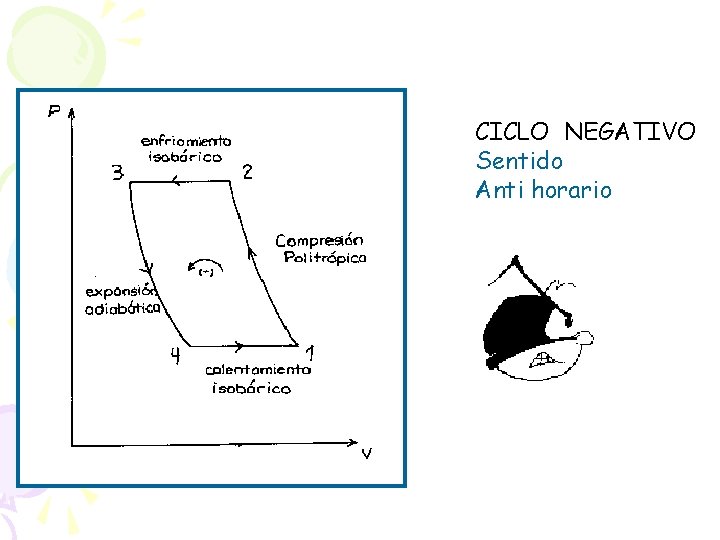
CICLO NEGATIVO Sentido Anti horario

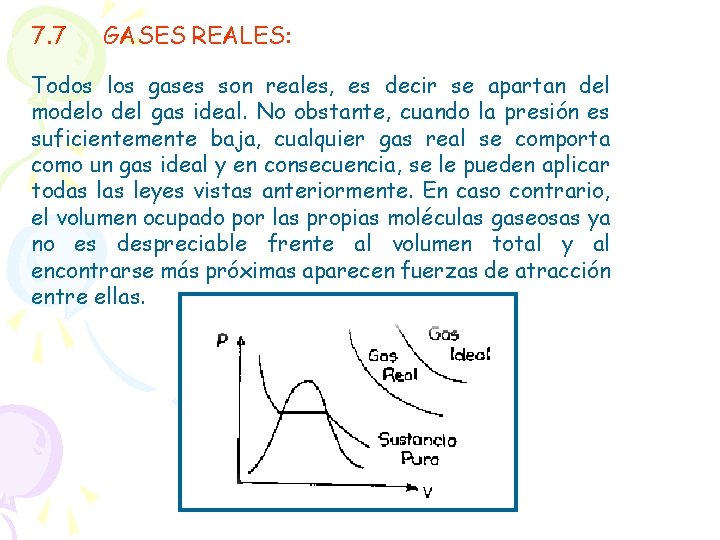
7. 7 GASES REALES: Todos los gases son reales, es decir se apartan del modelo del gas ideal. No obstante, cuando la presión es suficientemente baja, cualquier gas real se comporta como un gas ideal y en consecuencia, se le pueden aplicar todas leyes vistas anteriormente. En caso contrario, el volumen ocupado por las propias moléculas gaseosas ya no es despreciable frente al volumen total y al encontrarse más próximas aparecen fuerzas de atracción entre ellas.

Factor de Compresibilidad: (Z) A un estado de la fase gaseosa de cualquier sustancia, esta tenderá a comportarse como un gas ideal, en la medida de que Z: Si Z está entre 0. 95 y 1. 05 , se puede considerar como un gas ideal, caso contrario es un gas real.

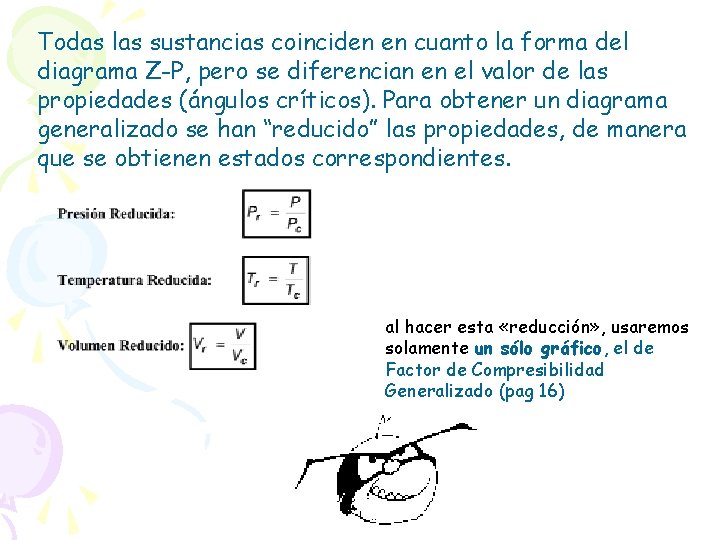
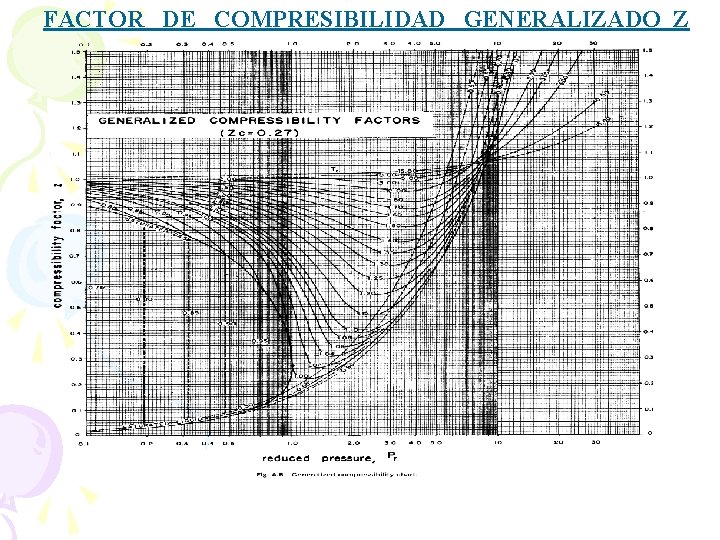
Todas las sustancias coinciden en cuanto la forma del diagrama Z-P, pero se diferencian en el valor de las propiedades (ángulos críticos). Para obtener un diagrama generalizado se han “reducido” las propiedades, de manera que se obtienen estados correspondientes. al hacer esta «reducción» , usaremos solamente un sólo gráfico, el de Factor de Compresibilidad Generalizado (pag 16)


z c = 0. 27 tomaremos. . … el promedio

FACTOR DE COMPRESIBILIDAD GENERALIZADO Z

Ejemplo de gas real: ¿Cuál será la presión del Propano (C 3 H 8), cuando este tiene un volumen específico de 0. 006152 m 3/ kg. y una temperatura de 150°C ? NOTA: Los valores de P c, T c (Tabla A. 7) - Pág. 15

PROBLEMAS-GASES 1. Un tanque rígido que tiene un agujero en la parte superior contiene 0. 5 m 3 de aire a 1 bar y 27°C. Se le enfría hasta una cierta temperatura T 2 y luego se tapa herméticamente el agujero; a continuación se le somete a un calentamiento hasta que la temperatura sea igual a la inicial, observándose que la presión se ha duplicado. Se pide determinar la masa de aire que ingreso (kg) y la temperatura T 2 (°C).

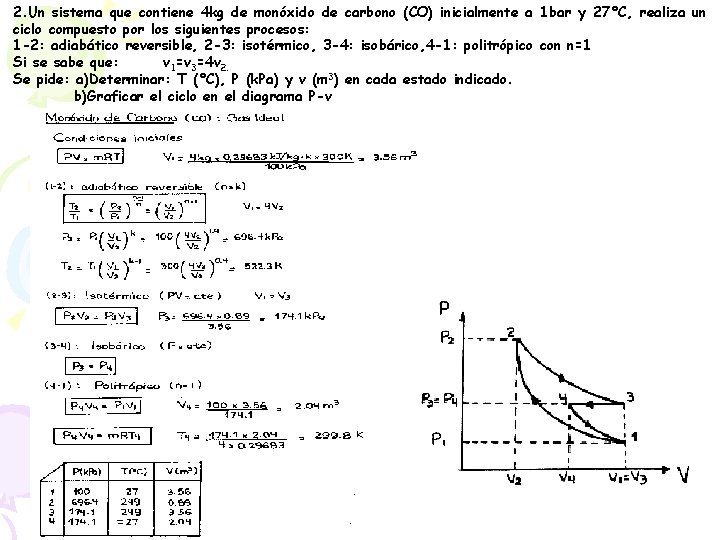
2. Un sistema que contiene 4 kg de monóxido de carbono (CO) inicialmente a 1 bar y 27°C, realiza un ciclo compuesto por los siguientes procesos: 1 -2: adiabático reversible, 2 -3: isotérmico, 3 -4: isobárico, 4 -1: politrópico con n=1 Si se sabe que: v 1=v 3=4 v 2. Se pide: a)Determinar: T (°C), P (k. Pa) y v (m 3) en cada estado indicado. b)Graficar el ciclo en el diagrama P-v

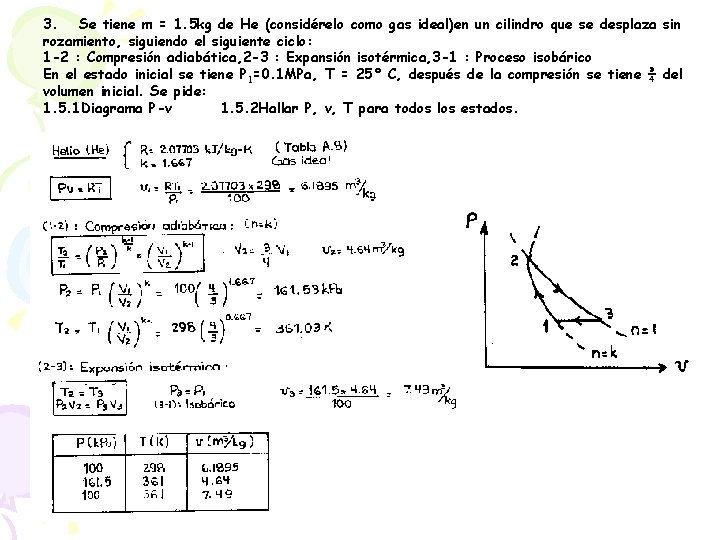
3. Se tiene m = 1. 5 kg de He (considérelo como gas ideal)en un cilindro que se desplaza sin rozamiento, siguiendo el siguiente ciclo: 1 -2 : Compresión adiabática, 2 -3 : Expansión isotérmica, 3 -1 : Proceso isobárico En el estado inicial se tiene P 1=0. 1 MPa, T = 25° C, después de la compresión se tiene ¾ del volumen inicial. Se pide: 1. 5. 1 Diagrama P-v 1. 5. 2 Hallar P, v, T para todos los estados.

4. Dos kg de O 2 (considerado como gas ideal) realiza los siguientes procesos cuasiestáticos reversibles: 1 -2 : compresión politrópica (n=1. 5), 2 -3 : calentamiento isócoro, 3 -4 : calentamiento isobárico, 4 -5 : expansión adiabática, 5 -1 : enfriamiento isobárico Si se sabe que P 1=1 bar, T 1=27°C, P 3=1. 5 P 2 , V 4= 2 V 3 y V 1=9 V 2, se pide: a) Graficar el ciclo en un diagrama P-v, no es necesario indicar valores. b) Determinar la P(bar) y temperatura (°C) en todos los estados. este ciclo positivo puede ser el de un motor a petroleo y gas

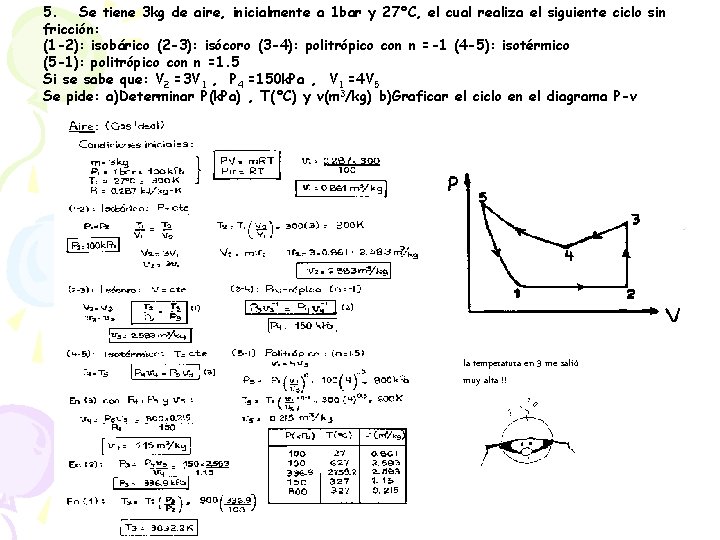
5. Se tiene 3 kg de aire, inicialmente a 1 bar y 27°C, el cual realiza el siguiente ciclo sin fricción: (1 -2): isobárico (2 -3): isócoro (3 -4): politrópico con n =-1 (4 -5): isotérmico (5 -1): politrópico con n =1. 5 Si se sabe que: V 2 =3 V 1 , P 4 =150 k. Pa , V 1 =4 V 5 Se pide: a)Determinar P(k. Pa) , T(°C) y v(m 3/kg) b)Graficar el ciclo en el diagrama P-v la temperatura en 3 me salió muy alta !!

6. Un sistema sigue el proceso cíclico siguiente: 1 -2: calentamiento isócoro 2 -3: enfriamiento isobárico 3 -4: expansión isotérmica 4 -1: proceso isobárico El portador es un gas ideal (Cp=0. 922 k. J/kg-K y Cv=0. 662 k. J/kg-K). Se sabe que P 1=1. 5 bar; v 1=0. 03 m 3/kg; P 2=5 bar; v 4=0. 01 m 3/kg. Se pide: a) Dibujar el diagrama P-v b)Las temperaturas en °C en todos los estados.

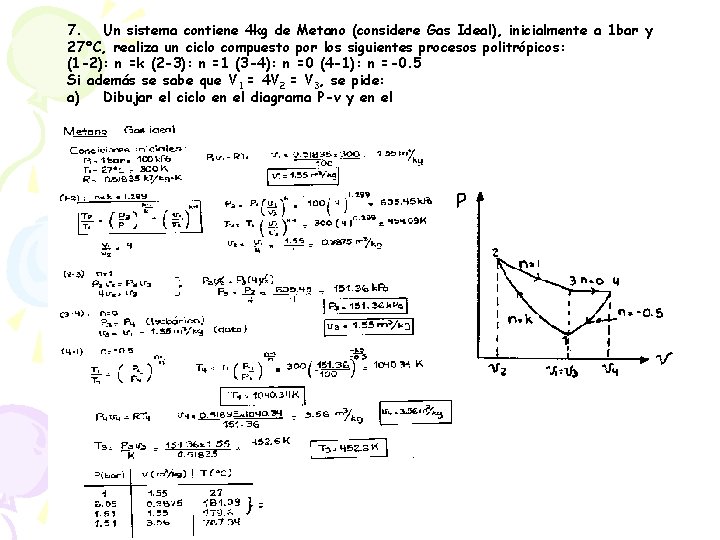
7. Un sistema contiene 4 kg de Metano (considere Gas Ideal), inicialmente a 1 bar y 27°C, realiza un ciclo compuesto por los siguientes procesos politrópicos: (1 -2): n =k (2 -3): n =1 (3 -4): n =0 (4 -1): n =-0. 5 Si además se sabe que V 1 = 4 V 2 = V 3, se pide: a) Dibujar el ciclo en el diagrama P-v y en el

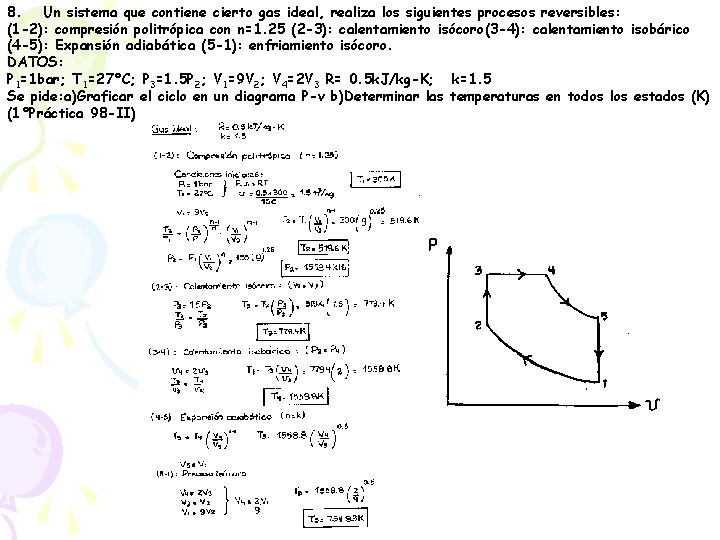
8. Un sistema que contiene cierto gas ideal, realiza los siguientes procesos reversibles: (1 -2): compresión politrópica con n=1. 25 (2 -3): calentamiento isócoro(3 -4): calentamiento isobárico (4 -5): Expansión adiabática (5 -1): enfriamiento isócoro. DATOS: P 1=1 bar; T 1=27°C; P 3=1. 5 P 2; V 1=9 V 2; V 4=2 V 3 R= 0. 5 k. J/kg-K; k=1. 5 Se pide: a)Graficar el ciclo en un diagrama P-v b)Determinar las temperaturas en todos los estados (K) (1°Práctica 98 -II)

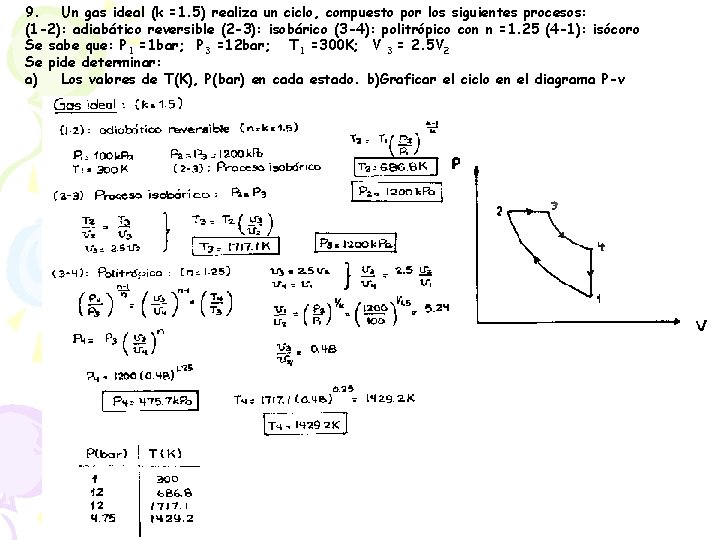
9. Un gas ideal (k =1. 5) realiza un ciclo, compuesto por los siguientes procesos: (1 -2): adiabático reversible (2 -3): isobárico (3 -4): politrópico con n =1. 25 (4 -1): isócoro Se sabe que: P 1 =1 bar; P 3 =12 bar; T 1 =300 K; V 3 = 2. 5 V 2 Se pide determinar: a) Los valores de T(K), P(bar) en cada estado. b)Graficar el ciclo en el diagrama P-v

10. ¿Cuál será la temperatura del Propano, cuando este tiene un volumen específico de 0. 006152 m 3/kg y una presión de 7 MPa? Considere al Propano como gas real. Explique brevemente su procedimiento. para resolver este problema tienes que ir tanteando en la formula y el en diagrama, hasta que coincidan. . . buen provecho

11. Se tiene 2 kg de vapor de agua a 4 MPa y 300°C. Determine el volumen que ocupa el vapor, utilizando: a)Tablas de vapor los resultados son diferentes !!! solo el de gas ideal se dispara un poco. . . tranquilo chico b) Ecuación de estado de los gases ideales c) Factor de compresibilidad generalizado.
 Mmhg a atm
Mmhg a atm Gaseoso
Gaseoso Condiciones normales de un mol de gas
Condiciones normales de un mol de gas Ecuacion de los gases ideales
Ecuacion de los gases ideales Constante de los gases ideales
Constante de los gases ideales Ley combinada de los gases ideales
Ley combinada de los gases ideales Cuales son las leyes de los gases
Cuales son las leyes de los gases Https://slidetodoc.com/captulo-2-o-sudeste-e-o-sul-do/
Https://slidetodoc.com/captulo-2-o-sudeste-e-o-sul-do/ Https://slidetodoc.com/captulo-2-o-sudeste-e-o-sul-do/
Https://slidetodoc.com/captulo-2-o-sudeste-e-o-sul-do/ Introduccin
Introduccin Introduccin
Introduccin Introduccin
Introduccin Induccin
Induccin Que diferencia hay entre filosofia y ciencia
Que diferencia hay entre filosofia y ciencia Introducción de enzimas
Introducción de enzimas Tipos de ideales de weber
Tipos de ideales de weber Fluidos ideales
Fluidos ideales Ideales ja
Ideales ja Voto de fidelidad ala biblia
Voto de fidelidad ala biblia Tipos de ideales de weber
Tipos de ideales de weber Repuesta
Repuesta Tipos de ideales de weber
Tipos de ideales de weber Change of gases
Change of gases Constant specific heats
Constant specific heats List 2 of the important properties of gases
List 2 of the important properties of gases Gases characteristics
Gases characteristics The thin envelope of gases
The thin envelope of gases Stp for gases
Stp for gases Constante universal de los gases
Constante universal de los gases Lei de charles
Lei de charles Equação gases ideais
Equação gases ideais Mendeleev
Mendeleev Alcalosis hipocloremica
Alcalosis hipocloremica Ei wirds
Ei wirds Physical characteristics of gases
Physical characteristics of gases It is a mixture of several gases
It is a mixture of several gases Equação geral dos gases
Equação geral dos gases Venn diagram of solid liquid gas
Venn diagram of solid liquid gas Características de los gases nobles
Características de los gases nobles Fugacity of real gases
Fugacity of real gases Cintico
Cintico Esta compuesto
Esta compuesto Radio atomico
Radio atomico The earthworm
The earthworm Factores que influyen en el comportamiento de un gas
Factores que influyen en el comportamiento de un gas Noble gases bohr diagrams
Noble gases bohr diagrams