Gases Ideais Prof Leonis Loureno Presso Atmosfrica Presso









- Slides: 16

Gases Ideais Prof Leonis Lourenço

Pressão Atmosférica • Pressão Atmosférica

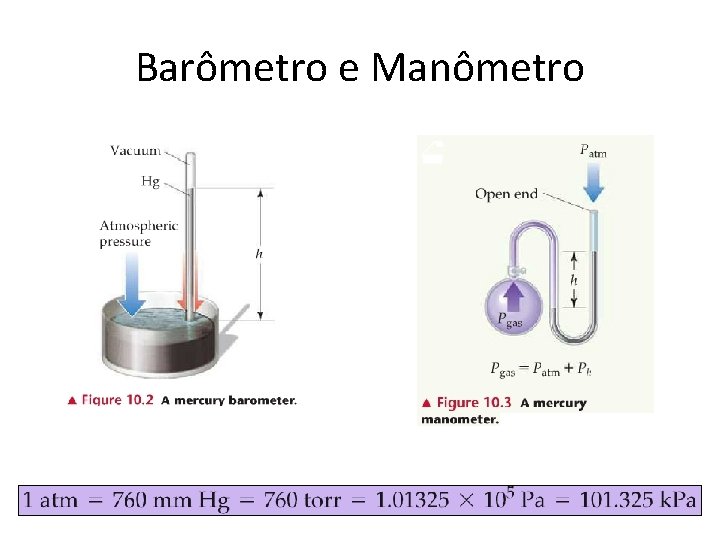
Barômetro e Manômetro

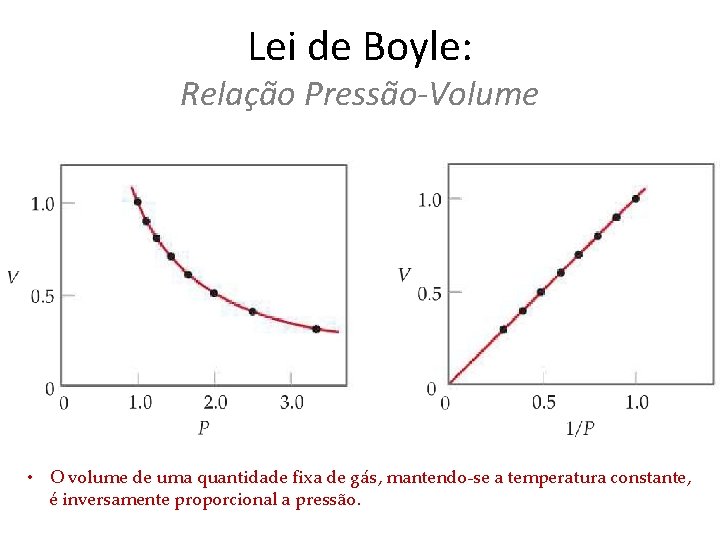
Lei de Boyle: Relação Pressão-Volume ou

Lei de Boyle: Relação Pressão-Volume • O volume de uma quantidade fixa de gás, mantendo-se a temperatura constante, é inversamente proporcional a pressão.

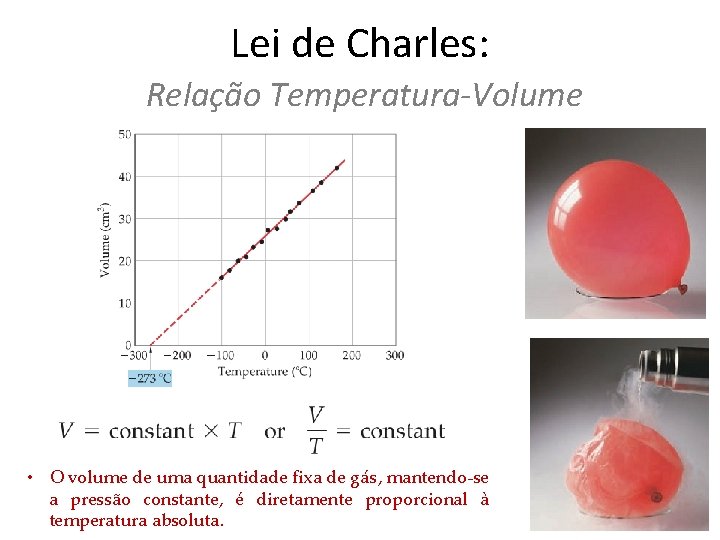
Lei de Charles: Relação Temperatura-Volume • O volume de uma quantidade fixa de gás, mantendo-se a pressão constante, é diretamente proporcional à temperatura absoluta.

Lei de Avogadro: Relação Quantidade-Volume • Iguais volumes de gases, a mesma temperatura e pressão, contém igual número de moléculas.

Equação dos Gases Ideais

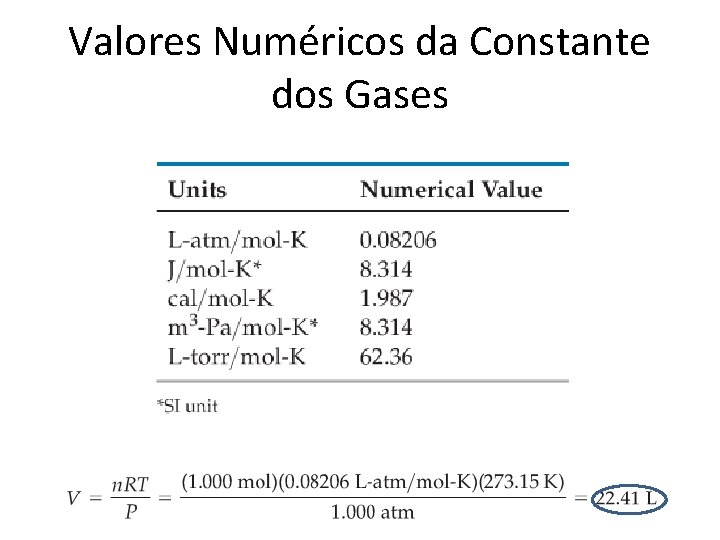
Valores Numéricos da Constante dos Gases

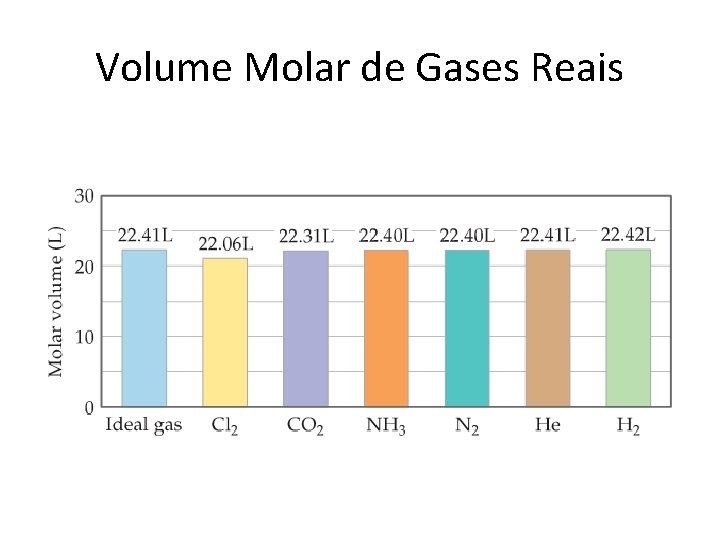
Volume Molar de Gases Reais

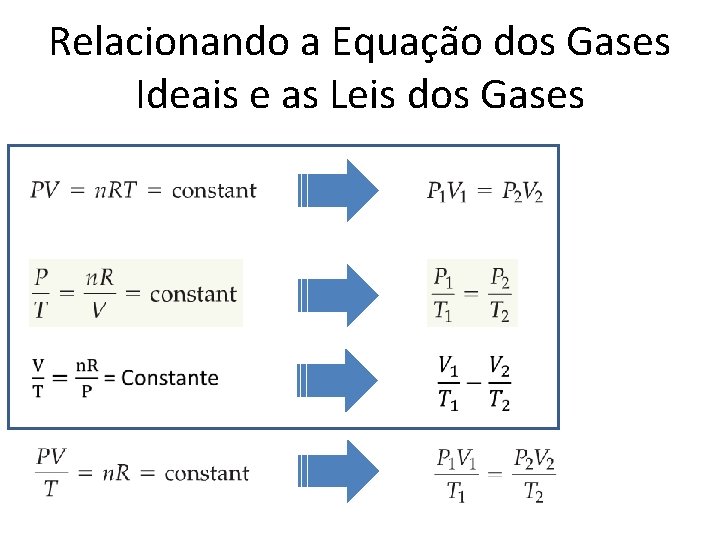
Relacionando a Equação dos Gases Ideais e as Leis dos Gases

Densidade dos gases e Massa Molar • Densidade relativa dos gases

Misturas de Gases Pressões Parciais • Lei de Dalton: A pressão total de uma mistura gasosa é igual a soma das pressões parciais exercidas por cada um dos gases

Misturas de Gases Pressão Parcial e Fração Molar • Lei de Amagat (Volume Parcial) Volume Parcial é o volume que um gás ocuparia se sobre ele estivesse sendo exercida a pressão total da mistura gasosa à mesma temperatura.

Teoria Cinética dos Gases 1. As moléculas dos gases estão em movimento caótico; 2. As interações não são consideradas; 3. As moléculas são consideradas pontuais; 4. As colisões entre as partículas são consideradas perfeitamente elásticas; 5. A energia cinética média das moléculas são proporcionais à temperatura absoluta.

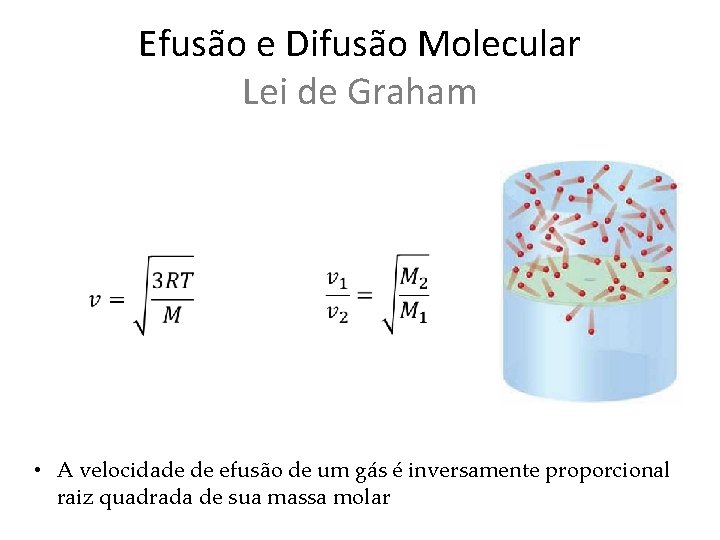
Efusão e Difusão Molecular Lei de Graham • A velocidade de efusão de um gás é inversamente proporcional raiz quadrada de sua massa molar
 Equação gases ideais
Equação gases ideais Equação gases ideais
Equação gases ideais Constante dos gases ideais
Constante dos gases ideais Volume temperatura
Volume temperatura La senna al ponte di iena gauguin
La senna al ponte di iena gauguin Determine as trações t nos fios ideais ab e bc
Determine as trações t nos fios ideais ab e bc Buoyancyability
Buoyancyability Adiabatica
Adiabatica Specific heat of monatomic gas
Specific heat of monatomic gas Which of the following gases will effuse the most rapidly
Which of the following gases will effuse the most rapidly The actual exchange of gases occurs at the site of the *
The actual exchange of gases occurs at the site of the * Plant tissue and organs
Plant tissue and organs Cuales son los gases nobles
Cuales son los gases nobles Ley de dalton
Ley de dalton Manejo de cilindros de gases comprimidos
Manejo de cilindros de gases comprimidos Element boron
Element boron Dosage form meaning
Dosage form meaning