Gases ideais O que um gs Na suco





























- Slides: 34

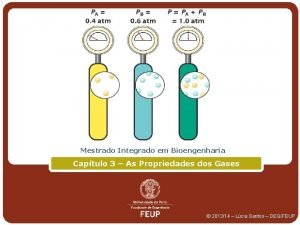
Gases ideais

O que é um gás ?


















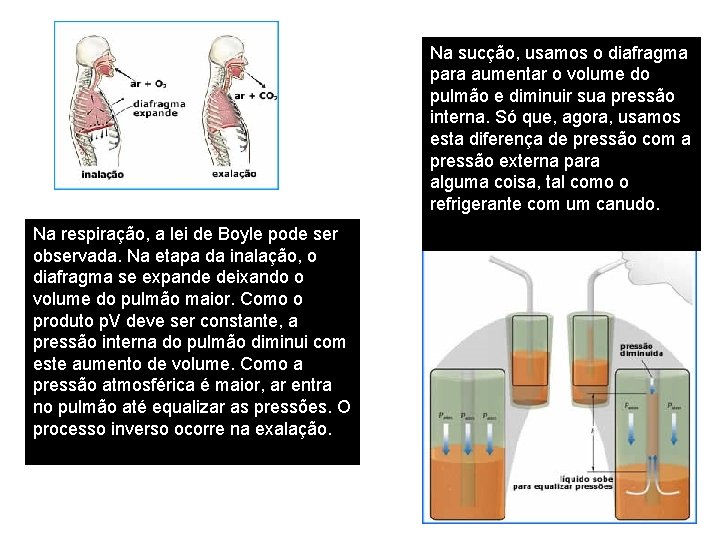
Na sucção, usamos o diafragma para aumentar o volume do pulmão e diminuir sua pressão interna. Só que, agora, usamos esta diferença de pressão com a pressão externa para sugar alguma coisa, tal como o refrigerante com um canudo. Na respiração, a lei de Boyle pode ser observada. Na etapa da inalação, o diafragma se expande deixando o volume do pulmão maior. Como o produto p. V deve ser constante, a pressão interna do pulmão diminui com este aumento de volume. Como a pressão atmosférica é maior, ar entra no pulmão até equalizar as pressões. O processo inverso ocorre na exalação. A isoterma de Boyle também indica que o produto p. V


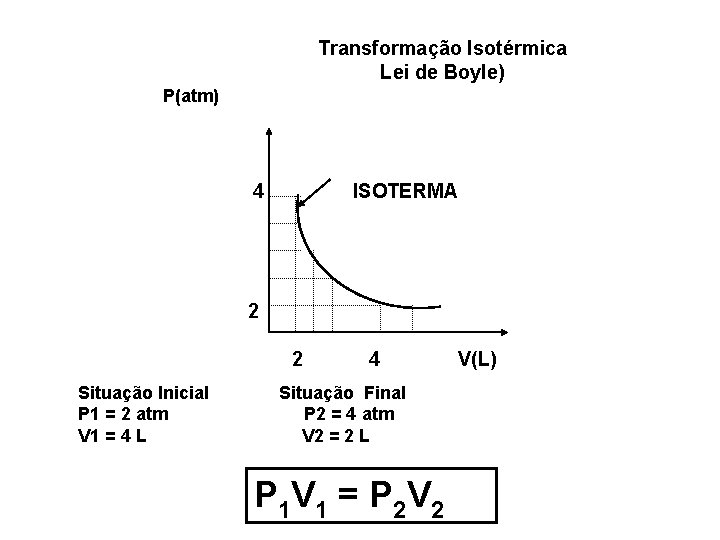
Transformação Isotérmica ( Lei de Boyle) Para uma massa fixa de gás, mantida a temperatura constante, o volume ocupado pelo gás é inversamente proporcional à pressão exercida.

Transformação Isotérmica Lei de Boyle) P(atm) 4 ISOTERMA 2 2 Situação Inicial P 1 = 2 atm V 1 = 4 L 4 Situação Final P 2 = 4 atm V 2 = 2 L P 1 V 1 = P 2 V 2 V(L)




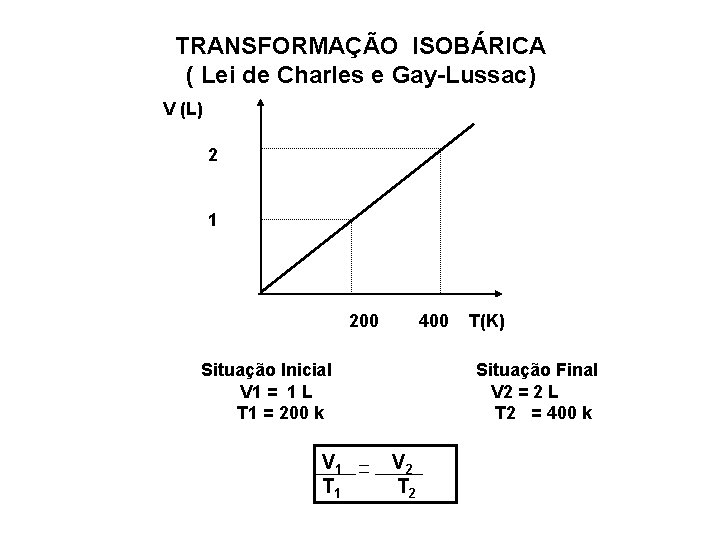
TRANSFORMAÇÃO ISOBÁRICA ( Lei de Charles e Gay-Lussac) Para uma massa fixa de gás mantida a pressão constante, o volume ocupado pelo gás é diretamente proporcional à temperatura absoluta.



TRANSFORMAÇÃO ISOBÁRICA ( Lei de Charles e Gay-Lussac) V (L) 2 1 200 400 Situação Inicial V 1 = 1 L T 1 = 200 k V 1 T(K) Situação Final V 2 = 2 L T 2 = 400 k V 2 T 2

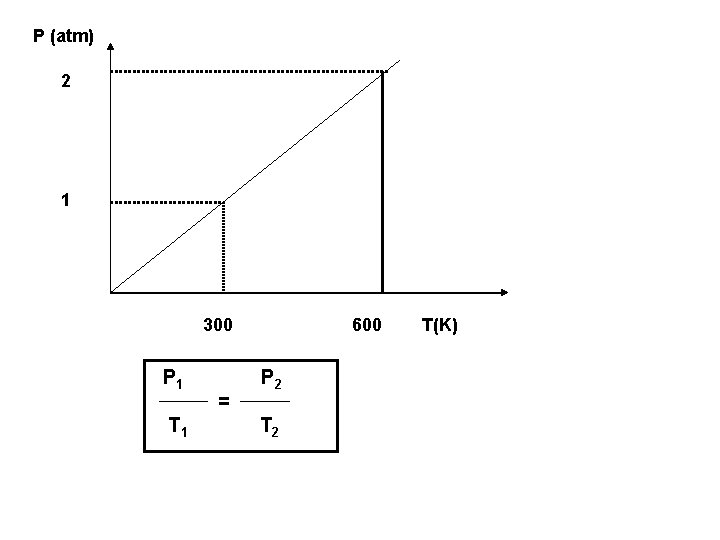
TRANSFORMAÇÃO ISOCÓRICA (ISOMÉTRICA OU ISOVOLUMÉTRICA) Lei de GAY-LUSSAC Para uma massa fixa de gás, mantida a volume constante , a pressão exercida pelo gás é diretamente proporcional à temperatura absoluta.

P (atm) 2 1 300 P 1 T 1 = 600 P 2 T(K)

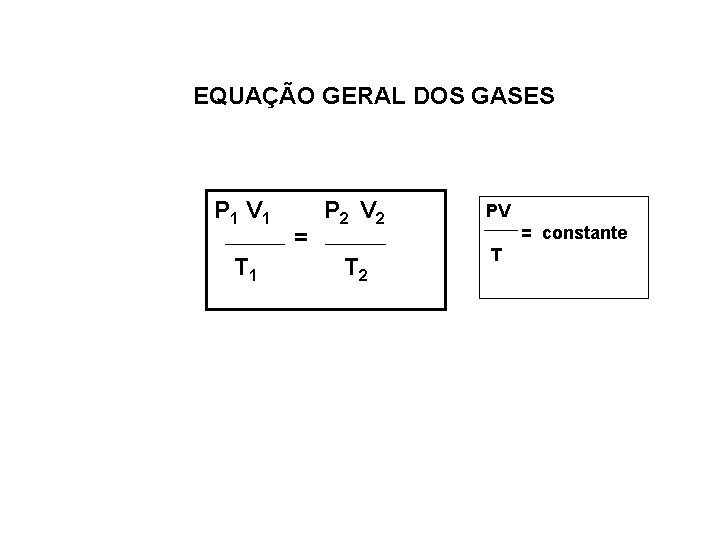
EQUAÇÃO GERAL DOS GASES P 1 V 1 T 1 = P 2 V 2 T 2 PV = constante T

 Equação gases ideais
Equação gases ideais Equação gases ideais
Equação gases ideais Constante dos gases perfeitos
Constante dos gases perfeitos Volume temperatura
Volume temperatura Doze fabricas trabalhando 8 horas por dia
Doze fabricas trabalhando 8 horas por dia Ef07ma08
Ef07ma08 Imagem dupla interpretação
Imagem dupla interpretação Suco enterico
Suco enterico Suco entérico
Suco entérico Determine as trações t nos fios ideais ab e bc
Determine as trações t nos fios ideais ab e bc Variables que afectan el comportamiento de los gases
Variables que afectan el comportamiento de los gases Ley de gases combinados
Ley de gases combinados Mapa conceptual de la ley 031
Mapa conceptual de la ley 031 Ley de dalton
Ley de dalton Eficiencia de carnot
Eficiencia de carnot Where are the noble gases on the periodic table
Where are the noble gases on the periodic table Expansion of solids liquids and gases examples
Expansion of solids liquids and gases examples Periodic table metals nonmetals metalloids noble gases
Periodic table metals nonmetals metalloids noble gases Colour of noble gases
Colour of noble gases Is the greenhouse effect good or bad
Is the greenhouse effect good or bad A gas occupies 473 cm3 at 36°c. find its volume at 94°c
A gas occupies 473 cm3 at 36°c. find its volume at 94°c The atmosphere is a mixture of what
The atmosphere is a mixture of what Buoyancyability
Buoyancyability Gas stoichiometry
Gas stoichiometry Solid liquid gas venn diagram
Solid liquid gas venn diagram Gas exchange lungs
Gas exchange lungs Degree of freedom of gases
Degree of freedom of gases Gases have low densities
Gases have low densities Diffusion of gases across respiratory membranes:
Diffusion of gases across respiratory membranes: Mendeleev
Mendeleev Noble gases configuration
Noble gases configuration Fraccion molar gases
Fraccion molar gases Chapter 11 review gases section 1
Chapter 11 review gases section 1 Chapter 11 review gases section 1
Chapter 11 review gases section 1 20 examples of liquids
20 examples of liquids