APOSTILA 2 MDULO 1 Gases e suas Transformae





















- Slides: 30

APOSTILA 2: MÓDULO 1 Gases e suas Transformaçõe s SITE: WWW. ISRAELAVEIRO. COM

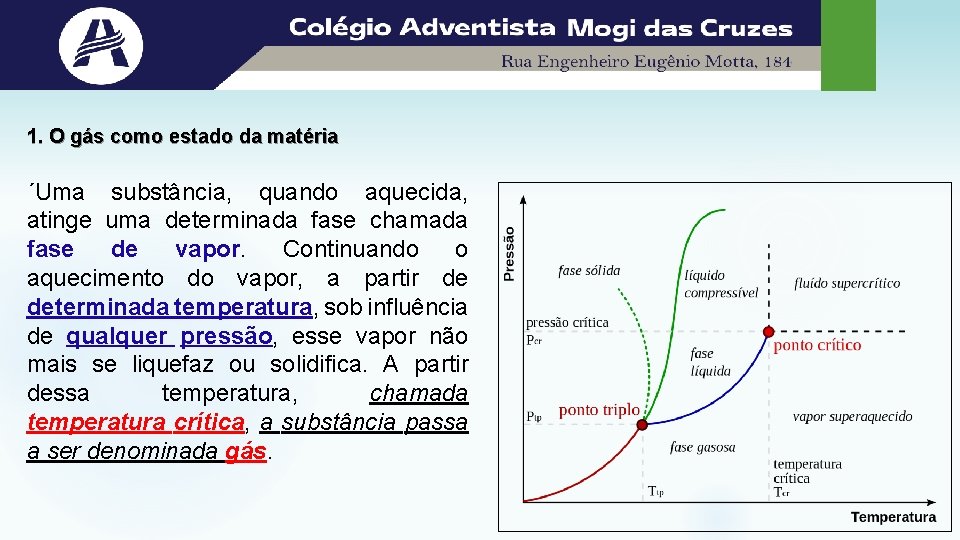
1. O gás como estado da matéria ´Uma substância, quando aquecida, atinge uma determinada fase chamada fase de vapor. Continuando o aquecimento do vapor, a partir de determinada temperatura, sob influência de qualquer pressão, esse vapor não mais se liquefaz ou solidifica. A partir dessa temperatura, chamada temperatura crítica, a substância passa a ser denominada gás.

Postulado da teoria cinética dos gases – Características do Gás Ideal As regras do comportamento dos gases ideais foram estabelecidas por Robert Boyle, Jacques Charles, Joseph Louís Gay-Lussac e Paul Emile Clapeyron, entre os séculos XVII e XIX. Basicamente, consideram-se no gás perfeito as seguintes características: 1) Os gases são formados por partículas chamadas moléculas; 2) As moléculas se encontram em movimento desordenado e obedecem aos princípios fundamentais da mecânica newtoniana; 3) O número total de moléculas é muito grande; 4) O volume de cada molécula é uma fração mínima do volume ocupado pelo gás; 5) Exceto durante as colisões, não agem forças apreciáveis nas moléculas; 6) As colisões são perfeitamente elásticas e de duração desprezível.

Gases Perfeitos O estado de um gás é definido por apenas três variáveis: Volume Pressão Temperatura Relacionadas

Lei Geral dos Gases Sistema termicamente Isolado.

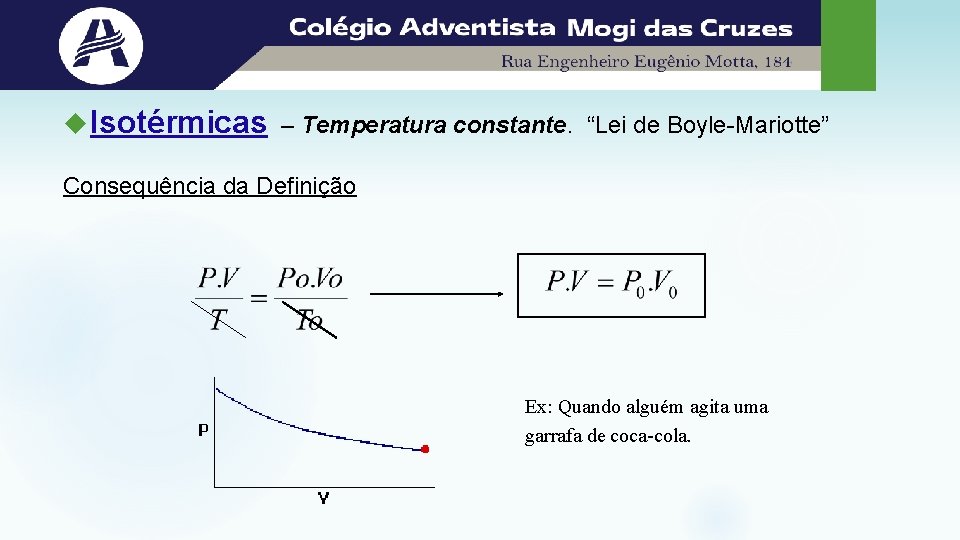
Isotérmicas – Temperatura constante. “Lei de Boyle-Mariotte” Consequência da Definição Ex: Quando alguém agita uma garrafa de coca-cola.

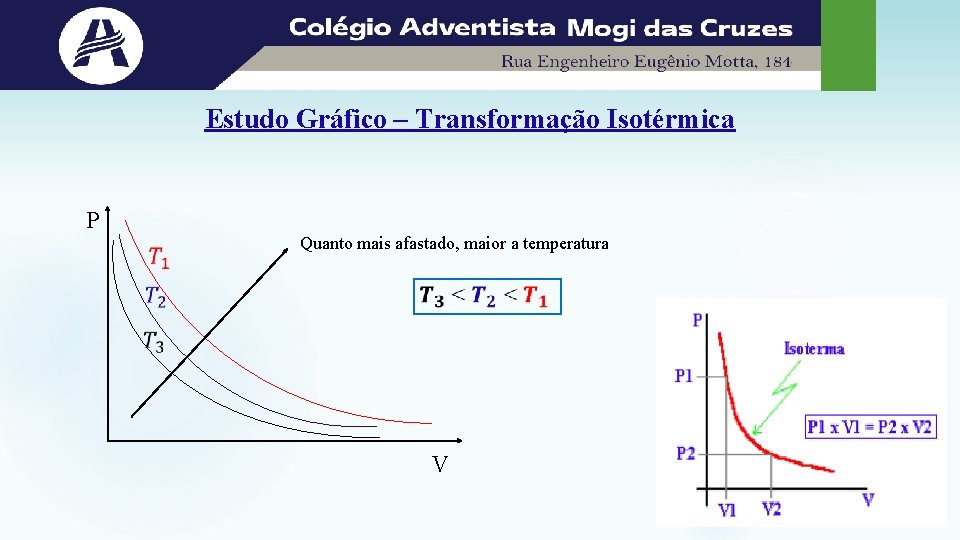
Estudo Gráfico – Transformação Isotérmica P Quanto mais afastado, maior a temperatura V

Isobáricas – Pressão Constante. “Lei de Gay-Lussac” Consequência da Definição Ex: leite fervendo a Pressão normal

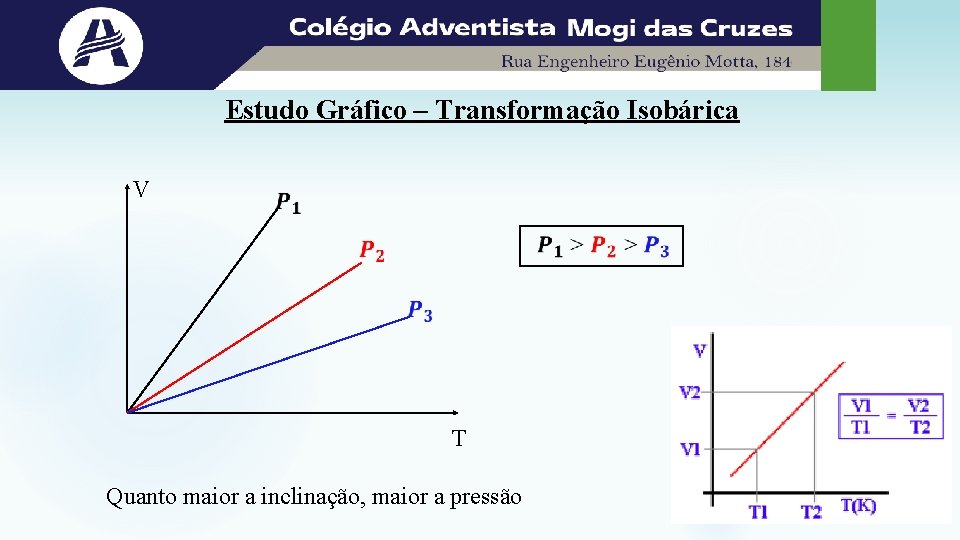
Estudo Gráfico – Transformação Isobárica V T Quanto maior a inclinação, maior a pressão

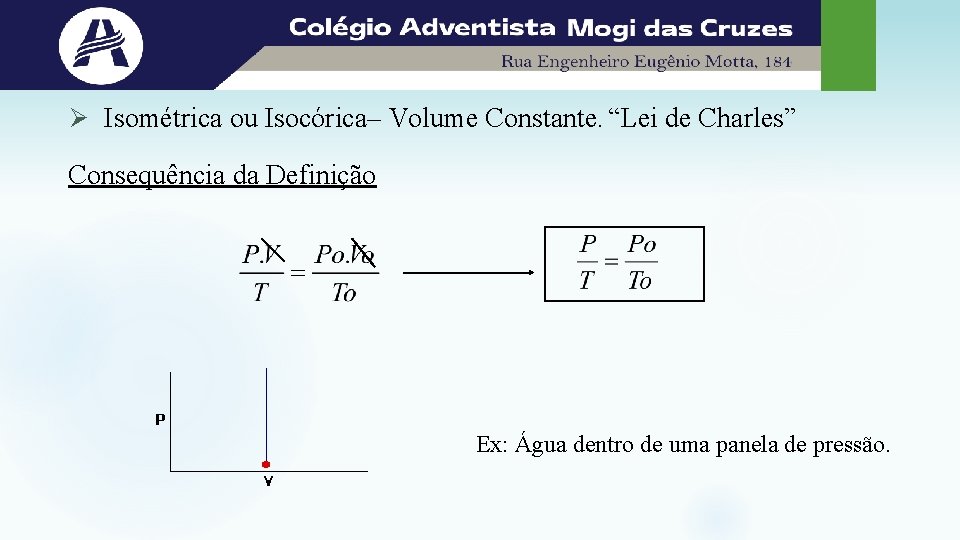
Ø Isométrica ou Isocórica– Volume Constante. “Lei de Charles” Consequência da Definição Ex: Água dentro de uma panela de pressão.

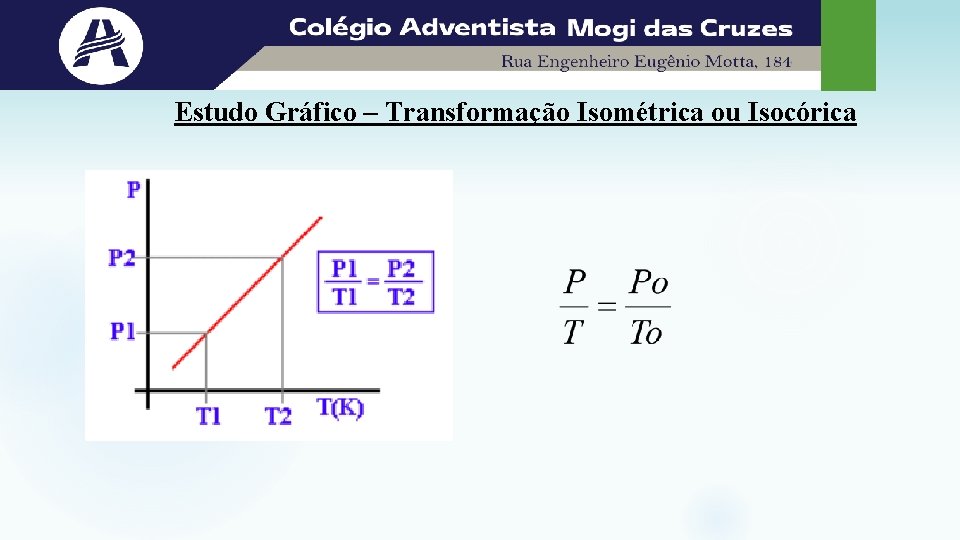
Estudo Gráfico – Transformação Isométrica ou Isocórica

Equação Geral dos Gases Ao relacionar as três transformações gasosas obtemos a equação geral dos gases. Equação de Clapeyron P = Pressão V = Volume n = Nº de mols R = Constante universal dos gases T = Temperatura

Exemplos ¨ 1 (UERJ) – Considere um gás ideal, cujas transformações I, II e III são mostradas no diagrama P x V abaixo. P Essas transformações, I a III, são denominadas, respectivamente, de: T P 1 I P 2 II T III V 1 a) b) c) d) V 2 V adiabática, isocórica, isométrica Isométrica, isotérmica, isobárica Isobárica, isométrica, adiabática. Isométrica, adiabática, isotérmica

2. (Mackenzie-SP) Um recipiente de volume V, totalmente fechado, contém 1 mol de um gás ideal, sob pressão p. A temperatura absoluta do gás é T e a constante universal dos gases perfeitos é: Se esse gás é submetido a uma transformação isotérmica, cujo gráfico está representado abaixo, podemos afirmar que a pressão no instante em que ele ocupa o volume de 32, 8 litros, é: P(atm) a) b) c) d) e) 4, 0 47ºC 32, 8 V(litro) 0, 1175 atm 0, 5875 atm 0, 80 atm 1, 175 atm 1, 33 atm Dados Resolução

3. (UNOPAR-PR) Um sistema gasoso ideal está, inicialmente, sob pressão p e ocupa um volume V à temperatura T. Ao sofrer um aquecimento, sua pressão duplica e sua temperatura triplica. Seu novo volume passa a ser: a) 3 V b) 2 V c) 3 V/2 d) 2 V/3 e) V/2 Estado inicial Pressão = p Volume = V Temperatura = T Estado Final Pressão = 2 p Temperatura = 3 T V=? Resolução

4. (MACKENZIE-SP) Certa massa de gás perfeito sofre uma transformação de maneira que seu volume aumenta 20% e sua temperatura absoluta diminui de 40%. Terminada essa transformação, a pressão do gás será: a) 50% maior que a inicial. b) 50% menor que a inicial c) 30% maior que a inicial Admitindo Po = 100 atm Vo = 100 l To = 100 K Então P=? V = 120 l T = 60 K d) 30% menor que a inicial e) Igual a inicial. Diminuiu 50% logo 50% menor que a inicial de 100 %

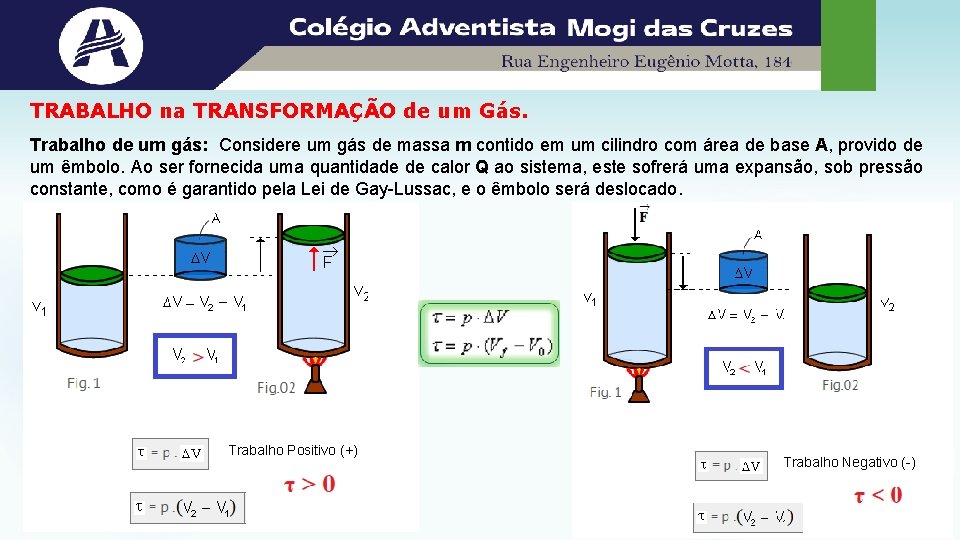
TRABALHO na TRANSFORMAÇÃO de um Gás. Trabalho de um gás: Considere um gás de massa m contido em um cilindro com área de base A, provido de um êmbolo. Ao ser fornecida uma quantidade de calor Q ao sistema, este sofrerá uma expansão, sob pressão constante, como é garantido pela Lei de Gay-Lussac, e o êmbolo será deslocado. Trabalho Positivo (+) Trabalho Negativo (-)

Trabalho Positivo (+) Trabalho Negativo (-)

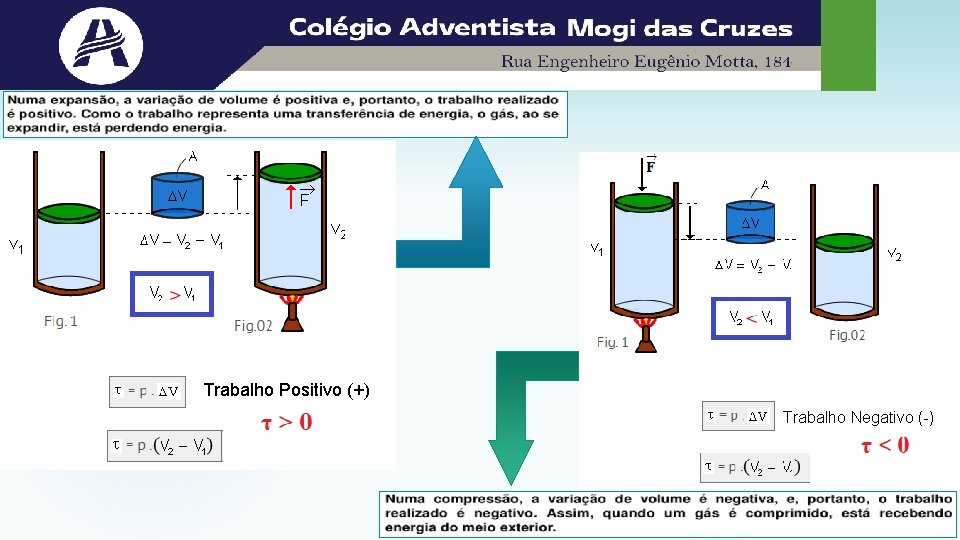
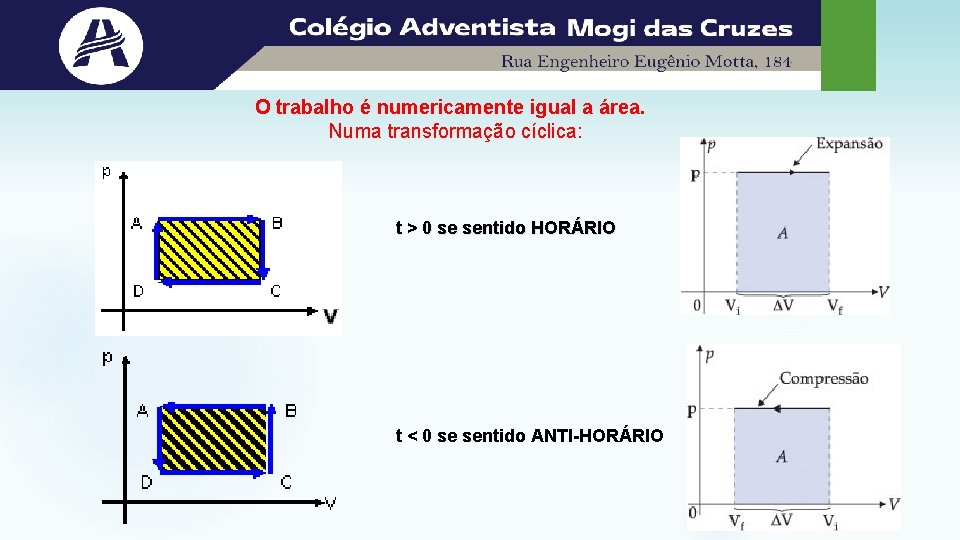
Assim, o trabalho realizado por um sistema, em uma transformação com pressão constante, é dado pelo produto entre a pressão e a variação do volume do gás. Quando: • o volume aumenta no sistema, o trabalho é positivo, ou seja, é realizado sobre o meio em que se encontra (como por exemplo empurrando o êmbolo contra seu próprio peso); • o volume diminui no sistema, o trabalho é negativo, ou seja, é necessário que o sistema receba um trabalho do meio externo; • o volume não é alterado, não há realização de trabalho pelo sistema. O trabalho é numericamente igual a área. Numa transformação cíclica: τ = p. ΔV

O trabalho é numericamente igual a área. Numa transformação cíclica: t > 0 se sentido HORÁRIO t < 0 se sentido ANTI-HORÁRIO

Resolução de Exercício Exemplo: 01) Um gás ideal de volume 12 m³ sofre uma transformação, permanecendo sob pressão constante igual a 250 Pa. Qual é o volume do gás quando o trabalho realizado por ele for 2 k. J? Solução: Sendo 1 k. J = 1000 J então: 2 k. J = 2000 J τ = 2000 J p = 250 Pa Vi = 12 m³ Vf = ? τ = p. ΔV τ = p. (Vf – Vi) 2000 = 250. ( Vf – 12 ) 2000 = ( Vf – 12 ) 250 8 + 12 = Vf Vf = 20 m³

Apostila 2 – Módulo 1 / página 17 – Exercício: 20 20. (Unicamp-SP) O aperfeiçoamento da máquina a vapor ao longo do século XVIII, que atingiu o ápice com o trabalho de James Watt, permitiu a mecanização do modo de produção, desempenhando papel decisivo na revolução industrial. A figura abaixo mostra o diagrama de pressão P versus volume V do cilindro de uma máquina a vapor contendo 1, 0 mol de água. Os diferentes trechos do gráfico referem-se a: q 1 → 2: água líquida é bombeada até a pressão P 2; q 2 → 3: a temperatura da água é aumentada pela caldeira a pressão constante; q 3 → 4: a água é vaporizada a pressão e temperatura constantes (T 3 = 400 K); q 4 → 5: o vapor é aquecido a pressão constante, expandindo de V 4 a V 5; q 5 → 6: o vapor sofre expansão sem troca de calor, fazendo com que a temperatura e a pressão sejam reduzidos; q 6 → 1: o vapor é condensado com a retirada de calor do cilindro a pressão constante.

Apostila 2 – Módulo 1 / página 17 – Exercício: 20 20. (Unicamp-SP) SOLUÇÃO: a) No ponto 5 o vapor d'água se comporta como um gás ideal. Encontre a temperatura do vapor neste ponto. A constante universal dos gases é R = 8, 3 J/mol. K b) Calcule o trabalho realizado pelo vapor d'água no trecho de 4 → 5

Apostila 2 – Módulo 1 / página 17 – Exercício: 20 20. (Unicamp-SP) b) Calcule o trabalho realizado pelo vapor d'água no trecho de 4 → 5

Apostila 2 – Módulo 1 / página 12 – Exercício: 05 05) Dado o gráfico da pressão versus volume para uma transformação gasosa, indo do estado inicial A para o estado final B, conclui-se que o trabalho envolvido no processo: Solução: τ = ρ. ΔV τ = (ρA. VA) – (ρB. VB) a) foi recebido pelo sistema e é numericamente menor que 10, 5 J. b) foi cedido pelo sistema e é numericamente maior que – 10, 5 J. c) foi realizado sobre o sistema e é numericamente igual a – 10, 5 J. d) foi realizado pelo sistema e é numericamente maior que 10, 5 J. e) foi resistente recebido pelo sistema e de módulo menor que 10, 5 J. τ = 1. 8, 5 - 10. 1, 5 τ = 8, 5 – 15 τ = | - 6, 5 | τ = 6, 5 J

Apostila 2 – Módulo 1 / página 13 – Exercício: 02 02) No alto de uma montanha a 8°C, um cilindro munido de um Êmbolo móvel de peso desprezível possui 1 litro de ar no seu interior. Ao levá-lo ao pé da montanha, cuja pressão é de 1 atm, o volume do cilindro se reduz a 900 cm 3 e sua temperatura se eleva em 6°C. A pressão no alto da montanha é aproximadamente em atm, de? Solução: a) 0, 66 b) 0, 77 c) 0, 88 d) 0, 99 e) 1, 08

Apostila 2 – Módulo 1 / página 15 – Exercício: 08 08) (UERJ 2012) Em um reator nuclear, a energia liberada na fissão de 1 g de urânio é utilizada para evaporar a quantidade de 3, 6 x 104 kg de água a 227 o. C e sob 30 atm, necessária para movimentar uma turbina geradora de energia elétrica. Admita que o vapor d’água apresenta comportamento de gás ideal. O volume de vapor d’água, em litros, gerado a partir da fissão de 1 g de urânio, corresponde a: a) 1, 32 x 105 b) 2, 67 x 106 c) 3, 24 x 107 d) 7, 42 x 108 Solução:

Apostila 2 – Módulo 1 / página 15 – Exercício: 10 10) Um gás em uma câmara fechada passa pelo ciclo termodinâmico representado no diagrama p x V a seguir: Solução: o trabalho realizado por um sistema, é representado pela multiplicação da pressão e do volume, como mostra a seguir: τ = p. v analisando o gráfico p x v, podemos dizer que o trabalho realizado por esse gás é igual a área formada pela curva do gráfico, logo: τ = área τ = (4 - 1). (30 - 10)/2 o trabalho, em joules, realizado durante um ciclo é: τ = 3. 20 / 2 τ = 3. 10 a) + 30 j τ = 30 J b) 90 j Em um ciclo fechado o trabalho é numericamente igual à c) + 90 j área da figura. Seu valor é negativo devido ao sentido d) - 60 j anti-horário, então τ = - 30 J e) - 30 j

Apostila 2 – Módulo 1 / página 16 – Exercício: 15 15) (UERJ) Um professor realizou com seus alunos o seguinte experimento para observar fenômenos térmicos: - colocou, inicialmente, uma quantidade de gás ideal em um recipiente adiabático; - comprimiu isotermicamente o gás à temperatura de 27 o. C, até a pressão de 2, 0 atm; - liberou, em seguida, a metade do gás do recipiente; - verificou, mantendo o volume constante, a nova temperatura de equilíbrio, igual a 7 o. C. Calcule a pressão do gás no recipiente ao final do experimento. Dados: Solução:

Apostila 2 – Módulo 1 RESOLUÇÃO DE EXERCICIOS Apostila 2 – Módulo 1 / Página 11 à 13 >> Ex. : 01; 02; 03; 04; 06; 07; 08; 09 e 10 (B); (C); (D); (C); (B); (E); (D) Apostila 2 – Módulo 1 / Página 13 à 17 >> Ex. : 01; 02; 05; 06; 08; 09; 10; 11; 13; 15; 16 ; 18 (A); (C); (B); (E); (D); (C); (0, 93); (C) Site: www. israelaveiro. com