Gases Ideales Leyes de los Gases Ideales Permiten


















- Slides: 19

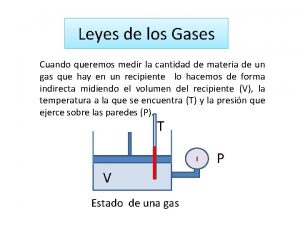
Gases Ideales

Leyes de los Gases Ideales: Permiten relacionar dos o tres variables para un gas ideal, cuando modificamos algunas condiciones.

Ecuación general de los Gases: P. V = n. R. T n Permite relacionar las variables del estado gaseoso para un gas en un “estado” o instante. n Las unidades de las variables están determinadas por la constante de los gases: R

Pero … Ni la Ecuación General de los Gases ni las Leyes de los Gases Ideales … permiten comprender porqué los gases tienen ese determinado comportamiento.

Preguntas como … • ¿Por qué el aumento del volumen es inversamente proporcional a la presión? • ¿Por qué la presión de un gas aumenta de forma directamente proporcional con la T (K)?

TEORÍA CINÉTICO MOLECULAR Es un modelo “que permite visualizar y comprender los sucedido en un gas cuando cambian las condiciones experimentales. ”

Desarrollada a lo largo del siglo XIX por los físicos Maxwell – Boltzman y culminada por Rudolf Claussius en 1857

Postulados Los gases poseen una estructura discontinua, por lo tanto … … están formados por partículas.

Partículas se encuentran en continuo movimiento “caótico” Las colisiones de las partículas son perfectamente “elásticas”. Es decir durante las colisiones no hay pérdida de energía.

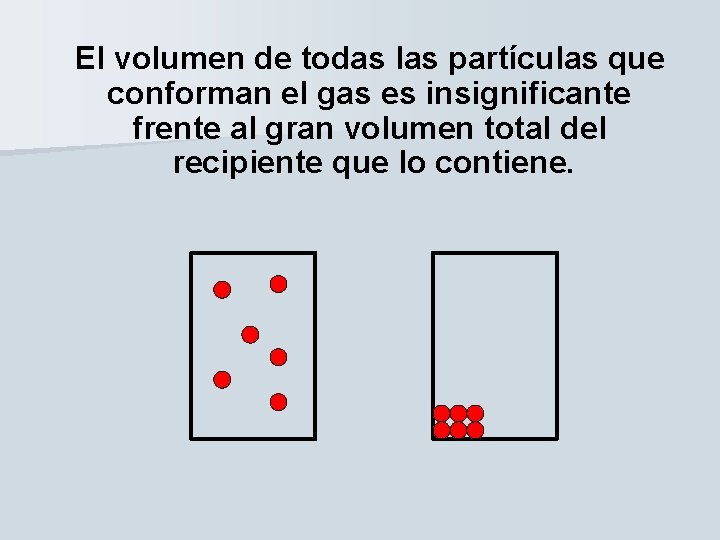
El volumen de todas las partículas que conforman el gas es insignificante frente al gran volumen total del recipiente que lo contiene.

Las fuerzas de atracción y repulsión entre partículas son insignificantes. La energía cinética promedio de las partículas es directamente proporcional a la temperatura absoluta.

LUEGO… * Las partículas chocan entre sí y con las paredes del recipiente. * Al no existir pérdida de energía, la temperatura de un gas es constante a lo largo del tiempo. * El E volumen de un gas es el volumen del sistema que lo contiene.

* El movimiento de las partículas es independiente de la presencia cercana de otras partículas del mismo u otro gas. * Al aumentar la T, se incrementa la Ec de las partículas en la misma

Variables de los gases y la teoría cinética molecular Presión de un gas “Es causada por el choque de las partículas contra las paredes del recipiente. ” Depende de la frecuencia y la fuerza de los choques.

La temperatura absoluta de un gas “Es una medida del contenido energético cinético promedio de las partículas” Al aumentar la T, aumenta de forma directamente proporcional la energía cinética y viceversa.

El volumen de las partículas de un gas es completamente insignificante, por lo tanto las partículas de un gas son puntuales.

Aplicación de la Teoría cinético Molecular a las Leyes de los Gases. Ley de Boyle: La presión ejercida por un gas es consecuencia del impacto de sus partículas con las paredes del recipiente. La frecuencia y número de las colisiones de las partículas con las paredes es directamente proporcional a la densidad (número de moléculas por unidad de volumen) del gas.

Aplicación de la Teoría cinético Molecular a las Leyes de los Gases. Ley de Boyle: por lo tanto al disminuir el volumen de una cierta cantidad de gas, aumenta la densidad numérica y por lo tanto la frecuencia de las colisiones, por ello la P de un gas aumenta.

Ley de Charles – Gau Lussac: Debido a que la energía cinética promedio de las partículas es directamente proporcional a la T, un aumento de la T, incrementa la Ec promedio, provocando que las partículas choquen con mayor fuerza contra las paredes del recipiente; entonces la P aumenta.
 Formula de gases ideales
Formula de gases ideales Cte
Cte Ley combinada de los gases formula
Ley combinada de los gases formula Que es el comportamiento de los gases
Que es el comportamiento de los gases Constante de los gases
Constante de los gases Ley de charles
Ley de charles Isomasico
Isomasico P * v = n * r * t
P * v = n * r * t Postulados de la teoría cinética de los gases
Postulados de la teoría cinética de los gases Los ideales del club de conquistadores
Los ideales del club de conquistadores Los factores que afectan el comportamiento de los gases son
Los factores que afectan el comportamiento de los gases son Ejemplos de rasgos fonéticos
Ejemplos de rasgos fonéticos El conjunto de saberes que permiten fabricar objetos
El conjunto de saberes que permiten fabricar objetos Tipos de ideales de weber
Tipos de ideales de weber Ideales ja
Ideales ja Tipos de ideales de weber
Tipos de ideales de weber Sociologia interpretativa max weber
Sociologia interpretativa max weber Fluidos reales e ideales
Fluidos reales e ideales Filtros ideales
Filtros ideales Levítico 26:3-13
Levítico 26:3-13