INTRODUCCIN A LOS MTODOS PTICOS DE ANLISIS Qumica






















- Slides: 57

INTRODUCCIÓN A LOS MÉTODOS ÓPTICOS DE ANÁLISIS Química Analítica General e Instrumental

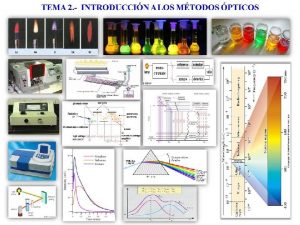
Los métodos ópticos de análisis cubren un amplio campo de aplicación, incluyéndose bajo su denominación todos aquellos que implican la medida de la radiación electromagnética emitida por la materia o que interacciona con ella. Actualmente el uso de métodos espectroscópicos está generalizado, debido a su rapidez, a la gran gama de instrumentación disponible y sus grandes posibilidades de automatización.

Interacción entre la Radiación Electromagnética (REM) y la Materia La REM posee una doble condición con sus propiedades respectivas: es una onda en cuanto a su transmisión y es partícula (Fotón) en cuanto tiene una energía asociada. Las Propiedades de onda nos permite seguir su movimiento y podemos ver como se transmite, si es reflejada, si cambia de dirección o refractada, si es interferida si se produce un dispersión anómala o “scattering” o si es polarizada. Las propiedades de partícula nos indica cual es su energía con la que puede interaccionar con la materia.

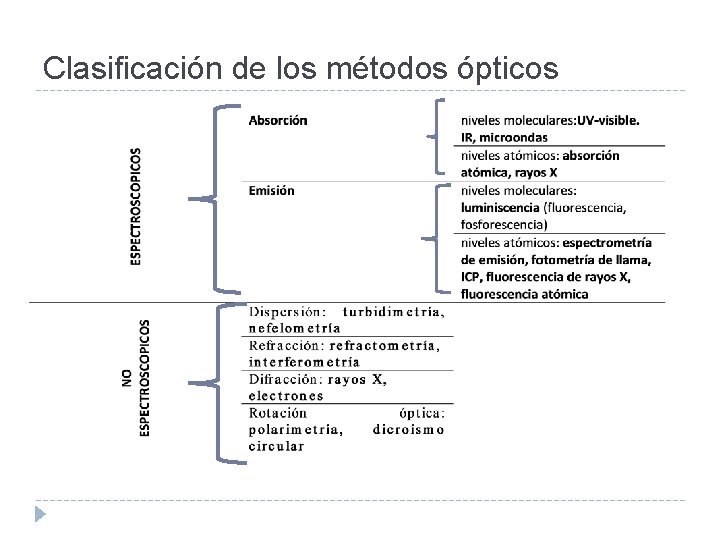
Clasificación de los métodos ópticos Es posible clasificar los métodos ópticos en espectroscópico s y no espectroscópico s. Métodos espectroscópicos, son aquellos en los que existe intercambio de energía entre la radiación electromagnética y la materia. En estos métodos se miden espectros, siendo éstos debidos a transiciones entre distintos niveles energéticos. Se basan en procesos de absorción y emisión, y las transiciones entre distintos niveles energéticos pueden tener lugar a nivel atómico o molecular.

Clasificación de los métodos ópticos

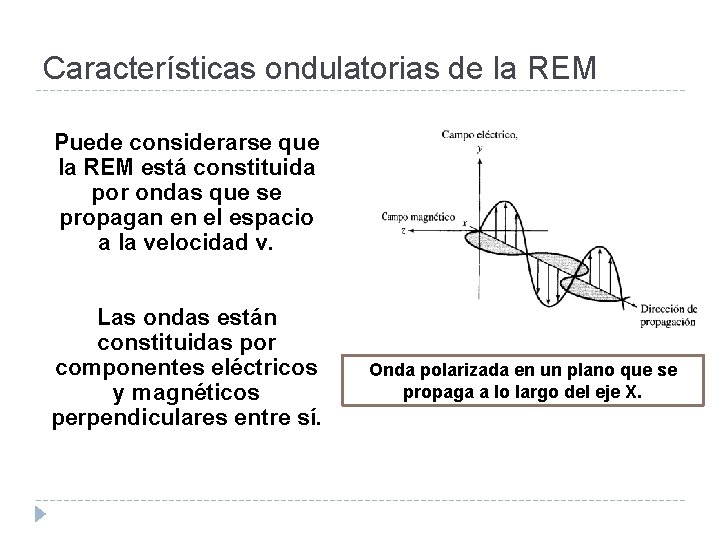
Características ondulatorias de la REM Puede considerarse que la REM está constituida por ondas que se propagan en el espacio a la velocidad v. Las ondas están constituidas por componentes eléctricos y magnéticos perpendiculares entre sí. Onda polarizada en un plano que se propaga a lo largo del eje X.

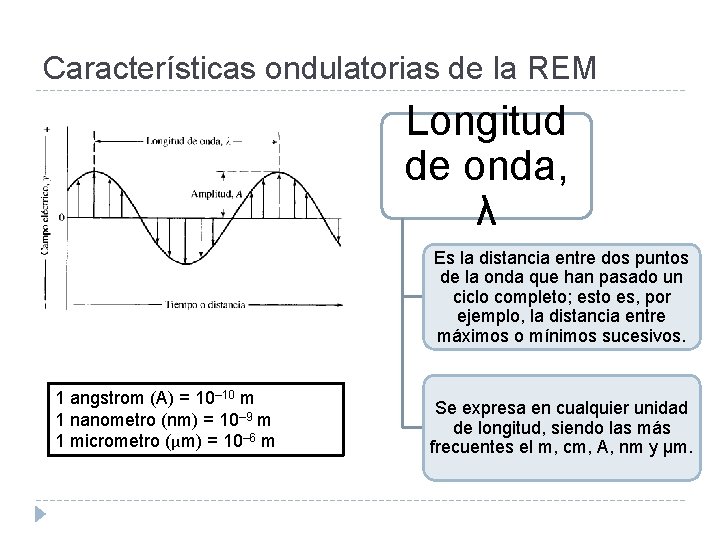
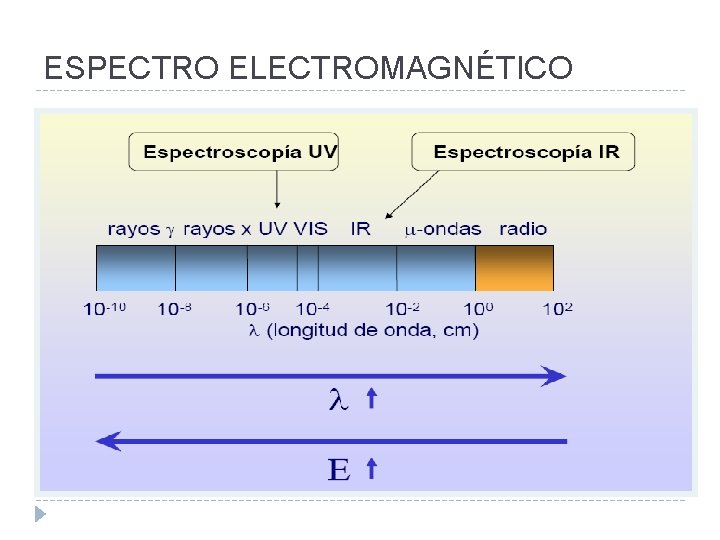
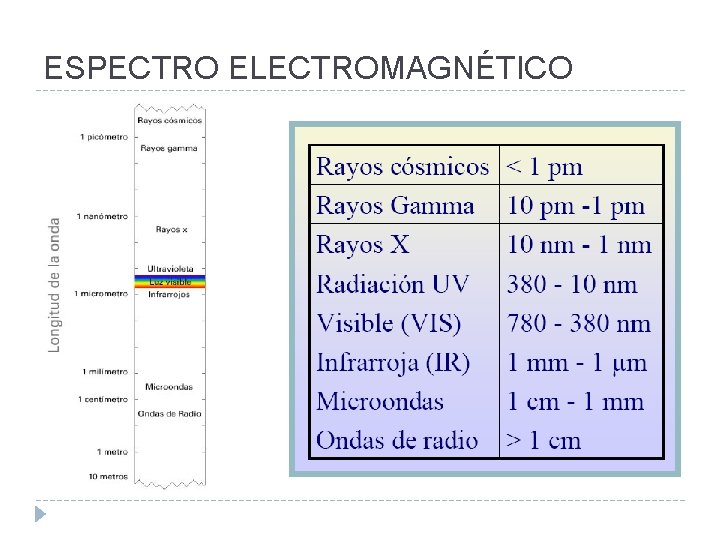
Características ondulatorias de la REM Longitud de onda, λ Es la distancia entre dos puntos de la onda que han pasado un ciclo completo; esto es, por ejemplo, la distancia entre máximos o mínimos sucesivos. 1 angstrom (A) = 10– 10 m 1 nanometro (nm) = 10– 9 m 1 micrometro (μm) = 10– 6 m Se expresa en cualquier unidad de longitud, siendo las más frecuentes el m, cm, A, nm y µm.

Características ondulatorias de la REM Frecuencia, ν Es el número de ciclos por unidad de tiempo. Veces que pasa por un determinado punto en 1 seg. La unidad de frecuencia es el segundo recíproco, s– 1 o hertz (Hz) Número de onda, Se define como la inversa de la longitud de onda. Su unidad más utilizada es el cm– 1.

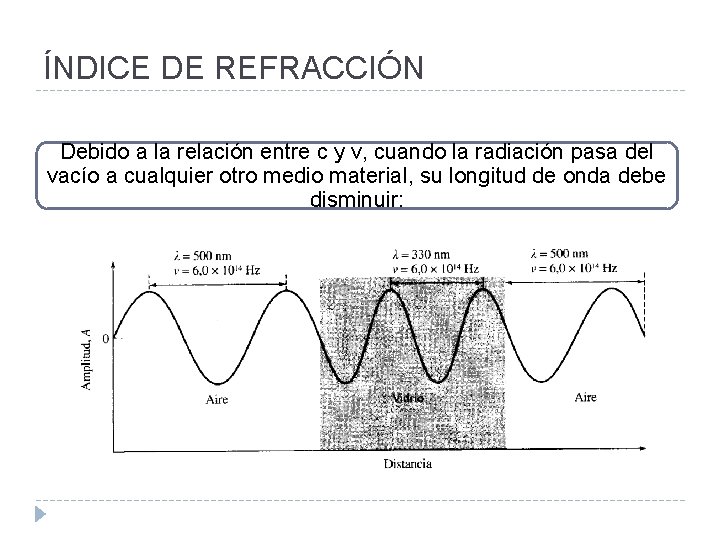
Características ondulatorias de la REM v La relación entre los parámetros mencionados es: Donde v= velocidad de propagación de la onda. v En el vacío la velocidad de propagación alcanza su máximo valor, que es de 2. 9979 x 1010 cm. s-1 v En cualquier medio distinto del vacío, la velocidad de propagación, v, es menor que c. v Su cociente se denomina índice de refracción, n v

ÍNDICE DE REFRACCIÓN Debido a la relación entre c y v, cuando la radiación pasa del vacío a cualquier otro medio material, su longitud de onda debe disminuir:

Propiedades corpusculares de la radiación Para describir cuantitativamente determinadas interacciones con la materia se hace necesario considerar a la REM como un flujo de partículas o corpúsculos, llamados fotones. La energía del fotón es proporcional a la frecuencia de la radiación (relación de Einstein–Planck): donde h es la constante de Planck (6. 63 x 10– 34 J. s).

ESPECTRO ELECTROMAGNÉTICO

ESPECTRO ELECTROMAGNÉTICO

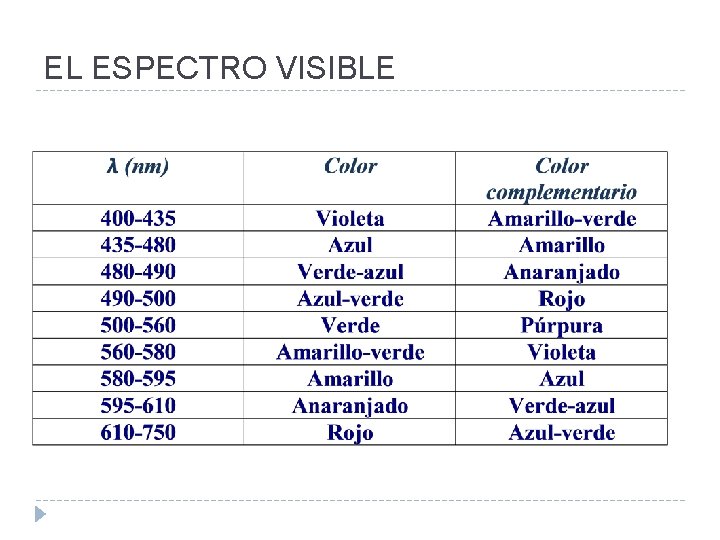
EL ESPECTRO VISIBLE Las λ asociadas con la luz visible son capaces de afectar la retina del ojo humano, creando la impresión subjetiva de la visión y el color. Nosotros “vemos” los objetos por medio de la luz que ellos emiten o reflejan. Cuando la “luz blanca” (que contiene todas longitudes de onda) pasa a través de un objeto que es transparente a ciertas λ, pero que absorbe otras, el medio aparece coloreado. Dado que sólo las λ transmitidas llegan al ojo, éstas indican el color del objeto. Este color es complementario a la luz que absorbe el objeto.

EL ESPECTRO VISIBLE

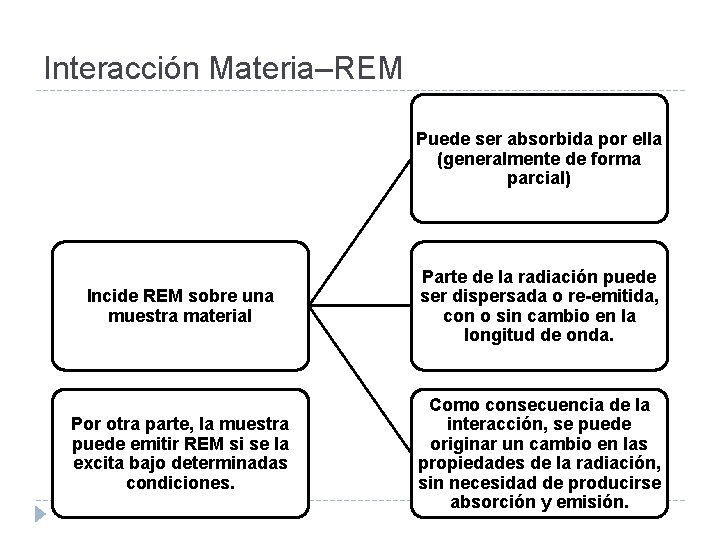
Interacción Materia–REM Puede ser absorbida por ella (generalmente de forma parcial) Incide REM sobre una muestra material Parte de la radiación puede ser dispersada o re-emitida, con o sin cambio en la longitud de onda. Por otra parte, la muestra puede emitir REM si se la excita bajo determinadas condiciones. Como consecuencia de la interacción, se puede originar un cambio en las propiedades de la radiación, sin necesidad de producirse absorción y emisión.

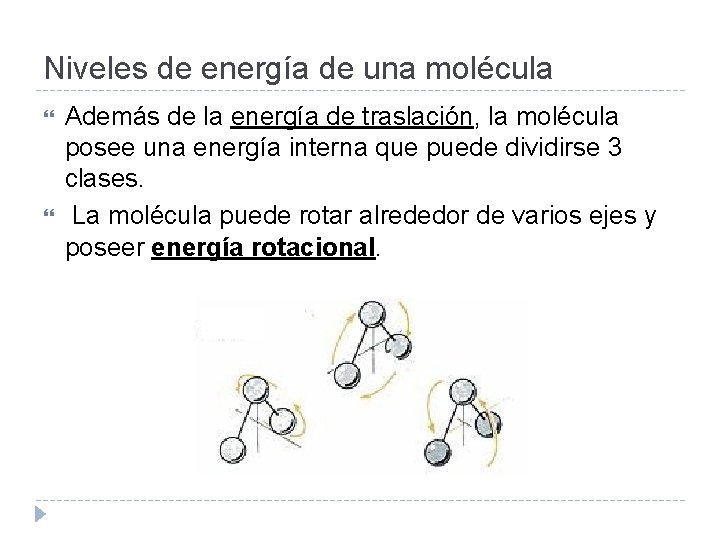
Niveles de energía de una molécula Además de la energía de traslación, la molécula posee una energía interna que puede dividirse 3 clases. La molécula puede rotar alrededor de varios ejes y poseer energía rotacional.

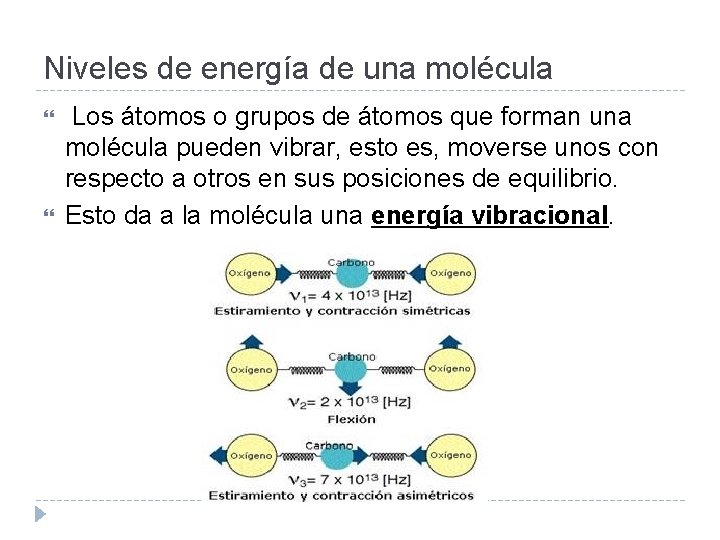
Niveles de energía de una molécula Los átomos o grupos de átomos que forman una molécula pueden vibrar, esto es, moverse unos con respecto a otros en sus posiciones de equilibrio. Esto da a la molécula una energía vibracional.

Niveles de energía de una molécula Una molécula posee energía electrónica, la cual es el potencial asociado a la distribución de las cargas eléctricas negativas (electrones) con relación al núcleo cargado positivamente. Una molécula no puede poseer una cantidad arbitraria de Eint, sólo puede existir en ciertos estados de energía permitidos.

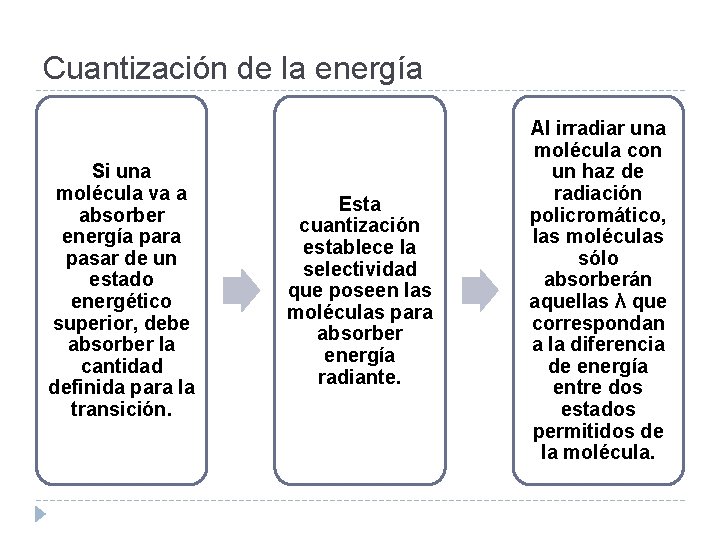
Cuantización de la energía Si una molécula va a absorber energía para pasar de un estado energético superior, debe absorber la cantidad definida para la transición. Esta cuantización establece la selectividad que poseen las moléculas para absorber energía radiante. Al irradiar una molécula con un haz de radiación policromático, las moléculas sólo absorberán aquellas λ que correspondan a la diferencia de energía entre dos estados permitidos de la molécula.

Ley de distribución de Boltzman Relaciona el número de átomos o moléculas que pasan al estado excitado con el de los que permanecen en el estado fundamental y con la energía absorbida: Ni : número de átomos o moléculas en el estado excitado, N 0 : átomos o moléculas que permanecen en el estado fundamental, E la energía aplicada, k la constante de Bolzman, T la temperatura g 0 y gi son constantes relacionadas con la probabilidad de que el átomo o molécula interaccione con la energía aplicada.

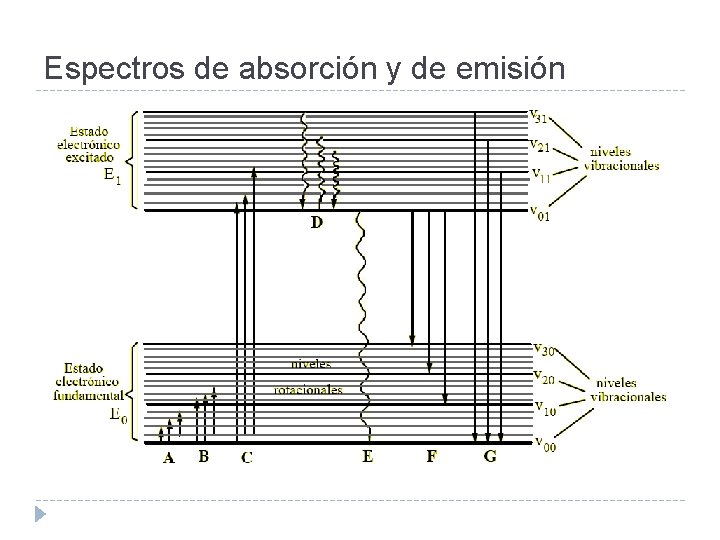
Espectros de absorción y de emisión Cuando una especie absorbe REM pasa a un estado excitado de mayor contenido energético: Para que tenga lugar la absorción es necesario que se cumplan las siguientes condiciones: a) Tiene que existir una interacción entre el campo eléctrico de la radiación y alguna carga eléctrica de la materia. b) La energía del fotón incidente debe satisfacer exactamente los requerimientos de la energía cuantizada de la sustancia.

Espectros de absorción y de emisión

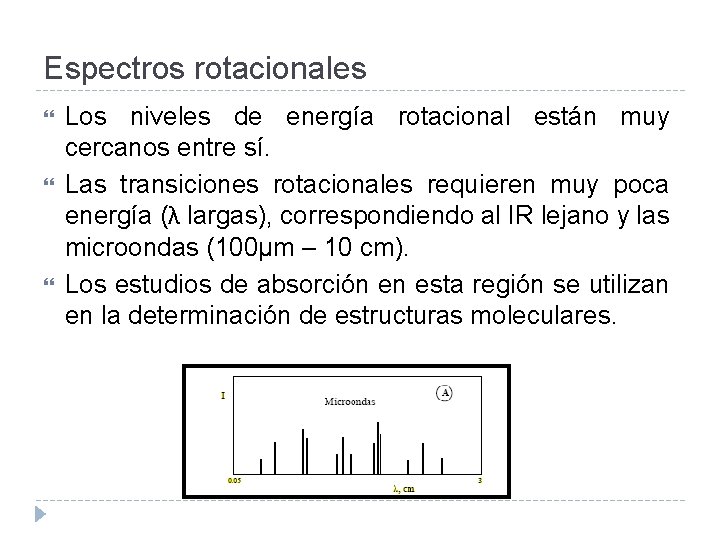
Espectros rotacionales Los niveles de energía rotacional están muy cercanos entre sí. Las transiciones rotacionales requieren muy poca energía (λ largas), correspondiendo al IR lejano y las microondas (100µm – 10 cm). Los estudios de absorción en esta región se utilizan en la determinación de estructuras moleculares.

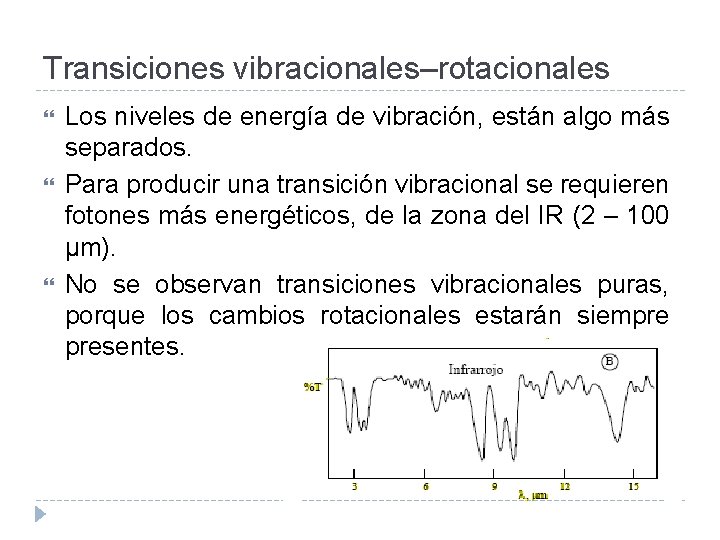
Transiciones vibracionales–rotacionales Los niveles de energía de vibración, están algo más separados. Para producir una transición vibracional se requieren fotones más energéticos, de la zona del IR (2 – 100 µm). No se observan transiciones vibracionales puras, porque los cambios rotacionales estarán siempre presentes.

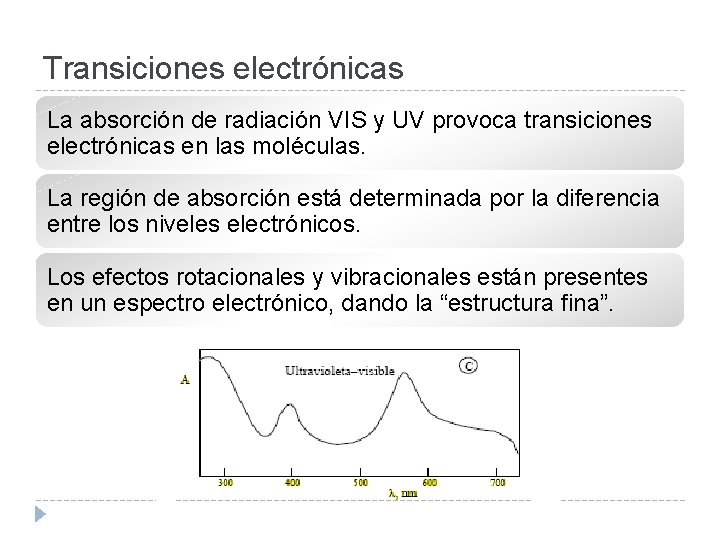
Transiciones electrónicas La absorción de radiación VIS y UV provoca transiciones electrónicas en las moléculas. La región de absorción está determinada por la diferencia entre los niveles electrónicos. Los efectos rotacionales y vibracionales están presentes en un espectro electrónico, dando la “estructura fina”.

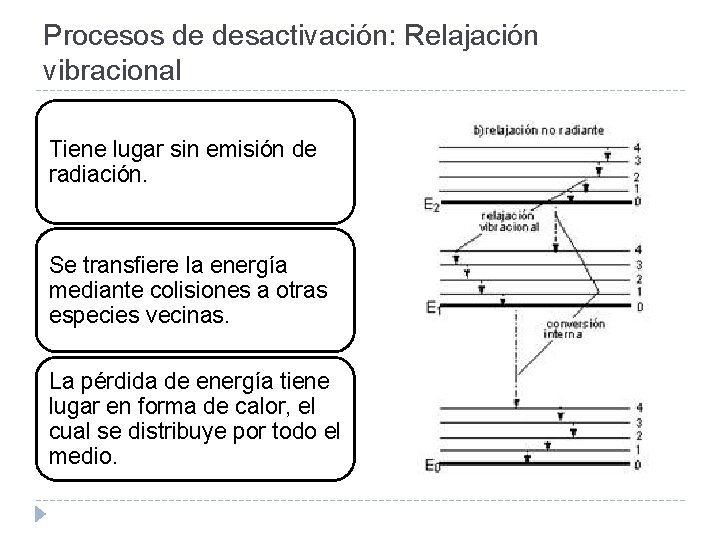
Procesos de desactivación: Relajación vibracional Tiene lugar sin emisión de radiación. Se transfiere la energía mediante colisiones a otras especies vecinas. La pérdida de energía tiene lugar en forma de calor, el cual se distribuye por todo el medio.

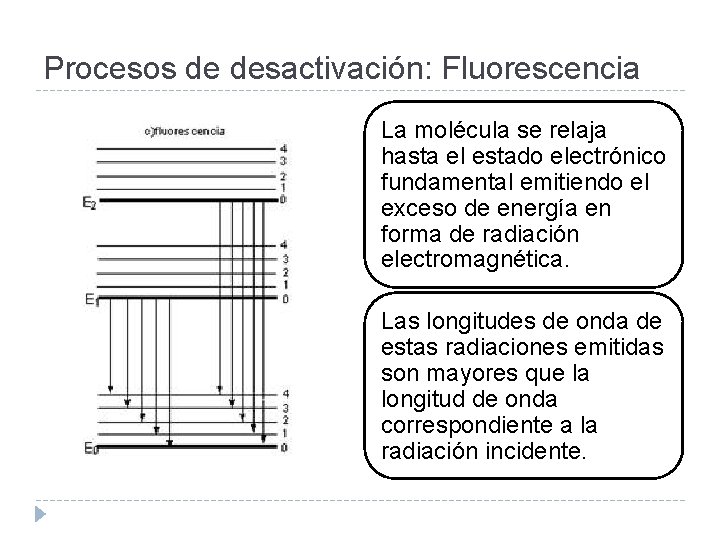
Procesos de desactivación: Fluorescencia La molécula se relaja hasta el estado electrónico fundamental emitiendo el exceso de energía en forma de radiación electromagnética. Las longitudes de onda de estas radiaciones emitidas son mayores que la longitud de onda correspondiente a la radiación incidente.

ESPECTROFOTOMETRÍA DE ABSORCIÓN UV-VISIBLE

Fundamentos Se basa en la absorción de radiación UV y Vis por un analito Se origina un estado excitado que posteriormente elimina su exceso de energía en forma de calor Esquemáticamente: La cantidad de calor disipado es muy pequeño.

Leyes de absorción de la radiación. Ley de Beer Ambas leyes se combinan en la ley de Bouguer-Lambert. Beer, o más comúnmente, ley de Beer, por ser la concentración el parámetro de mayor aplicación en Química Analítica.

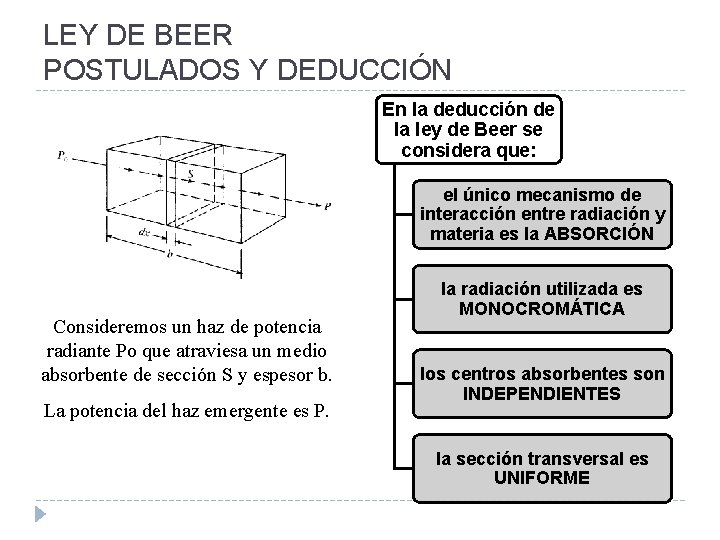
LEY DE BEER POSTULADOS Y DEDUCCIÓN En la deducción de la ley de Beer se considera que: el único mecanismo de interacción entre radiación y materia es la ABSORCIÓN Consideremos un haz de potencia radiante Po que atraviesa un medio absorbente de sección S y espesor b. La potencia del haz emergente es P. la radiación utilizada es MONOCROMÁTICA los centros absorbentes son INDEPENDIENTES la sección transversal es UNIFORME

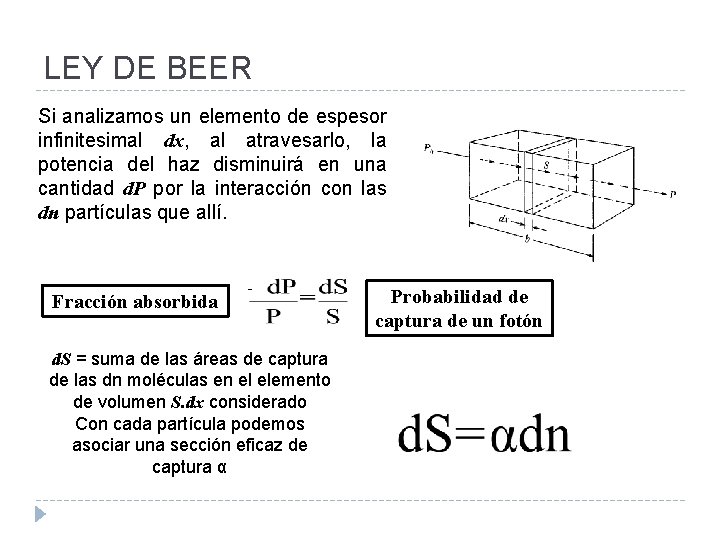
LEY DE BEER Si analizamos un elemento de espesor infinitesimal dx, al atravesarlo, la potencia del haz disminuirá en una cantidad d. P por la interacción con las dn partículas que allí. Fracción absorbida - d. S = suma de las áreas de captura de las dn moléculas en el elemento de volumen S. dx considerado Con cada partícula podemos asociar una sección eficaz de captura α Probabilidad de captura de un fotón

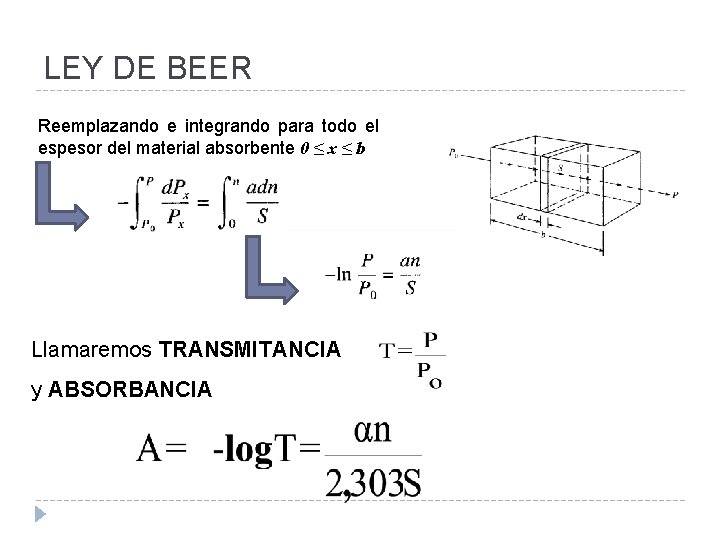
LEY DE BEER Reemplazando e integrando para todo el espesor del material absorbente 0 ≤ x ≤ b Llamaremos TRANSMITANCIA y ABSORBANCIA

LEY DE BEER Para su uso en Química Analítica, se prefiere expresar la absorbancia en función de la concentración: ü ε se donomina absortividad molar, si la concentración está expresada en mol/L. ü Es una característica de la especie absorbente, de la λ de la radiación incidente, de la naturaleza del solvente, de la temperatura, etc. . ü Es independiente del camino óptico (b) y de la concentración de la sustancia (c).

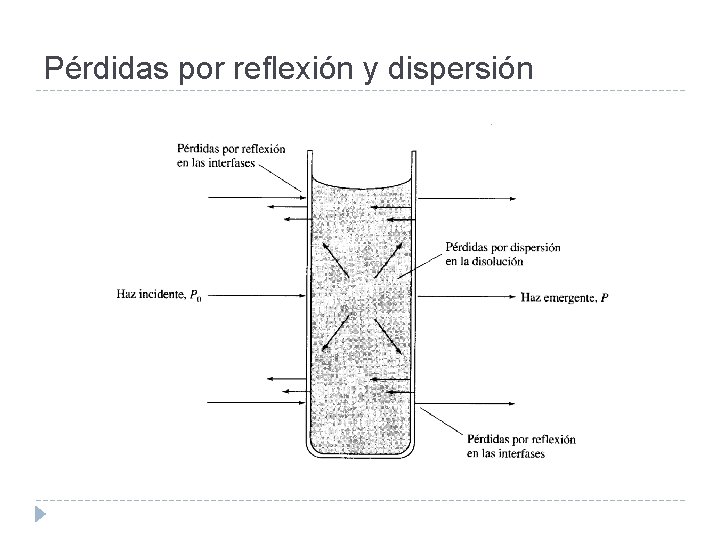
Medida de la Transmitancia y de la Absorbancia En cada interfase que separe medios de diferentes valor de n habrá pérdidas por reflexión de radiación. Normalmente, T y A no pueden medirse directamente ya que la solución que contiene al analito debe colocarse en una cubeta. Aproximadamente un 8. 5% de la radiación se pierde cuando atraviesa una cubeta llena de agua. Además hay pérdidas de radiación cuando la presencia de ciertas moléculas grandes dispersan la radiación

Pérdidas por reflexión y dispersión

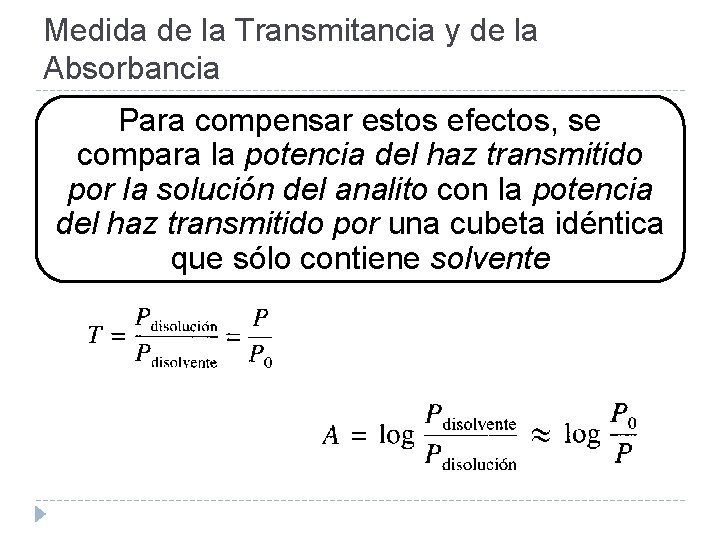
Medida de la Transmitancia y de la Absorbancia Para compensar estos efectos, se compara la potencia del haz transmitido por la solución del analito con la potencia del haz transmitido por una cubeta idéntica que sólo contiene solvente

DESVIACIONES DE LA LEY DE BEER

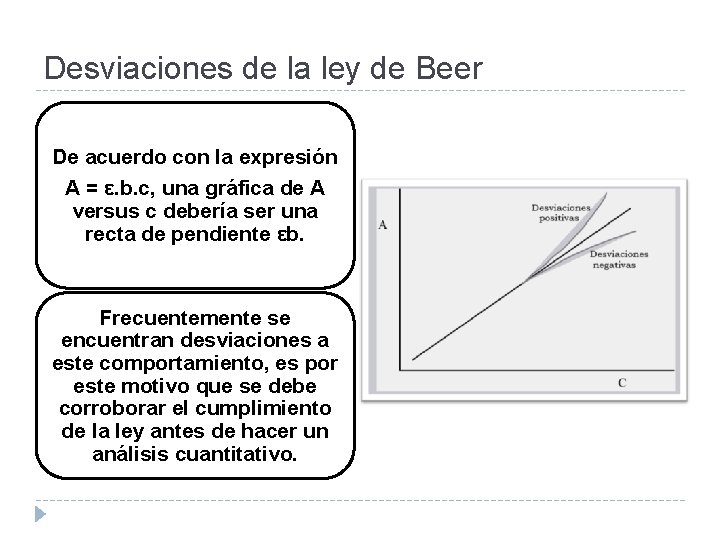
Desviaciones de la ley de Beer De acuerdo con la expresión A = ε. b. c, una gráfica de A versus c debería ser una recta de pendiente εb. Frecuentemente se encuentran desviaciones a este comportamiento, es por este motivo que se debe corroborar el cumplimiento de la ley antes de hacer un análisis cuantitativo.

Desviaciones de la ley de Beer

DESVIACIONES REALES En la deducción de la ley de Beer no se ha considerado que la absortividad depende del índice de refracción, n, según la expresión: Como, a su vez, n varía con la concentración, la absortividad no es rigurosamente constante para cualquier concentración, provocando desviaciones negativas. En la práctica, para concentraciones inferiores a 10– 3 M puede prescindirse de la influencia de este factor, al ser el índice de refracción esencialmente constante.

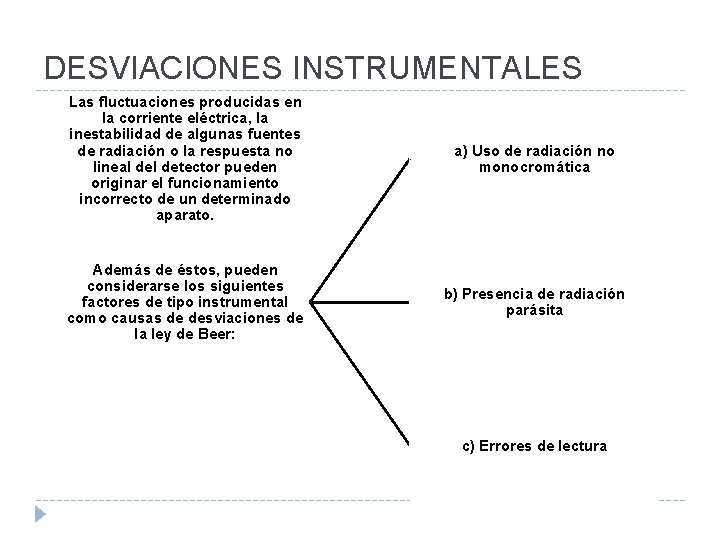
DESVIACIONES INSTRUMENTALES Las fluctuaciones producidas en la corriente eléctrica, la inestabilidad de algunas fuentes de radiación o la respuesta no lineal detector pueden originar el funcionamiento incorrecto de un determinado aparato. a) Uso de radiación no monocromática Además de éstos, pueden considerarse los siguientes factores de tipo instrumental como causas de desviaciones de la ley de Beer: b) Presencia de radiación parásita c) Errores de lectura

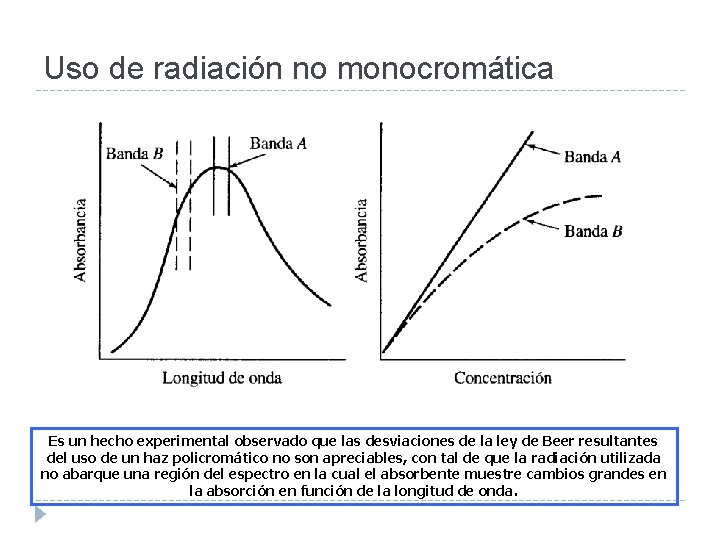
Uso de radiación no monocromática El cumplimiento estricto de la ley de Beer sólo se observa cuando la radiación empleada es monocromática. En la práctica es raro el uso de radiación de una única λ. Los dispositivos empleados para seleccionar la λ de trabajo generan una banda más o menos estrecha de longitudes de onda.

Uso de radiación no monocromática Es un hecho experimental observado que las desviaciones de la ley de Beer resultantes del uso de un haz policromático no son apreciables, con tal de que la radiación utilizada no abarque una región del espectro en la cual el absorbente muestre cambios grandes en la absorción en función de la longitud de onda.

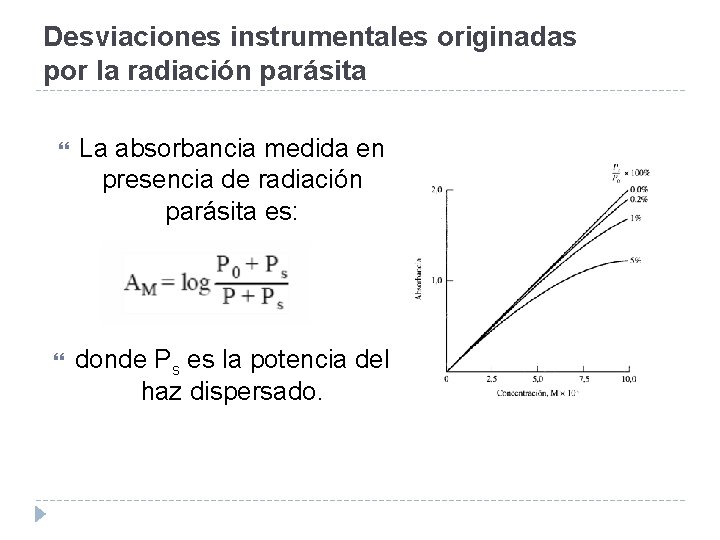
Desviaciones instrumentales originadas por la radiación parásita El haz de radiación que sale de un monocromador suele estar contaminado con pequeñas cantidades de radiación parásita o dispersada originada por reflexión de los distintos componentes ópticos, dispersión por partículas de polvo atmosférico, etc. Por otra parte, la propia muestra puede originar dispersiones. Con frecuencia, la radiación dispersada tiene una longitud de onda diferente respecto a la radiación principal, pudiendo además, en ocasiones, llegar al detector sin haber atravesado la muestra.

Desviaciones instrumentales originadas por la radiación parásita La absorbancia medida en presencia de radiación parásita es: donde Ps es la potencia del haz dispersado.

Errores de lectura Los errores indeterminados en la lectura de la transmitancia o absorbancia son errores que potencialmente siempre están presentes y es necesario tenerlos en cuenta. En ocasiones, pequeños errores en la lectura de la transmitancia o de la absorbancia pueden ocasionar errores grandes en la concentración cuando se opera en los extremos de la escala.

DESVIACIONES QUÍMICAS Se incluyen en este ítem toda una serie de desviaciones aparentes de la ley de Beer producidas como consecuencia de procesos químicos en los que participan las especies absorbentes

Influencia del equilibrio Cuando la sustancia problema interviene o forma parte de un sistema en equilibrio con otras especies, el desplazamiento del equilibrio implica una modificación en la concentración, y, en consecuencia, en la absorbancia

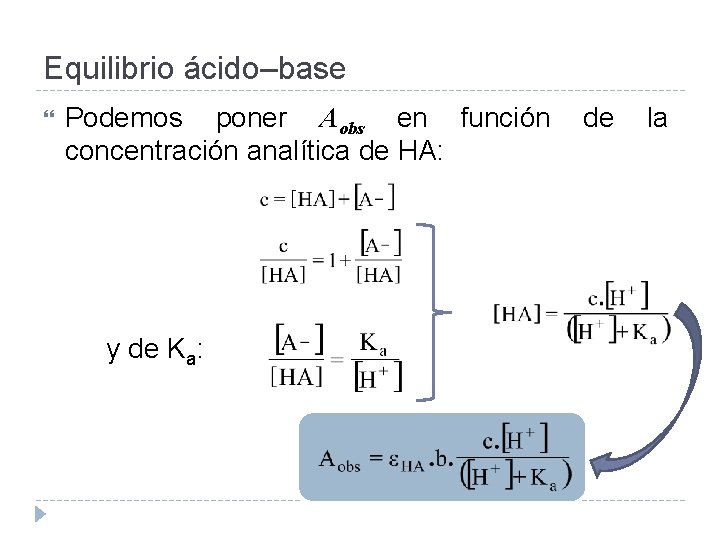
Equilibrio ácido–base Tomemos como ejemplo el caso de un ácido débil HA: Si se trabaja a una λ a la que absorbe sólo la especie HA, se cometerá un error si no se considera correctamente la concentración de esta especie.

Equilibrio ácido–base Podemos poner Aobs en función concentración analítica de HA: y de Ka: de la

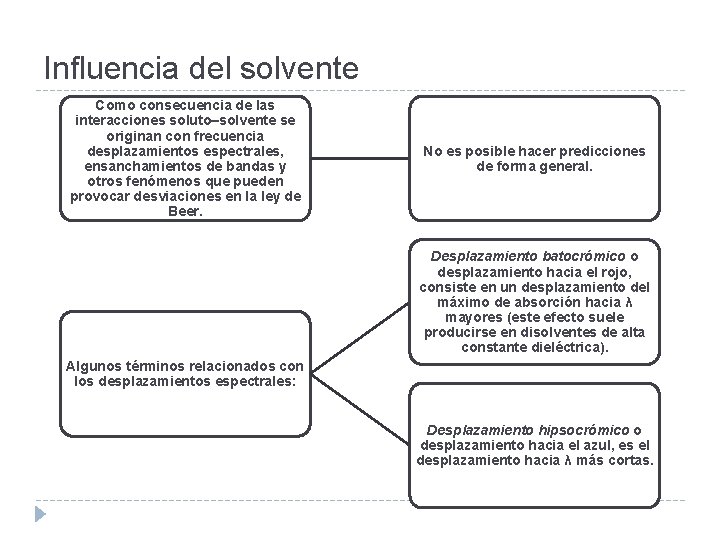
Influencia del solvente Como consecuencia de las interacciones soluto–solvente se originan con frecuencia desplazamientos espectrales, ensanchamientos de bandas y otros fenómenos que pueden provocar desviaciones en la ley de Beer. No es posible hacer predicciones de forma general. Desplazamiento batocrómico o desplazamiento hacia el rojo, consiste en un desplazamiento del máximo de absorción hacia λ mayores (este efecto suele producirse en disolventes de alta constante dieléctrica). Algunos términos relacionados con los desplazamientos espectrales: Desplazamiento hipsocrómico o desplazamiento hacia el azul, es el desplazamiento hacia λ más cortas.

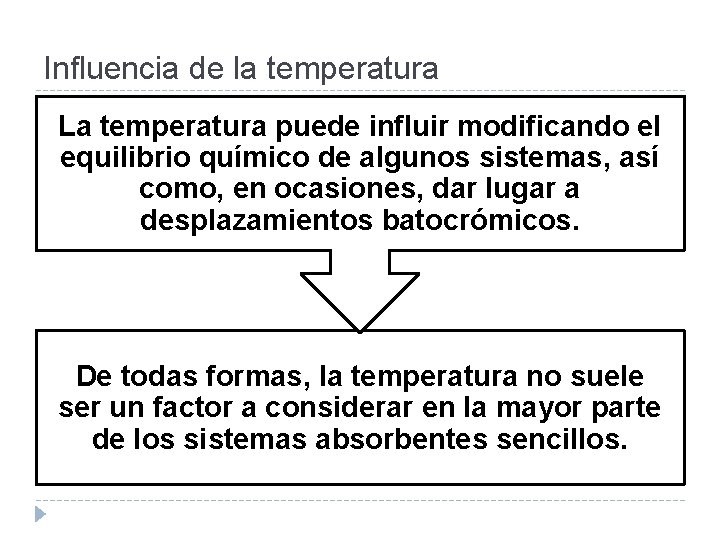
Influencia de la temperatura La temperatura puede influir modificando el equilibrio químico de algunos sistemas, así como, en ocasiones, dar lugar a desplazamientos batocrómicos. De todas formas, la temperatura no suele ser un factor a considerar en la mayor parte de los sistemas absorbentes sencillos.

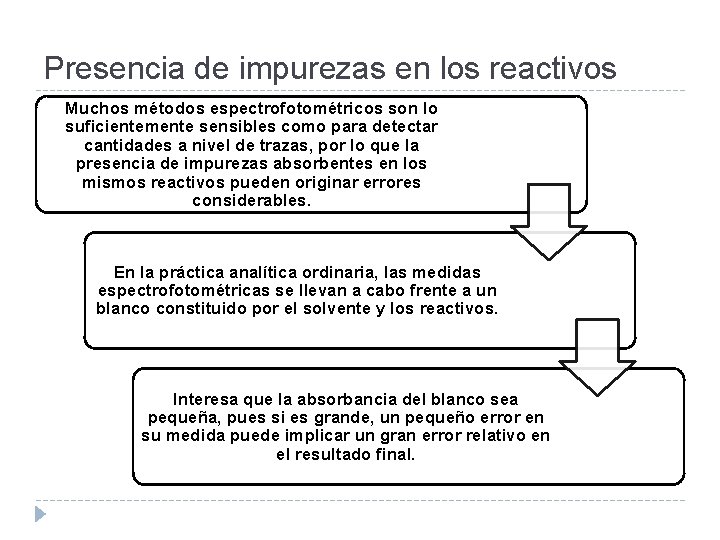
Presencia de impurezas en los reactivos Muchos métodos espectrofotométricos son lo suficientemente sensibles como para detectar cantidades a nivel de trazas, por lo que la presencia de impurezas absorbentes en los mismos reactivos pueden originar errores considerables. En la práctica analítica ordinaria, las medidas espectrofotométricas se llevan a cabo frente a un blanco constituido por el solvente y los reactivos. Interesa que la absorbancia del blanco sea pequeña, pues si es grande, un pequeño error en su medida puede implicar un gran error relativo en el resultado final.

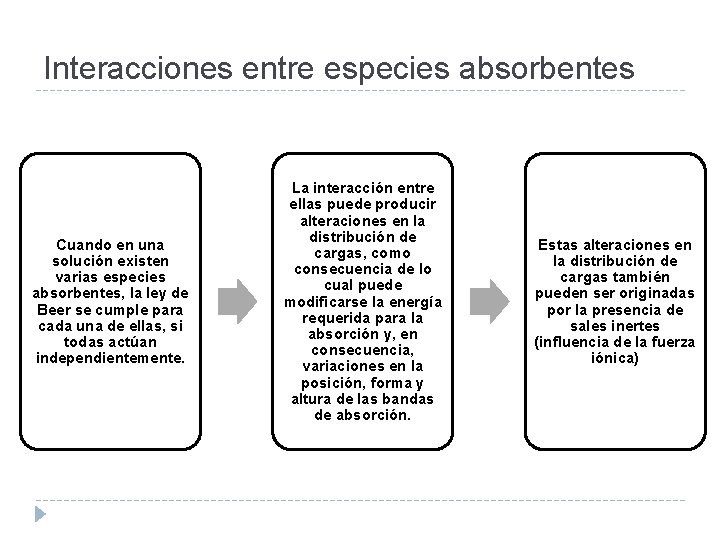
Interacciones entre especies absorbentes Cuando en una solución existen varias especies absorbentes, la ley de Beer se cumple para cada una de ellas, si todas actúan independientemente. La interacción entre ellas puede producir alteraciones en la distribución de cargas, como consecuencia de lo cual puede modificarse la energía requerida para la absorción y, en consecuencia, variaciones en la posición, forma y altura de las bandas de absorción. Estas alteraciones en la distribución de cargas también pueden ser originadas por la presencia de sales inertes (influencia de la fuerza iónica)

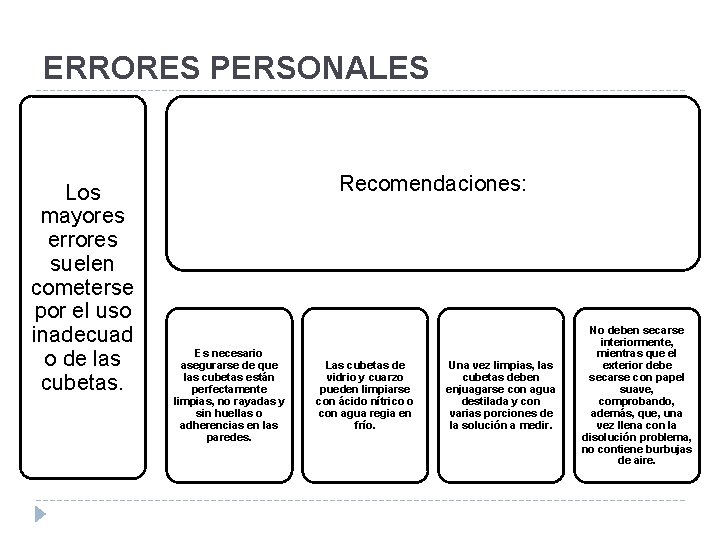
ERRORES PERSONALES Los mayores errores suelen cometerse por el uso inadecuad o de las cubetas. Recomendaciones: Es necesario asegurarse de que las cubetas están perfectamente limpias, no rayadas y sin huellas o adherencias en las paredes. Las cubetas de vidrio y cuarzo pueden limpiarse con ácido nítrico o con agua regia en frío. Una vez limpias, las cubetas deben enjuagarse con agua destilada y con varias porciones de la solución a medir. No deben secarse interiormente, mientras que el exterior debe secarse con papel suave, comprobando, además, que, una vez llena con la disolución problema, no contiene burbujas de aire.
 Pticos
Pticos Anlisis foda
Anlisis foda Birrefringence
Birrefringence Introduccin
Introduccin Introduccin
Introduccin Analisis foda de una universidad
Analisis foda de una universidad Que diferencia hay entre filosofia y ciencia
Que diferencia hay entre filosofia y ciencia Pticos
Pticos Pticos
Pticos Niveles í“pticos
Niveles í“pticos Introducción de enzimas
Introducción de enzimas Introduccin
Introduccin Anlisis financiero
Anlisis financiero Optica fisica
Optica fisica Pticos
Pticos Introduccin
Introduccin Anlisis foda
Anlisis foda Anlisis de riesgos
Anlisis de riesgos Amenazas de una empresa ejemplos
Amenazas de una empresa ejemplos Mtodos
Mtodos Mtodos
Mtodos Mtodos
Mtodos Mtodos
Mtodos Mtodos
Mtodos Mtodos
Mtodos Mtodos
Mtodos Mtodos
Mtodos Condón femenino
Condón femenino Mtodos
Mtodos Reaccion de condensacion
Reaccion de condensacion Qumica moderna
Qumica moderna Qumica
Qumica Qumica
Qumica Hidrocarbonetos
Hidrocarbonetos Qumica
Qumica Qumica
Qumica Entalpia
Entalpia Qumica
Qumica Carbono hibridacion
Carbono hibridacion Qumica
Qumica Tabla qumica
Tabla qumica Qumica
Qumica Pilha de daniell
Pilha de daniell Qumica
Qumica Qumica
Qumica Atomos de carbono
Atomos de carbono Qumica
Qumica Qumica
Qumica Clasificacion de compuesto inorganico
Clasificacion de compuesto inorganico Qumica
Qumica Química orgânica resumo
Química orgânica resumo Qumica
Qumica Qumica
Qumica Qumica
Qumica Numero magnetico de spin
Numero magnetico de spin Qumica
Qumica Qumica
Qumica Qumica
Qumica