Instrumentalna analiza Profesor Hemije HZS POTENCIOMETRIJA Dr D








![Potencijal Ag/Ag. Cl elektrode: E = E 0 Ag+ + 0. 059 log[Ag+] P=[Ag+][Cl-] Potencijal Ag/Ag. Cl elektrode: E = E 0 Ag+ + 0. 059 log[Ag+] P=[Ag+][Cl-]](https://slidetodoc.com/presentation_image_h/b9af8d35059b29160f53d26b5eb02fba/image-10.jpg)



































































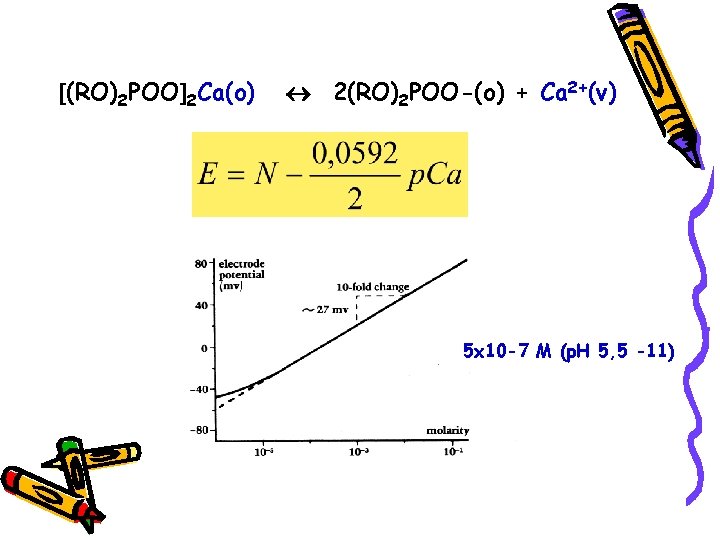










- Slides: 114

Instrumentalna analiza , Profesor Hemije HZS POTENCIOMETRIJA Dr D. Manojlović, Hemijski fakultet Beograd D. Manojlovic, Hemijski fakultet Beograd

Kad se metalna šipka uroni u rastvor u kome postoje njegovi korespodentni joni onda joni metala prelaze sa mesta “višeg pritiska” ka mestu “nižeg pritiska”.

Izvesna količina metalnih jona prelazi u rastvor i elektroda postaje negativnija a rastvor u odgovarajućoj meri pozitivniji Nernstova osmotska teorija galvanskog dobijanja struje, težnju jona metala da prelazi sa metala u ratvor naziva “elektrolitičkim naponom rastvaranja” Prema Nernstu joni metala će prelaziti u rastvor sve dotle dok rastući osmotski pritisak u rastvoru dostigne vrednost elektrolitičkog napona rastvaranja

Posle određenog vremena uspostavlja se dvostruki (dvogubi) električni sloj Potencijalska razlika kojom raspolaže ovaj sistem naziva se potencijalom elektrode u rastvoru Potencijal elektrode u rastvoru je funkcija koncentracije korespodentnih jona Kad se uspostavi ravnotežno stanje (Izjednači se elektrolitički napon rastvaranja i osmotski pritisak korespodentnih jona u rastvoru) govorimo o ravnotežnom potencijalu elektrode

Ravnotežni potencijal zavisi od koncentracije korespodentnih jona i elektrolitičkog napona rastvaranja koji je karakteristična veličina za svaki metal i predstavlja merilo njegove plemenitosti Kada je elektroda nekog metala uronjena u rastvor čija je koncentracija korespodentnih jona (a) =1 mol/dm 3 (T 298 o. K) imamo Eo Ravnotežni potencijal koji se pri ovim uslovima naziva normalni (standardni) potencijal i meri se prema SVE (standardna vodonična elektroda) CH+=1 mol/dm 3 , T= 298 o. K, P= 101. 3 KPa Po konvenciji Eo=0, 000000 V

Nernstova jednačina

• ELEKTRODE U POTENCIOMETRIJI • Podela elektroda: • Prve vrste • Druge vrste • Treće vrste

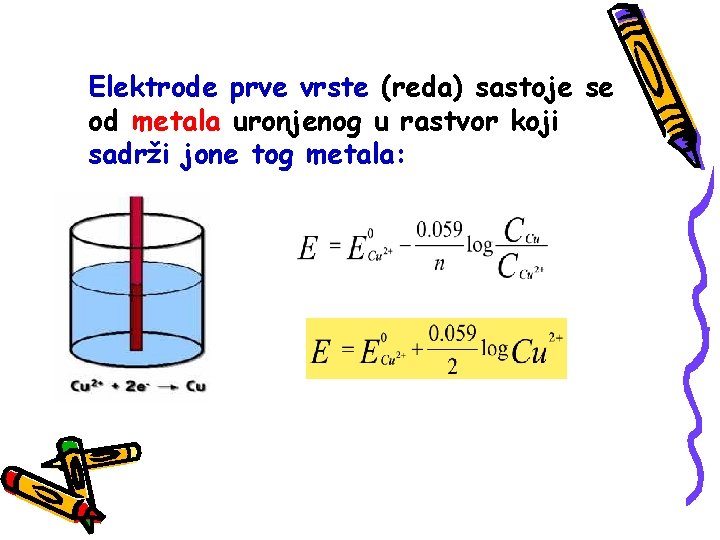
Elektrode prve vrste (reda) sastoje se od metala uronjenog u rastvor koji sadrži jone tog metala:

Elektrode druge vrste (reda) sastoje se od metala uronjenog u rastvor koji ima zajedniči jon i koji sadrži teško rastvornu so tog metala: Ag/Ag+Cl-/K+Cl- ili Ag/Ag. Cl/Cl- sastoji se od srebrne žice uronjene u Ag. Cl (presvučene sa Ag. Cl) i rastvor zasićen KCl. Hg/Hg 2 Cl 2/Cl-- satoji se od žive, živina(I)-hlorida i rastvora KCl
![Potencijal AgAg Cl elektrode E E 0 Ag 0 059 logAg PAgCl Potencijal Ag/Ag. Cl elektrode: E = E 0 Ag+ + 0. 059 log[Ag+] P=[Ag+][Cl-]](https://slidetodoc.com/presentation_image_h/b9af8d35059b29160f53d26b5eb02fba/image-10.jpg)
Potencijal Ag/Ag. Cl elektrode: E = E 0 Ag+ + 0. 059 log[Ag+] P=[Ag+][Cl-] Ag žica Zacićen rastvor KCL Ag. Cl Azbestno vlakno Ag/Ag. Cl/Cl- referentna elektorda E = 0. 80 + 0. 059 log [10 -10]/[Cl-] EAg. Cl=0. 80 + 0. 059 log[10 -10]-0. 059 log[Cl-] EAg. Cl= E 0 Ag. Cl – 0. 059 log[Cl-] EAg. Cl= 0. 20 – 0. 059 log[Cl-]

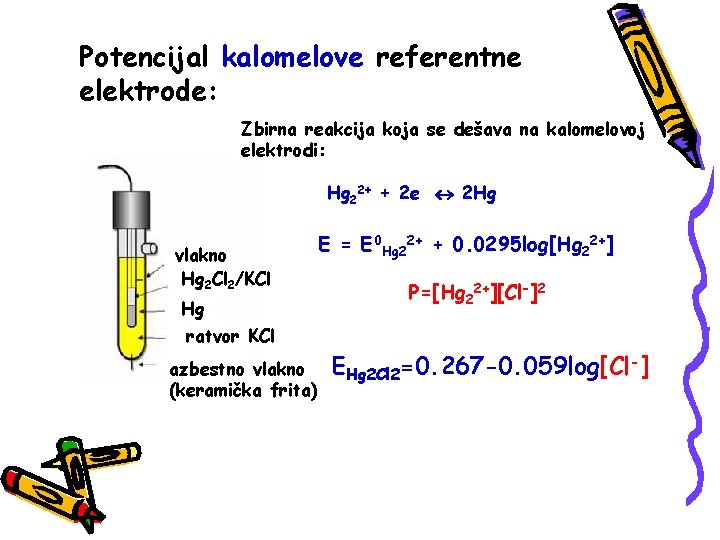
Potencijal kalomelove referentne elektrode: Zbirna reakcija koja se dešava na kalomelovoj elektrodi: Hg 22+ + 2 e 2 Hg vlakno Hg 2 Cl 2/KCl Hg E = E 0 Hg 22+ + 0. 0295 log[Hg 22+] P=[Hg 22+][Cl-]2 ratvor KCl azbestno vlakno (keramička frita) EHg 2 Cl 2=0. 267 -0. 059 log[Cl-]

Referentne elektrode Ag/Ag. Cl/KCl 0. 1 M = 0. 2900 Ag/Ag. Cl/KCl 1 M = 0. 2370 Ag/Ag. Cl/KCl Zas. = 0. 1988 Hg/Hg 2 Cl 2/KCl 0. 1 M = 0. 3365 Hg/Hg 2 Cl 2/KCl 1 M = 0. 2828 Hg/Hg 2 Cl 2/KCl Zas = 0. 2438 Hg/Hg 2 SO 4/H 2 SO 4 1 M = 0. 68 V V V V

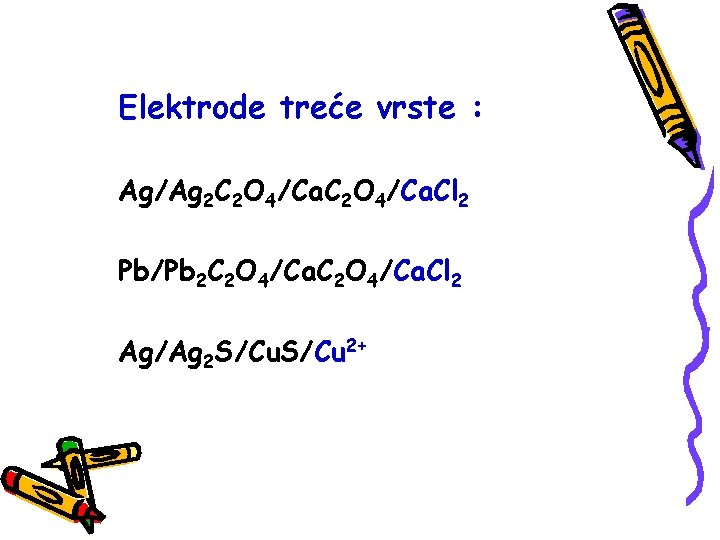
Elektrode treće vrste : Ag/Ag 2 C 2 O 4/Ca. Cl 2 Pb/Pb 2 C 2 O 4/Ca. Cl 2 Ag/Ag 2 S/Cu 2+

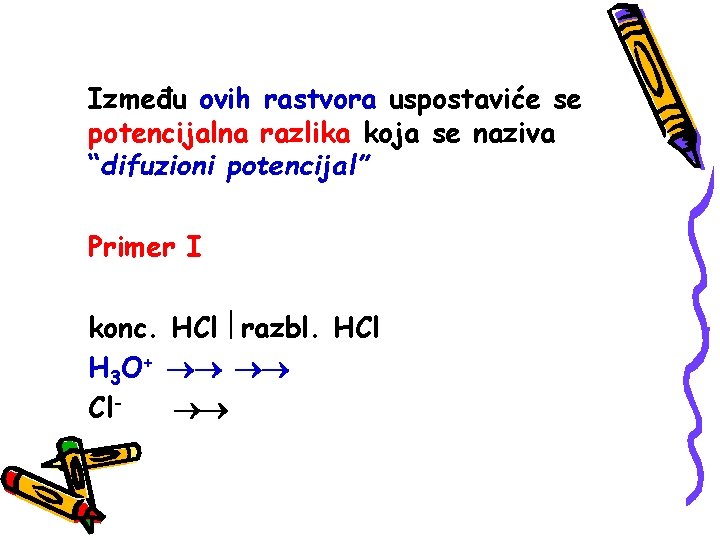
DIFUZIONI POTENCIJAL Na dodirnoj površini dveju tečnih faza koje su istog sastava ali različitih koncentracija, ili su različitog sastava a istih koncentracija, ili su i različitog sastava i različitih koncentracija, doći će do difuzije jona sa višeg na niži nivo hemijskog potencijala. Kako difuzija nije brz proces, jedan od dva rastvora zahvaljujući pomenutom “raslojavanju” sistema postaće sve pozitivniji a drugi sve negativniji.

Između ovih rastvora uspostaviće se potencijalna razlika koja se naziva “difuzioni potencijal” Primer I konc. HCl razbl. HCl H 3 O+ Cl

Oba jona difunduju iz koncentrovanijeg u razblaženiji rastvor. Putna brzina H 3 O+ je daleko veća pa će se razblaženiji rastvor brže bogatiti pozitivnim naelektrisanjem. Zbog toga će rastvor sa leve strane dodirne površine postajati sve negativniji a sa desne sve pozitivniji

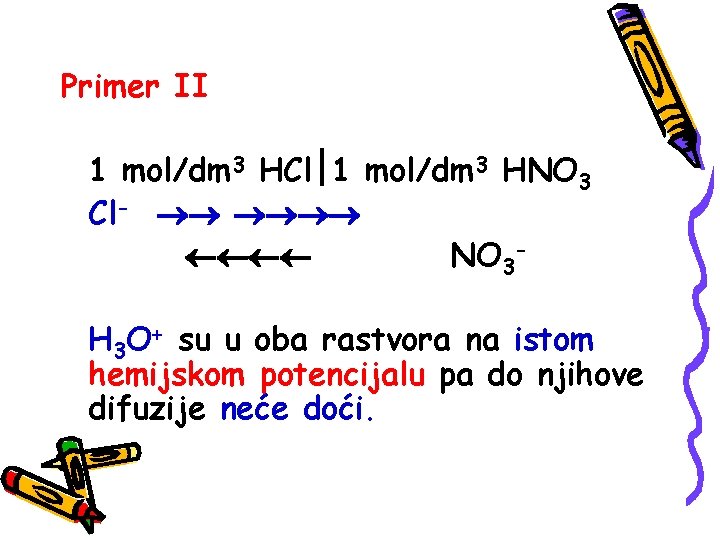
Primer II 1 mol/dm 3 HCl 1 mol/dm 3 HNO 3 Cl- NO 3 H 3 O+ su u oba rastvora na istom hemijskom potencijalu pa do njihove difuzije neće doći.

Cl- i NO 3 - joni difundovaće u pravcima rastvora u kojima ih uopšte nema Brzina difuzije Cl- je veća od difuzije NO 3 - pa će rastvor sa desne strane postati negativniji a sa leve strane pozitivniji.

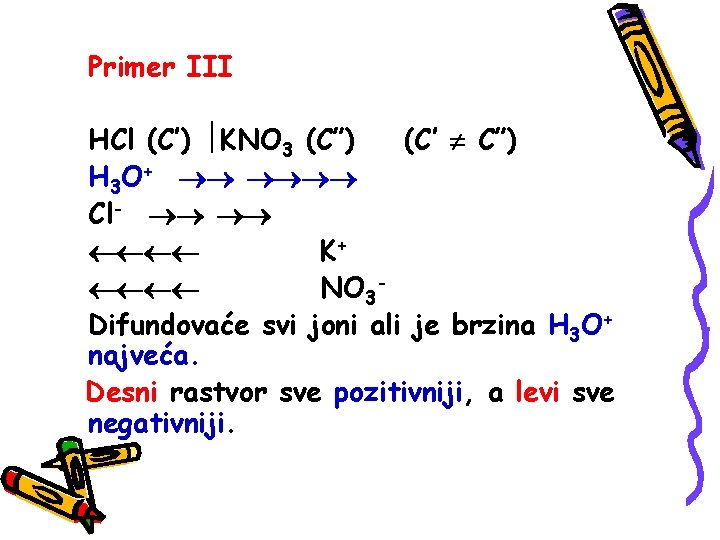
Primer III HCl (C’) KNO 3 (C”) (C’ C”) H 3 O+ Cl- K+ NO 3 Difundovaće svi joni ali je brzina H 3 O+ najveća. Desni rastvor sve pozitivniji, a levi sve negativniji.

Eksperimentalno je utvrđeno da su difuzioni potencijali imaju vrednost od milivolta do desetine milivolta Kada se Nernst-ov izraz primeni za koncentaciju H 3 O+ jona, i kada se njegova koncentracija promeni za “jednu potencu” (npr. 0. 1 do 0. 01) menja se ravnotežni potencijal odgovarajuće elektrode za 59 m. V.

Očigledno je da, ukoliko se ne eliminiše difuzioni potencijal, elektrohemijsko merenje p. H vrednosti može biti krajnje netačno i potpuno bez značaja. U sistemu sprega indikatorska elektroda ispitivani rastvor nepoznate koncentracije H 3 O+ jona referentna elektroda, difuzioni potencijali se javljaju na dodirnoj površini faza ispitivani rastvor referentna elektroda.

Ukoliko se na ovom mesu postavi koncentrovani elektrolit čiji joni migriraju istom brzinom difuzioni potencijal će biti sveden na minimum. Pokazalo se da je za ovo najpogodniji koncentrovani rastvor KCl koji se i onako nalazi u cevi kalomelove elektrode Vrednost difuzionog potencijala se svodi u ovom slučaju na manje od 1 m. V pa se ova elektroda po pravilu primenjuje za p. H merenjima

Prodiranje jona (difuzija) iz jedne u drugu fazu dešavaće se i ako ove dve faze odvojimo membranom propustljivom za te jone Ako su dva rastvora različitih koncentracija H 3 O+ razdvojeni membranom propustljivom za te jone doći će i u ovom slučaju do difuzije i “raslojavanja” sistema.

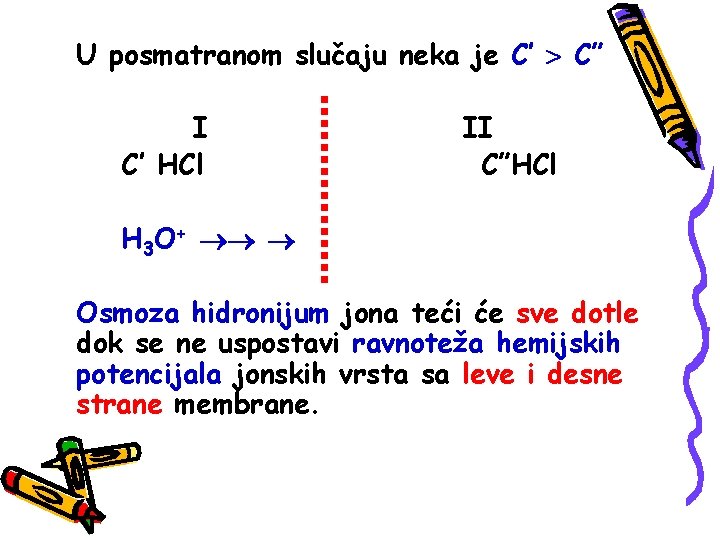
U posmatranom slučaju neka je C’ C” I C’ HCl II C”HCl H 3 O+ Osmoza hidronijum jona teći će sve dotle dok se ne uspostavi ravnoteža hemijskih potencijala jonskih vrsta sa leve i desne strane membrane.

Ova ravnoteža zahteva izjednačavanje srednjih aktivnosti rastvora razdvojenih membranom a’H 3 O+ a’Cl- = a ”H 3 O+ a ”Cl. Na osnovu ove Donnan-ove ravnoteže proizilazi, da pojedinačni aktiviteti H 3 O+ i Cl- u svakom od ovih rastvora moraju biti različiti.

Ako se u ova dva rastvora postavi po jedna vodonična elektroda, onda će one zbog različitih aktiviteta njihovih korespodentnih jona zauzeti različite potencijale. Razlika ovih potencijala naziva se membranskim ili Donnan-ovim potencijalom.

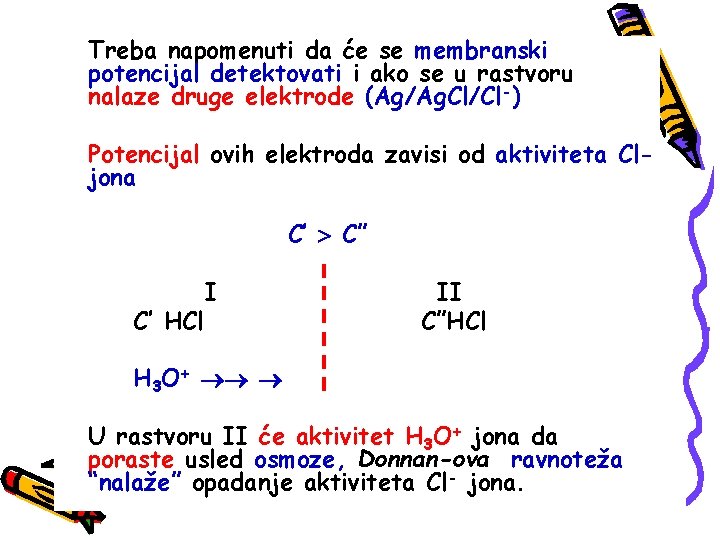
Treba napomenuti da će se membranski potencijal detektovati i ako se u rastvoru nalaze druge elektrode (Ag/Ag. Cl/Cl-) Potencijal ovih elektroda zavisi od aktiviteta Cljona C’ C” C’ HCl I II C”HCl H 3 O+ U rastvoru II će aktivitet H 3 O+ jona da poraste usled osmoze, Donnan-ova ravnoteža “nalaže” opadanje aktiviteta Cl- jona.

Ovo za posledicu ima porast koncentracije Ag+ jona elektrode druge vrste, a to znači pozitiviranje njenog potencijala Iz sličnog razloga u rastvoru I doći će do porasta aktiviteta Cl- jona i negativiranja porencijala Ag/Ag. Cl/Cl- elektrode Upravo ovo je našlo izvanrednu primenu kod “staklene elektrode” i drugih membranskih elektroda

Postojanje membranskog potencijala veoma je važno sa biološkog gledišta jer su pojave osmoze u biljnom i životinjskom svetu vezane za pojavu ovog fenomena Prema tome možemo zaključiti: Difuzioni potencijal se uspostavlja uvek, kad je uzrok “raslojavanja” sistema različita brzina migracije njihovih komponenti koji se nalaze na različitim hemijskim potencijalima.

Membranski potencijal uspostavlja se onda kada se “raslojavanje” sistema odvija posredstvom membrane propustljive samo za neke jonske vrste Difuzioni potencijal se prilikom potenciometrijskih merenja mora obavezno svesti na najmanju moguću meru jer samo na taj način obezbeđujemo dovoljno pouzdana merenja Difuzioni potencijal se uklanja upotrebom kontakata (elektrolitičkih) od koncentrovanih rastvora soli (KCl kod kalomelove i srebrohloridne elektrode ili KNO 3 kod kalomelove elektrode sa modifikovanim mostom).

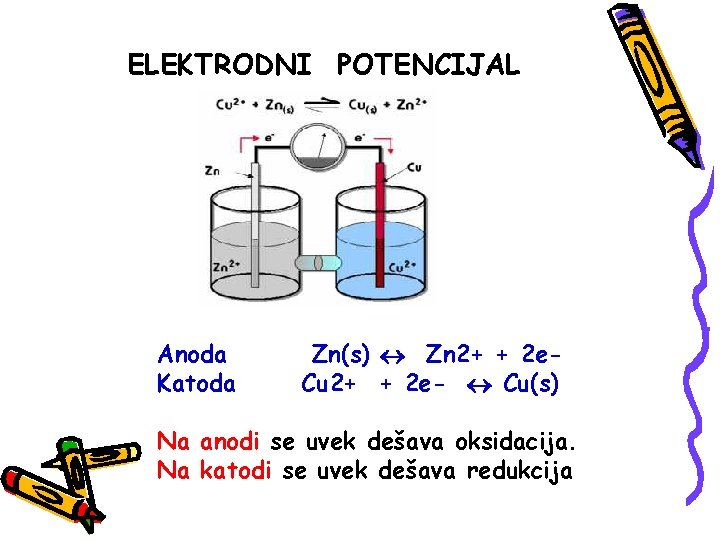
ELEKTRODNI POTENCIJAL Anoda Katoda Zn(s) Zn 2+ + 2 e. Cu 2+ + 2 e- Cu(s) Na anodi se uvek dešava oksidacija. Na katodi se uvek dešava redukcija

Po pravilu (dogovoreno je) se uvek sa leve strane piše deo u kome se dešava anodna reakcija Zn Zn. SO 4 (1 M) Cu. SO 4 (1 M) E= Ek-Ea E=0, 370 – (-0, 763)= 1, 100 V

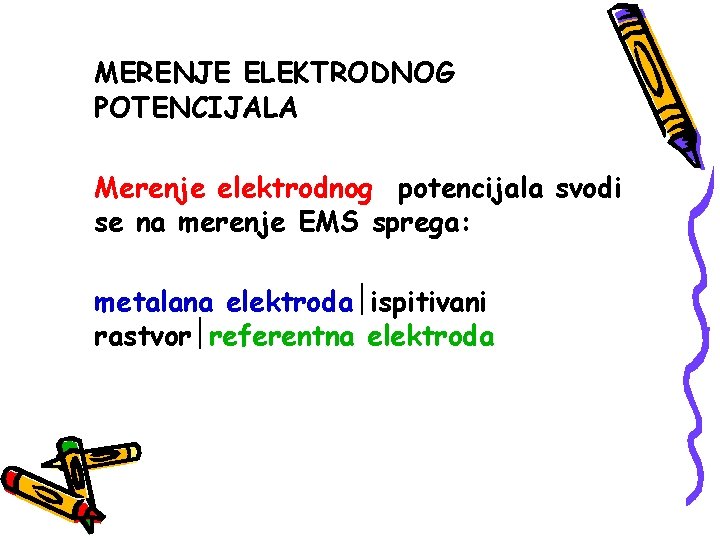
MERENJE ELEKTRODNOG POTENCIJALA Merenje elektrodnog potencijala svodi se na merenje EMS sprega: metalana elektroda ispitivani rastvor referentna elektroda

i Pogendorfova metoda Es=Ea-Ek Ea – potencijal pozitivne Ek- potencijal negativne elektrode Diboa-Rajmondova metoda

Tako npr. Ravnotežni potencijal Er za Ag/Ag+ (10 -6) je Er=+0. 440 m. V (NVE) Ako se meri prema ZKE (Er=244 m. V) iznosi 196 m. V Prema sulfatnoj (Er=680 m. V) iznosi 240 m. V

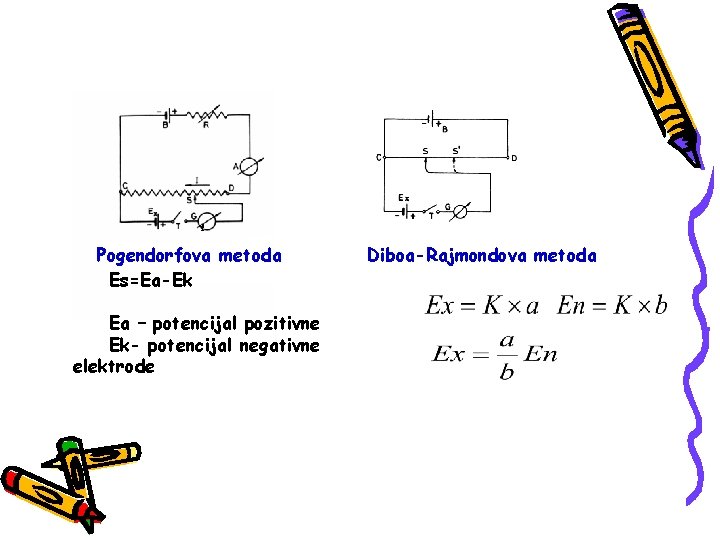
Cevni voltmetar-elektronski (p. H-metar) Veliki unutrašnji opor, omogućava merenje potencijalske razlike pri uslovima bezstrujnosti cevni-elektronski voltmetar referentna elektroda Indikatorsak elektroda

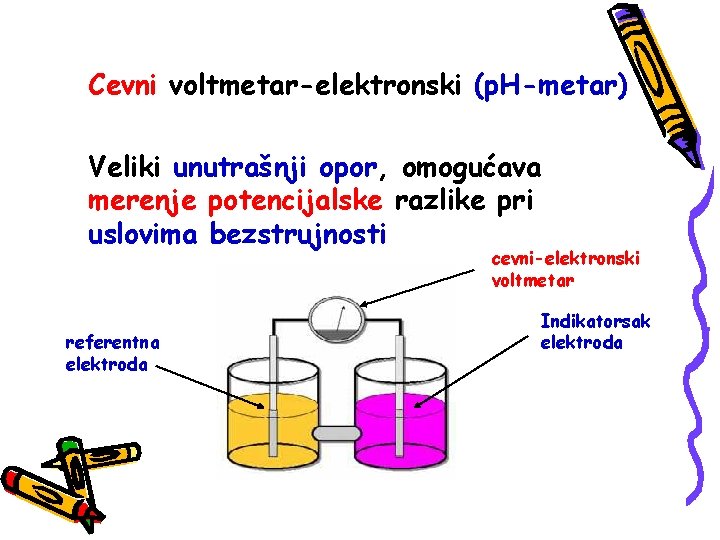
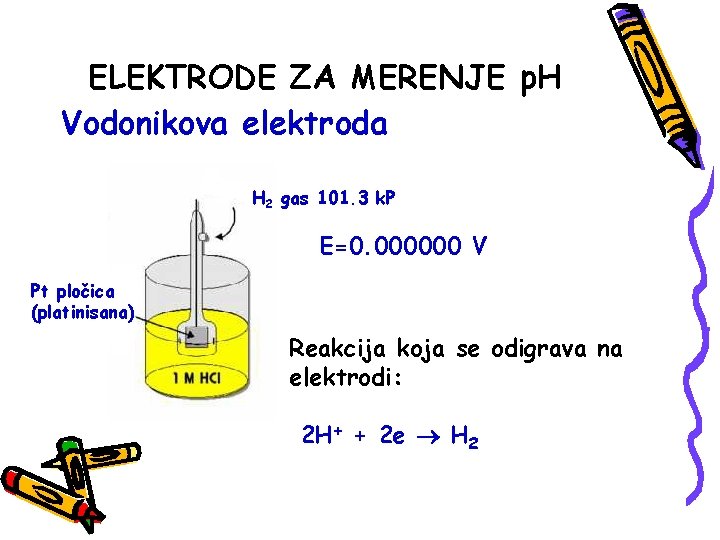
ELEKTRODE ZA MERENJE p. H Vodonikova elektroda H 2 gas 101. 3 k. P E=0. 000000 V Pt pločica (platinisana) Reakcija koja se odigrava na elektrodi: 2 H+ + 2 e H 2

Pored toga što je konstrukcijski komlikovana, vodonikova elektroda se ne može primeniti u rastvorima u kojima se nalazi neko oksidaciono ili redukciono sredstvo Vodonikova elektroda može biti referentna (standardna) i ponaša se kao da je iskovana od gasovitog vodonika.


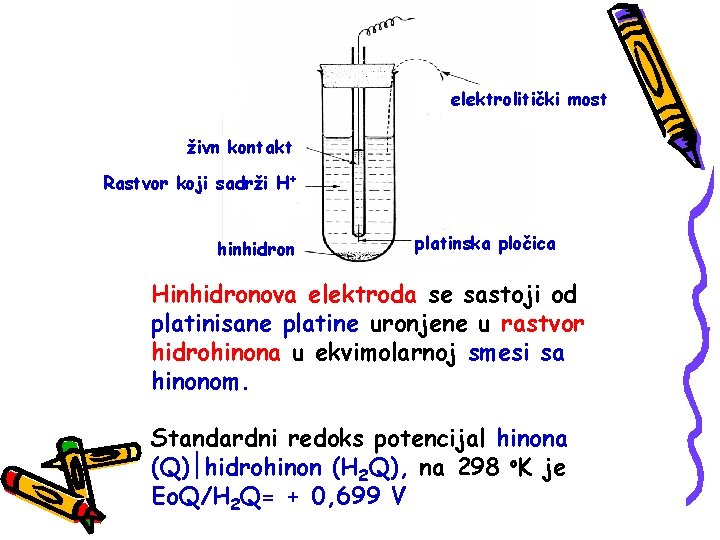
HINHIDRONOVA ELEKTROHA Mnoge teškoće povezane sa radom sa vodonikovom elektrodom mogu biti prevaziđene upotrebom hinhidronove elektrode. C 6 H 4 O 2 + 2 H+ + 2 e C 6 H 4(OH)2

elektrolitički most živn kontakt Rastvor koji sadrži H+ hinhidron platinska pločica Hinhidronova elektroda se sastoji od platinisane platine uronjene u rastvor hidrohinona u ekvimolarnoj smesi sa hinonom. Standardni redoks potencijal hinona (Q) hidrohinon (H 2 Q), na 298 o. K je Eo. Q/H 2 Q= + 0, 699 V

Kada se sistem: platina u zasićenom rastvoru hinhidrona upotrebi kao indikatorska elektroda, ravnotežni potencijal dat je Nernst-ovim izrazom: C Q = C H 2 Q

Iako se hinhidronova elektroda lako pravi a dostupna je svakom analitičaru ona ipak ima ograničenu upotrebu. Kao i vodonikova i ovo je redoks elektroda i ne može se primeniti u rastvorima koji sadrže redukcione ili oksidacione agense Pored toga ova elektroda se ne može upotrebiti u rastvorima koji imaju p. H vrednost veću od 8

ANTIMONOVA ELEKTRODA Ima svoju najveću primenu kod ne suviše tačnih, pogonskih merenja, naročito u protočnim sistemima Veoma je pogodna zbog svoje mehaničke postojanosti i veoma jednostavne izrade U staklenoj cevčici se na plameniku istopi antimon, doda se bakarni kontakt Nakon hlađenja staklo se razbije i elektroda je spremna za upotrebu

Svaki metal (uključujući i platinu) prevučena je tankim slojem oksida, a kod antimonove elektrodna reakcija je sledeća: Sb 2 O 3 + 6 H 3 O+ + 6 e 2 Sb + 9 H 2 O Za redoks par Sb/Sb 3+ Eo= +0, 212 V

Ne može se primeniti u jako kiselim sredinama, u prisustvu organskih kompleksirajućih kiselina (vinska), kao i u prisustvu oksidacionih i redukcionih agenasa.

BIZMUTOVA ELEKTRODA Slična je antimonovoj elektrodi i može da se napravi na sličan način Standardni potencijal Bi/Bi 3+ iznosi +0, 320 V

Kao i u slučaju antimonove elektrode nema dovoljno sigurno definisan potencijal. Ova elektroda takođe služi za pogonska merenja, a pored toga se kao i antimonova uspešno koristi u neutralizacionim titracijama, kada nije potrebno tačno znati p. H vrednost, već je dovoljno pratiti njenu promenu Kao i antimonova i bizmutova elektroda je redoks elektroda.

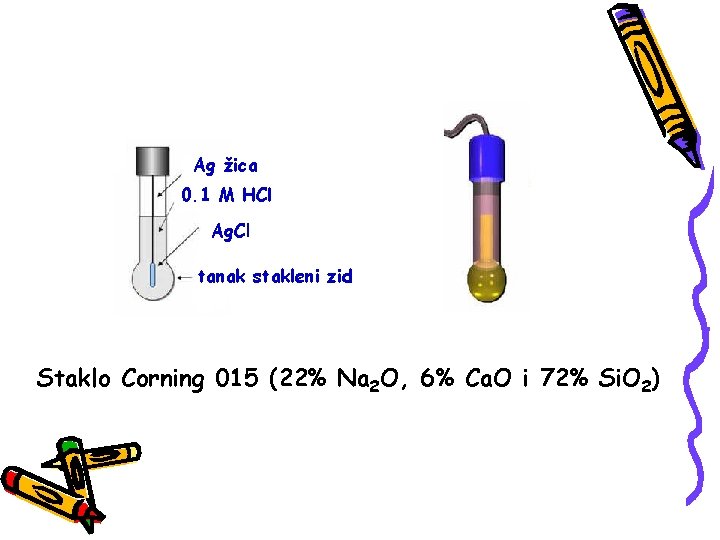
STAKLENA ELEKTRODA Mada je mehanički najosetljivija, staklena elektroda predstavlja najčešće primenjivanu i skoro univerzalnu elektrodu za merenja p. H vrednosti. Merenje p. H vrednosti staklenom elektrodom svodi se na merenje razlike potencijala sledećeg sistema: Ag Ag. Cl(s), HCl(0, 1 M) st. membrana Cx H 3 O+ Hg 2 Cl 2(s), KCl Hg

Ag žica 0. 1 M HCl Ag. Cl tanak stakleni zid Staklo Corning 015 (22% Na 2 O, 6% Ca. O i 72% Si. O 2)

Nije redoks elektroda. Pored mehaničke osetljivosti, kod staklene elektrode, problem predstavlja kisela a posebno alkalna greška

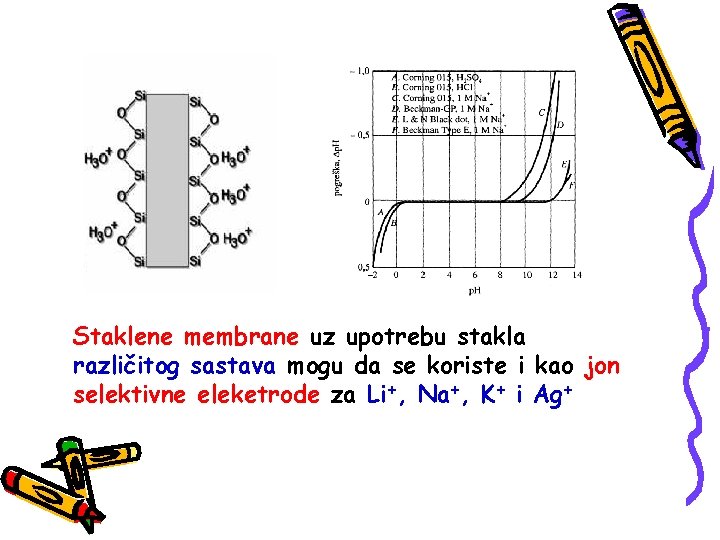
Staklene membrane uz upotrebu stakla različitog sastava mogu da se koriste i kao jon selektivne eleketrode za Li+, Na+, K+ i Ag+

Zbog asimetričnog potencijala prilikom merenja staklenom elektrodom uvek se radi prethodna kalibracija prema poznatim puferskim rastvorima Vremenom se smanjuje nagib potencijala staklene elelktrode (59 m. V) pa je to dodatni razlog za kalibraciju Postoje i čip elektrode za merenje p. H

JON-SELEKTIVNE ELEKTRODE Određivanje koncentracije jona jon-selektivnom elektrodom je “nedestruktivna” metoda. Određivanje traje samo kratko vreme. Potrebna je samo mala količina rastvora (do 0, 01 cm 3). Postoji mogućnost kontinualnog praćenja koncentracije jona u protočnim sistemima (F-, NH 4+, CN-).

Koriste se za izradu uređaja za automatsko određavanje nivoa koncentracije jona u tehničkim protočnim sistemima (F- u vodi). Određivanje koncentracija je u opsegu od 10 -7 – 10 -1 M, mada se u pojedinim slučajevima mogu odrediti i koncentracija manje od 10 -7 M. Ovaj opseg koncentracija, zajedno sa jednostavnošću i brzinom određivanja, omogućavaju njihovu primenu u analizi nečistoća u različitim proizvodima.

Analiza zemljišta, biološkog materijala, zagađenja vode, kvaliteta prirodnih voda, voda za piće, krvi, farmaceutskih proizvoda kao i u nizu fundamentalnih i primenjenih istraživanja. Početni radovi o jon-selektivnim elektrodama počeli su ispitivanjima Cremer-a 1906. i Haber-a 1909. god. koji su otkrili da staklena elektroda registruje koncentraciju vodoničnih jona i da je promena potencijala elektroda sa koncentracijom saglasna sa Nernstov-im izrazom.

Lengey i Blum su 1934. god. su našli da elektrode od stakla koje sadrže Al 2 O 3 i B 2 O 3 menjaju potencijal sa koncentracijom natrijumovih jona prema Nernst-ovoj jednačini. Tendeloo je 1936. god. prvi upotrebio membranu od Ca. F 2 (fluorit) za detekciju Ca 2+ jona. Kltkofi i Sanders su 1936. god. su konstruisali elektrodu sa membranom od srebro-halogenida za detekciju jona halogena.

Za detekciju katjona pokušana je konstrukcija membrana od prirodnih zeolita Marshall 1942. kolodijuma, Solner 1943 -1946. god. Wyllie i Patenode 1950 god. za detekciju katjona i anjona koriste heterogenu mambranu od sintetičkih jonoizmenjivača, a za matricu internu supstancu (polistiren), u kojoj je rastvorena aktivna supstanca. Pungor i Hollos-Rokosiniyi 1961. god. su koristili Ag. J kao aktivnu supstancu u matrici od parafina za građenje membrana p. J elektrode.

Pungor i saradnicu su od 1961 -1965. god. razvili niz jon-selektivnih elektroda na bazi heterogenih membrana, sa silikonskom gumom kao matricom i teško rastvornih soli odgovarajućih supstanci kao aktivnom komponentom. Ove elektrode su bile prve “prave” jonselektivne elektrode čiji je potencijal termodinamički reversibilan u odnosu na koncentraciju primarnih jona. Od 1965. god. jon-selektivne elektrode za stebro i halogene su počele komercijalno da se proizvode.

Dalji razvoj jon-selektivnih elektroda počinje od rada Frant-a i Ross-a 1966. god. koji su za gradnju jon-selektivne fluoridne elektrode upotrebili membranu od kristala La. F 3 dopingovanog malim količinama europijuma. Jon-selektivnu elektrodu sa tečnom membranom za detekciju kalcijuma razvio je Ross 1967. god. koristeći kalcijum-didodecilfosfat u di-noktilfenil fosfonatu dok je kao matrica služio filter.

Za gradnju membrana od elektron-neutralnih aktivnih supstanci ideju su dali Stefanec i Simon 1966. god. kao kod kalijumov jonselektivne elektrode gde je kao aktivna supstanca antibiotik valinomicin rastvoren u difeniletru. Koristeći matricu od poroznog grafita koji se natopi rastvorom odgovarajuće soli primarnog jona u organskom rastvaraču, Ružička i saradnici su 1971. god. su razvili elektrodu koja izmenom rastvora može da služi za selektivnu detekciju više jonskih vrsta.

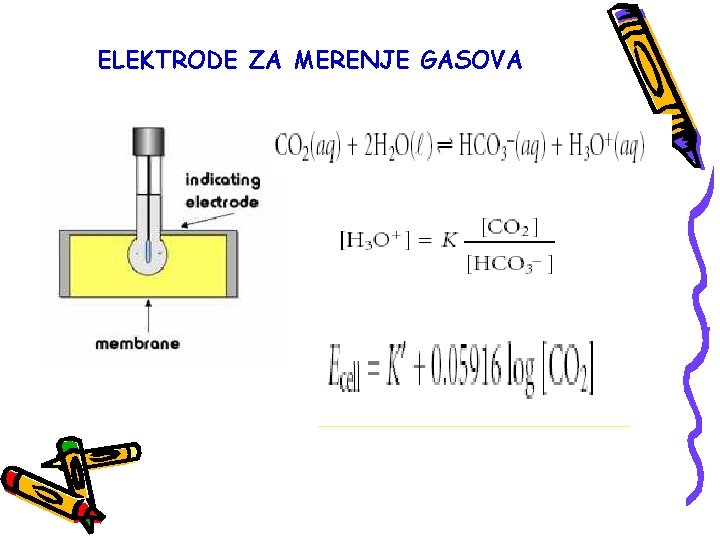
Posebnu vrstu jon-selektivnih elektroda pretstavljaju detektori gasa, pomoću kojih se mogu odrediti koncentracije gasovite supstance u rastvoru ili u gasnoj fazi. Detekcija se zasniva na korišćenju membrane koja propušta gas u unutrašnji detektor (hidrofobna membrana) unutar koje se nalazi odgovarajuća jon-selektivna elektroda i elektrolit. Rastvaranjem gasa u elektrolitu dobijaju se joni na koje reaguje jon selektivna elektroda.

Prve dodatke za detekciju gasa dali su Stow, Bear i Randall 1957. god. i to a detekciju CO 2 u krvi. Kombinacija jon-selektivnih elektroda i različitih dodatnih detektora dala je mogućnost za stvaranje senzora za određivanje niza supstanci. Primer je enzimski senzor kod koga se enzimskom reakcijom urea razlaže do amonijaka koji se određuje amonijačnom jon-selektivnom elektrodom.

Konstrukcijom hiralnih elektroda moguće je razlikovati prisustvo enantiomera. Halkogenidna stakla se mogu koristiti za detekciju gvožđa i bakra. Zamenom oksidnih poluprovodnika jonselektivnim membranama konstruisan je senzor u kome je struja, koja prolazi kroz tranzistor, regulisana potencijalom jon-selektivne membrane.

TERMINOLOGIJA IUPAC-ova -Jon-selektivna elektroda Elektrohemijski senzor koji reaguje na aktivnost jona prema Nernst-ovoj jednačini, nekad i sa subnernstovskim nagibom. Elektroda ne meri direktno potencijal kao elektrode prvog i drugog reda.

-Uređaj za detekciju gasa (gasni detektor) Ovaj uređaj predstavlja kompletnu elektrohemijsku ćeliju sa referentnom i detektorskom elektrodom. -Primarni jon Jon za čije je merenje konstruisana elektroda (K+ za kalijumovu jonselektivnu elektrodu).

Vreme odgovora Vreme potrebno da jon-selektivna elektroda ili uređaj za detekciju gasa postigne potencijal manji za 1 m. V od krajnjeg ravnotežnog potencijala nakon pretpostavljene trenutne promene aktivnosti određenog jona. Koeficijent selektivnosti Merilo selektivnosti elektrode za primarni jon A u prisustvu interferirajućeg jona B.

Granica detekcije Koncentracija određivane supstance A pri kojoj potencijal elektrode odstupa za 18/z. A m. V od pravolinijskog dela kalibracionog dijagrama.

PRINCIPI MERENJA KONCENTRACIJE JONA Za merenje jon-selektivnom elektrodom koristi se elektrohemijska ćelija: Referentna elektroda rastvor jon-selektivna elektroda EMS = Ers - Ej ukoliko je potencijal sistema referentne elektrode (Ers) pozitivniji od potencijala jonselektivne elektrode (Ej) u suprotnom slučaju njihova mesta se u jednačini zamenjuju.

Kako je potencijal referentne elektrode konstantan, promena EMS ćelije potiče jedino od promene potencijala jonselektivne elektrode prouzrokovane promenom aktivnosti primarnih jona u rastvoru. Potencijal jon-selektivne elektrode daje se obično u odnosu na potencijal sistema referentne elektrode, što znači da je elektromotorna sila ćelije jednaka relativnom potencijalu jon-selektivne elektrode.

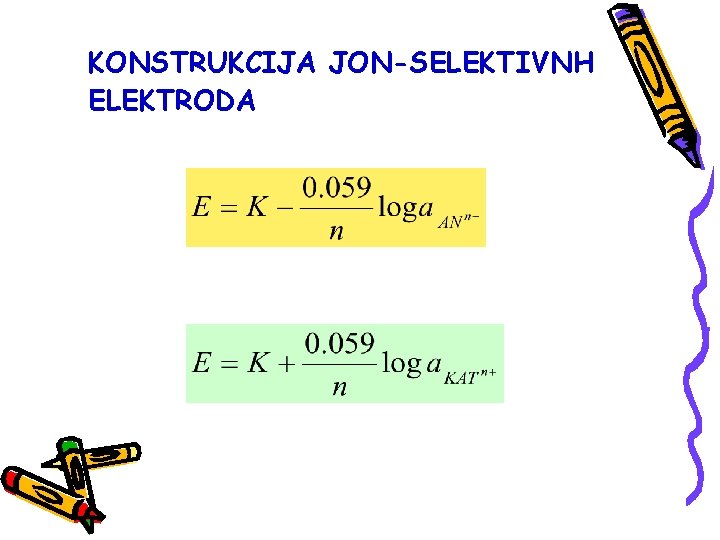
U slučaju da je iz potencijala jonselektivne elektrode potrebno izračunati aktivnost jona, ili neku drugu veličinu, potrebno je znati tačnu vrednost potencijala referentne elektrode. Zavisnost potencijala jon-selektivne elektrode od aktivnosti primarnih jona definisana je jednačinom Nernst-ovog tipa iako jon-selektivne elektrode nisu elektrode ni prvog ni drugog tipa.

Konstanta može imati vrednosti standardnog potencijala ili različite od njih zavisno od tipa jon-selektivne elektrode i odgovarajućeg procesa uspostavljanja potencijala. Potencijal jon-selektivne elektrode je linearna funkcija logai.

Ukoliko se umesto aktivnosti upotrebljava koncentracija, onda zbog značajnije promene faktora aktiviteta pri koncentracijama većim od 10 -4 M dolazi do odstupanja od prave linije. Zbog toga je neophodno održavati konstantnu jonsku silu rastvora , pa prema tome i konstantnu vrednost faktora aktivnosti primarnih jona pomoću viška internog elektrolita.

Na ovaj način se dobija pravolinijska zavisnost potencijala jon-selektivne elektrode od log. Ci. Ovo znači da se prilikom određivanja jonske vrste, metodom kalibracionog dijagrama, merenje potencijala jon-selektivnom elektrodom mora izvoditi pri istoj jonskoj sili u standardnim rastvorima kao i u uzorcima. Treba naglasiti da na potencijal jon-selektivne elektrode utiču samo “slobodni” primarni joni a ne oni vezani u kompleks ili nedisosovano jedinjenje, što je bitna razlika od drugih metoda (polarografija, kulometrija, elektrogravimetrija)

SELEKTIVNOST JON-SELEKTIVNIH ELEKTRODA Iako se očekuje da jon-selektivna elektroda reaguje samo na primarne jone, ne postoji ni jedna koja neće reagovati na prisustvo drugih jona. Iz ovoga proizilazi da će u prisustvu interferirajućih jona potencijal elektrode zavisiti i od koncentracije primarnih i koncentracije interferirajućih jona.

GRANICA DETEKCJE Granica detekcije je definisana na više načina zavisno od tipa elektrode i načina merenja. Kako kalibracioni dijagram u širem opsegu koncentracija nakon pravolinijskog dela prelazi u krivolinijski, to se definiše i Nernstovska granica detakcije koji pretstavlja minimalnu koncentraciju ispod koje kalibracioni dijagram odstupa od prave linije. Ova granica i pravolinijski deo se najčešće koriste.

Nagib pravolinijskog dela prema jednačini za potencijal jon-seletivne eketrode treba da iznosi 59 m. V na 25 o. C. Kao Nernstovski nagibi uzimaju se i oni do 55 m. V, dok se kod jon-selektivnih elektroda, kod kojih je nagib manji od 55 m. V koristi termin subnersntovski nagib pod uslovom da je potencijal elektrode linearna funkcija lnai.

Krivolinijski deo dijagrama pri manjim koncentracijama karakteriše sva manja reverzibilnost, što doprinosi povećanju vremena odgovora elektrode, odnosno povećanju broja tačaka za konstrukciju kalibracionog dijagrama. Granica detekcije i Nernstovska granica detekcije zavise takođe i od rastvora elektrolita. Najniža granica detekcije dobija se u čistim razblaženim rastvorima primarnih jona.

Povećanje ukupne koncentracije supstanci u rastvoru i prisustvo interferirajućih jona pomera ovu granicu ka višim vrednostima, što praktično znači da one zavise od sastava elektrolita u kome se izvodi merenje. Vrsta jon-selektivne elektrode utiče na obe granice detekcije jona. Kalijumova elektroda sa membranom od stakla ima za dve potence veću granicu detekcije od elektrode sa tečnom membranom (sa valinomicinom)

Kod srebro-halogene membrane granica detekcije je određena proizvodom rastvorljivosti određenog srebro-halogenida. Ukoliko je koncentracija jona srebra ili halogena, u čistim rastvorima niža od koncentracije određene proizvodom rastvorljivosti, doći će do rastvaranja membrane. Ova pojava onemogućava merenje nižih koncentracija.

Pored toga kod ovih membrana sniženje temperature povećava granicu detekcije usled smanjenja proizvoda rastvorljivosti. Kod membrana sa jonoizmenjivačima (čvrstim ili tečnim) na granicu detekcije utiču i veličine koje definišu potencijal membrane, koje je teško odrediti da bi se omogućilo izračunanje granice detekcije.

VREME ODGOVORA Vreme postizanja ravnotežnog potencijala elektrode je takođe bitna karakteristična veličina za jon-selektivnu elektrodu i nije jednoznačno određena. Ukoliko je veća koncentracija primarnih jona vreme odgovora je kraće. Najkraće vreme odgovora imaju elektrode sa čvrstom membranom i ono se kreće od nekoliko desetina sekundi do desetak minuta.

Kod jon-selektivnih elektroda sa tečnim ili čvrstim jonoizmenjivačkim membranama je od nekoliko do trideset minuta. Pored vrste membrane i načina njene izrade, koncentracija elektrolita, vrsta elektrolita i sl. imaju odraz na vreme odgovora, pa je njegova vrednost vezana za promenu parametara a ne za vrstu jona koji se određuje.

KONSTRUKCIJA JON-SELEKTIVNH ELEKTRODA

Elektrode sa čvrstim kontaktom Elektrode sa unutrašnjim referentnim rastvorom Elektrode sa čvrstom membranom Eletrode sa tečnom membrenom Uređaji za detekciju gasova (CO 2) Potenciometrijski biosenzori (enzimske elektrode)

Ag žica telo Ag 2 S/Ag. Cl p. Cl- Membrane od teško rastvornih soli mogu se primeniti kad u kristalu odgovarajuće soli postoji neka mobilna jonska vrsta koja može da prenosi naelektrisanje.

Kod membrana na bazi srebro-halogenida to su Ag+ joni koji se Frenkel-ovim mehanizmom kreću kroz membranu. Kod membrana od La. F 3 to su F- joni dok je jon La. F 2 - čvrsto vezan. Dodatak Eu poboljšava provodjenje ove membrane usled defekata u kristalnoj strukturi. Unutrašnje referentne elektrode kod Ag. Cl membrana sadrže Cl- jon dok kod La. F 3 sadrže F - jon. Kod Ag. X membrana moguć je i čvrsti kontakt srebrom u prahu.

Poboljšane Ag. X membrane dobijaju se dodavanjem Ag 2 Sx. Ag. X. Dobijanjem membrana od sulfida Ag+, Cu 2+ , Pb 2+, Hg 2+ i Cd 2+ dobijaju se elektrode selektivne za te katjone. Selktivna elektroda za Cs ima matricu od Cs-12 -molibdofosfata a za K od valinomicina.

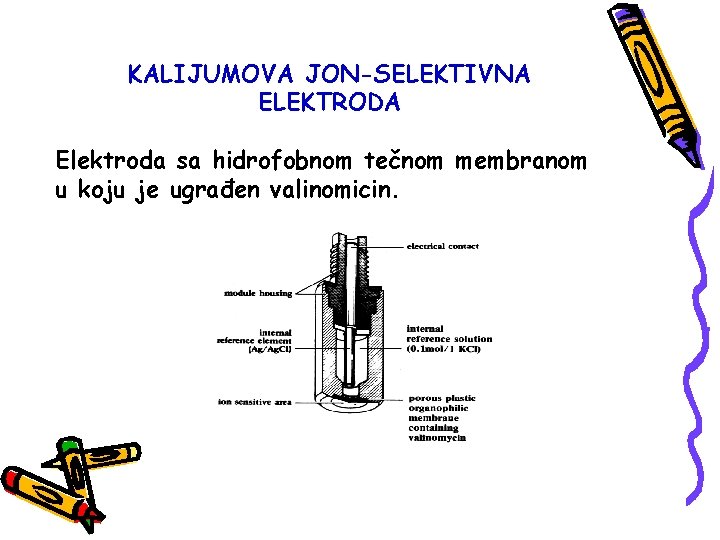
ELEKTRODE SA TEČNOM MEMBRANOM Kod ovih elektroda je rastvorljivost soli korespodentnih jona manja u vodi nego u organskom rastvaraču. K-selektivna elektoda ovog tipa sadrži valinomicin rastvoren u difenil-etru, vrlo je selektivna na alkalne jone i ima granicu detekcije 10 -5.

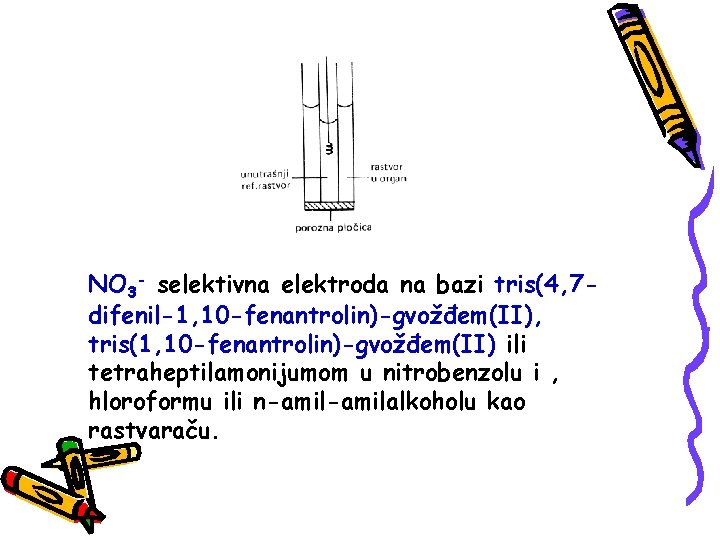
NO 3 - selektivna elektroda na bazi tris(4, 7 difenil-1, 10 -fenantrolin)-gvožđem(II), tris(1, 10 -fenantrolin)-gvožđem(II) ili tetraheptilamonijumom u nitrobenzolu i , hloroformu ili n-amilalkoholu kao rastvaraču.

KALIJUMOVA JON-SELEKTIVNA ELEKTRODA Elektroda sa hidrofobnom tečnom membranom u koju je ugrađen valinomicin.



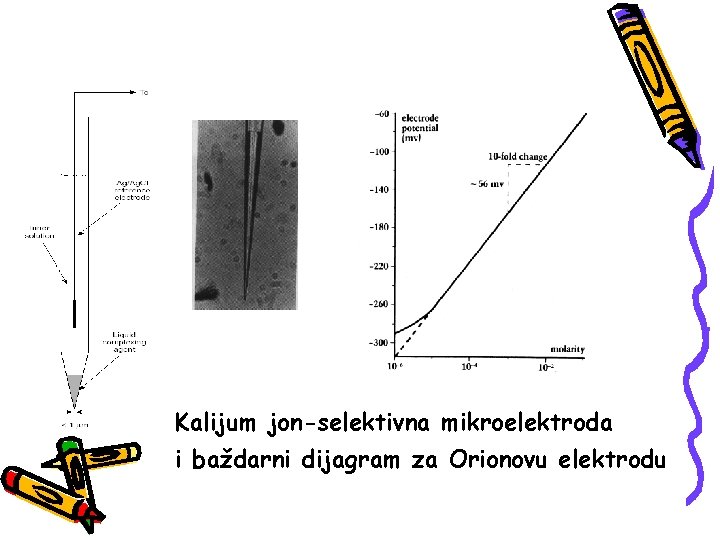
Kalijum jon-selektivna mikroelektroda i baždarni dijagram za Orionovu elektrodu

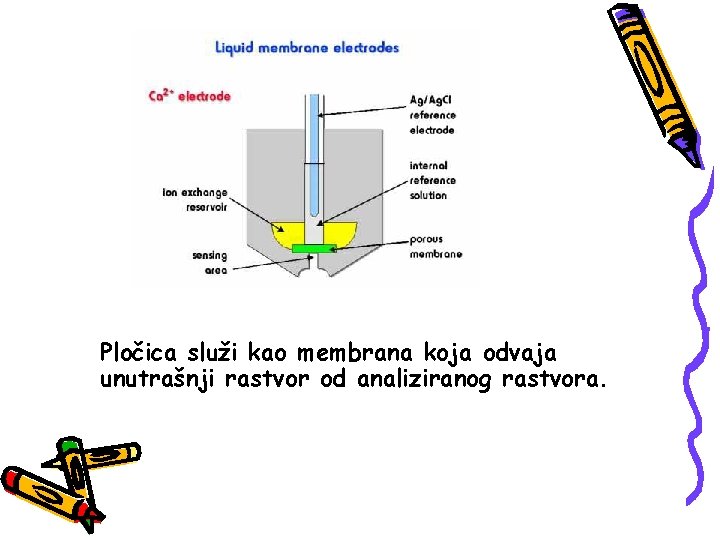
ELEKTRODA ZA ODREĐIVANJE Ca 2+ Sastoji se iz tečne membrane koja selektivno veže jone kalcijuma iz unutrašnjeg rastvora stalne koncentracije i srebrne elektrode presvučne srebro -hloridom (unutrašnja referentna elektroda). Aktivni sastojak membrane je jonski izmenjivač na bazi kalcijum-dialkilfosfata koji je nerastvoran u vodi. Pod dejstvom gravitacije jonski izmenjivač rastvoren u organskom rastvaraču ulazi u pore hidrofobne porozne pločice.

Pločica služi kao membrana koja odvaja unutrašnji rastvor od analiziranog rastvora.

Kod novijeg tipa Ca elektroda jonski izmenjivač se fiksira čvrstom polivinilnom gelu.
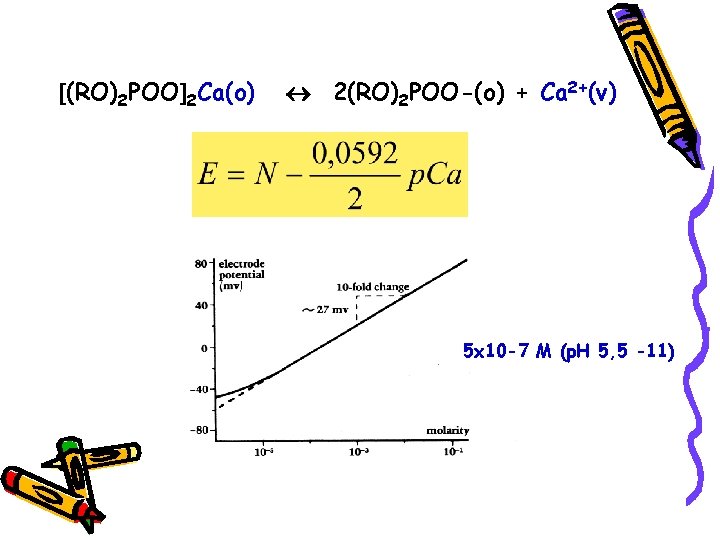
(RO)2 POO 2 Ca(o) 2(RO)2 POO-(o) + Ca 2+(v) 5 x 10 -7 M (p. H 5, 5 -11)

ELEKTRODE ZA MERENJE GASOVA



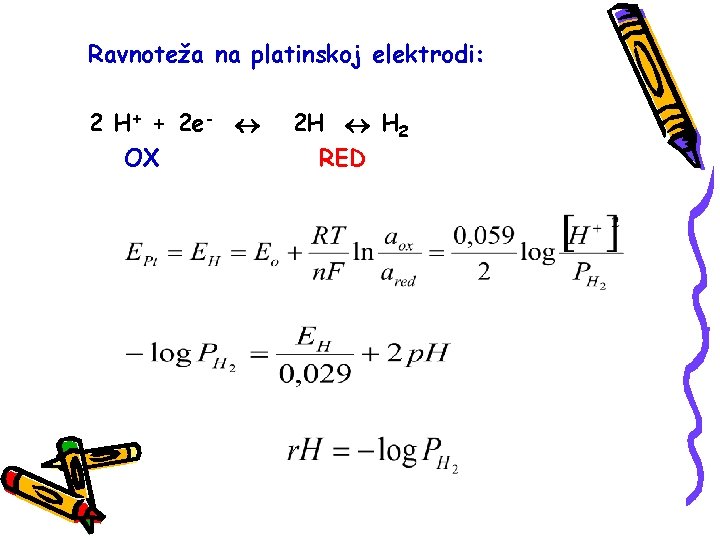
r. H –VREDNOST r. H je veličina koju je 1926. godine uveo Clark kao meru oksido-redukcionih osobina sistema. Predstavlja negativan logaritam pritiska molekulskog vodonika. Clark je pošao od pretpostavke da u bilo kome sistemu u koji uronimo Pt-elektrodu imamao H+ kao oksidovani i H 2 kao redukovani oblik.

Ravnoteža na platinskoj elektrodi: 2 H+ + 2 e- OX 2 H H 2 RED

Skalu obuhvata vrednosti od potencijala normalne vodonične elektrode (r. H=0) do potencijala kiseonične elektrode (r. H=41, 7) r. H neutralno (r. H=28) kad je pritisak O 2 i H 2 isti. Dobra vina imaju r. H 15 (13, 5 -18, 0)


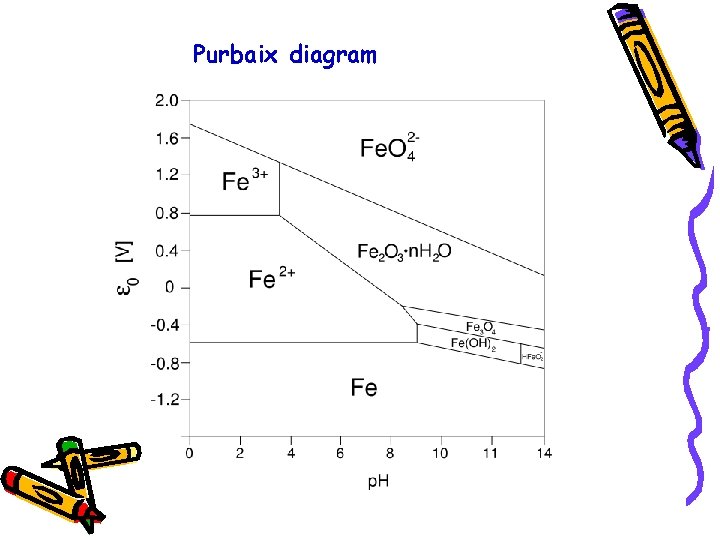
Purbaix diagram


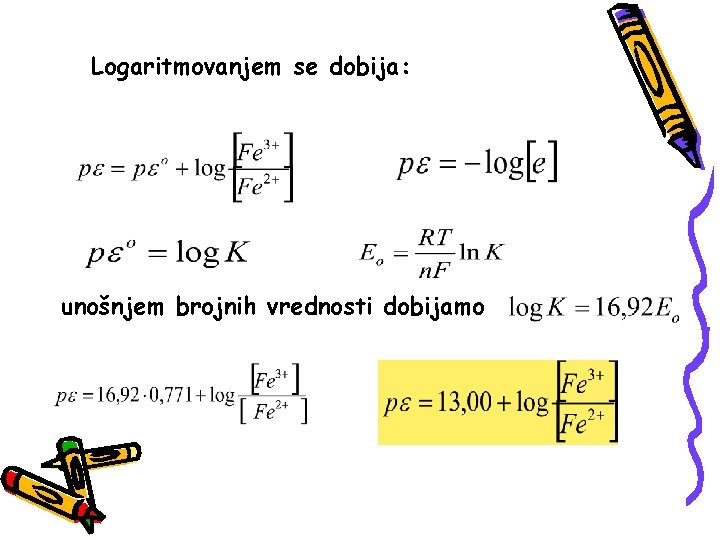
KONCEPT p Oksido-redukciona sposobnost konkretne sredine karakteriše se veličinom p. Ova karakteristika sredine omogućava donošenje zaključka o tome, da li se neka supstanca u datoj sredini nalazi u oksidovanim ili redukovanom obliku.

Posmatrajmo jednostavnu reakciju: Fe 3+ + e- Fe 2+ Eo = 0, 771 V Iako se u rastvoru ne nalaze slobodni elektroni možemo napisati:

Logaritmovanjem se dobija: unošnjem brojnih vrednosti dobijamo

Poredjenje veličina p i p. H

Oblasti stabilnosti vode i p /p. H karakteristike prirodnih voda

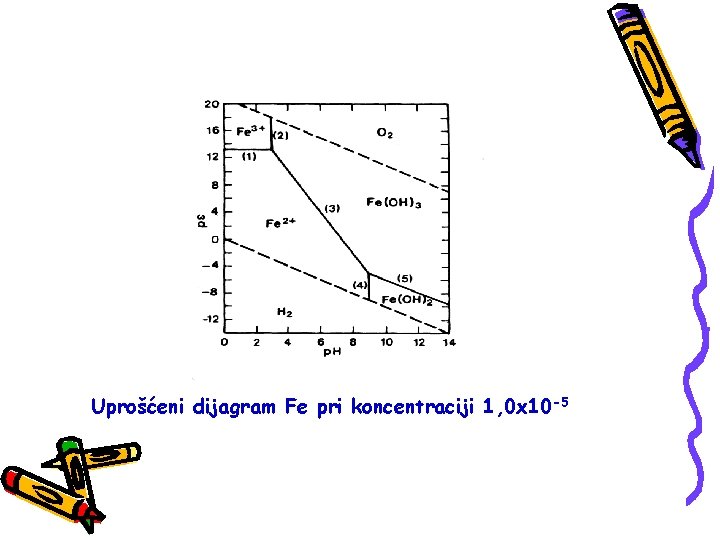
Uprošćeni dijagram Fe pri koncentraciji 1, 0 x 10 -5

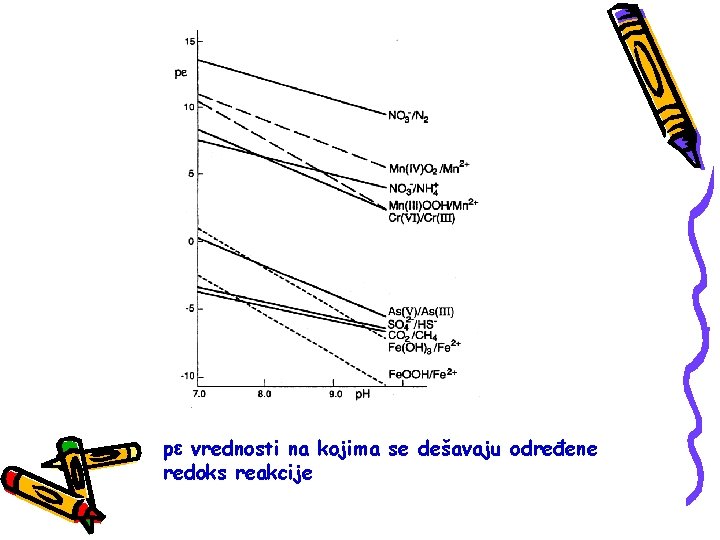
p vrednosti na kojima se dešavaju određene redoks reakcije
 Instrumentalna analiza
Instrumentalna analiza Instrumentalna analiza
Instrumentalna analiza Instrumentalna analiza
Instrumentalna analiza Instrumentalna analiza
Instrumentalna analiza Krajša instrumentalna skladba
Krajša instrumentalna skladba Gis hzs pk
Gis hzs pk Gis hzs
Gis hzs Gis hzs pk
Gis hzs pk Statusy hzs
Statusy hzs Alexander settles
Alexander settles Profesor de operaciones unitarias
Profesor de operaciones unitarias Felul unui adjectiv
Felul unui adjectiv Profesor milorad jankovic
Profesor milorad jankovic Profesor przewratil
Profesor przewratil Profesor tica
Profesor tica Dijastereoizomeri
Dijastereoizomeri Profesor martin
Profesor martin Moje buduce zanimanje crtez
Moje buduce zanimanje crtez Atributos de un profesor
Atributos de un profesor El tiempo de permanencia del profesor santos
El tiempo de permanencia del profesor santos Domeny kolizyjne i rozgłoszeniowe
Domeny kolizyjne i rozgłoszeniowe Profesor itk
Profesor itk Milic simic profesor
Milic simic profesor Profesor jano
Profesor jano Simona podgoreanu
Simona podgoreanu Dr sead dizdarevic tuzla
Dr sead dizdarevic tuzla Skim perkhidmatan pensyarah universiti
Skim perkhidmatan pensyarah universiti El profesor nelson explica a sus alumnos
El profesor nelson explica a sus alumnos Nebojsa pusara profesor
Nebojsa pusara profesor Nombre de pas
Nombre de pas Mientras _______ el profesor yo siempre ______ notas.
Mientras _______ el profesor yo siempre ______ notas. Historia de ron clark pelicula en español
Historia de ron clark pelicula en español Profesör gg tr
Profesör gg tr El profesor holland
El profesor holland Profesor magdalena strus
Profesor magdalena strus Resumen de el asesinato del profesor de matematicas
Resumen de el asesinato del profesor de matematicas Profesor indrumator
Profesor indrumator Desarrollo de la geografía en panamá
Desarrollo de la geografía en panamá Plavi lonac priča
Plavi lonac priča Adraz
Adraz Budenbrookovi
Budenbrookovi Calcula lleva acento
Calcula lleva acento Nenad glumbic fasper
Nenad glumbic fasper Profesor pdf
Profesor pdf Profesor milorad jankovic
Profesor milorad jankovic Reprezentanti ai postmodernismului
Reprezentanti ai postmodernismului Ass amina
Ass amina Web del profesor
Web del profesor Bullying al profesor
Bullying al profesor Placement of adjectives
Placement of adjectives La lengua de las mariposas
La lengua de las mariposas Profesor newton
Profesor newton Structura angiospermelor
Structura angiospermelor Este un profesor iluminist
Este un profesor iluminist Elena doamna
Elena doamna Profesor baltazar nastavni listić
Profesor baltazar nastavni listić Semi formal letter
Semi formal letter Causas basicas factores de trabajo
Causas basicas factores de trabajo Fisa postului profesor itinerant de sprijin
Fisa postului profesor itinerant de sprijin Istilah jejaring sosial diperkenalkan oleh profesor j
Istilah jejaring sosial diperkenalkan oleh profesor j Liceul teoretic
Liceul teoretic Luis alvarado cieza
Luis alvarado cieza Usted y el profesor ruiz subject pronoun
Usted y el profesor ruiz subject pronoun Webdelprofesor
Webdelprofesor Primary meaning
Primary meaning Pengasas pengakap dunia
Pengasas pengakap dunia Istilah jejaring sosial diperkenalkan oleh profesor j
Istilah jejaring sosial diperkenalkan oleh profesor j Principii poo
Principii poo Kewajiban khusus profesor
Kewajiban khusus profesor Binomul lui newton formula
Binomul lui newton formula Profesor tica
Profesor tica Master profesor predmetne nastave
Master profesor predmetne nastave Diferenciaciones de membrana
Diferenciaciones de membrana Curso profesor de yoga intensivo
Curso profesor de yoga intensivo Professor gaia
Professor gaia Robert lembrych furtak
Robert lembrych furtak Profesor hel
Profesor hel Profesor nicolae cretu
Profesor nicolae cretu Prof wojciech krajewski
Prof wojciech krajewski Profesor descubridor
Profesor descubridor Perfil del profesor de religión
Perfil del profesor de religión Profesor jano
Profesor jano Raport de activitate educatoare online
Raport de activitate educatoare online Punoznačne riječi
Punoznačne riječi Izzi nastava na daljinu
Izzi nastava na daljinu Esej cvijet s raskršća
Esej cvijet s raskršća Analiza fazowa
Analiza fazowa Eli eli lama azavtani analiza pjesme
Eli eli lama azavtani analiza pjesme Dijalektna pjesma
Dijalektna pjesma Feal široki brijeg
Feal široki brijeg Swot analysis of samsung
Swot analysis of samsung Analiza sieciowa
Analiza sieciowa Sunovrati william wordsworth
Sunovrati william wordsworth Okovani prometej analiza
Okovani prometej analiza Vrio analiza
Vrio analiza Analiza kluczowych czynnikow sukcesu
Analiza kluczowych czynnikow sukcesu Sve zbog jednog dječaka pdf
Sve zbog jednog dječaka pdf Ce este o serie spectrala
Ce este o serie spectrala Osobine lisice u basnama
Osobine lisice u basnama Ivan cankar bobi obnova
Ivan cankar bobi obnova Strah od knjige suzana tamaro analiza
Strah od knjige suzana tamaro analiza Fmea analiza
Fmea analiza Zaljubljen do ušiju likovi
Zaljubljen do ušiju likovi Modelul porter pentru o firma
Modelul porter pentru o firma Tehno ekonomska analiza
Tehno ekonomska analiza Wskaźnik łatwości zadań
Wskaźnik łatwości zadań 3čave pjesme interpretacija
3čave pjesme interpretacija Analiza posla
Analiza posla Ekonomska analiza privrednih subjekata
Ekonomska analiza privrednih subjekata Dnevnik pauline p osobine glavnog lika
Dnevnik pauline p osobine glavnog lika Kolajna analiza
Kolajna analiza Alisa u zemlji cuda likovi
Alisa u zemlji cuda likovi Analiza konkurencije
Analiza konkurencije Pjesma mrtvog pjesnika analiza
Pjesma mrtvog pjesnika analiza Mali pot ivan goran kovačić analiza pjesme
Mali pot ivan goran kovačić analiza pjesme