Instrumentalna analiza Profesor Hemije Ciklina voltametrija Dr D

















- Slides: 33

Instrumentalna analiza , Profesor Hemije Ciklična voltametrija Dr D. Manojlović, Hemijski fakultet Beograd

Voltametrijske metode se zasnivaju na promeni potencijala stacionarne radne elektrode sa vremenom i merenja odgovarajuće struje koja se javlja kao posledica redukciono-oksidacionih procesa U toku preliminarnih istraživanja elektrohemijskog ponašanja ispitivanog sistema, upravo se koriste voltametrijske tehnike. Snimljeni voltamogrami predstavljaju svojevrsne “elektrohemijske spektre”.

“Elektrohemijski spektri” pokazuju: potencijale na kojima se dešavaju oksidacioni ili redukcioni procesi, učešće homogenih reakcija u ukupnom elektrohemijskom procesu adsorpciju elektroaktivnih vrsta i slične informacije o ponašanju ispitivanog sistema.

Najjednostavnija od ovih tehnika je voltametrija sa linearnom promenom potencijala “linearna voltametrija (LV)”, kod koje se potencijal menja od početne vrednosti E 1 do vrednosti E 2 određenom brzinom v. Potencijal E 1 Vreme E 2

ELEKTRODE I ĆELIJE

Reverzibilni (Nernst-ovski) sistemi Da bi videli kako nastaju voltamogrami razmotrićno jednostavnu reverzibilnu elektrohemijsku reakciju predstavljenu jednačinom: U slučaju da se potencijal menja vrlo sporo dobijeni voltamogrami će biti identični ravnotežnoj polarizacionoj I-E krivi.

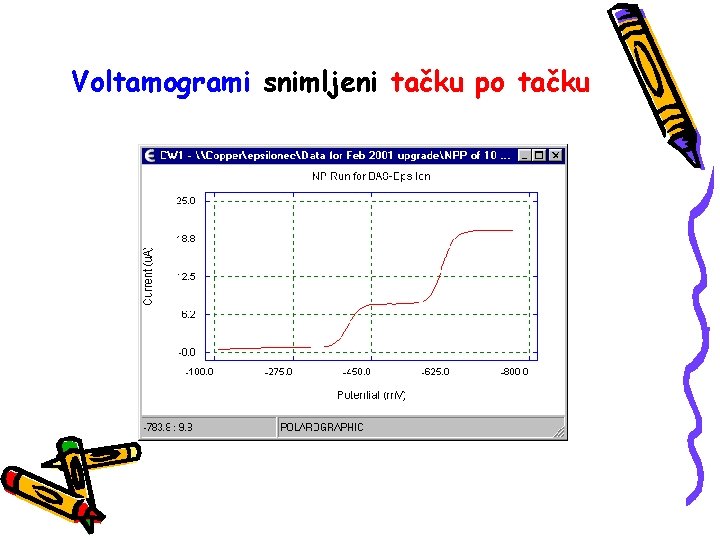
Voltamogrami snimljeni tačku po tačku

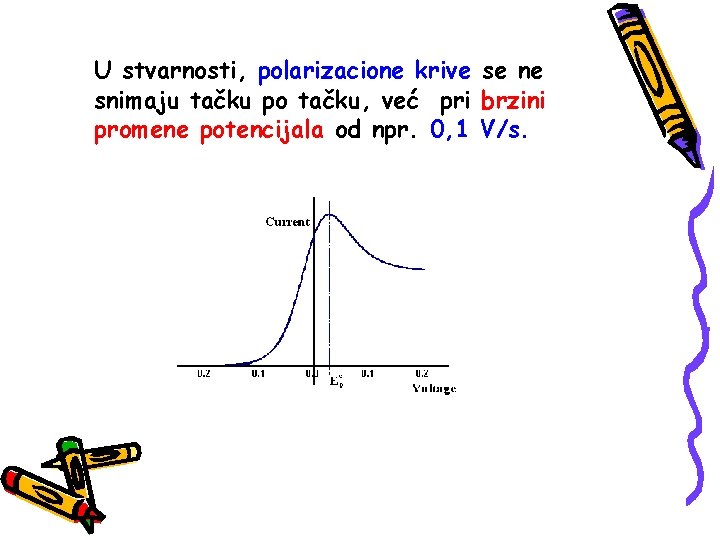
U stvarnosti, polarizacione krive se ne snimaju tačku po tačku, već pri brzini promene potencijala od npr. 0, 1 V/s.

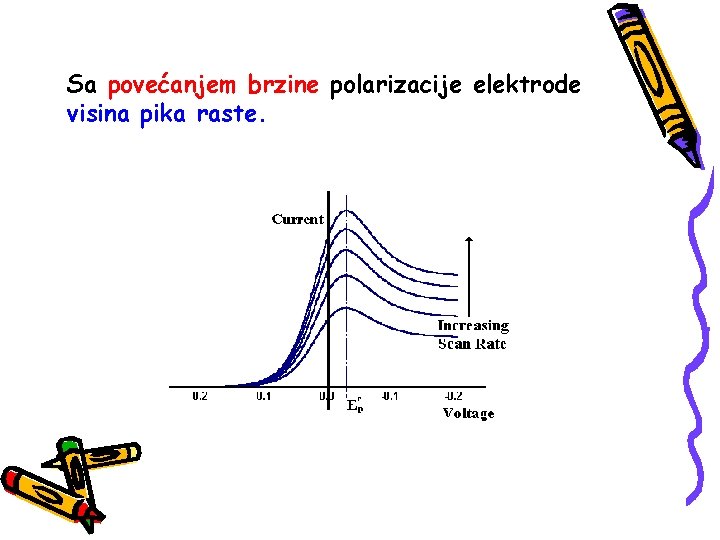
Sa povećanjem brzine polarizacije elektrode visina pika raste.

Pri ravnotežnim uslovima koncentracija Fe 3+, i to u oblasti izvan određenog rastojanja od elektrode, je uniformna odnosno ujednačena zahvaljujući prirodnoj konvekciji. Unutar oblasti poznate kao Nernst-ov difuzioni sloj postoji razlika u koncentraciji pri čemu je koncentracioni gradijent linearan.

Iz ove jednačine sledi da ukoliko je potencijal negativniji površinska koncentracija oksidovanog oblika Fe 3+ mora da se progresivno smanjuje Koncentracioni gradijent se na taj način povećava što uzrokuje povećanje struje

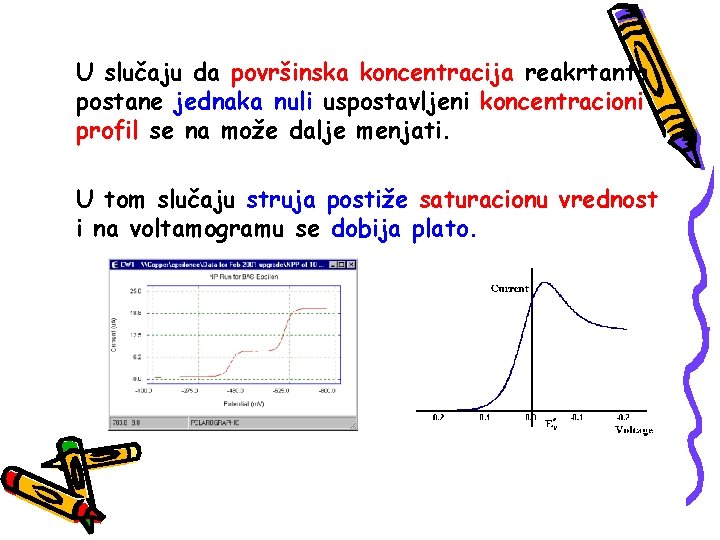
U slučaju da površinska koncentracija reakrtanta postane jednaka nuli uspostavljeni koncentracioni profil se na može dalje menjati. U tom slučaju struja postiže saturacionu vrednost i na voltamogramu se dobija plato.

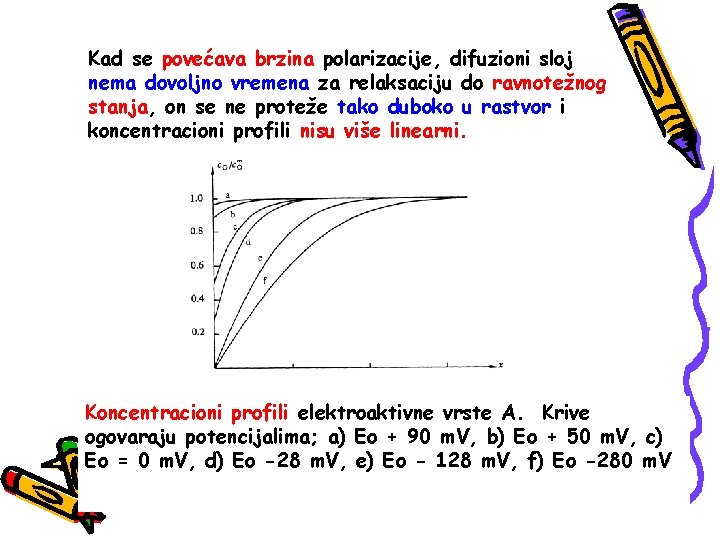
Kad se povećava brzina polarizacije, difuzioni sloj nema dovoljno vremena za relaksaciju do ravnotežnog stanja, on se ne proteže tako duboko u rastvor i koncentracioni profili nisu više linearni. Koncentracioni profili elektroaktivne vrste A. Krive ogovaraju potencijalima; a) Eo + 90 m. V, b) Eo + 50 m. V, c) Eo = 0 m. V, d) Eo -28 m. V, e) Eo - 128 m. V, f) Eo -280 m. V

Kada se postigne potencijal pri kome se komponenta A redukuje njena površinska koncentracija opada u odnosu na njenu vrednost u dubini rastvora i dolazi do pojave koncentracionog gradijenta i njemu proporcijonalne struje. Kod voltametrijskih tehnika (koje spadaju u potencijodinamičke elektrohemijske metode) elektrodni potencijal se menja i samim tim površinska koncentracija vrste A i dalje opada, kriva b i c, dok efektivno ne dostigne nulu.

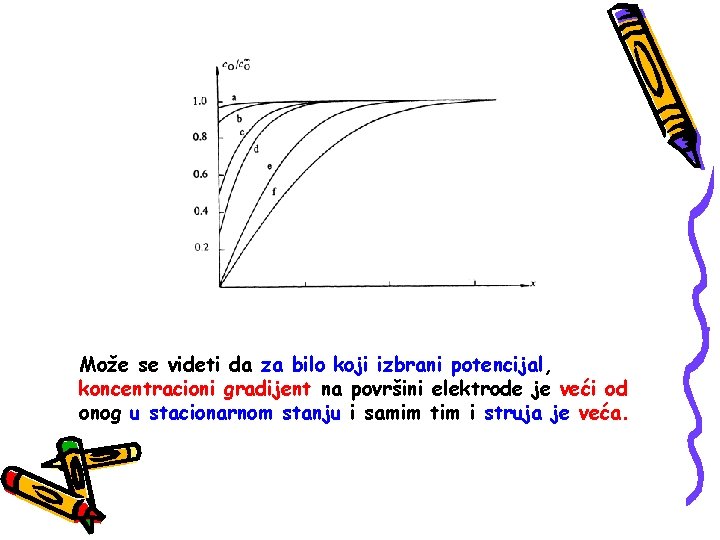
Može se videti da za bilo koji izbrani potencijal, koncentracioni gradijent na površini elektrode je veći od onog u stacionarnom stanju i samim tim i struja je veća.

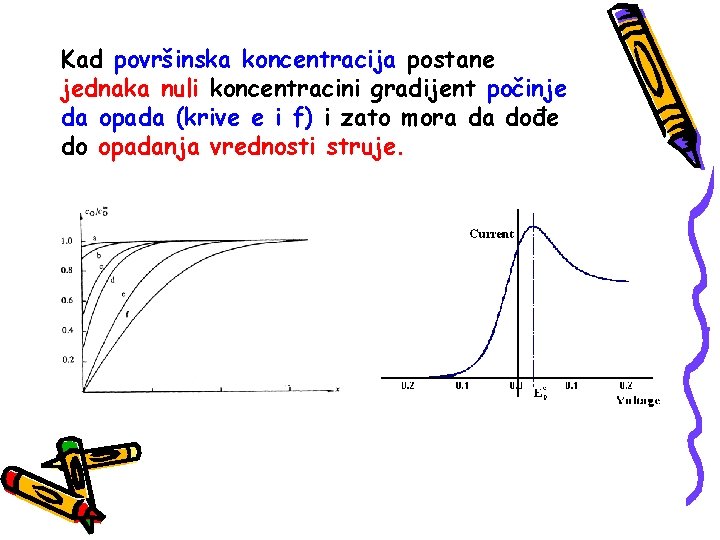
Kad površinska koncentracija postane jednaka nuli koncentracini gradijent počinje da opada (krive e i f) i zato mora da dođe do opadanja vrednosti struje.

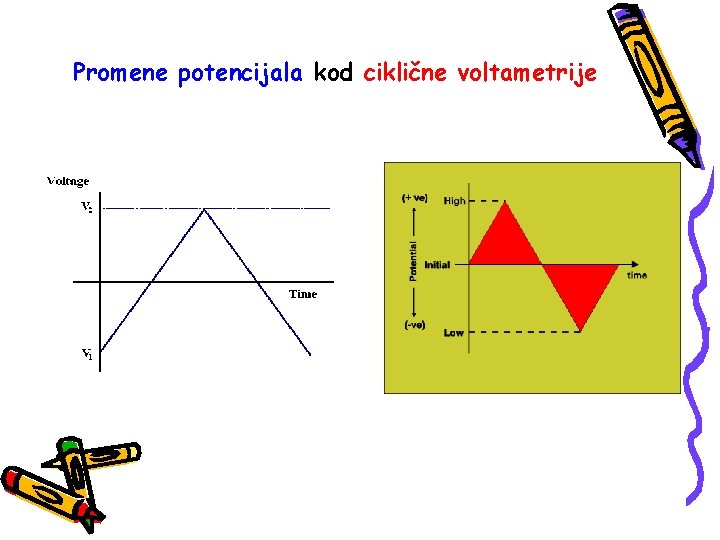
Promene potencijala kod ciklične voltametrije

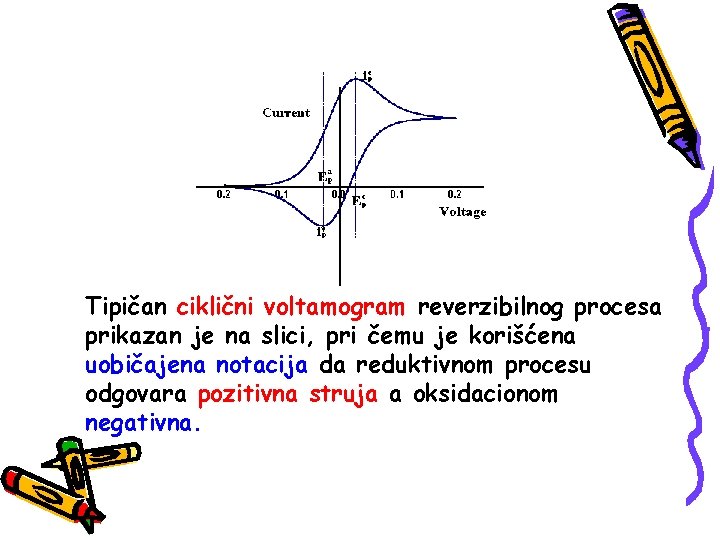
Tipičan ciklični voltamogram reverzibilnog procesa prikazan je na slici, pri čemu je korišćena uobičajena notacija da reduktivnom procesu odgovara pozitivna struja a oksidacionom negativna.

Sa slike se može videti da u prvom cikliranju kličina naelektrisanja povezana sa anodnim procesom je manja u odnosu na prethodi redukcioni proces. Uzrok ovome je što tokom redukcionog procesa, kad vrsta Fe 2+ i nastaje, ova eletroaktivna vrsta difunduje od elektrode ka unutrašnjosti rastvora usled postojanja koncentracionog gradijenta.

Na taj način dolazi do toga da se izvesna količina Fe 2+ ne može oksidovati tokom ograničenog trajanja eksperimenta, te otuda i nejednakost naelektrisanja pri katodnom i anodnom procesu.


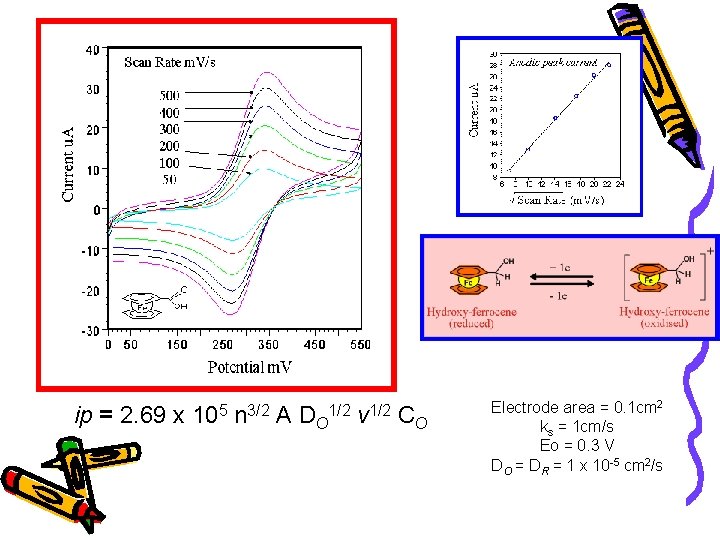
ip = 2. 69 x 105 n 3/2 A DO 1/2 v 1/2 CO Electrode area = 0. 1 cm 2 ks = 1 cm/s Eo = 0. 3 V DO = DR = 1 x 10 -5 cm 2/s

Ireverzibilni sistemi U slučaju reverzibilnog sistema brzine prenosa elektrona pri svim potencijalima je znatno veća od brzine masenog transporta elektroaktivnih vrsta i samim tim na površini elektrode stalno postoji Nernst-ovska ravnoteža. Kada je brzina prenosa elektrona nedovoljna da omogući ovu površinsku ravnotežu i oblik ciklovoltamograma se menja.

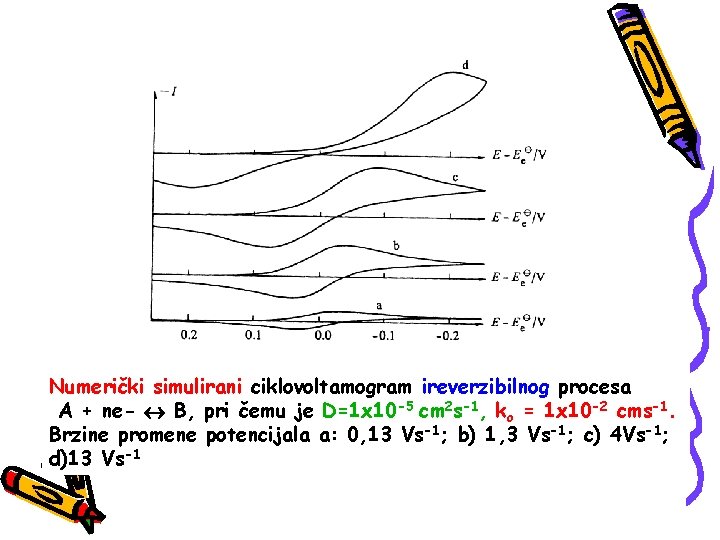
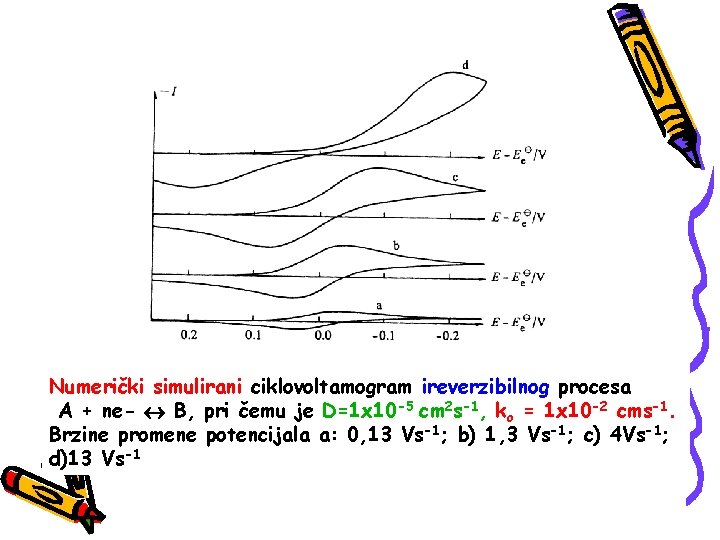
Numerički simulirani ciklovoltamogram ireverzibilnog procesa A + ne- B, pri čemu je D=1 x 10 -5 cm 2 s-1, ko = 1 x 10 -2 cms-1. Brzine promene potencijala a: 0, 13 Vs-1; b) 1, 3 Vs-1; c) 4 Vs-1; d)13 Vs-1

Pri nižim vrednostima brzine promene eletrodnog potencijala prenos elektrona je brži od masenog transporta elektrodne vrste što se manifestuje dobijanjem reverzibilnog ciklovoltamograma. Kako brzina promene potencijala raste tako i brzina masenog transporta raste i ove dve veličine postaju uporedljive i dolazi do remećenja ravnoteže na elektrodnoj površini Najvidljiviji efekat ovakvog nereverzbilnog ponašanja je povećanje razlike potencijala katodnog i anodnog pika sa povećanjem brzine promene potencijala

Numerički simulirani ciklovoltamogram ireverzibilnog procesa A + ne- B, pri čemu je D=1 x 10 -5 cm 2 s-1, ko = 1 x 10 -2 cms-1. Brzine promene potencijala a: 0, 13 Vs-1; b) 1, 3 Vs-1; c) 4 Vs-1; d)13 Vs-1

Najsigurnija identifikacija ireverzibilnosti nekog elektrohemijskog procesa je odsustvo reverznog ciklovoltametrijskog pika. Međutim, ovakav slučaj može da se javi i kao posledica neke naknadne i vrlo brze hemijske reakcije te ga ne treba odmah i bez drugih provera pripisati ireverzibilnosti elektrohemijskih procesa.

Matsuda je postavo, danas opšte prihvaćene uslove koje bi morala da ispunjava vrednost standardne konstante brzine prenosa elektrona k 0 izražena u cms-1 i brzine promene potencijala v da bi se elektrodni proces svrstao u neku od grupa reverzibilnosti:

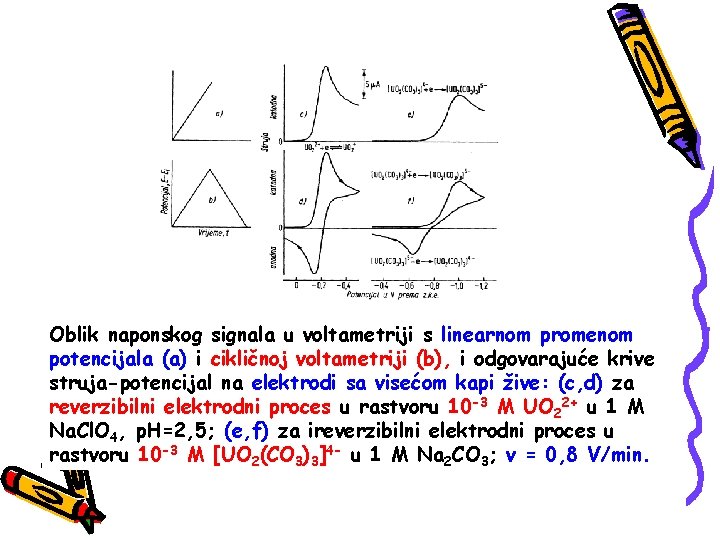
Oblik naponskog signala u voltametriji s linearnom promenom potencijala (a) i cikličnoj voltametriji (b), i odgovarajuće krive struja-potencijal na elektrodi sa visećom kapi žive: (c, d) za reverzibilni elektrodni proces u rastvoru 10 -3 M UO 22+ u 1 M Na. Cl. O 4, p. H=2, 5; (e, f) za ireverzibilni elektrodni proces u rastvoru 10 -3 M [UO 2(CO 3)3]4 - u 1 M Na 2 CO 3; v = 0, 8 V/min.

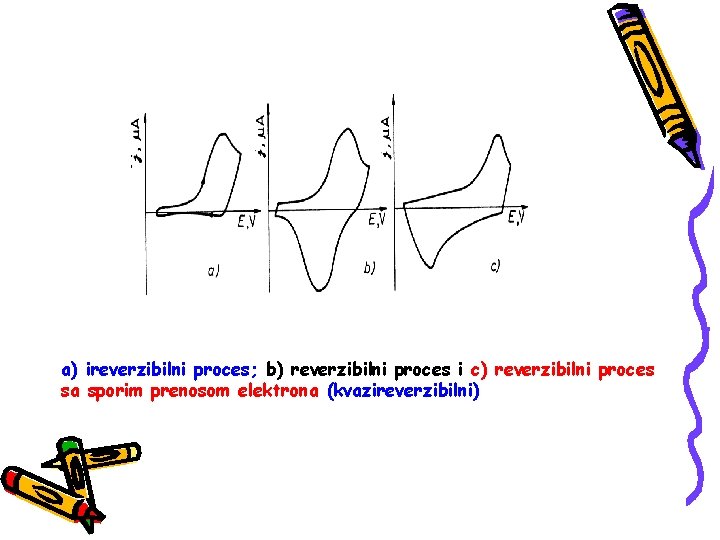
a) ireverzibilni proces; b) reverzibilni proces i c) reverzibilni proces sa sporim prenosom elektrona (kvazireverzibilni)



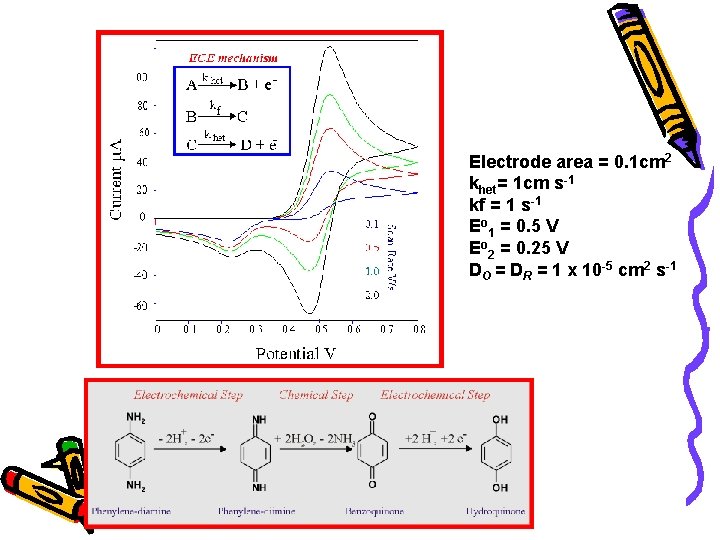
Electrode area = 0. 1 cm 2 khet= 1 cm s-1 kf = 1 s-1 Eo 1 = 0. 5 V Eo 2 = 0. 25 V DO = DR = 1 x 10 -5 cm 2 s-1
 Instrumentalna analiza
Instrumentalna analiza Instrumentalna analiza
Instrumentalna analiza Instrumentalna analiza
Instrumentalna analiza Instrumentalna analiza
Instrumentalna analiza Krajša instrumentalna skladba
Krajša instrumentalna skladba Master profesor predmetne nastave
Master profesor predmetne nastave Raport de autoevaluare educatoare 2020
Raport de autoevaluare educatoare 2020 Uniones gap junction
Uniones gap junction Profesorado de yoga intensivo
Profesorado de yoga intensivo Prof przewratil
Prof przewratil Profesor nicolae cretu
Profesor nicolae cretu Professor gaia com
Professor gaia com Robert lembrych furtak
Robert lembrych furtak Profesor wojciech krajewski
Profesor wojciech krajewski Profesor descubridor
Profesor descubridor Zanimanja crtezi
Zanimanja crtezi Profesor jano
Profesor jano Profesor poro lan
Profesor poro lan 1www2
1www2 Profesor de operaciones unitarias
Profesor de operaciones unitarias Ce inseamna profesor asociat
Ce inseamna profesor asociat Alexander settles
Alexander settles Profesor milorad jankovic
Profesor milorad jankovic Profesor tica
Profesor tica Indicati adjectivele si substantivele determinate
Indicati adjectivele si substantivele determinate Profesor martin
Profesor martin Enantiomeri i dijastereoizomeri
Enantiomeri i dijastereoizomeri Atributos de un profesor
Atributos de un profesor El tiempo de permanencia del profesor santos
El tiempo de permanencia del profesor santos Profesor jano
Profesor jano El asesinato del profesor de matematicas
El asesinato del profesor de matematicas Itk vtk
Itk vtk Milic simic profesor
Milic simic profesor Sead dizdarevic profesor
Sead dizdarevic profesor























































