SPECTRE ATOMICE SERII SPECTRALE ANALIZA SPECTRAL Atomul este







- Slides: 14

SPECTRE ATOMICE SERII SPECTRALE ANALIZA SPECTRALĂ

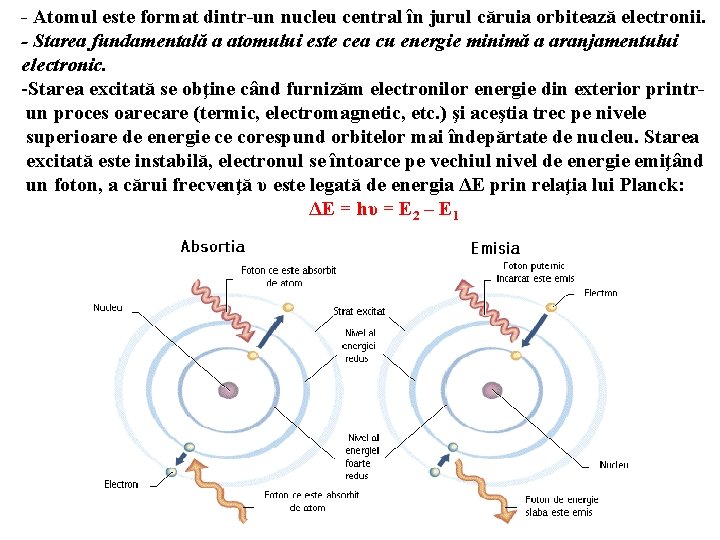
- Atomul este format dintr-un nucleu central în jurul căruia orbitează electronii. - Starea fundamentală a atomului este cea cu energie minimă a aranjamentului electronic. -Starea excitată se obţine când furnizăm electronilor energie din exterior printrun proces oarecare (termic, electromagnetic, etc. ) şi aceştia trec pe nivele superioare de energie ce corespund orbitelor mai îndepărtate de nucleu. Starea excitată este instabilă, electronul se întoarce pe vechiul nivel de energie emiţând un foton, a cărui frecvenţă υ este legată de energia ΔE prin relaţia lui Planck: ΔE = hυ = E 2 – E 1

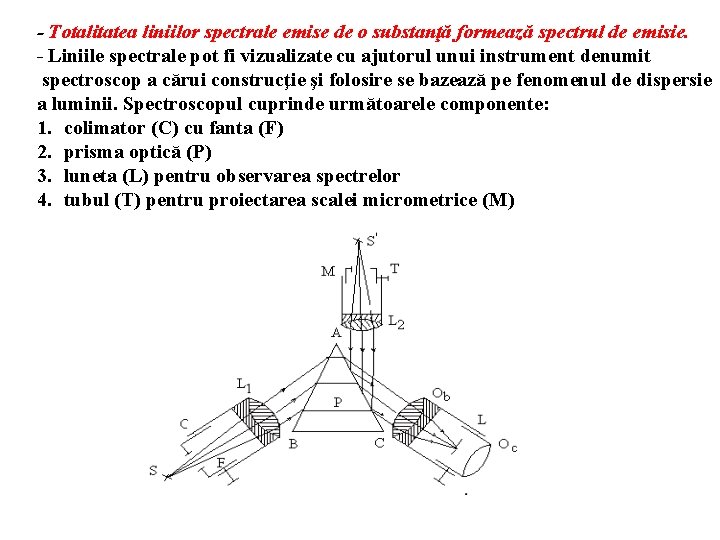
- Totalitatea liniilor spectrale emise de o substanţă formează spectrul de emisie. - Liniile spectrale pot fi vizualizate cu ajutorul unui instrument denumit spectroscop a cărui construcţie şi folosire se bazează pe fenomenul de dispersie a luminii. Spectroscopul cuprinde următoarele componente: 1. colimator (C) cu fanta (F) 2. prisma optică (P) 3. luneta (L) pentru observarea spectrelor 4. tubul (T) pentru proiectarea scalei micrometrice (M)

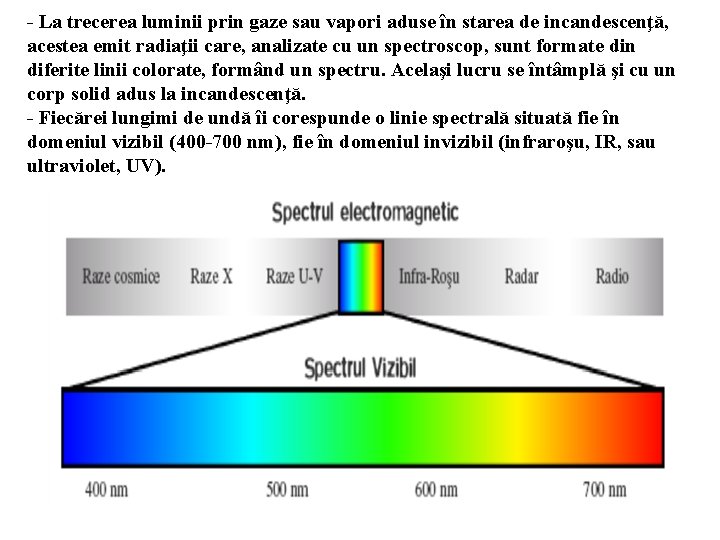
- La trecerea luminii prin gaze sau vapori aduse în starea de incandescenţă, acestea emit radiaţii care, analizate cu un spectroscop, sunt formate din diferite linii colorate, formând un spectru. Acelaşi lucru se întâmplă şi cu un corp solid adus la incandescenţă. - Fiecărei lungimi de undă îi corespunde o linie spectrală situată fie în domeniul vizibil (400 -700 nm), fie în domeniul invizibil (infraroşu, IR, sau ultraviolet, UV).

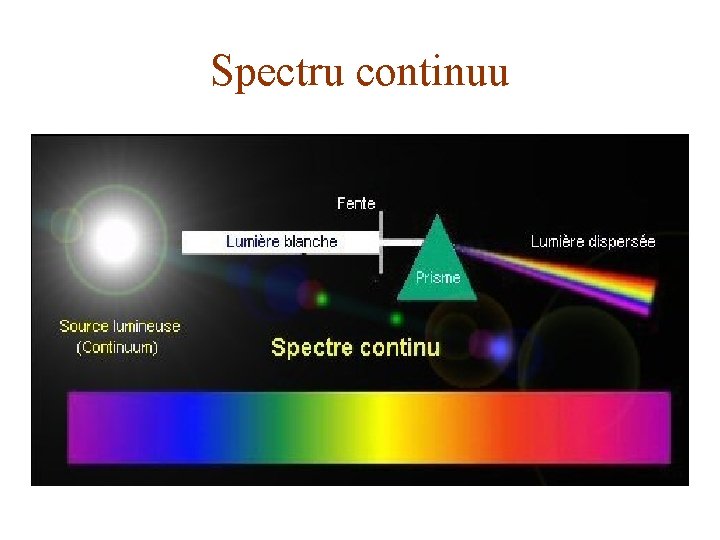
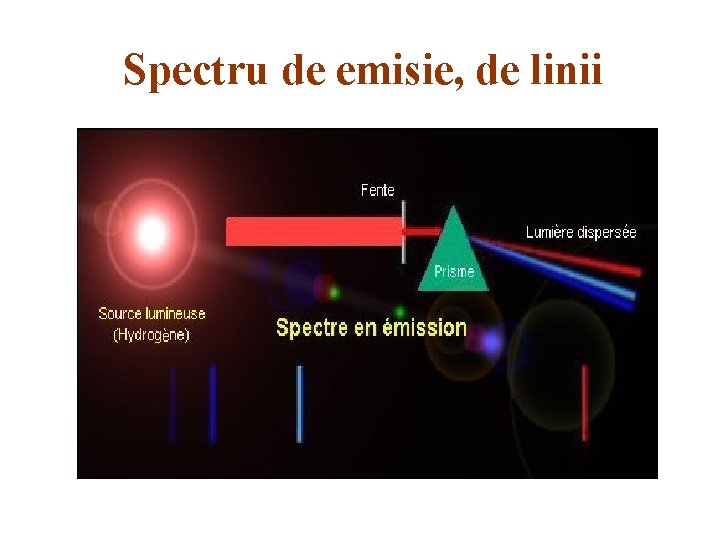
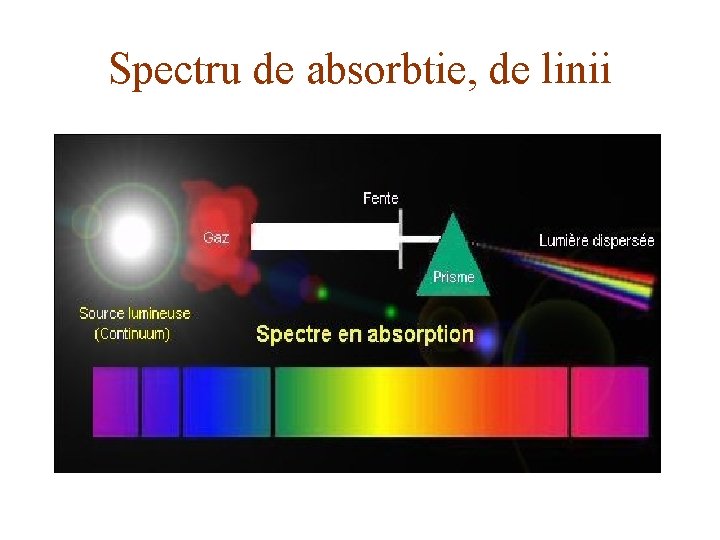
CLASIFICAREA SPECTRELOR - Spectrele reprezintă, de fapt, o succesiune de imagini colorate ale fantei colimatorului. - Spectrele pot fi: de emisie şi de absorbţie. - Spectrele de emisie sunt cele date de vapori, gaze sau corpuri solide aduse în stare de incandescenţă. - Spectrul de absorbţie al unui corp dat este un ansamblu de linii şi benzi întunecoase care apar pe fondul spectrului continuu de emisie, atunci când lumina trece printr-un mediu absorbant. - Atât spectrele de emisie cât şi cele de absorbţie se împart în trei tipuri: spectre continue, de linii şi de bandă. - Spectrele de linii aparţin atomilor şi ionilor lor. - Spectrele de bandă aparţin moleculelor. - Spectrele continue sunt emise de sistemele cu densitate mare, cum sunt corpurile solide şi lichidele. - Spectrele de linii depind de structura materialului care le emite. - Fiecare substanţă emite spectrul său caracteristic şi poate fi identificată după lungimea de undă caracteristică.

Spectru continuu

Spectru de emisie, de linii

Spectru de absorbtie, de linii

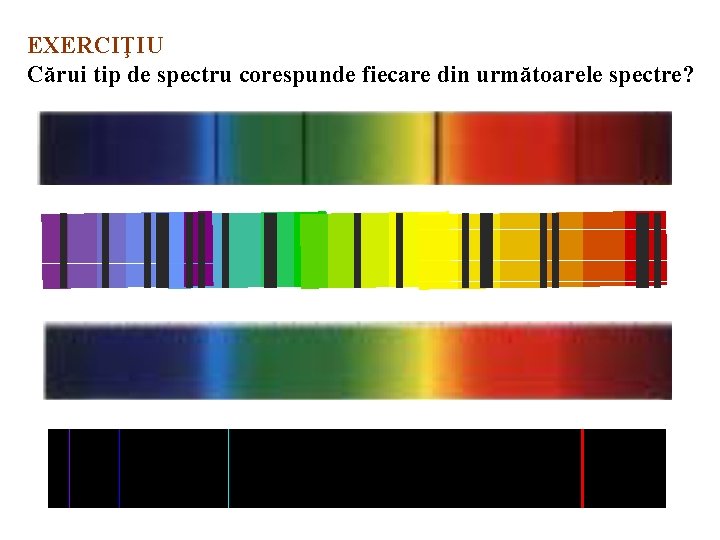
EXERCIŢIU Cărui tip de spectru corespunde fiecare din următoarele spectre?

Serii spectrale • În anul 1885 Balmer constată că lungimile de undă ale spectrului atomului de hidrogen pot fi redate cu ajutorul unei formule empirice: • Mai târziu Rydberg a notat 1/ =număr de undă şi a generalizat formula pentru întreg spectrul atomului de hidrogen: unde n 1 caracterizează seria spectrală iar n 2 linia în spectrul respectiv; R = 1, 097· 107 m-1 este constanta lui Rydberg.

Seriile spectrale atomului de hidrogen S-a dovedit experimental că atomul de hidrogen emite radiaţii şi în ultraviolet, precum şi în infraroşu, liniile spectrale formând de asemenea serii spectrale. Pe baza formulei generalizate dată de Rydberg se obţin următoarele serii spectrale: • n 1 = 1, n 2 = 2, 3, 4, …seria Lyman, în UV; • n 1 = 2, n 2 = 3, 4, 5, …seria Balmer, în VIZ; • n 1 = 3, n 2 = 4, 5, 6, …seria Paschen, în IR apropiat; • n 1 = 4, n 2 = 5, 6, 7, …seria Brackett; • n 1 = 5, n 2 = 6, 7, 8, …seria Pfundt; • n 1 = 6, n 2 = 7, 8, 9, …seria Humphrey, ultimele trei fiind toate în IR îndepărtat.

Analiza spectrală • Deoarece spectrele caracterizează substanţele care emit sau absorb lumina, studiul acestora pot da informaţii despre natura acestora. • Analiza spectrală poate fi calitativă sau cantitativă. • În analiza spectrală calitativă se compara spectrul substanţei date cu unul de referinţă cunoscut (de obicei, cu spectrul fierului). Se caută lungimile de undă identificate în tabele cunoscute şi se află cărei substanţe îi aparţine spectrul respectiv. • Analiza spectrală cantitativă se bazează pe faptul că intensitatea liniei spectrale depinde de concentraţia atomilor emiţători din substanţa de studiat. Cu cât concentraţia este mai mare cu atât intensitatea liniilor spectrale este mai mare. • Metodele spectrale de analiză sunt larg răspândite în metalurgie, industria chimică, în prospecţiuni geologice etc. , precum şi în laboratoarele de cercetare ştiinţifică, deoarece sunt mai rapide, mai precise şi mai simple.

APLICAŢII 1. Să se calculeze lungimile de undă ale spectrului emis de atomul de hidrogen, folosind formula lui Balmer. 2. Calculaţi lungimea de undă a celei de-a doua linii spectrale din seria Paschen (n 1 = 3, n 2 = 5).

TEMĂ PENTRU ACASĂ • Calculaţi: a) cea mai scurtă lungime de undă şi cea mai mare lungime de undă din seria Lyman pentru atomul de hidrogen; b) aceeaşi cerinţă pentru seria Balmer.
 Spectre de linii
Spectre de linii Istoria atomului
Istoria atomului Atomul ppt
Atomul ppt Analyse spectrale audacity
Analyse spectrale audacity Test serii walda wolfowitza
Test serii walda wolfowitza Test shapiro wilka
Test shapiro wilka Cand se lasa umbra serii
Cand se lasa umbra serii Spectre électromagnétique
Spectre électromagnétique Spectre cism
Spectre cism Tp spectre seconde
Tp spectre seconde Spectre infrarouge salicylate de méthyle
Spectre infrarouge salicylate de méthyle Spectre production companies
Spectre production companies Transformée de fourier discrète
Transformée de fourier discrète Sts audiovisuel
Sts audiovisuel Acide pentanoique spectre ir
Acide pentanoique spectre ir