Atomul Macovei Emil ARENYoung Generation Cuprins Ce este











- Slides: 18

Atomul Macovei Emil AREN-Young Generation

Cuprins • Ce este atomul • Din ce este format atomul • Care sunt proprietăţile atomului ?

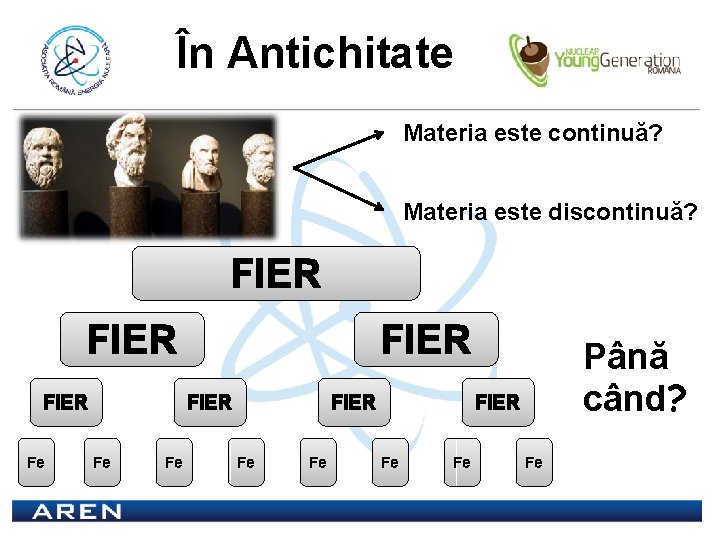
În Antichitate Materia este continuă? Materia este discontinuă? FIER Fe FIER Fe Fe Până când? FIER Fe Fe Fe

ATOMUL Datorită eforturilor oamenilor de ştiinţă, am aflat mai târziu că materia este discontinuă. În cazul fierului, în momentul divizării repetate a bucăţilor de metal, vine un moment când părţile rezultate nu mai sunt “fier”. Această ultimă bucată de materie cu caracteristicile fierului este cunoscută ca un atom de fier. Acelaşi lucru se întamplă cu orice alt material, ultima mica bucatică din el se numeşte atom al aceluiaşi material.

Structura atomului Atomii sunt alcătuiţi din trei tipuri de particule, numite particule subatomice, şi care sunt: a)Protonii b)Neutronii c)Electronii Aceste particule subatomice sunt aceleaşi în toţi atomii. Toţi atomii aceluiaşi tip de material sunt la fel. Materialele diferă de fapt prin structura şi numărul particulelor subatomice.

Exemple de atomi Atomul de Hidrogen Atomul de Heliu Neutronii şi protonii sunt aşezaţi “ca o grămadă” în “centrul” atomului, iar această “grămadă” poartă numele de nucleu. Electronii “se mişcă” în jurul acestui nucleu precum planetele în jurul soarelui, de unde şi numele de electroni orbitali. De ce electronii rămân pe orbite şi nu “zboară” din atom?

Echilibrul sarcinilor electrice în atom Protonul este o particulă încărcată POZITIV Electronul este o particulă încărcată NEGATIV Neutronul este o particulă fără sarcină electrică Sarcina netă a atomului este ZERO

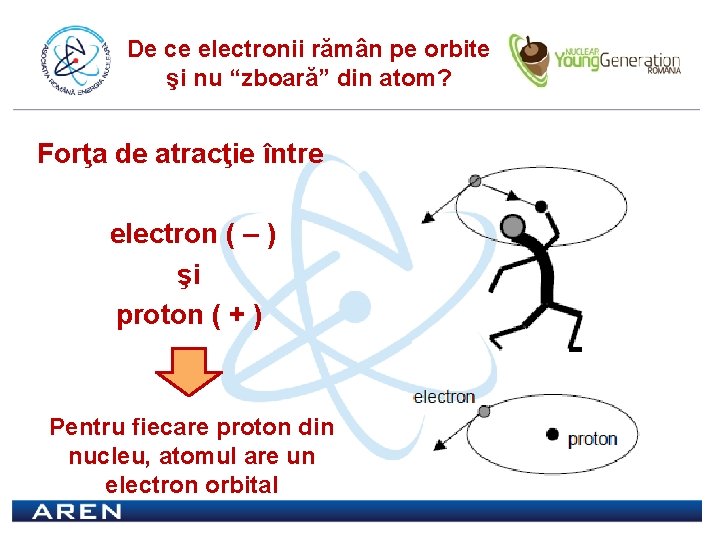
De ce electronii rămân pe orbite şi nu “zboară” din atom? Forţa de atracţie între electron ( – ) şi proton ( + ) Pentru fiecare proton din nucleu, atomul are un electron orbital

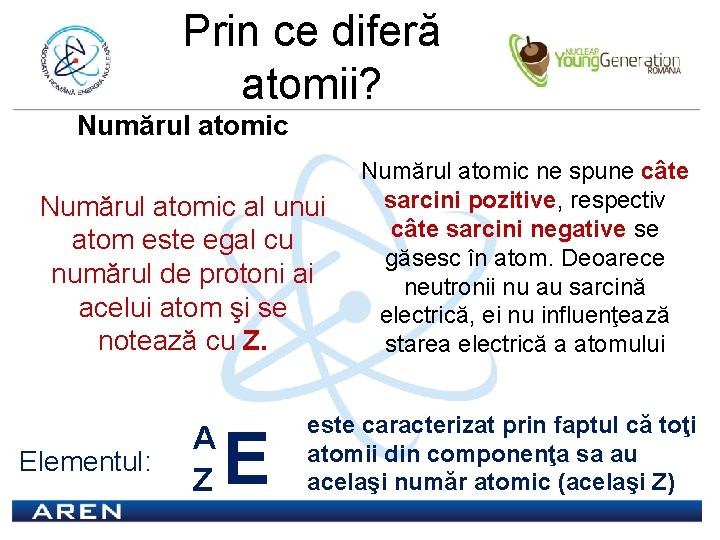
Prin ce diferă atomii? Numărul atomic al unui atom este egal cu numărul de protoni ai acelui atom şi se notează cu Z. Elementul: A Z E Numărul atomic ne spune câte sarcini pozitive, respectiv câte sarcini negative se găsesc în atom. Deoarece neutronii nu au sarcină electrică, ei nu influenţează starea electrică a atomului este caracterizat prin faptul că toţi atomii din componenţa sa au acelaşi număr atomic (acelaşi Z)

Prin ce diferă atomii? Numărul de masă al unui atom este egal cu suma dintre numărul de protoni şi numărul de neutroni ai acelui atom şi se notează cu A A=Z+N N=A-Z

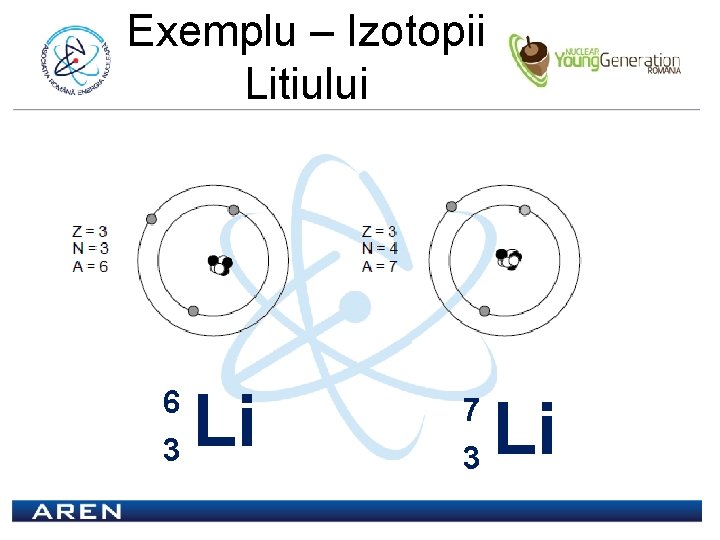
Izotopii Numărul atomic al unui atom este egal cu numărul de protoni ai acelui atom şi se notează cu Z. E E A 1 Z A 2 Z Numărul de masă al unui atom este egal cu suma dintre numărul de protoni şi numărul de neutroni ai acelui atom şi se notează cu A Izotopii unui element au acelaşi Z dar A diferit.

Exemplu – Izotopii Litiului 6 3 Li 7 3 Li

Proprietăţile izotopilor Proprietăţi chimice Proprietăţi fizice • Descriu modul în care • Ex. : Temperatura de reacţionează cu alt fierbere, Temperatura element. de topire. • Numărul de electroni • Numărul de neutroni determină proprietăţile chimice ale unui fizice. element. • ACELEAŞI • DIFERITE

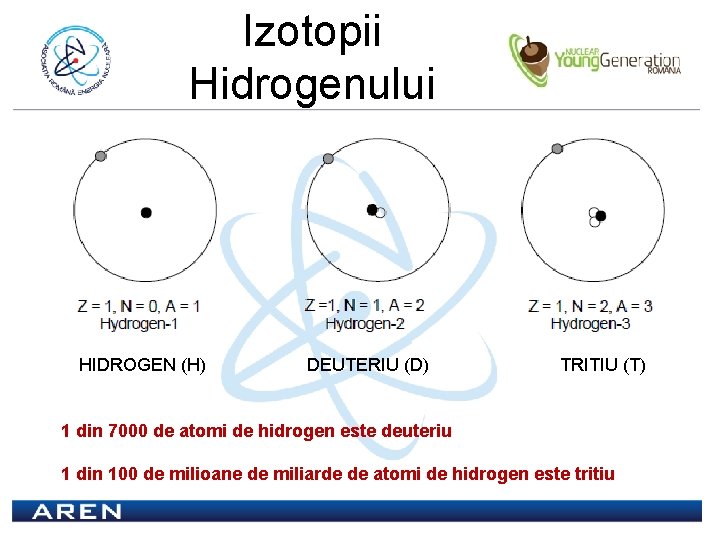
Izotopii Hidrogenului HIDROGEN (H) DEUTERIU (D) TRITIU (T) 1 din 7000 de atomi de hidrogen este deuteriu 1 din 100 de milioane de miliarde de atomi de hidrogen este tritiu

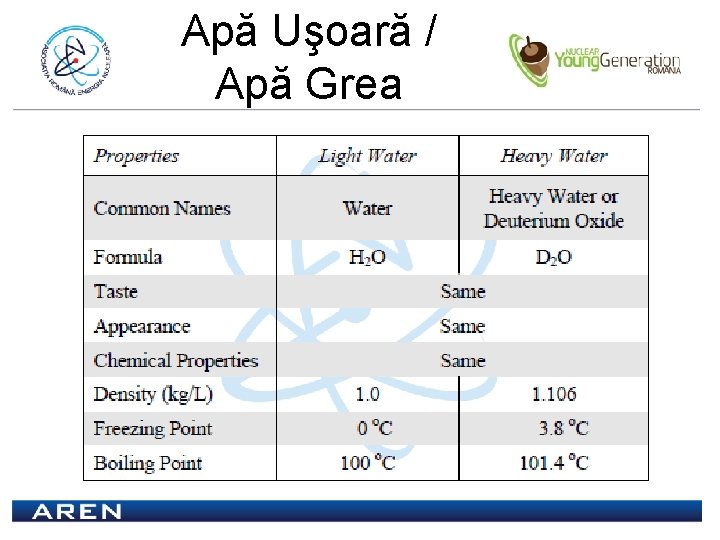
Apă Uşoară / Apă Grea

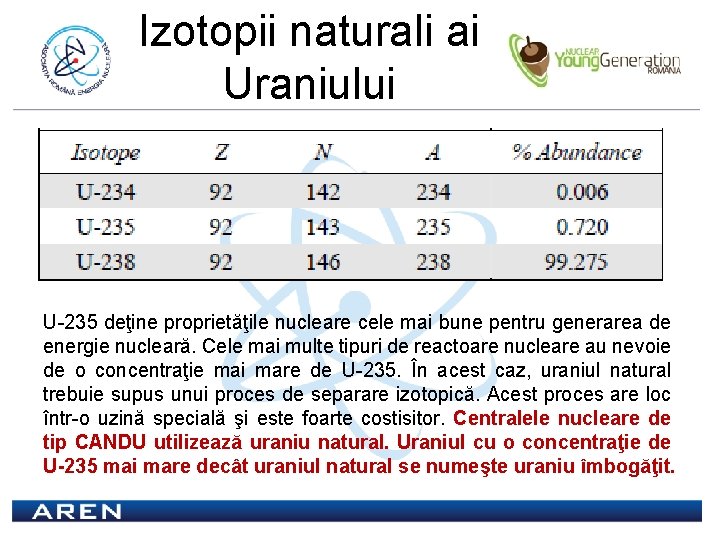
Izotopii naturali ai Uraniului U-235 deţine proprietăţile nucleare cele mai bune pentru generarea de energie nucleară. Cele mai multe tipuri de reactoare nucleare au nevoie de o concentraţie mai mare de U-235. În acest caz, uraniul natural trebuie supus unui proces de separare izotopică. Acest proces are loc într-o uzină specială şi este foarte costisitor. Centralele nucleare de tip CANDU utilizează uraniu natural. Uraniul cu o concentraţie de U-235 mai mare decât uraniul natural se numeşte uraniu îmbogăţit.

Concluzii • Materia este alcătuită din atomi care la rândul lor sunt constituiţi din protoni, neutroni şi electroni. • Neutronii nu au sarcină electrică, protonii au sarcină pozitivă iar electronii au sarcină negativă. • Neutronii şi protonii au mase aproximativ egale ( o unitate atomică de masă) iar electronii au masa mult mai mică (1/1840). • Neutronii şi protonii formează nucleul atomului. Numărul de protoni dintr-un atom se numeşte Număr Atomic şi este egal cu numărul de electroni ce orbitează în jurul nucleului. • Atomul este mai mult gol deoarece diametrul lui este de multe mii de ori mare decât diametrul nucleului. • Izotopul unui element este un atom care acelaşi număr atomic dar număr de masă diferit. • Izotopii unui element au aceleaşi proprietăţi chimice dar proprietăţi fizice diferite.

Va multumim pentru atentie !!!
 Caracteristicile atomului
Caracteristicile atomului Orientul antic este cuprins intre
Orientul antic este cuprins intre Atomul ppt
Atomul ppt Erich kastner emil i detektivi
Erich kastner emil i detektivi Inserare cuprins word
Inserare cuprins word You are good and your mercy
You are good and your mercy Second generation vs first generation antipsychotics
Second generation vs first generation antipsychotics Fiecare este robul lucrului de care este biruit
Fiecare este robul lucrului de care este biruit Ejemplo claro
Ejemplo claro Emil praun
Emil praun Emil i detektivi pitanja i odgovori
Emil i detektivi pitanja i odgovori Emil boleslav lukáč paradoxon
Emil boleslav lukáč paradoxon Emil strainu
Emil strainu Emil moshkovich
Emil moshkovich Román nana
Román nana Emil praun
Emil praun Paul kremer
Paul kremer Where was vincent van gogh born
Where was vincent van gogh born Maximilian karl emil weber
Maximilian karl emil weber