Freie Radikale und Antioxidantien Oxidativer Stress ist ein
















































































- Slides: 105

Freie Radikale und Antioxidantien Oxidativer Stress ist ein Zustand, in dem ansonsten stabile Moleküle ein Elektron verlieren und somit instabil werden. Auf der Suche nach einem zusätzlichen Elektron greifen diese instabilen Moleküle, die so genannten „freien Radikale“, gesunde Zellen im Körper an. Die tägliche Einwirkung von - Umweltverschmutzung - Rauchen - physischem Stress, usw. führt zur Enstehung von freien Radikalen.

Keine Zelle ist vollkommen sicher vor den Auswirkungen freier Radikalen. Dieser Prozess spaltet und zerstört die Zellen. Die beschädigten Zellen verstärken dann den Alterungsprozess. Ähnlich wie bei der Bildung von Rost auf einem Auto ist diese Oxidation sozusagen der „Rost“ in unseren Körpern.

Hauptschädigungsquellen durch freie Radikale Umweltverschmutzung Rauchen oder Passivrauchen Stress, einschließlich körperlicher Belastung ( wie Sport ) Strahlung – Röntgenstrahlung, kosmische Strahlung, Mikrowellenstrahlung

Einige Ursachen für die Entstehung freier Radikale sind jedoch unvermeidlich: Atmung Normaler Nahrungsstoffwechsel zur Energieproduktion in jeder menschlichen Zelle (Mitochondrien) Ultraviolettes Licht der Sonne

Die Rolle der Antioxidantien: Die einzige Möglichkeit, um freie Radikale zu neutralisieren und so den oxidativen Prozess zu minimieren, sind Antioxidantien. Interne (körpereigene) Antioxidantien: Antioxidantien, die unser Körper selbst herstellt. -Superoxid-Dismutase =Kupfer-Zink-Superoxid-Dismutase =Mangan-Superoxid-Dismutase -Glutathion-Peroxidase, Glutathion-Transferasen Glutathion-Reduktasen -Katalase(n) -Selen-Glutathion-Peroxidase Mineralische Kofaktoren unterstützen den Aufbau körpereigener Antioxidantien. (Selen, Kupfer, Zink)

Die Rolle der Antioxidantien – 2 Die Superoxiddismutase (SOD) ermöglicht die Umwandlung des Superoxidradikals in das weniger reaktive - Wasserstoffperoxid (H 2 O 2) welches durch zwei weitere Enzyme, Glutathionperoxidase (GPX) und Katalase zu Sauerstoff und Wasser abgebaut wird Die Selen-abhängige Glutathion-Peroxidase (GPX) ist eines der wichtigsten antioxidativen Enzyme für die Entgiftung von reaktiven Sauerstoffspezies. Vor allem Hydroperoxide (zu denen Wasserstoffperoxid und Lipidhydroperoxide aus biologischen Membranen dazugehören) werden durch die Glutathion-Peroxidase zu unschädlichen Verbindungen ( Wasser bzw. Alkohol) abgebaut. Für die optimale GPX-Aktivität ist eine genügende Bereitstellung von Glutathion unerlässlich. Die Aktivität der Glutathion-Peroxidase kann durch eine unzureichende Selenversorgung reduziert sein.

Lipidperoxidationsprodukte: Lipidperoxidationsprodukte entstehen, wenn freie Radikale körpereigene Schutzmechanismen überwinden und mit ungesättigten Fettsäuren der Zellmembranen reagieren. Solche Hydroperoxide der Fettsäuren sind chemisch instabil und zerfallen in - Alkane - aliphatische Aldehyde - ungesättigte Aldehyde, darunter das Malondialdehyd (MDA) Das die Eigenschaft hat Proteine und Lipide zu vernetzen. MDA ist ein sogenanntes sekundäres Lipidperioxidationsprodukt und entfaltet seine toxischen Eigenschaften auf verschiedenen Ebenen der zellulären Mechanismen. Es kann mit der DNA reagieren

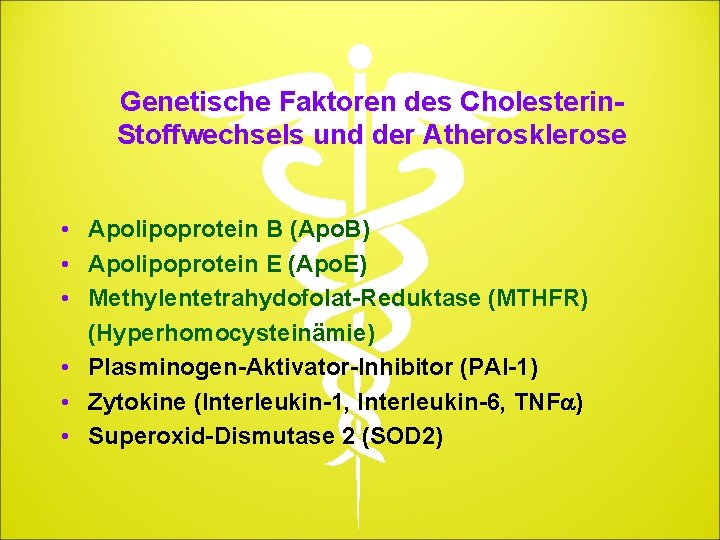
Die Rolle der Antioxidantien – 4 Externe Antioxidantien: Die 5 wichtigsten Familien der externen Antioxidantien sind: antioxidative Vitamineralische Kofaktoren Carotinoide Flavonoide andere wie z. B. Alphaliponsäure

Biologische Schädlichkeit von Mobilfunkstrahlung erneut bewiesen Oxidativer Stress durch Mikrowellenstrahlung, mögliche Ursache für viele negative Zellveränderungen und eine Vielzahl von systemischen Störungen im menschlichen Körper Quelle: Pubmed, Med Pr. 2002, 53(4): 311 -4. Polisch. PMID: 12474410 Prof. Dr. Peter Semm „Neuroscience Letters“ Abstrakt der Studie: Ziel der Studie war es, an Zellkulturen in vitro die Wirkung des von Mobiltelefonen produzierten elektromagnetischen Feldes auf die Aktivität von Superoxid-Dismutase (SOD-1) und den Anteil von Malondialdehyd (MDA) in menschlichen Blutplättchen (Thrombozyten) zu prüfen. Die Blutplättchen-Suspension wurde 1, 3, 5 und 7 Minuten mit Mikrowellen (900 MHz, heutige GSM-Mobilfunk-Frequenz/D-Netz) bestrahlt. Die Studie bewies, dass die von Mobiltelefonen ausgehenden Mikrowellen die SOD-1 -Aktivität nach 1, 5 und 7 Minuten Exposition signifikant stark reduziert und nach 3 Minuten erhöhte – im Vergleich zum Kontrolltest. Nach 1, 5 und 7 Minuten gab es eine signifikante Erhöhung der MDAKonzentration und eine Abnahme nach 3 Minuten im Vergleich zum Kontroll-Test. Die Wissenschaftler folgerten aus ihren Studienergebnissen, dass oxidativer Stress nach Mikrowellen-Exposition der Grund für viele negative Zellveränderungen sein könne und eine Vielzahl von systemischen Störungen im menschlichen Körper verursachen könne.

Die medizinische Zeitschrift Praxis – Wissenschaft – Originalia äußerte in ihrer Ausgabe 7/97 bereits: „Das antioxidative Potential des Organismus ist vorrangigstes Überlebensprinzip und entscheidet weitgehend unmittelbar über Gesundheit oder Krankheit. “ Superoxid-Dismutase: Ein sehr wichtiges Anti-Oxidanz-Enzym!! Primärer enzymatischer Fänger für freie Radikale! Es gibt Mangan-Superoxid-Dismutase in Mitochondrien und cystosolische Kupfer-Zink. Dismutase mit extrazellulären Formen in Blut, Lymphen und anderen Körperflüssigkeiten. Superoxid-Ionen werden durch die mitochondriale Atmung, aktivierte Leukocyten, Mikrosomen, toxische Chemikalien und Strahlung in den lebenden Zellen produziert. Superoxid-Dismutase sorgt für den 200 fach schnelleren Spontanzerfall von Superoxid. Die Bildung von hochaggressivem Singulett-Sauerstoff, Hydroxyl-Radikalen und anderen reaktiven Sauerstoff-Radikalen wird wirksam vorgebeugt.

Malondialdehyd: Malondialdehyd – ein Marker für den oxidativen Stress der Zelle Der menschliche Organismus ist in der modernen Gesellschaft einer Vielzahl Belastungen aus seiner Umwelt ausgesetzt, die hohe Anforderungen an die antioxidativ wirkenden Systeme des Körpers stellen. Durch UV-Strahlung und verschiedenste Noxen werden in den Zellen eine große Menge freier Radikale freigesetzt. Eine Überproduktion von Sauerstoffradikalen oder unzureichende antioxidative Abwehrmechanismen führen im Organismus zu einem vermehrten Auftreten von pathologischen Abbauprodukten, die zu schweren Zellschädigungen führen können. Vorzeitiges Altern und Krankheiten (Diabetes mellitus, Krebs) können sich in der Folge einstellen. Durch die Oxidation ungesättigter Fettsäuren der Zellmembran werden im Organismus unterschiedliche Hydroperoxide gebildet. Diese sind chemisch instabil und zerfallen in Aldehyde. Ein besonderes unter diesen stellt das Malondialdehyd (MDA) dar, da es die Eigenschaft hat, Proteine und Lipide zu vernetzen. Malondialdehyd stellt damit einen Marker dar, der anzeigt, inwieweit das antioxidative System eines Patienten mit der einwirkenden oxidativen Belastung zurechtkommt. Oxidativer Streß führt zu einer verstärkten Lipidoxidation in der Zelle und damit zum Ansteigen der Konzentration von MDA.

Malondialdehyd: Solche erhöhten Werte weisen darauf hin, dass ein oder mehrere Faktoren der antioxidativen Regulation überlastet sind und ein Eingreifen erforderlich wird. An dieser Stelle sollte nach Möglichkeiten der Veränderung der Lebensweise (Rauchen, Ernährung, Wohn-/Arbeitsumfeld) gesucht und eventuelle Schwachstellen in der antioxidativen Abwehr - Vitamine, Spurenelemente diagnostiziert und gegebenenfalls ausgeglichen werden. Im Anschluss an eine Therapie lässt sich durch die Bestimmung des Malondialdehyd bei sinkenden Werten ein Erfolg der eingeleiteten Maßnahmen belegen.

Zur Interpretation: Deutlich erhöhte Werte für MDA werden vor allem bei terminaler Niereninsuffizienz, - septischem Schock - Schwangeren - bei Einnahme von Antikontrazeptiva - akuter Pankreatitis - Myokardinfarkt beobachtet. Allgemein nimmt der MDA-Spiegel mit zunehmendem Alter zu. Fast alle Risikofaktoren für kardiovaskuläre Erkrankungen - Rauchen, Adipositas, usw. Manifestieren sich auch in erhöhten Konzentrationen von Malondialdehyd.

Zuweilen werden geringfügig erniedrigte Konzentrationen beobachtet. Hier scheint ein Mangel an ungesättigten freien Fettsäuren zu einem geringeren Gesamtumsatz zu führen. In diesen Fällen sollten andere Wege zur Diagnose des oxidativen Stress - z. B. die Messung des Antioxidantienstatus Redox-Serumanalyse - Raman-Spektroskopie zur Messung von bestimmte Nährstoffen in lebendem Gewebe beschritten werden.

Eisen, Mangan und Parkinson Auf der Suche nach möglichen Ursachen von Morbus Parkinson interessiert sich die Wissenschaft zunehmend für Ernährungsfaktoren. In der vorliegenden Fall-Kontroll-Studie wurde der statistische Einfluss von Mineralstoffen, Spurenelementen sowie Vitaminen aus Lebensmitteln wie Nahrungsergänzungsmitteln auf die Erkrankung geprüft. Lediglich zwei Inhaltsstoffe korrelierten mit Parkinson: - Eisen und Mangan Dieses Resultat ist biochemisch durchaus plausibel. Schließlich weisen Parkinson. Patienten einen erhöhten Eisengehalt in der geschädigten Substantia nigra auf. Zudem ist freies Eisen im Körper sehr reaktiv und kann Nervenzellen schädigen. Eine erhöhte Manganaufnahme hingegen hat sich längst als Ursache von Parkinson etabliert. Zu den Lebensmittel, die beide Spurenelemente enthalten, zählen vor allem Spinat, Limabohnen, Pflaumen, Weizen und Erdnüsse. Powers KM et al: Pakinson`s disease risks associated with dietary iron, manganese, and other nutrient intakes. Neurology 2003/60/S. 1761 -1766

Multiple Sklerose: Hilfe durch Harnsäure Scott GS et al: Therapeutic intervention in experimental allergic encephalomyelitis by administration of uric acid precursors. Proceedings of the National Academy of Sciences 2002/99/S. 16303 -16308 Bei Multipler Sklerose (MS) und anderen neurodegenerativen Erkrankungen spielt das reaktionsfreudige Stoffwechselprodukte - Peroxynitrit – eine zentrale Rolle. Die Substanz ist in der Lage, riskante Reaktionsprodukte zu bilden, die allerdings von Harnsäure abgefangen werden können. Schon in der Vegangenheit hat man festgestellt, dass ein niedriger Harnsäurespiegel typisch für MS-Patienten ist, während Menschen mit erhöhtem Harnsäurespiegel, also Gichtpatienten, äußerst selten an MS erkranken. Dieser Unterschied ließ sich sogar an eineiigen Zwillingen nachweisen, von denen einer an MS litt. Erhöht man den Harnsäurespiegel von MS-Patienten durch die Gabe von zwei Vorstufen der Harnsäure - Inosin, - Inosinsäure besserte sich auch das Krankheitsbild. Inosin wird derzeit ohne Wirkungsnachweis als Nahrunsergänzungsmittel zur sportlichen Leistungssteigerung verkauft. Inosinsäure findet als Geschmacksverstärker(E 630) breite Anwendung.

Mineralien: anorganische Mineralien In Mineralwasser finden sich ausschließlich anorganische Verbindungen zwischen Elementen wie - Calcium - Magnesium - Natrium - Salzresten wie -sulfat, - carbonat, -hydrogencarbonat, -chlorid etc. In Pflanzen finden sich hauptsächlich organische Verbindungen zwischen Elementen und Kohlenstoffresten wie z. B. : - citrate, -celate, metallorganische Verbindungen


Genetische Faktoren des Cholesterin. Stoffwechsels und der Atherosklerose • Apolipoprotein B (Apo. B) • Apolipoprotein E (Apo. E) • Methylentetrahydofolat-Reduktase (MTHFR) (Hyperhomocysteinämie) • Plasminogen-Aktivator-Inhibitor (PAI-1) • Zytokine (Interleukin-1, Interleukin-6, TNFa) • Superoxid-Dismutase 2 (SOD 2)

Definition der WHO für Atherosklerose ist eine variable Kombination von Veränderungen der Intima, bestehend aus: • herdförmigen Ansammlungen von Fettsubstanzen • komplexen Kohlenhydraten • Blut und Blutbestandteilen • Bindegewebe und Kalziumablagerungen verbunden mit Veränderungen der Arterienmedia

Koronare Herzerkrankungen (KHK) Manifestation der Atherosklerose an den Herzkranzarterien • flusslimitierende Koronarstenosen • Koronarinsuffizienz daraus folgt: • Missverhältnis zwischen Sauerstoffbedarf und – angebot des Herzmuskels Ø Angina pectoris Ø Herzinfarkt Ø Herzrythmusstörungen Ø plötzlicher Herztod

Risikofaktoren der KHK 1. männliches Geschlecht 2. hohes Lebensalter 3. familiäre KHKBelastung 4. Hypercholesterinämie 5. niedriger HDLCholesterinwert Durch die frühzeitige Erkennung von Stoffwechselstörungen kann das Risiko durch diätetische und medikamentöse Therapie gemindert werden! 6. Zigarettenrauchen 7. hoher Blutdruck 8. Diabetes mellitus 9. körperliche Inaktivität 10. Übergewicht Quelle: Castelli et al. , 1986; Framingham-Studie

Besondere Rolle der Cholesterin-Werte Inzidenz eines Herzinfarktes innerhalb von 4 Jahren bei isolierten Risikofaktoren: • Hypertonie 14/1000 Personen • Diabetes mellitus 15/1000 Personen • Diabetes mellitus + Hypertonie 48/1000 Personen • Hyperlipidämie 96/1000 Personen • Hyperlipidämie + Diabetes mellitus 114/1000 Personen oder Hypertonie potenzierender Effekt von Einzelrisiken Quelle: Assmann et al. , 1988; „Prosektive Cardiovaskuläre Münster-Studie (PROCAM)“

Pathogenese der Atherosklerose 1. Endotheliale Dysfunktion • oxidative Modifikation der LDL • Einschwemmung von LDL-Cholesterin in die Intima • vermehrte Expression von Adhäsionsmolekülen Einwanderung von Monozyten 2. Umwandlung der Monozyten in Makrophagen • Aufnahme von LDL-Cholesterin mittels „Scavenger“ Rezeptoren in die Makrophagen • Sezernierung von Cholesterin in Form von Apo. E-haltigen Apolipoproteinen (HDL) Apo. E-abhängige Aufnahme und Abbau durch die Leber Reverser Cholesterin-Transport

Hyperlipidämie als zentraler Faktor der Atherosklerose • Überangebot von Cholesterin Umwandlung der Makrophagen in Schaumzellen Schaumzellen: • Sezernierung von Entzündungsmediatoren (Interleukine, Tumor-Nekrosefaktor a) Migration und Proliferation von glatten Muskelzellen Nekrose und Atherom-Bildung Aus einer primär reversiblen Läsion folgt die Bildung fortgeschrittener und komplizierter Plaques! • Schutz-Mechanismus vor Atherosklerose: reverser Cholesterin-Transport (HDL!)

Rolle der Thrombozyten in der Atherosklerose-Entstehung Adhäsion von Thrombozytenthromben an die Intima Ø Thrombozyten und Makrophagen sezernieren „platelet-derived growth factor“ (PDGF) Anregung der Proliferation glatter Muskelzellen bindegewebiger Umbau: Ø Bildung von Collagen, Elastin, Proteoglykanen die somit gebildete Matrix kann sekundär „verkalken“

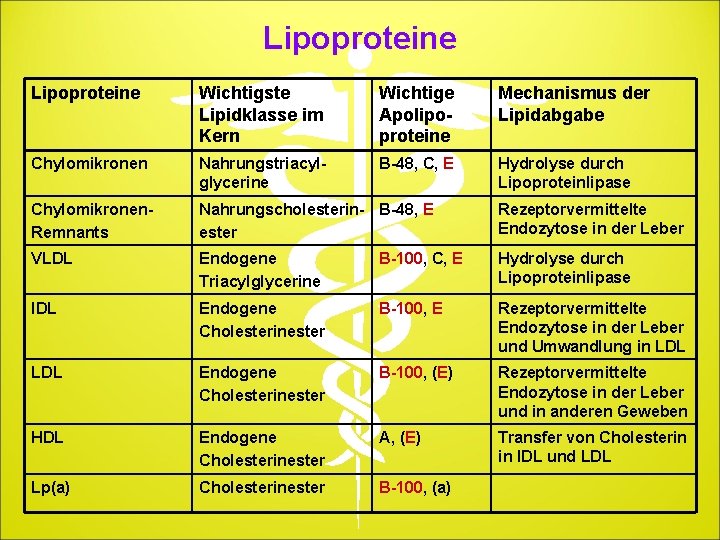
Lipoproteine Wichtigste Lipidklasse im Kern Wichtige Apolipoproteine Mechanismus der Lipidabgabe Chylomikronen Nahrungstriacylglycerine B-48, C, E Hydrolyse durch Lipoproteinlipase Chylomikronen. Remnants Nahrungscholesterin- B-48, E ester Rezeptorvermittelte Endozytose in der Leber VLDL Endogene Triacylglycerine B-100, C, E Hydrolyse durch Lipoproteinlipase IDL Endogene Cholesterinester B-100, E Rezeptorvermittelte Endozytose in der Leber und Umwandlung in LDL Endogene Cholesterinester B-100, (E) Rezeptorvermittelte Endozytose in der Leber und in anderen Geweben HDL Endogene Cholesterinester A, (E) Transfer von Cholesterin in IDL und LDL Lp(a) Cholesterinester B-100, (a)

Apolipoproteine • Synthese hauptsächlich in Leber und Darm • Löslichkeit der Fette im Blut • Mizellenstabilisierende Eigenschaften • Erkennung der LDL-Rezeptoren Aufnahme der Lipide in die Leber und in nichthepatisches Gewebe (Endozytose) • Aktivator bzw. Inhibitor von Enzymen Lipoproteinlipase (LPL), Lecithin-Cholesterin- Acyltransferase (LCAT)

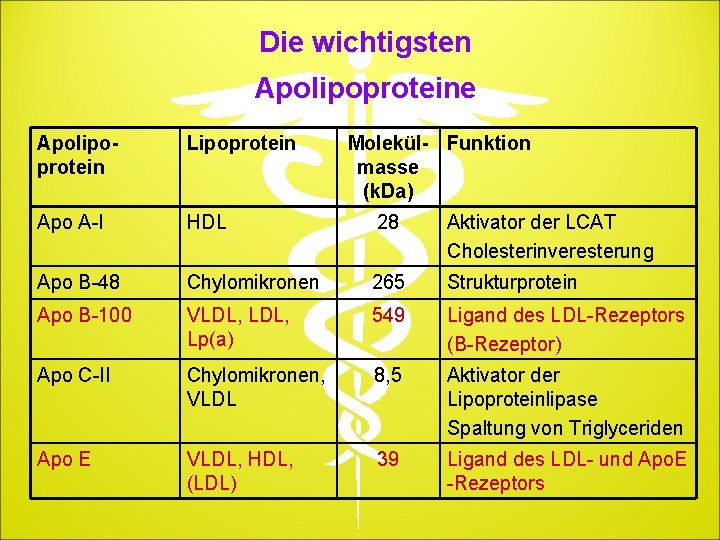
Die wichtigsten Apolipoproteine Apolipoprotein Lipoprotein Molekül- Funktion masse (k. Da) Apo A-I HDL 28 Aktivator der LCAT Cholesterinveresterung Apo B-48 Chylomikronen 265 Strukturprotein Apo B-100 VLDL, Lp(a) 549 Ligand des LDL-Rezeptors (B-Rezeptor) Apo C-II Chylomikronen, VLDL 8, 5 Aktivator der Lipoproteinlipase Spaltung von Triglyceriden Apo E VLDL, HDL, (LDL) 39 Ligand des LDL- und Apo. E -Rezeptors

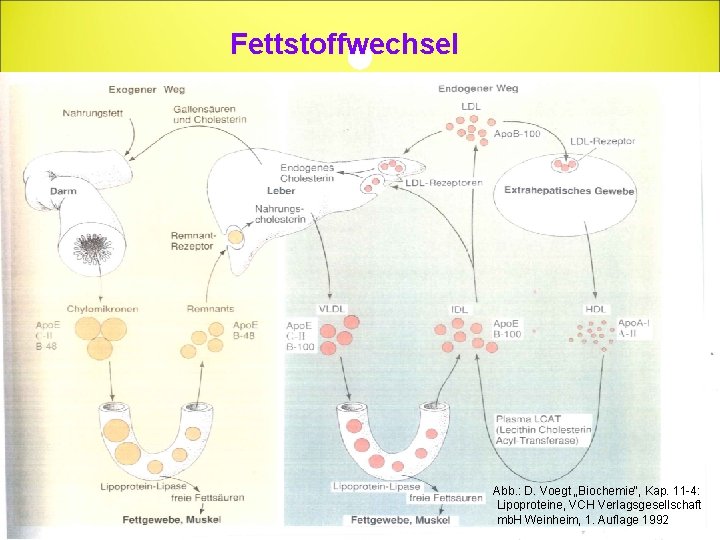
Fettstoffwechsel: Exogener Weg • Aus Chylomikronen werden Fettsäuren freigesetzt; • cholesterinangereicherte Remnants werden Apo. E und Apo. B-vermittelt in die Leber aufgenommen; • cholesterinhaltige Nahrung führt auf Dauer zu einer Herab-Regulierung der LDL-Rezeptoren der Leber Anstieg der LDL-Cholesterin-Werte im Plasma

Fettstoffwechsel Abb. : D. Voegt „Biochemie“, Kap. 11 -4: Lipoproteine, VCH Verlagsgesellschaft mb. H Weinheim, 1. Auflage 1992

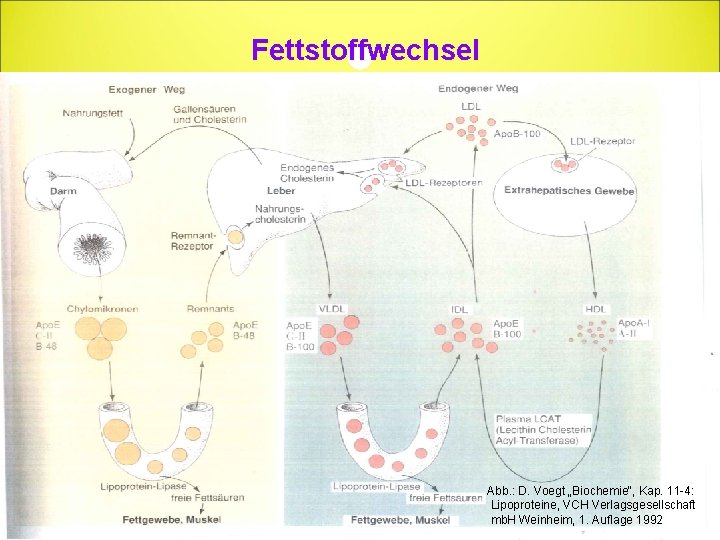
Endogener Weg • Endogene cholesterinreiche Lipoproteine (VLDL, LDL) und ihre Modifikation sind kausal für die Entstehung der Atherosklerose verantwortlich • Triglycerid-Anteil der VLDL verringert sich, es entstehen VLDL-Remnants (IDL) • Überschuss an Phospholipiden, freies Cholesterin, Apo. C und Apo. E werden an HDL übertragen • Großer Teil der VLDL-Remnants wird direkt über die Leber aus der Zirkulation entfernt • Verbleibender Teil wird über die hepatische Lipase (HL) weiter zu LDL abgebaut

Fettstoffwechsel Abb. : D. Voegt „Biochemie“, Kap. 11 -4: Lipoproteine, VCH Verlagsgesellschaft mb. H Weinheim, 1. Auflage 1992

LDL-Partikel • bestehen im Kern überwiegend aus Cholesterinestern • Hauptapolipoprotein = Apo. B, daneben Apo. E • Transport von ca. 80% des gesamten Plasma-Cholesterins • LDL werden zu ca. 70% über LDL-Rezeptoren aus der Blutzirkulation entfernt (Apo. B- bzw. Apo. E-vermittelt) • LDL-Moleküle lösen ihre eigene Phagozytose durch Makrophagen aus Ca. 30% werden über Rezeptor-unabhängigen Weg eliminiert (Akkumulation in Makrophagen, „Scavanger“-Rezeptor)

Regulation der LDL-Rezeptor. Synthese • negative Feedback-Kontrolle: • intrazellulärer Cholesterin-Gehalt hoch geringere Rezeptoren-Produktion • intrazelluärer Cholesterin-Gehalt niedrig (z. B. durch Hemmung der 3 -Hydroxy-3 -Methyl-Glutaryl. Co. A-Reduktase (HMG-Co. A-Reduktase)) erhöhte Rezeptor-Aktivität gesteigerte LDL-Clearance durch die Leber Abfall der Plasma-Cholesterin-Konzentration

Apolipoprotein B-100 (Apo. B) • Bedeutendste Apolipoprotein des VLDL und des LDL Transport von Triglyceriden und Cholesterin zwischen Leber und Peripherie • Nur einziges mal in LDL vorhanden • Veränderungen in der Proteinstruktur führt zu teilweise erheblichen Stoffwechseldefekten z. B. (Apo. B 3500): FDB (familiar defective apolipoprotein B) Apo. B erkennt seinen Rezeptor nicht mehr

Xba. I-Mutation im Apolipoprotein B-100 • stille Mutation (ohne AS-Austausch, vermutlich Kopplungseffekt ) • physiologische Auswirkung: erhöhter Gesamt-Cholesterin-Spiegel erhöhter Triglycerid-Spiegel erhöhter LDL-Cholesterin-Spiegel erhöhter Apo. B-Spiegel • tritt in der hiesigen Bevölkerung sehr häufig auf (ca. 40 % Xba. I Allel-Träger)

Apolipoprotein E (Apo. E) • Hauptprotein-Komponente in VLDL und HDL • Ausschleusung von Cholesterin aus der Peripherie (reverser Cholesterin-Transport) • Ligand des LDL-Rezeptors und des LRP 1 Regulation des Triglycerid- und Cholesterin Katabolismus • Bildungsorte: Leber, Niere, Nebenniere und Gehirn • bedeutende Rolle bei Regeneration und Degeneration von Nerven (Morbus Alzheimer!)

Apolipoprotein E-Polymorphismen • Epsilon 2: Cystein an Pos. 112 Cystein an Pos. 158 • Epsilon 3: Cystein an Pos. 112 Arginin an Pos. 158 • Epsilon 4: Arginin an Pos. 112 Arginin an Pos. 158 kann nicht mehr dimerisieren

Apolipoprotein E-Polymorphismen Physiologische Auswirkung Varianz von ca. 10% in der interindividuellen Plasma. Cholesterin-Konz. durch Apo. E-Polymorphismus verursach • Epsilon 2: stark herabgesetzte Bindungsfähigkeit an LDL-Rezeptor (<2% Bindung) erhöhtes Risiko für Typ-III-Hyperlipidämie • Epsilon 3: durchschnittliche starke Bindung an LDL-Rezeptor; bevorzugte Bindung an HDL • Epsilon 4: erhöhte Bindungsfähigkeit an LDL-Rezeptor, niedriger Apo. E-Plasmaspiegel Lipoproteine werden schneller aus dem Plasma entfernt Herabregulation der LDL-Rezeptoren der Leber Erhöhung der Plasma-Cholesterin-Konzentration

Apolipoprotein E und Morbus Alzheimer • E 4: erhöht Cholesterinspiegel erhöhte Aktivität der b- und c-Sekretase fehlerhafte Prozessierung von APP ( Amyloid-Vorläufer-Protein) extrazelluläre Plaques (Ablagerungen von b-Amyloid) • E 4: geringerer Schutz des Mikrotubuli-stabilisierenden Proteins Tau vor Phosphorylierung Bildung neurofibrillärer Bündel aus hyperphosphoryliertem Tau-Protein • Apo. E ist im Gehirn das alleinige Trägerprotein für Membranlipide E 4 transportiert weniger Cholesterin Unterversorgung von Neuronen mit Cholesterin Reparatur von Membranschäden gestört • Pro E 4 -Allel setzt der Krankheitsausbruch ca. 7 bis 9 Jahre früherer als bei E 3 -Trägern ein

Apolipoprotein E und weitere neuronale Schädigungen • Bis zu 50% aller 50 bis 60 jährigen M. Alzheimer. Patienten sind E 4 -Allel-Träger • Abnorme Proteinablagerungen bei verschiedenen Amyloidosen des Zentralnervensystems, Apo. E-Beteiligung denkbar bei: Creutzfeldt-Jakob-Krankheit Down-Syndrom Familiäre amyloidotische Polyneuropathie

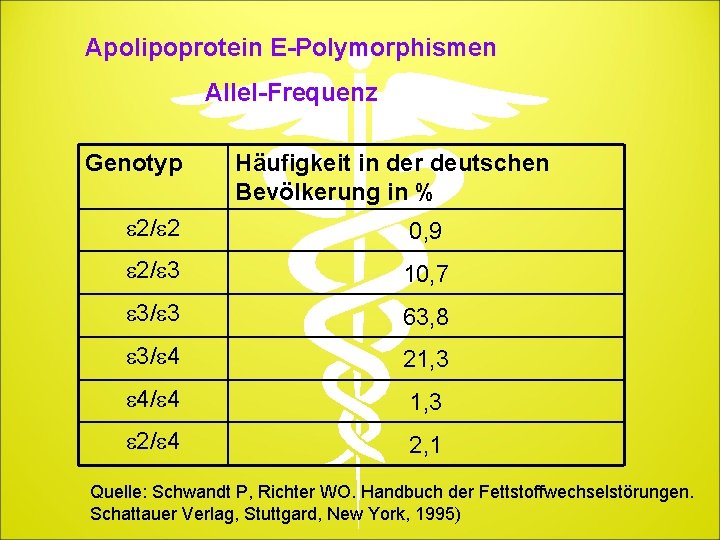
Apolipoprotein E-Polymorphismen Allel-Frequenz Genotyp Häufigkeit in der deutschen Bevölkerung in % e 2/e 2 0, 9 e 2/e 3 10, 7 e 3/e 3 63, 8 e 3/e 4 21, 3 e 4/e 4 1, 3 e 2/e 4 2, 1 Quelle: Schwandt P, Richter WO. Handbuch der Fettstoffwechselstörungen. Schattauer Verlag, Stuttgard, New York, 1995)

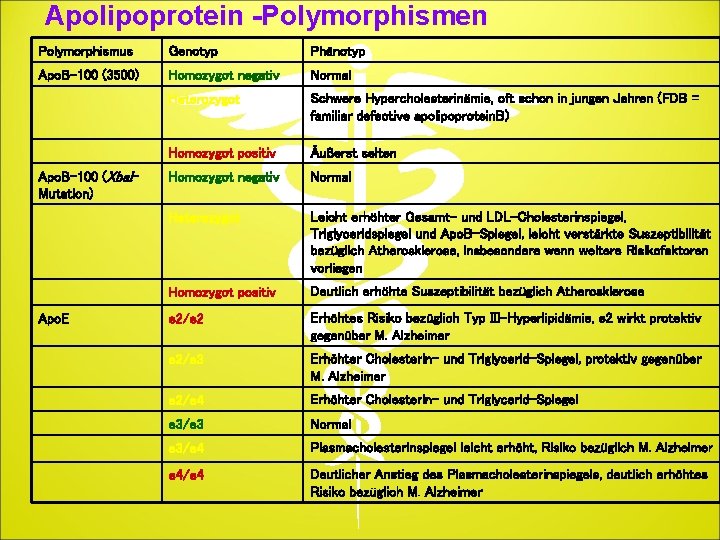
Apolipoprotein -Polymorphismen Polymorphismus Genotyp Phänotyp Apo. B-100 (3500) Homozygot negativ Normal Heterozygot Schwere Hypercholesterinämie, oft schon in jungen Jahren (FDB = familiar defective apolipoprotein. B) Homozygot positiv Äußerst selten Homozygot negativ Normal Heterozygot Leicht erhöhter Gesamt- und LDL-Cholesterinspiegel, Triglyceridspiegel und Apo. B-Spiegel, leicht verstärkte Suszeptibilität bezüglich Atherosklerose, insbesondere wenn weitere Risikofaktoren vorliegen Homozygot positiv Deutlich erhöhte Suszeptibilität bezüglich Atherosklerose e 2/e 2 Erhöhtes Risiko bezüglich Typ III-Hyperlipidämie, e 2 wirkt protektiv gegenüber M. Alzheimer e 2/e 3 Erhöhter Cholesterin- und Triglycerid-Spiegel, protektiv gegenüber M. Alzheimer e 2/e 4 Erhöhter Cholesterin- und Triglycerid-Spiegel e 3/e 3 Normal e 3/e 4 Plasmacholesterinspiegel leicht erhöht, Risiko bezüglich M. Alzheimer e 4/e 4 Deutlicher Anstieg des Plasmacholesterinspiegels, deutlich erhöhtes Risiko bezüglich M. Alzheimer Apo. B-100 (Xba. IMutation) Apo. E

Homocystein spielt eine große Rolle bei der Pathogenese der Atherosklerose Wirkung auf den Organismus: • oxidative Prozesse (Endothelschäden) • Gerinnungs- und Fibrinolysesystem (Plättchenaktivierung) • Zellsynthese und –proliferation (glatte Muskelzellen) • Cholesterinstoffwechsel der Leber (oxidative Modifikation des LDL) • Endothel-Leukozyten-Interaktion Gemeinsamer Mechanismus mit anderen Riskofaktoren?

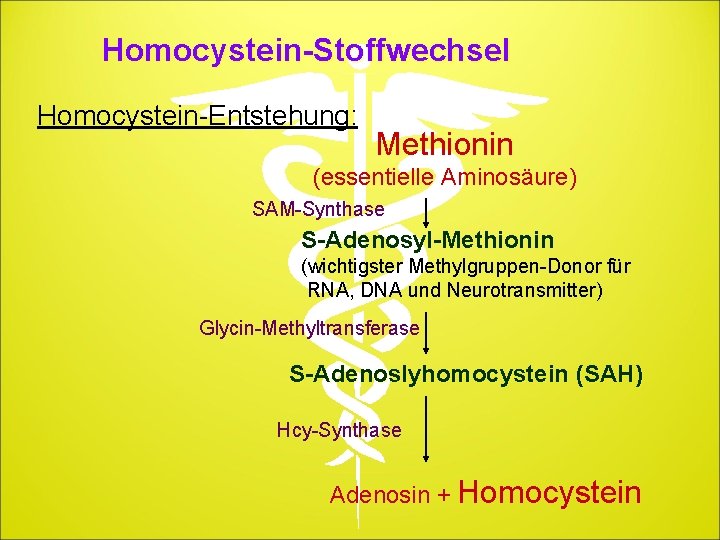
Homocystein-Stoffwechsel Homocystein-Entstehung: Methionin (essentielle Aminosäure) SAM-Synthase S-Adenosyl-Methionin (wichtigster Methylgruppen-Donor für RNA, DNA und Neurotransmitter) Glycin-Methyltransferase S-Adenoslyhomocystein (SAH) Hcy-Synthase Adenosin + Homocystein

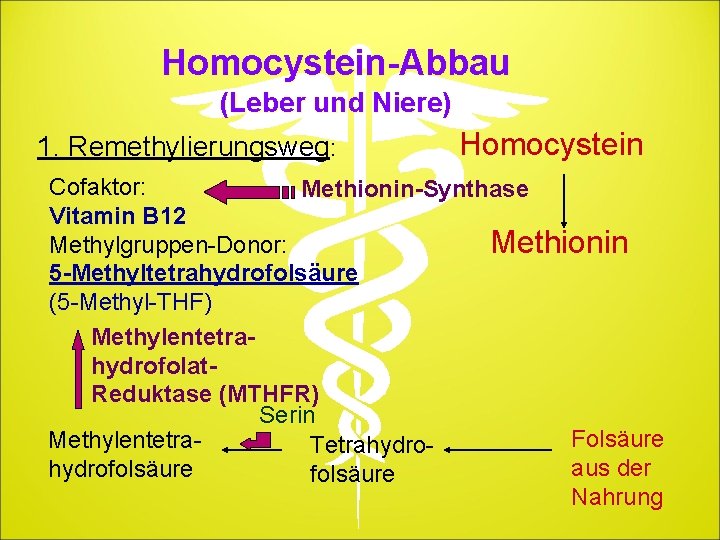
Homocystein-Abbau (Leber und Niere) 1. Remethylierungsweg: Homocystein Cofaktor: Methionin-Synthase Vitamin B 12 Methylgruppen-Donor: Methionin 5 -Methyltetrahydrofolsäure (5 -Methyl-THF) Methylentetrahydrofolat. Reduktase (MTHFR) Serin Folsäure Methylentetra. Tetrahydroaus der hydrofolsäure Nahrung

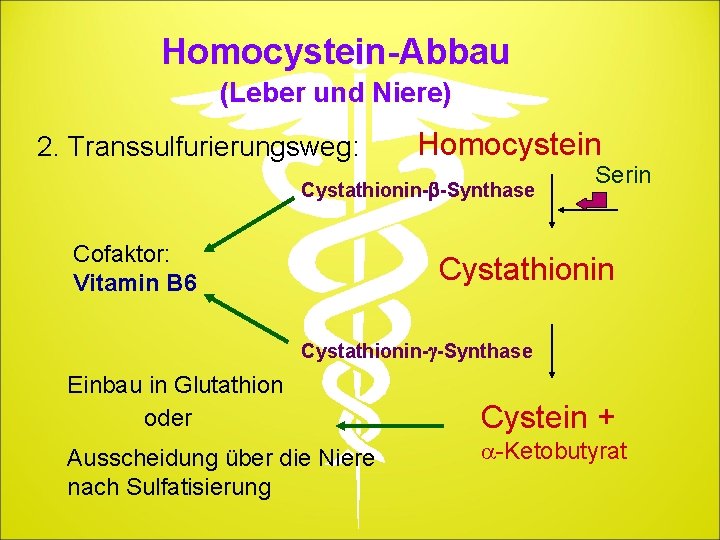
Homocystein-Abbau (Leber und Niere) 2. Transsulfurierungsweg: Homocystein Cystathionin-b-Synthase Cofaktor: Vitamin B 6 Serin Cystathionin-g-Synthase Einbau in Glutathion oder Ausscheidung über die Niere nach Sulfatisierung Cystein + a-Ketobutyrat

Homocystein-Stoffwechsel • physiologische Stoffwechselbedingungen: striktes Gleichgewicht zwischen Aufbau und Abbau des Homocysteins • ca. 50% des Methionins wird regeneriert • erhöhte Proteinaufnahme über die Nahrung: Transsulfurierungsweg gewinnt an Bedeutung • mehr Hyc gebildet, als verstoffwechselt: Zelle beginnt Hyc auszuscheiden

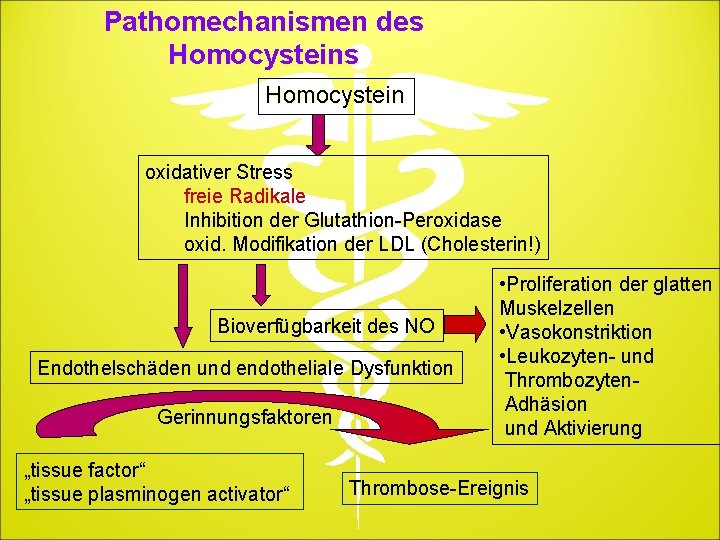
Pathomechanismen des Homocysteins • Infektionen, Entzündungen, Ischämie, Trauma oder Medikamente dosisabhängige Endothelschäden und endotheliale Dysfunktion oxidativer Stress: katalytische Autoxidation von Hyc Entstehung von Wasserstoffperoxid und Superoxid • Vermehrtes Auftreten von DNA-Strangbrüchen und verminderte NAD+-Konzentrationen (spontane Mutationen!) • beeinträchtige Vasodilatation durch Stickstoffmonoxid (Gefäßtonus-Regulierung ) Hcy verringert die Bioverfügbarkeit des NO, indem es dessen oxidativen Abbau fördert!

Pathomechanismen des Homocystein oxidativer Stress freie Radikale Inhibition der Glutathion-Peroxidase oxid. Modifikation der LDL (Cholesterin!) Bioverfügbarkeit des NO Endothelschäden und endotheliale Dysfunktion Gerinnungsfaktoren „tissue factor“ „tissue plasminogen activator“ • Proliferation der glatten Muskelzellen • Vasokonstriktion • Leukozyten- und Thrombozyten- Adhäsion und Aktivierung Thrombose-Ereignis

Homocystein-Genetik Methyltetrahydrofolat-Reduktase-Gen C 677 T-Austausch: • • • thermolabile Variante des MTHFR verminderte Enzym-Aktivität (TT: < 50%) um ca. 25% erhöhte Plasma-Hcy-Werte A 1298 C-Austausch: • signifikant erhöhte Hcy-Werte • synergistischer Effekt mit C 677 T-Austausch

Homocystein-Werte in Relation zum MTHFR-Genotyp (verschiedene Studien) Genotyp Homocystein-Werte CC/AA (WT), ansonsten normale Stoffwechsellage CC 677/CC 1298 < 15 µmol/l CT 677/CC 1298 > 15 µmol/l TT 677/AA 1298 > 15 µmol/l 37, 7 ± 12, 0 µmol/l

Nutritive Faktoren Singuläre Gabe von Folsäure: Metaanalyse: 500 – 5000 µg/Tag über 6 – 8 Wochen: Reduzierung von 12, 0 µmol/l auf 9, 0 µmol/l (gemittelte Werte) 25% Reduktion von Hcy Gabe von Vitamin B 12: gleiche Studie: 500 µg/Tag 7% Reduktion von Hcy Empfohlen wird kombinierte Gabe von Vitamin B 2, B 6 und B 12!

Weitere Faktoren, die zu einem erhöhten Hcy-Spiegel führen können ØNierenfunktion erhöhte Morbidität und Mortalität bei kardiovaskulärer Erkrankung ØFolsäure- bzw. Vitamin B 6 und B 12 -Mangel ØRauchen ØAlkohol- und Kaffeegenuss (> 600 ml/Tag) Øbewegungsarme Lebensweise Ømitbedingt durch verschiedene andere Krankheitsbilder ( KHK, periphere arterielle Verschlusskrankheit, Atherothrombose, Psoriasis, M. Parkinson, M. Alzheimer) ØArzneimittel ØEndokrine Faktoren (Östrogen, Testosteron, Insulin, Schilddrüsenhormone)

Interaktionen mit Medikamenten ØAntiepileptika: Phenytoin, Carbamazepin ØFolsäure- und Vitamin B 6 -Antagonisten: Methotrexat, Sulfasalazin, Trimethoprim ØDistickstoff ØLipidsenker: Statine, Niacin, Fibrate, Cholestyramin ØL-Dopa ØZytostatika: 6 -Mercaptopurin

Thrombusbildung und Entzündungsreaktionen Verschiedene imflammatorische Systeme interagieren mit der Thrombusbildung Ø Aktivierung des Komplement-Systems Ø Akt. des lokalen Angiotensins Ø Akt. von Matrixmetalloproteinasen Ø lokale Akt. von mononukleären Zellen Interleukin-6 vermittelt Akute-Phase-Reaktion: • vermehrte Synthese prothrombotischer (z. B. Fibrinogen, Plasminogen Aktivator Inhibitor-1) und inflammatorischer Mediatoren und Marker (CRP) • über Tage bis Wochen wird prokoagulatorischer Zustand aufrechterhalten!

Interleukin-6 Chronische Inflammation der Gefäßwand: Ø zentraler Regulator der Akutphase und somit der Expression des CRP-Gens bis zu 10 fach erhöhter Spiegel in atherosklerotischen Plaques Ø Bildung durch Monozyten, Adipozyten, Endothelzellen, glatte Muskelzellen und Fibroplasten Ø Variation von 35 -40% des CRP-Baselinespiegels über genetische Konstellation des IL-6 bestimmt Ø Promotor-Mutation bestimmt Transkriptionsrate und daher Aktivität des IL-6

Inflammatorische Regulatoren: Zytokine Entzündliche Prozesse werden im großen Ausmaß über Zytokine reguliert; am wichtigsten: Interleukin-1 Interleukin-6 Tumor-Nekrosefaktor a Mutationen: Ø Störung des „fine tunings“ im regulativen Netzwerk Ø Überschießen des Immunsystems Insbesondere Interleukin-6 wird mit einer Risikoerhöhung bezüglich KHK und Arteriosklerose in Zusammenhang gebracht!

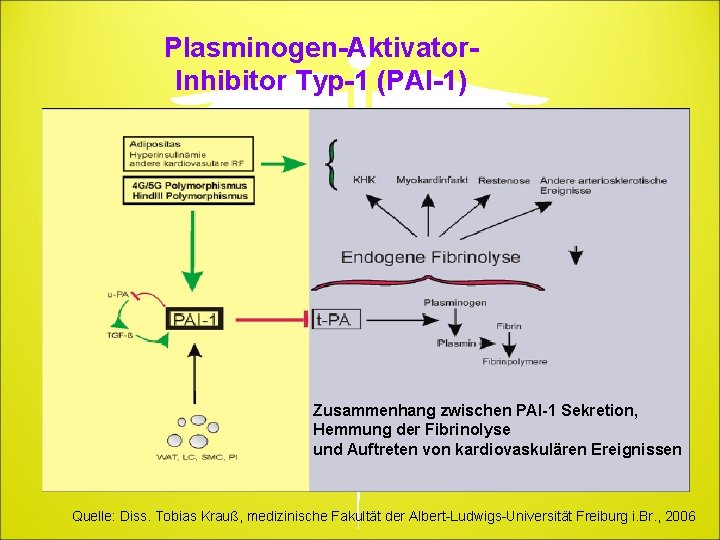
Plasminogen-Aktivator. Inhibitor Typ-1 (PAI-1) Ø Serin-Protease-Inhibitor, frei zirkulierend (PAI-2 in Leukozyten) Ø nur von wenigen Zellen ausgeschüttet (Hepatozyten, glatte Muskelzellen, Adipozyten und Thrombozyten) normalerweise geringe Konzentration von PAI (5 – 20 ng/ml) Ø Inflammatorische Prozesse PAI-Konz (Sezernierung durch viele andere Zellen) Wichtigster Regulator des fibrinolytischen Systems: Hemmung des „tissue-type-plasminogen-activator“ (t-PA) und des „urokinase-type-plasminogen-activator“ (u-PA)

Plasminogen-Aktivator. Inhibitor Typ-1 (PAI-1) Zusammenhang zwischen PAI-1 Sekretion, Hemmung der Fibrinolyse und Auftreten von kardiovaskulären Ereignissen Quelle: Diss. Tobias Krauß, medizinische Fakultät der Albert-Ludwigs-Universität Freiburg i. Br. , 2006

Fazit Das Gleichgewicht zwischen t. PA und PAI-1 entscheidet, ob ein Thrombus gebildet oder aufgelöst wird! Erhöhte Plasmakonzentrationen von PAI-1 führen zu einem prothrombotischen Zustand!

Erhöhung der PAIKonzentration 1. Insulin und Proinsulin stimulieren PAI-Synthese 2. Adipositas (Fibrinogenspiegel im Plasma ist direkt mit BMI korreliert) 3. PAI-Polymorphismen, die Synthese des Proteins steigern Folgen: Hemmung der fibrinolytischen Aktivität über eine verminderte endotheliale Freisetzung von Plasminogenaktivatoren (t-PA) Gesteigerte Thrombozytenaggregation, gesteigerte Plasmaviskosität Förderung der arteriosklerotischen Plaquebildung

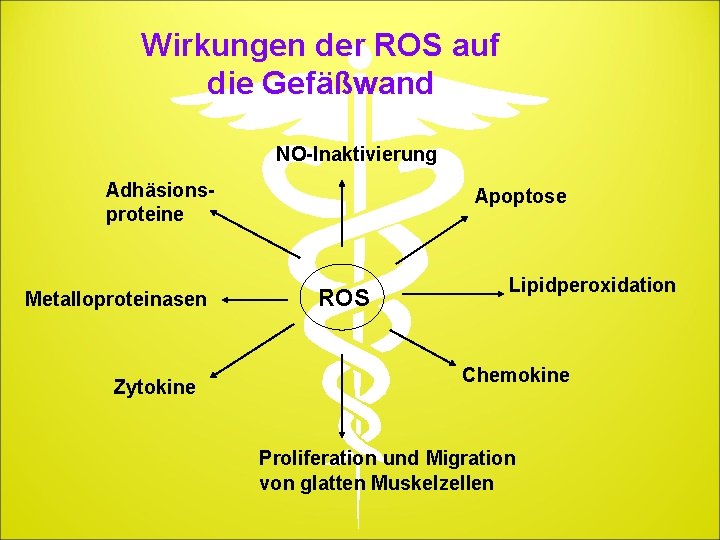
Rolle der freien Sauerstoffradikale (ROS) ROS werden als die molekulare Ursache einer Reihe pathophysiologischer Faktoren bei der Entstehung der endothelialen Dysfunktion angesehen: • oxidierte LDL • Homocystein (verminderte Bioverfügbarkeit von NO) • Hyperglykämie (verstärkte O-Glykosilierung, Hemmung der NOS) • Zytokine • bakterielle Stoffwechselprodukte • hämodynamische Streßfaktoren

Wirkungen der ROS auf die Gefäßwand NO-Inaktivierung Adhäsionsproteine Metalloproteinasen Zytokine Apoptose ROS Lipidperoxidation Chemokine Proliferation und Migration von glatten Muskelzellen

Mutationen in der Superoxid. Dismutase 2 (SOD 2) SOD 2: Mn-abhängige Superoxid-Dismutase 2; mitochondriales Enzym, fängt Radikale direkt am Entstehungsort ab Mutation in der Leadersequenz: Signalpeptid betroffen • häufigste Mutation: ca. 30% der hiesigen Bevölkerung ist homozygot positiv! • Assoziiert mit Erkrankungen wie chronisch entzündliche Prozesse, Arteriosklerose, Diabetes mellitus, Parodontitis, Krebserkrankungen, vorzeitigen Alterungsprozessen uvm. Mutation im Strukturgen: Aktivitätsverlust • selten in der hiesigen Bevölkerung

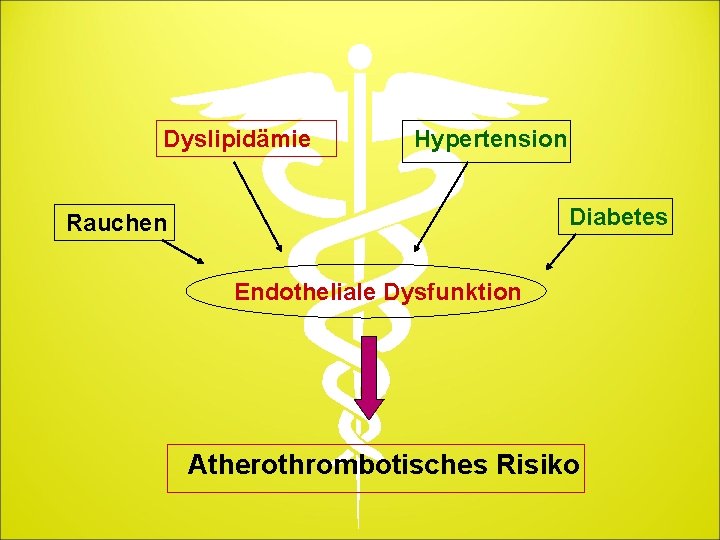
Dyslipidämie Hypertension Diabetes Rauchen Endotheliale Dysfunktion Atherothrombotisches Risiko

Was ist die Ursache, wenn meine Therapie bei meinem Patienten nicht anspricht (Non-Responder)? wenn sich die Besserung äußerst schleppend einstellt? wenn die Therapie schlecht vertragen wird? Können eventuell vorhandene weitere Symptome mit der Grunderkrankung assoziiert sein? Familienanamnese!!

Labordiagnostische Vorgehensweise Dyslipidämie Drastische Hypercholesterinämie Homocysteinämie, Neigung zu Fehlgeburten Thrombose-Neigung, familiäre Dickleibigkeit Generelle Veranlagung zu chronisch entzündlichen Erkrankungen, Vergiftungssymptomatiken, Verdauungsprobleme, Erschöpfung Apo. E, Apo. BXba. I Apo. B 3500 MTHFR PAI, Gerinnungsfaktor II, Faktor V SOD 2 Leadersequenz, GST -Enzyme

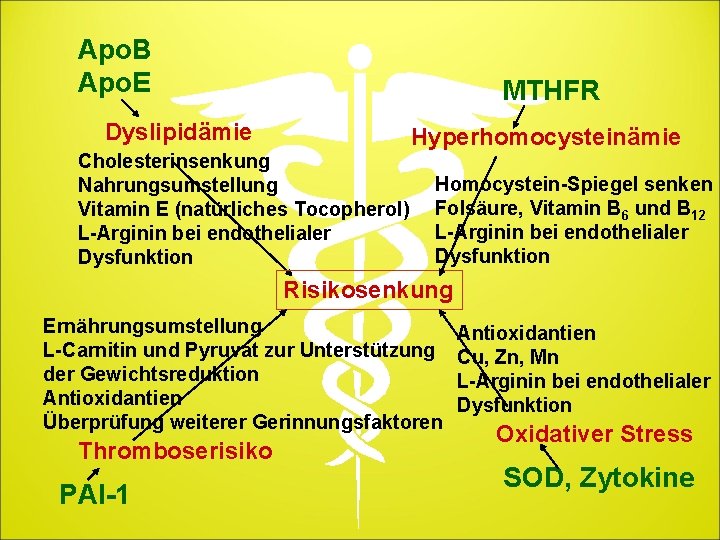
Apo. B Apo. E MTHFR Dyslipidämie Cholesterinsenkung Nahrungsumstellung Vitamin E (natürliches Tocopherol) L-Arginin bei endothelialer Dysfunktion Hyperhomocysteinämie Homocystein-Spiegel senken Folsäure, Vitamin B 6 und B 12 L-Arginin bei endothelialer Dysfunktion Risikosenkung Ernährungsumstellung L-Carnitin und Pyruvat zur Unterstützung der Gewichtsreduktion Antioxidantien Überprüfung weiterer Gerinnungsfaktoren Thromboserisiko PAI-1 Antioxidantien Cu, Zn, Mn L-Arginin bei endothelialer Dysfunktion Oxidativer Stress SOD, Zytokine

„The doctor of the future will give no medicine, but will interest his patients in the care of the human frame, in diet, and in the cause and prevention of disease. “ Thomas Edison


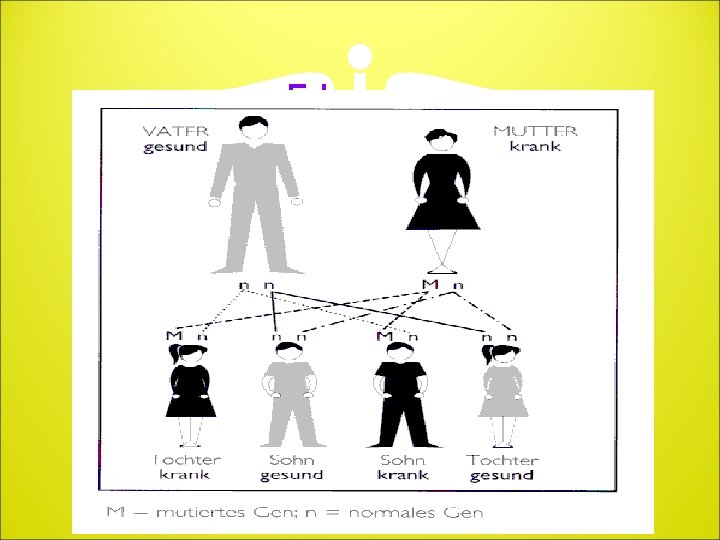
Vererbung Doppelter Chromosomensatz, doppelte Anzahl Gene: Warum? • Diversität der genetischen Informationen Potential der Weiterentwicklung Evolution • Mutationen betreffen zunächst ein Gen geringere Wirkung auf den Organismus

Erbgang

Mutationen - Polymorphismen • Punktmutationen meist in „hot spots“ • meist zunächst nur ein „Allel“ betroffen oft nur milde Effekte für den Träger • Weitervererbung: Mutation wird in der Population häufiger • Polymorphismus: Häufigkeit in der Bevölkerung > 1 % oder große Relevanz für den Träger

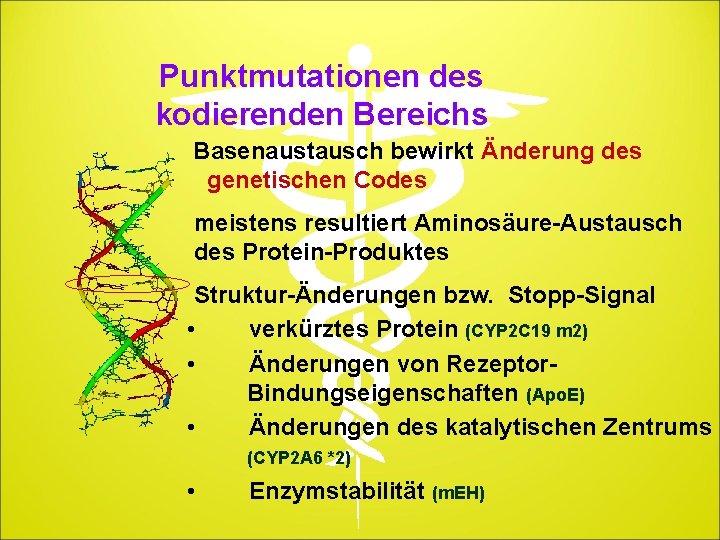
Punktmutationen des kodierenden Bereichs Basenaustausch bewirkt Änderung des genetischen Codes meistens resultiert Aminosäure-Austausch des Protein-Produktes Struktur-Änderungen bzw. Stopp-Signal • verkürztes Protein (CYP 2 C 19 m 2) • Änderungen von Rezeptor Bindungseigenschaften (Apo. E) • Änderungen des katalytischen Zentrums (CYP 2 A 6 *2) • Enzymstabilität (m. EH)

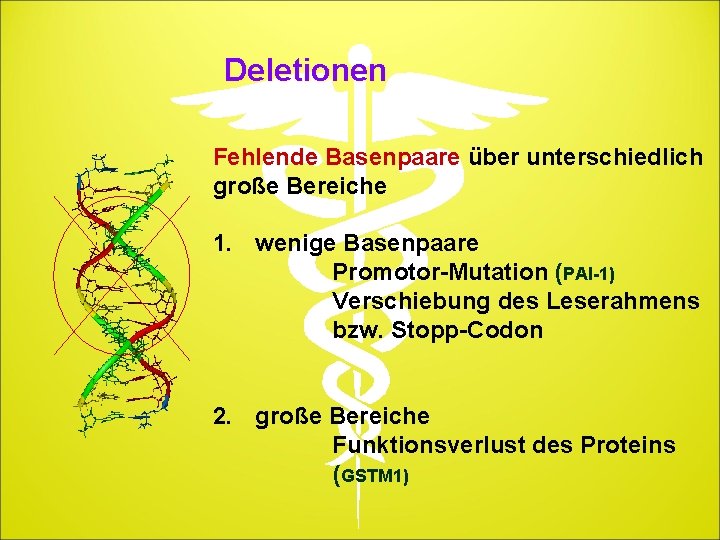
Deletionen Fehlende Basenpaare über unterschiedlich große Bereiche 1. wenige Basenpaare Promotor-Mutation (PAI-1) Verschiebung des Leserahmens bzw. Stopp-Codon 2. große Bereiche Funktionsverlust des Proteins (GSTM 1)

Ziel genetischer Analysen • Bewusstseinsförderung, evtl. Änderung von Lebensgewohnheiten Meidung weiterer Risiko-Faktoren Meidung oder Entfernung von Toxinen • Unterstützung betroffener Protein/Enzym Funktionen (z. B. über Mikronährstoffe) • Risikopotential innerhalb der Familie

Wie werden die Testungen ausgewählt? • Kriterien für die Übernahme in unser Testprogramm: 1. Klinische Studien weisen Assoziation Genotyp – Phänotyp auf; 2. Polymorphismus ist hinreichend häufig in der Bevölkerung vertreten; 3. Sinnvolle Ergänzung zu bestehenden Thematiken; 4. Möglichkeit einer Kompensation des genetischen Defektes;

Die Genetik hilft: • grundlegende Schwachstellen zu erkennen Schadstoffabbau Fehlfunktionen im Stoffwechsel-Geschehen Abbau von ROS (reactive oxygen species) Dysregulation von Signalketten • die Physiologie der Patienten zu optimieren, damit die Therapie mehr Chancen auf Erfolg hat!

Ende

Alle chemischen Reaktionen in Pflanzen und Tieren, die das Leben unterstützen, finden mit Hilfe von Wasser statt. Wasser liefert nicht nur das Medium, in dem die Reaktionen stattfinden, sondern Wasser ist oft auch ein wichtiger Bestandteil dieser Reaktionen. Wasser ist ein universelles Lösungsmittel! Wasser ist ein universelles starkes polares Lösungsmittel. Aufgrund seiner starken Polarität, ist es in der Lage alle polaren Stoffe zu lösen und Wasserstoffbrückenbindungen aufzubauen, die insbesondere für die spezielle Geometrie und damit für die Wirkung von Eiweißstoffen und Nukleinsäuren verantwortlich sind.

Die Struktur des Wassermoleküls Um das Phänomen „Wasser“ zu verstehen, müssen wir uns in die Welt der Atome (von Griechisch a-tomos=unteilbar), der kleinsten Teilchen, begeben. Diese Atome können Sie sich vorstellen wie unser Sonnensysteme: Um den Atomkern (bestehend aus Protonen und Neutronen) kreisen Elektronen in verschiedenen Schichten. Anders als die Planeten gibt es mehrere „Schalen“, d. h. Abstände vom Atomkern, auf denen die Elektronen sich bewegen. Die erste Schale besteht aus maximal 2, die zweite und dritte aus maximal 8 Elektronen. Jedes Atom hat den „Wunsch“, seine äußerste Schale zu komplettieren, d. h. mit der maximalen Anzahl von Elektronen zu füllen. Nur die Elektronen der äußersten Schale – die Valenzelektronen – sind für die chemische Reaktion wichtig.

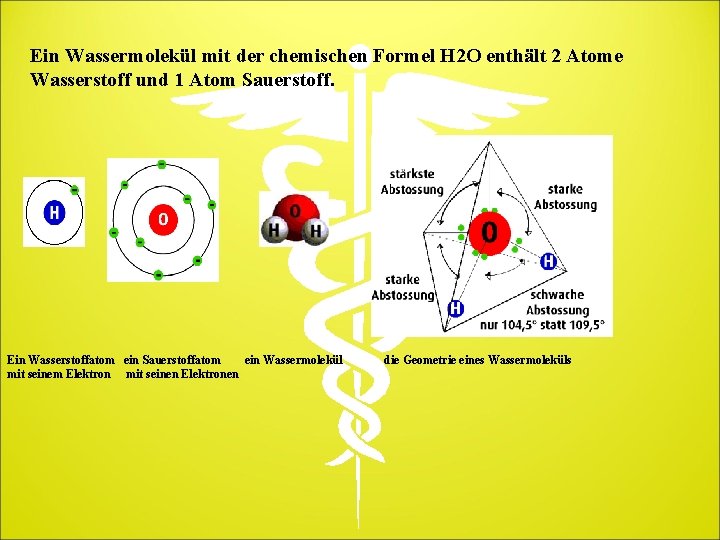
Ein Wassermolekül mit der chemischen Formel H 2 O enthält 2 Atome Wasserstoff und 1 Atom Sauerstoff. Ein Wasserstoffatom ein Sauerstoffatom ein Wassermolekül mit seinem Elektron mit seinen Elektronen die Geometrie eines Wassermoleküls

Allein betrachtet enthält das Wasserstoffatom ein Proton im Atomkern und ein Elektron in der Atomhülle. Wasserstoff ionisiert schnell, indem er sein einziges Elektron verliert und so zu einem alleinstehenden H+ wird, einem isolierten Proton, denn das Wasserstoffatom hat keine Neutronen. Sauerstoff enthält 8 Protonen und 8 Neutronen im Kern sowie 8 Elektronen, von denen sich aber 2 auf der inneren Schale befinden und so für die chemische Reaktion unwirksam sind. So hat Sauerstoff 6 Valenzelektronen. Verbindet er sich nun mit 2 Wasserstoffatomen, so kann er sich mit diesen die beiden Elektronen teilen. Das so entstehende Wassermolekül hat also insgesamt 8 Valenzelektronen auf der äußersten Schale – der Sauerstoff hat sein „Ziel“ erreicht – muss sich die Elektronen aber mit den beiden Wasserstoffmolekülen teilen. Durch die besondere Lage der Elektronenpaare entsteht ein asymmetrisches Molekül, bei dem die bindenden Elektronenpaare zum Wasserstoff einen Winkel von 104, 5 Grad (statt rechnerisch 109, 5 Grad) bilden.

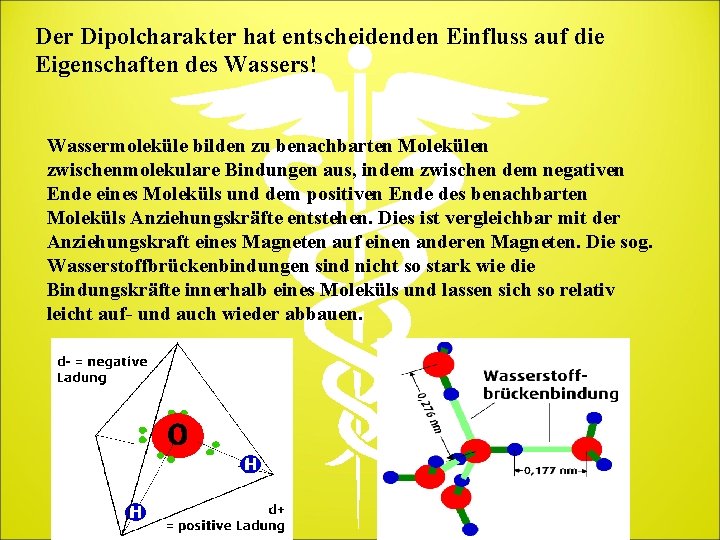
Die Polarität des Wassermoleküls ist entscheidend! In einem Wassermolekül sind zwei Wasserstoffatome kovalent mit einem Sauerstoffatom verbunden. Da das Sauerstoffatom jedoch wesentlich grösser ist als ein Wasserstoffatom, zieht es die gemeinsamen (bindenden) Elektronen auch stärker an. Diese Anziehungskraft nennt man die Elektronegativität eines Atoms. Mit einem Wert von 3, 5 ist die elektronenanziehende Wirkung von Sauerstoff nahe zu doppelt so groß wie die von Wasserstoff (2, 1). Das hat Konsequenzen für die Lage der bindenden Elektronenpaare. Sie werden dichter an den Sauerstoff gezogen und verursachen dort eine negative Teilladung (d-) am entgegengesetzten Ende des Moleküls, bei den beiden Wasserstoffatomen fehlen die Elektronen und somit tritt dort eine positive Teilladung auf (d+). Moleküle, die entgegengesetzt geladene Enden besitzen, bezeichnet man als Dipole.

Da der Elektronegativitätsunterschied beim Wassermolekül sehr hoch ist, ist Wasser ein starker Dipol und ein starkes polares Lösungsmittel. Diese positive und negative Ladung bewirkt, dass Wassermoleküle auch auf magnetische Einflüsse von außen reagieren – eine Eigenschaft, die z. B. bei der magnetischen Kalkbehandlung von Bedeutung ist.

Der Dipolcharakter hat entscheidenden Einfluss auf die Eigenschaften des Wassers! Wassermoleküle bilden zu benachbarten Molekülen zwischenmolekulare Bindungen aus, indem zwischen dem negativen Ende eines Moleküls und dem positiven Ende des benachbarten Moleküls Anziehungskräfte entstehen. Dies ist vergleichbar mit der Anziehungskraft eines Magneten auf einen anderen Magneten. Die sog. Wasserstoffbrückenbindungen sind nicht so stark wie die Bindungskräfte innerhalb eines Moleküls und lassen sich so relativ leicht auf- und auch wieder abbauen.

Diese schwachen Verbindungen spielen eine entscheidende Rolle bei der Stabilisierung vieler großer organischer Moleküle. Da sie schwach sind, können sie in den physiologischen Reaktionen schnell aufgebrochen und neu aufgebaut werden. Diese Auflösung und Neubildung ist die Essenz der Chemie des Lebens. Die Wasserstoffbrückenbindungen sind auch die Ursache für die Oberflächenspannung des Wassers (Tropfenbildung, Haut des Wassers) und den relativ hohen Siedepunkt des Wassers von 100 Grad Celsius.

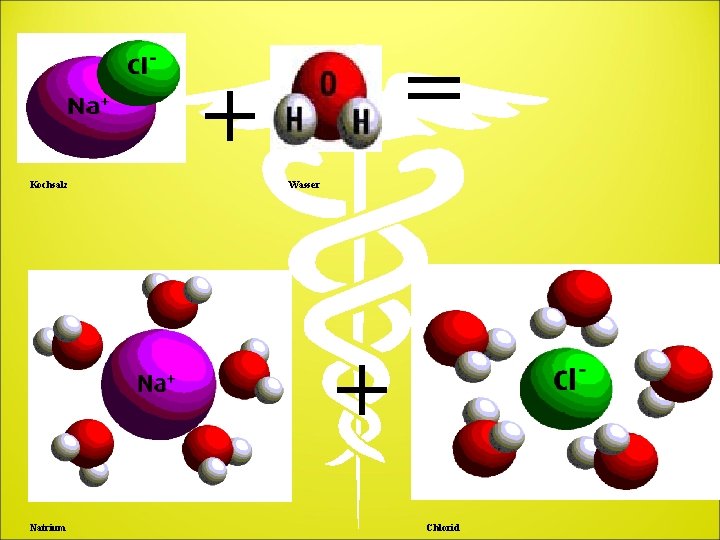
Schwache Verbindungen lösen feste Kristalle Wassermoleküle eignen sich hervorragend zur Auflösung von Ionenverbindungen. Aufgrund der unterschiedlichen Ladung können sich die Wassermoleküle zwischen die positiv und negativ geladenen Ionen eines Ionengitters schieben und die geladenen Teilchen mit einer Hydrathülle umgeben. Die positive Seite des Wasserdipols wendet sich den negativen Ionen zu, wobei die negativen Ionen so ummantelt werden, dass sich ihnen die positive Seite des Dipols zuwendet. So lösen sich die harten Kristalle von Kochsalz mit der starken Ionenbindung sehr leicht im Lösungsmittel Wasser mit den vielen schwachen Wasserstoffbrückenbindungen auf.

= + Kochsalz Wasser + Natrium Chlorid

Salz ist im trockenen Zustand seine sehr fest Verbindung. Gibt man es in Wasser, so wird es aufgelöst, indem das positiv geladene Na+ mit den negativen Polen der H 2 O-Moleküle und das negativ geladene CI- mit den positiven Polen H 2 O-Moleküle eine Verbindung eingeht. Wie man aus diesem einfachen Beispiel ersehen kann, sind die schwachen Verbindungen einzelner Wassermoleküle in der Lage, starke Verbindungen aufzulösen. Dies ist der Grund warum wir Wasser als ein universelles, natürliches Lösungsmittel bezeichnen, das starke und komplexe Verbindungen aufbrechen kann. Dies ist die Chemie des Lebens auf der Erde.

Oxidations- und Reduktionsreaktionen (Redoxreaktionen) Dieser Vorgang nimmt in den biologischen Systemen eine zentrale Stellung ein. In der Chemie definiert man die Oxidation als eine Elektronenabgabe (z. B. das Rosten von Metall) und die gegenläufige Reduktion als eine Elektronenaufnahme. Oxidation = Abgabe von Elektronen Reduktion = Aufnahme von Elektronen

Die Abgabe eines Elektrons (Oxidation) setzt Energie aus der oxidierten Verbindung frei, die Aufnahme eines Elektrons (Reduktion) speichert Energie in der reduzierten Verbindung. Es findet keine Oxidation statt, ohne dass gleichzeitig eine Reduktion stattfindet. Dieses Zusammenspiel der Reaktionstypen nennt sich Redoxreaktion. Sie bezeichnet folgende chemische Reaktion, die wir am Beispiel von zwei Molekülen, A und B, darstellen: A e. Elektronen Spender + B - Elektronen empfänger A + Oxidiert (hat ein e- verloren) Wenn die Moleküle A und B in Kontakt kommen, geschieht folgendes: Molekül B erhält ein Elektron (e-) vom Molekül A ist oxidiert, da es ein Elektron verloren hat. Die Ladung von Molekül B hat sich reduziert, da es ein negatives Elektron hinzugewonnen hat. In biologischen Systemen finden sehr häufig solche Redoxreaktionen an zentralen Stellen des Stoffwechsels statt. (Photosynthese, Zitronensäurezyklus Be. Reduziert hat ein egewonnen

Lebenswichtiger Sauerstoff Ohne Sauerstoff gibt es kein Überleben für „höhere“ Lebewesen. In der Luft ist er relativ stabil, da er als Molekül O 2 auftritt und zwei Sauerstoffatome eine gemeinsame Elektronenhülle bilden. Im Körper wird er durch die Lunge aufgenommen, geht in den Lungenbläschen in das Blut über und wird durch das Blut in die Körperzellen transportiert, wo er für eine effektive Energieerzeugung (Verbrennung, Oxidation) notwendig ist. Nur im aeroben Stoffwechsel können Kohlenhydrate effektiv in Kohlendioxid CO 2 und Wasser „zerlegt“ werden und dabei Energie freisetzen. Bei Sauerstoffmangel kann der Körper auf eine anaerobe (ohne Sauerstoff ablaufende) Umwandlung der Kohlenhydrate zurückgreifen, die aber nicht effektiv ist und problematische saure „Schlacken“ zurücklässt (die z. B. bei übermäßiger Beanspruchung der Muskeln zur Muskelkater führen).

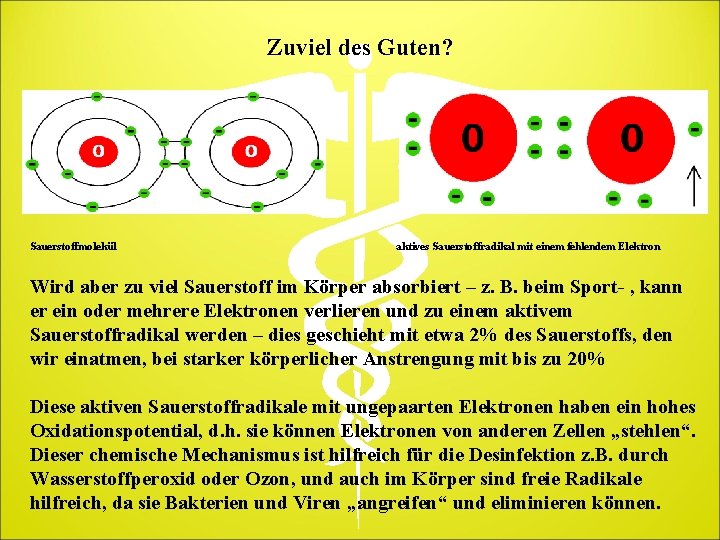
Zuviel des Guten? Sauerstoffmolekül aktives Sauerstoffradikal mit einem fehlendem Elektron Wird aber zu viel Sauerstoff im Körper absorbiert – z. B. beim Sport- , kann er ein oder mehrere Elektronen verlieren und zu einem aktivem Sauerstoffradikal werden – dies geschieht mit etwa 2% des Sauerstoffs, den wir einatmen, bei starker körperlicher Anstrengung mit bis zu 20% Diese aktiven Sauerstoffradikale mit ungepaarten Elektronen haben ein hohes Oxidationspotential, d. h. sie können Elektronen von anderen Zellen „stehlen“. Dieser chemische Mechanismus ist hilfreich für die Desinfektion z. B. durch Wasserstoffperoxid oder Ozon, und auch im Körper sind freie Radikale hilfreich, da sie Bakterien und Viren „angreifen“ und eliminieren können.

Aktiver Sauerstoff im Körper Wir sind im Leben einer ununterbrochenen Begegnung mit verschiedensten Mikroorganismen ausgesetzt und leben in ständigem Austausch mit ihnen. Insbesondere im Darm findet sich eine große Anzahl von Bakterien und anderen Mikroorganismen, die für die Verdauung und Zersetzung der Nahrung verantwortlich sind. Um das Wachstum dieser Mikroorganismen in Schach zu halten, bildet das Abwehrsystem des Körpers Neutrophile, eine Art Leukozyten, weiße Blutkörperchen. Diese Neutrophile erzeugen aktive Sauerstoffradikale, die unerwünschte Mikroorganismen oxidieren können und so eine desinfizierende Wirkung haben. Diese freien Radikale sind für das Überleben des Menschen notwendig.

Bilden sich aber zu viele freie Sauerstoffradikale im Körper und wird ihre Konzentration zu hoch, werden sie schädlich, greifen gesunde Moleküle und Zellen an und rauben ihnen Elektronen (d. h. oxidieren sie), schädigen das Zellgewebe und oft auch den genetischen Code und werden zur Ursache von Erkrankungen. Wie bei vielem anderen, kommt es also auch bei den aktiven Sauerstoffradikalen auf die Dosierung an - und zuviel des Guten ist auch hier schädlich. Diese Oxidation ist insofern besonders gefährlich, als dass sie eine Kettenreaktion auslöst: Das freie Sauerstoffradikal oxidiert Molekül A (d. h. es raubt ihm ein Elektron), dieses oxidiert Molekül B, dieses wieder Molekül C …. und so weiter.

Die Auswirkungen der Oxidation lebenswichtiger Organe Oxidiertes Organ -Leber -Pankreas -Nieren Führt zu: - Hepatitis, Leberzirrhose , Krebs - Pankreatitis, Diabetes, Krebs - Nierenentzündung, Nierenkrebs Entstehung und Wirkung freier Sauerstoffradikale im Körper: Mikroorganismen arbeiten in Symbiose im Körper und vermehren sich. Um das Wachstum der Mikroorganismen zu kontrollieren und schädlichen Mikroorganismen zu oxidieren, erzeugen Leukozyten freie Sauerstoffradikale Es werden überschüssige freie Sauerstoffradikale erzeugt.

Der überschüssige freie Sauerstoff oxidiert gesunde Zellen und setzt eine Kettenreaktion der Oxidation in Gang. Antioxidantien verhindern die gefährliche Oxidation!! Eine Möglichkeit um gesundes Gewebe vor der Oxidation durch aktive Sauerstoffradikale zu schützen ist, ihnen freie Elektronen zur Verfügung zu stellen, die ihr hohes Oxidationspotential neutralisieren. Die Erforschung der Zusammenhänge zwischen Ernährung und Krebs sind noch lange nicht abgeschlossen, aber es gibt ernst zu nehmende Anzeichen, dass unsere Nahrung die Anfälligkeit für eine Krebserkrankung beeinflusst. Es gibt anscheinend Nahrungsmittel, die Widerstandskräfte gegen Krebs stärken, und andere, die das Krebswachstum begünstigen. Viele Schäden durch krebserregende Stoffe werden wahrscheinlich durch eine Oxidationsreaktion in den Zellen hervorgerufen, indem ein freies Radikal oder aktiver Sauerstoff den genetischen Code der Zelle beschädigt.

Viele Forscher sind der Meinung, dass Stoffe, die eine Oxidation verhindern – sogenannte Antioxidantien – die Schädigung verhindern können. Dies führt zu der Auffassung, dass die Einnahme von natürlichen Antioxidantien einen wichtigen Beitrag zur Prävention gegen Krebs leisten kann – so z. B. von Vitamin C, Vitamin E, Beta-Carotin, Selen etc. . Diese Stoffe wirken reduzierend. Sie versorgen freie Radikale und aktiven Sauerstoff mit Elektronen und verhindern ihre Einwirkung auf gesundes Gewebe.

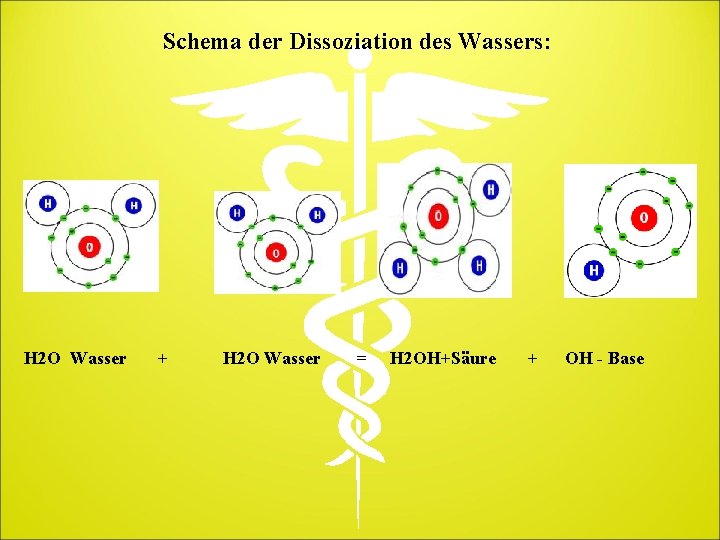
Sauer und alkalisch (basisch): der p. H-Wert! Ein weiterer wichtiger Reaktionstyp ist die „Säure-Basen-Reaktion“. Auch in hochreinem Wasser findet man Ionen. Sie verursachen eine geringe elektrische Leitfähigkeit des Wassers. Die Ionen entstehen aus einer Reaktion zwischen 2 Wassermolekülen. Diese Reaktion nennt sich Dissoziation des Wassers: Das eine Wassermolekül gibt dabei ein Wasserstoffion (Proton oder H+-Ion) ab. Das andere Wassermolekül nimmt dieses Proton auf. In der Chemie definiert man nun: Alle Stoffe, die Protonen abgeben können, bezeichnet man als Säuren. Alle Stoffe, die Protonen aufnehmen können, bezeichnet man als Basen.

Schema der Dissoziation des Wassers: H 2 O Wasser + H 2 O Wasser = H 2 OH+Säure + OH - Base

Was bedeutet der p. H-Wert? Wenn man in normalem Wasser die Konzentration der H 3 O+ - Ionen bestimmt, so erhält man eine Konzentration von 10 hoch minus 7 mol. Diesen Wert kann man beeinflussen, indem man entweder Säuren dazu gibt und die Konzentration an H 3 O+ - Ionen bzw. der H+ - Ionen erhöht (z. B. 10 hoch minus 3 mol/l), oder aber indem man Basen dazu gibt und die Konzentration an H+ - Ionen senkt (z. B. 10 hoch minus 9 mol/l). In der Chemie kennzeichnet man die Wasserstoff-Ionen-Konzentration mit dem p. H-Wert. Der p. H-Wert der ist der negative dekadische Logarithmus der Wasserstoff-Ionen-Konzentration. p. H=1/log[H+] = -log[H+] Bei einer p. H-Wertskala ergibt sich daraus folgende Einteilung: Da die Konzentrationsangaben logarithmisch erfolgen bedeutet der Sprung von p. H 3 auf p. H 2 eine Verzehnfachung der Säurekonzentration.

 Ein volk ein reich ein führer
Ein volk ein reich ein führer Stromkreismodelle
Stromkreismodelle Trapez in der natur
Trapez in der natur Ein hund ist ein herz auf vier pfoten
Ein hund ist ein herz auf vier pfoten Männer herbert grönemeyer analyse
Männer herbert grönemeyer analyse Zentralverwaltungswirtschaft
Zentralverwaltungswirtschaft Goethe das veilchen interpretation
Goethe das veilchen interpretation Ein geschäftsmann sendet ein fax an seine frau
Ein geschäftsmann sendet ein fax an seine frau Ein neuer tag und ein neuer morgen
Ein neuer tag und ein neuer morgen Serisen
Serisen Ein tag der sagts dem anderen
Ein tag der sagts dem anderen Jeden tag ist ein neuer tag
Jeden tag ist ein neuer tag Owg knittelfeld freie wohnungen
Owg knittelfeld freie wohnungen Idealtyp freie marktwirtschaft
Idealtyp freie marktwirtschaft Freie wechselkurse
Freie wechselkurse Private träger definition
Private träger definition Freie rechtslehre
Freie rechtslehre Gleichgewichtskonstante druck
Gleichgewichtskonstante druck Freie suchtselbsthilfe
Freie suchtselbsthilfe Was ist ein bedingungssatz
Was ist ein bedingungssatz Essay schreiben
Essay schreiben Eine parabel
Eine parabel Was ist ein segway
Was ist ein segway Attribute deutsch
Attribute deutsch Was ist ein emur
Was ist ein emur Digital oszilloskop funktionsweise
Digital oszilloskop funktionsweise Was ist ein verweis schule
Was ist ein verweis schule Was sind vielfache
Was sind vielfache Warum sind wale keine fische
Warum sind wale keine fische Was ist ein genitivattribut
Was ist ein genitivattribut Was ist ein lernprodukt
Was ist ein lernprodukt Textverarbeitungsprogramme
Textverarbeitungsprogramme Attribut partizip
Attribut partizip Wie verfasse ich einen bericht
Wie verfasse ich einen bericht Schlaf kindlein schlaf dein vater ist ein schaf
Schlaf kindlein schlaf dein vater ist ein schaf Pantoffelheld hausschuhe
Pantoffelheld hausschuhe Was ist ein protokollrahmen
Was ist ein protokollrahmen Was ist ein problem
Was ist ein problem Außentext
Außentext Ein bisschen schwund ist immer
Ein bisschen schwund ist immer Was ist ein standortgespräch
Was ist ein standortgespräch September ira
September ira Was ist ein heimnetzwerk
Was ist ein heimnetzwerk Substantiven
Substantiven Was sind relativpronomen
Was sind relativpronomen Thesenpapier was ist das
Thesenpapier was ist das Teilchenmodell fest
Teilchenmodell fest Pap elemente
Pap elemente Gebotszeichen handschuhe
Gebotszeichen handschuhe Konzessivbestimmung
Konzessivbestimmung Das leben ist wie ein karussell
Das leben ist wie ein karussell Nominativ akkusativ dativ
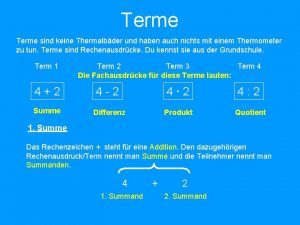
Nominativ akkusativ dativ Was ist ein rechenausdruck
Was ist ein rechenausdruck Instrumentalsatz beispiel
Instrumentalsatz beispiel Was ist eine zuordnung
Was ist eine zuordnung Gestaltungsspiele beispiele
Gestaltungsspiele beispiele Matrix projektorganisation definition
Matrix projektorganisation definition Objektmodellierung
Objektmodellierung Novell groupwise ib
Novell groupwise ib Frühblüher mit erdspross
Frühblüher mit erdspross Textknacker beispiel
Textknacker beispiel Was ist ein relativsatz
Was ist ein relativsatz Einheitspapier ausfüllhilfe
Einheitspapier ausfüllhilfe Was ist ein umlaut
Was ist ein umlaut Das ist eine tafel
Das ist eine tafel Zusammenkunft ist ein anfang
Zusammenkunft ist ein anfang Was ist ein koeffizient
Was ist ein koeffizient Hunde
Hunde Mir ist ein licht aufgegangen
Mir ist ein licht aufgegangen Levrai wortarten
Levrai wortarten Leitziel grobziel feinziel
Leitziel grobziel feinziel Silbenreim
Silbenreim Kein keinen akkusativ
Kein keinen akkusativ Gedicht ein neuer tag
Gedicht ein neuer tag Slidetodoc.com
Slidetodoc.com Was ist eine strophe
Was ist eine strophe Minimalpaaranalyse übung
Minimalpaaranalyse übung Alt englische schrift
Alt englische schrift Lexem definition
Lexem definition Arabisches sprichwort
Arabisches sprichwort Nebensatztypen
Nebensatztypen Was ist ein sakrament?
Was ist ein sakrament? Lframes
Lframes Lelde sutena
Lelde sutena Was ist ein programm
Was ist ein programm Teekesselchen wörter mit mehreren bedeutungen
Teekesselchen wörter mit mehreren bedeutungen Lobpreis anbetung
Lobpreis anbetung Morphologie stamm und wurzel beispiele
Morphologie stamm und wurzel beispiele Gott wohnt im lobpreis seines volkes
Gott wohnt im lobpreis seines volkes über das wetter sprechen
über das wetter sprechen Verzweigter stromkreis
Verzweigter stromkreis Verbale wortkette
Verbale wortkette Alter mann ist kein d-zug
Alter mann ist kein d-zug Was ist deine lieblingsjahreszeit
Was ist deine lieblingsjahreszeit Klassendienst
Klassendienst Es ist herbst bunte blätter fliegen
Es ist herbst bunte blätter fliegen Winter kommt flocken fallen nieder
Winter kommt flocken fallen nieder Zu glauben ist schwer. nichts zu glauben ist unmöglich
Zu glauben ist schwer. nichts zu glauben ist unmöglich True strain formula
True strain formula Normal stress vs axial stress
Normal stress vs axial stress Chapter 10 stress responses and stress management
Chapter 10 stress responses and stress management Landser afrika für affen
Landser afrika für affen Das ist die perfekte welle songtext
Das ist die perfekte welle songtext Mir dir pronomen
Mir dir pronomen In jedem anfang liegt ein zauber
In jedem anfang liegt ein zauber Augen werfen
Augen werfen