Facult Mdecine Universit Denis Diderot Paris 7 L




































- Slides: 55

Faculté Médecine - Université Denis Diderot – Paris 7 L 2 -UE 8 – 2016 METABOLISME DES PROTEINES: le bilan azoté, cycle de l’urée Pr Jean-Charles Deybach, MD Ph. D Hôpital Louis Mourier, Biochimie et Génétique Moléculaire Hôpitaux Universitaires Paris Nord Val de Seine - APHP Inserm U 1149 - Université Denis Diderot Paris 7 Centre Référence Maladies Rares « Porphyries » Centre Français des Porphyries – CFP

I- LES PROTEINES I-1 Rappels I-2 Schéma général I-3 Renouvellement des protéines II- LE BILAN AZOTE III- Variations physiologiques et pathologiques des ENTREES III-1 Alimentation NB: En italique bleu : parties non traitées dans ce cours III-1 -1 Aspects quantitatifs III-1 -2 Aspects qualitatifs III-1 -3 Digestion et absorption des protéines III-2 Protéolyse III-2 -1 Apport des AA endogènes et 3 Systèmes protéasiques III-2 -2 Système lysosomal III-2 -3 Système Calcium dépendant III-2 -4 Système Protéasome III-3 Synthèse de novo des AA IV- Variations physiologiques et pathologiques des SORTIES IV-1 Synthèse des Protéines IV-2 Synthèse des autres composés azotés IV-3 Dégradation irréversible des AA IV-3 -1 Perte du groupement amine IV-3 -2 Elimination de l’azote: A- Origine de l’Azote sous forme NH 3 B-Synthèse de la Glutamine C-Cycle de l’Alanine D-Cycle de l’Urée V—REGULATION du métabolisme Protéique V-1 Régulation nutritionnelle V-2 Régulation Hormonale E-Ammoniogenèse rénale F-Pathologie

L’évaluation du métabolisme des protéines et du « bilan Azoté » est une pratique quotidienne en clinique. - Paramètres cliniques: - masse corporelle (IMC), masse musculaire - évaluation des fonctions rénales, hépatiques, digestives, hormonales… - Examens de laboratoire courants: -Protidémie -Albuminémie -Electrophorèse des protéines sériques -Urée -Ammoniémie -Amino-Acidémie -ASAT, ALAT - Equilibre acido-basique ( « Gaz du sang » ) -…

IMC = Poids / Taille 2 IMC + de 40 35 à 40 30 à 35 25 à 30 18. 5 à 25 16. 5 à 18. 5 - de 16. 5 Interprétation (adulte) obésité morbide ou massive obésité sévère obésité modérée surpoids corpulence normale maigreur famine

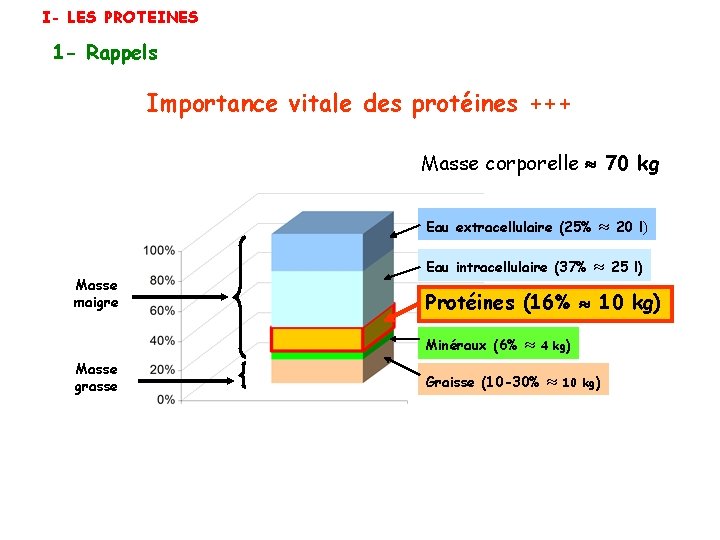
I- LES PROTEINES 1 - Rappels Importance vitale des protéines +++ Masse corporelle 70 kg Eau extracellulaire (25% Masse maigre Eau intracellulaire (37% l) 25 l) Protéines (16% 10 kg) Minéraux (6% Masse grasse 20 4 kg) Graisse (10 -30% 10 kg)

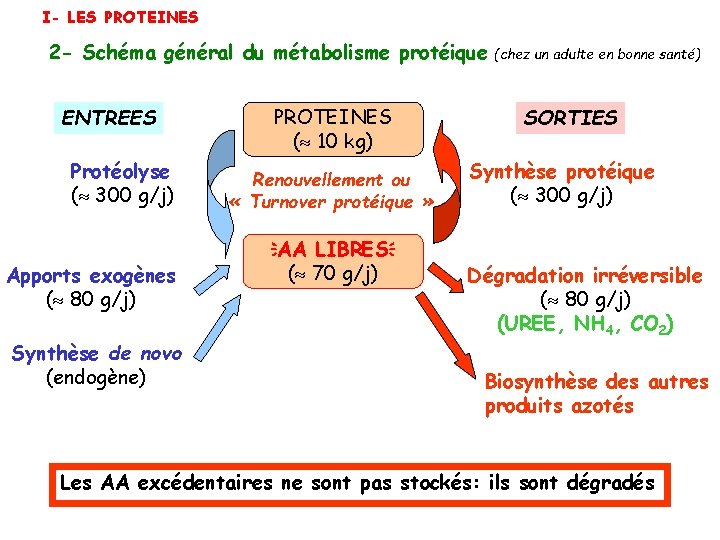
I- LES PROTEINES 2 - Schéma général du métabolisme protéique ENTREES Protéolyse ( 300 g/j) Apports exogènes ( 80 g/j) Synthèse de novo (endogène) PROTEINES ( 10 kg) Renouvellement ou « Turnover protéique » AA LIBRES ( 70 g/j) (chez un adulte en bonne santé) SORTIES Synthèse protéique ( 300 g/j) Dégradation irréversible ( 80 g/j) (UREE, NH 4, CO 2) Biosynthèse des autres produits azotés Les AA excédentaires ne sont pas stockés: ils sont dégradés

I- LES PROTEINES 3 - Renouvellement des protéines Les protéines de l’organisme participent de façon très variable au renouvellement protéique global En fonction 1 - de l’importance qualitative de la protéine (muscles, foie, intestin, peau) 2 - de la rapidité de renouvellement de chaque protéine Ex: Protéines du cristallin: renouvellement = 0 Stock Apo. B 100 des VLDL: renouvelé 3 fois/j Renouvellement des P musculaires = 20 % " P hépatiques = 10% du renouvellement global

I- LES PROTEINES 3 - Renouvellement des protéines (suite) Variations du renouvellement protéique Selon l’âge: NNé 15 g/kg/j >> adulte 4 g/kg/j Synthèse >> protéolyse Selon l’état nutritionnel: au cours du jeune (Protéolyse > Synthèse) Selon l’état pathologique: Situations cataboliques Renouvellement x 3 -4 (syndrome inflammatoire, traumatisme, sepsis, brûlés) mais pas de gain protéique! Hépatique +++ = synthèse des Protéines de l’inflammation Muscle produit des AA (Protéolyse > Synthèse) Possible dissociation entre synthèse protéique et gain protéique synthèse et catabolisme

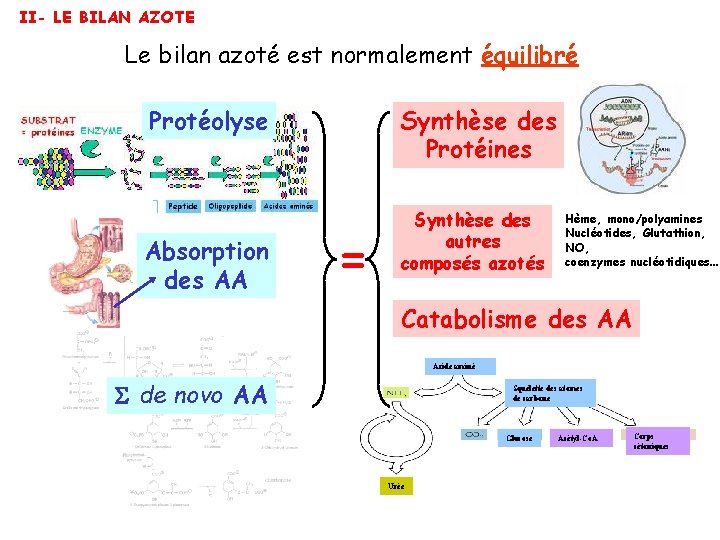
II- LE BILAN AZOTE Le bilan azoté est normalement équilibré Protéolyse Absorption des AA Synthèse des Protéines = Synthèse des autres composés azotés Hème, mono/polyamines Nucléotides, Glutathion, NO, coenzymes nucléotidiques… Catabolisme des AA Acide aminé de novo AA Squelette des atomes de carbone Glucose Urée Acétyl-Co. A Corps cétoniques

III- Variations physiologiques et pathologiques des ENTREES III-1 Alimentation = Apport des AA exogènes Correspond à l’apport alimentaire en protéines qui subissent leur digestion au niveau du tractus digestif III-1 -1 Aspects quantitatifs Chez l’adulte, en pays développé, apports 70 -100 g/j Besoins recommandés: 55 g Dépendent 45 g/j 4 -6 mois 110 g/j de l’apport par les autres nutriments de l’âge et du sexe de l’activité physique

III- Variations physiologiques et pathologiques des ENTREES III-1 Alimentation = Apport des AA exogènes III-1 -1 Aspects quantitatifs (suite): en pathologie Carence protéique Kwashiorkor Carence globale (P, vitamines, minéraux) E de 6 mois-3 ans au moment du sevrage Pays en voie de développement Opérés, cancéreux, brûlés Perte protéique >> besoins Marasme Anoréxie

III- Variations physiologiques et pathologiques des ENTREES III-2 PROTEOLYSE (catabolisme protéique): Apport des AA endogènes -Source principale d’AA pour l’organisme (75%) -Difficultés d’étude car la protéolyse a de multiples fonctions - « ménage cellulaire » -Renouvellement basal des Protéines -Élimination des Protéines anormales -Genèse des peptides antigéniques -Production d’ ( Protéines endo & exogènes) en situation de carence (muscle) -Régulation de l’abondance tissulaire des Protéines Consomme de l’énergie +++ Régulée +++ par conditions nutritionnelles et hormonales

III- Variations physiologiques et pathologiques des ENTREES III-2 PROTEOLYSE : Protéases réparties en 3 systèmes Système lysosomal: Foie, reins +++ (< 15% protéolyse) (ATP dépendant) Système calcium dépendant: Calpaïne-Capastatine Cytosolique dégradation des P du cytosquelette +++ Système Protéasome Muscle +++ dans les états cataboliques +++ (ATP dépendant)

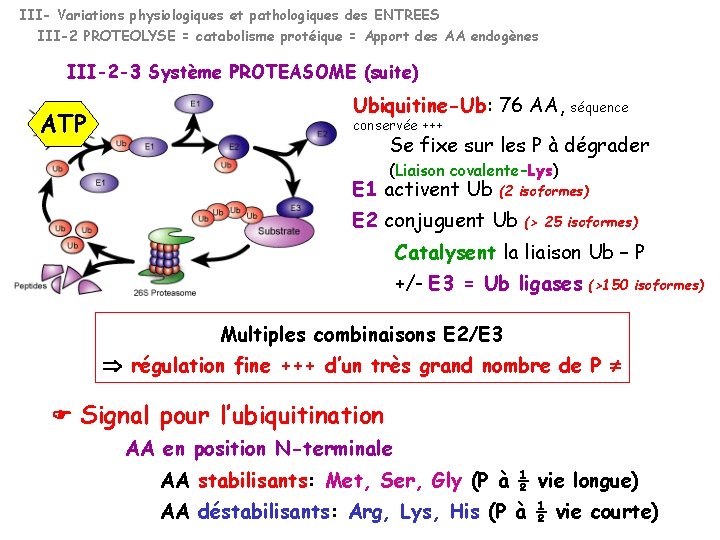
III- Variations physiologiques et pathologiques des ENTREES III-2 PROTEOLYSE 3 Systèmes protéasiques III-2 -3 Système PROTEASOME Complexe multienzymatique 19 S 26 S 20 S -Complexe 19 S: Régulateur Founit l’ (> 18 su , dont ATPasiques) assemblage 20 S + 19 S protéolyse -Complexe 20 S: Protéolytique (14 su ) P marquées par l’Ubiquitine Dégradation des P intracellulaire (enzymes limitantes, P régulatrices) Dégradation des P anormales Intervient ds la présentation des Antigènes aux molécules de classe I du CMH Majorité de la protéolyse au niveau musculaire +++ Ds les états cataboliques

III- Variations physiologiques et pathologiques des ENTREES III-2 PROTEOLYSE = catabolisme protéique = Apport des AA endogènes III-2 -3 Système PROTEASOME (suite) ATP Ubiquitine-Ub: 76 AA, conservée +++ séquence Se fixe sur les P à dégrader (Liaison covalente–Lys) E 1 activent Ub (2 isoformes) E 2 conjuguent Ub (> 25 isoformes) Catalysent la liaison Ub – P +/- E 3 = Ub ligases (>150 isoformes) Multiples combinaisons E 2/E 3 régulation fine +++ d’un très grand nombre de P Signal pour l’ubiquitination AA en position N-terminale AA stabilisants: Met, Ser, Gly (P à ½ vie longue) AA déstabilisants: Arg, Lys, His (P à ½ vie courte)

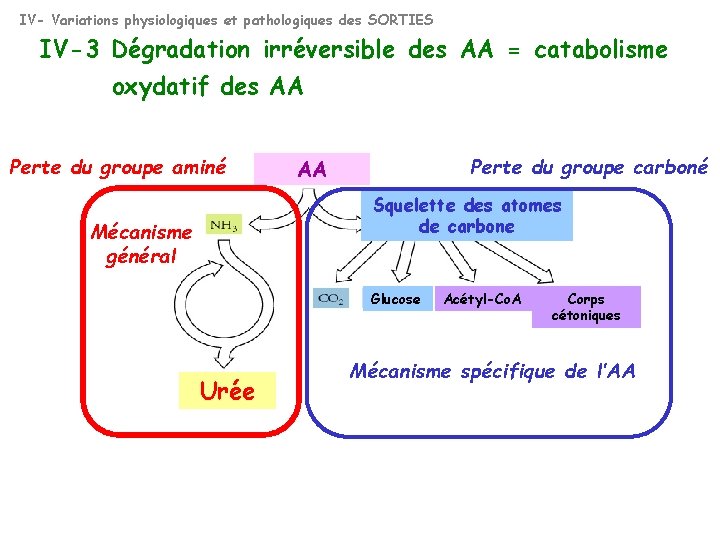
IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA = catabolisme oxydatif des AA Perte du groupe aminé Perte du groupe carboné AA Squelette des atomes de carbone Mécanisme général Glucose Urée Acétyl-Co. A Corps cétoniques Mécanisme spécifique de l’AA

IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA IV-3 -1 Perte du groupement amine FOIE +++ 3 mécanismes: a-Désaminations oxydatives b-Désaminations non oxydatives c-Désamidation d-Transaminations

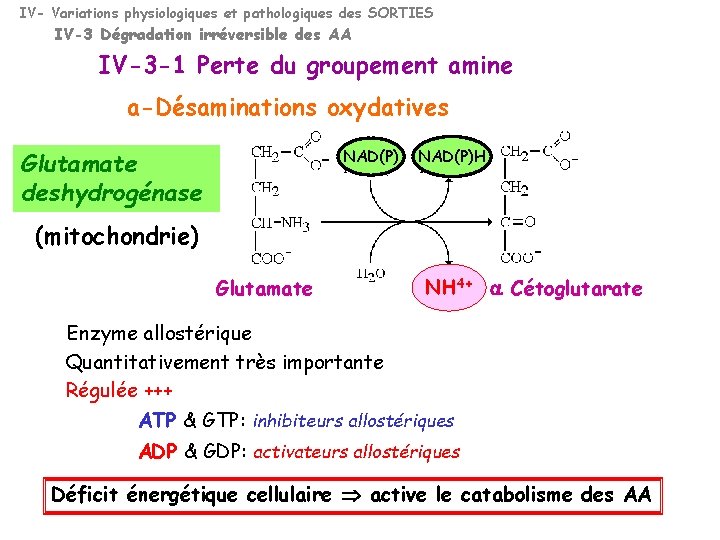
IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA IV-3 -1 Perte du groupement amine a-Désaminations oxydatives NAD(P) Glutamate deshydrogénase NAD(P)H (mitochondrie) Glutamate NH 4+ a Cétoglutarate Enzyme allostérique Quantitativement très importante Régulée +++ ATP & GTP: inhibiteurs allostériques ADP & GDP: activateurs allostériques Déficit énergétique cellulaire active le catabolisme des AA

IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA IV-3 -1 Perte du groupement amine b-Désaminations NON oxydatives Certains AA peuvent être désaminés directement: S H Déshydratases (déshydratation puis désamination) (Ser), T (His) Sérine Pyruvate + NH 4+ Thréonine a cétobutyrate +NH 4+ c-Désamidation Glutaminase GLN GLU + NH 3 d-Transaminations (cf P 1) (et ASN) (Thr) +++

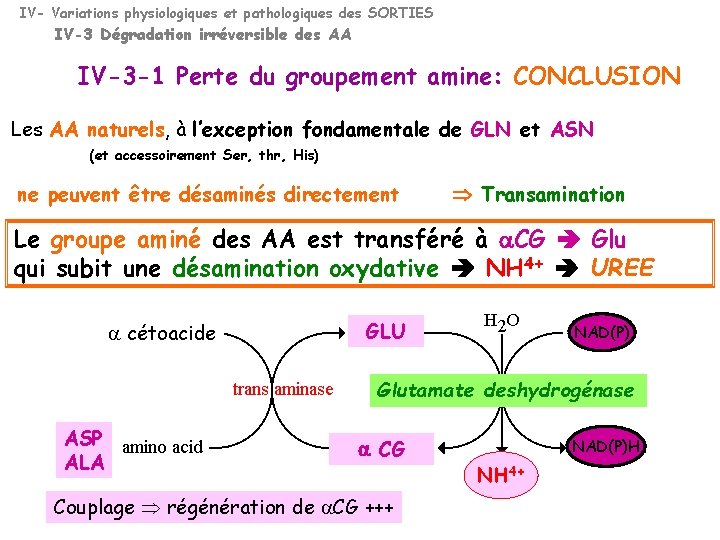
IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA IV-3 -1 Perte du groupement amine: CONCLUSION Les AA naturels, à l’exception fondamentale de GLN et ASN (et accessoirement Ser, thr, His) ne peuvent être désaminés directement Transamination Le groupe aminé des AA est transféré à a. CG Glu qui subit une désamination oxydative NH 4+ UREE a cétoacide GLU NAD(P) Glutamate deshydrogénase ASP ALA a CG Couplage régénération de a. CG +++ NAD(P)H NH 4+

IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA IV-3 -2 Elimination de l ’AZOTE Pourquoi faut-il éliminer NH 3 ? ? NH 3 TOXIQUE +++ si NH 3, liposoluble CERVEAU NH 3 + a. CG glutamate Déplétion en a. CG Cycle de Krebs bloqué Phosphorylation oxydative bloquée ATP Mort des cellules neuronales Glutamate + NH 3 Glutamine GLU Or GLU précurseur du g aminobutyrate, GABA (neurotransmetteur) COMA

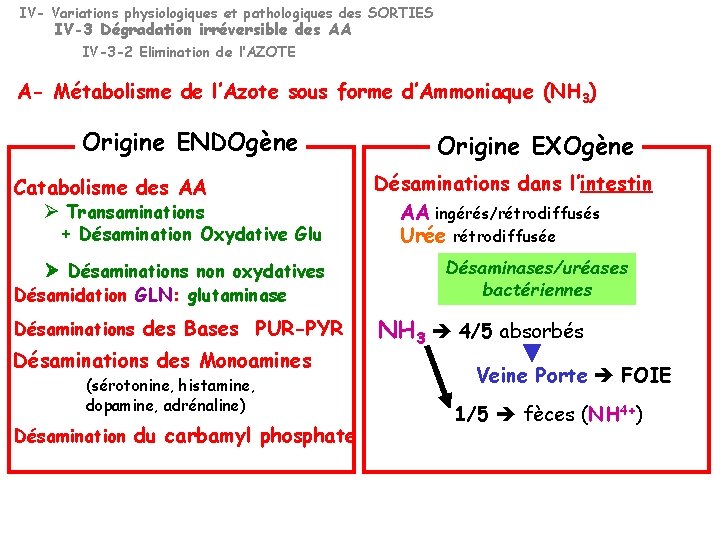
IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA IV-3 -2 Elimination de l’AZOTE A- Métabolisme de l’Azote sous forme d’Ammoniaque (NH 3) Origine ENDOgène Catabolisme des AA Transaminations + Désamination Oxydative Glu Désaminations non oxydatives Désamidation GLN: glutaminase Désaminations des Bases PUR-PYR Désaminations des Monoamines (sérotonine, histamine, dopamine, adrénaline) Désamination du carbamyl phosphate Origine EXOgène Désaminations dans l’intestin AA ingérés/rétrodiffusés Urée rétrodiffusée Désaminases/uréases bactériennes NH 3 4/5 absorbés Veine Porte FOIE 1/5 fèces (NH 4+)

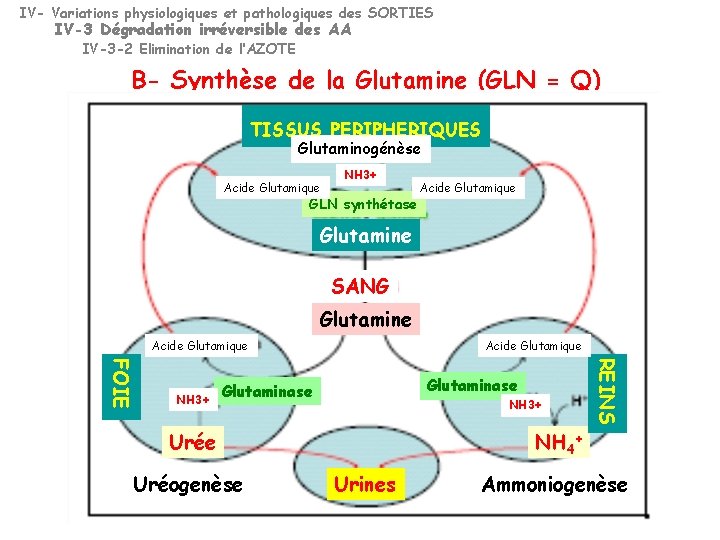
IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA IV-3 -2 Elimination de l ’AZOTE A- Métabolisme de l’Azote sous forme d’Ammoniaque (NH 3) 1 -Tissus périphériques exportent l’Azote vers le FOIE sous forme de GLN (GLU + NH 4+), Glutamine synthétase sous forme de ALA dans le muscle +++ (Cycle de l’ALA) +++ 2 -Dans le Foie: GLN GLU + NH 4+ UREE Glutaminase 3 -Dans les Reins: élimination sous forme NH 4+ : NH 3+ + H+ 20% de l’Azote urinaire total


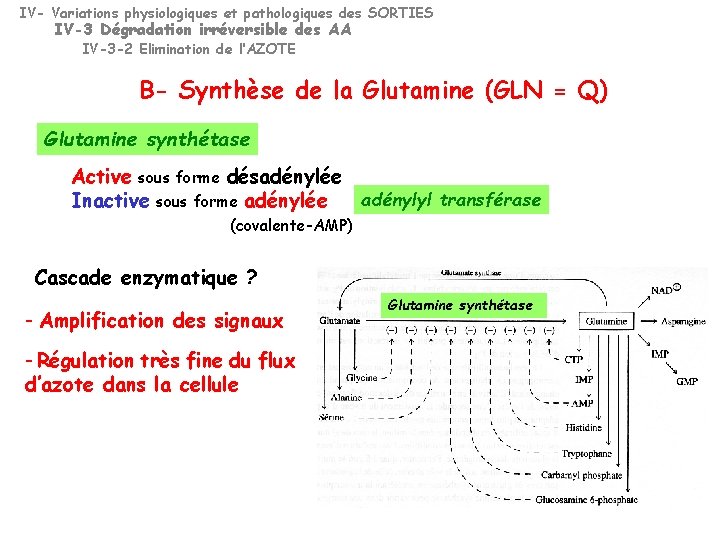
IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA IV-3 -2 Elimination de L’AZOTE B- Synthèse de la Glutamine = GLN = Q GLU + NH 3 + ATP GLN + ADP + Pi Glutamine synthétase Dans TOUS les tissus (FOIE, MUSCLE +++) SAUF intestin et reins hépatocytes périveineux Glutamine synthétase Enzyme allostérique Régulée +++ par rétroinhibition cumulative et multivalente Cette régulation joue un rôle critique dans le contrôle du métabolisme de l’azote

IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA IV-3 -2 ELIMINATION DE L’AZOTE B- Synthèse de la Glutamine (GLN = Q) GLN Transporteur d’Azote entre les tissus Foie: Glutaminase Uréogenèse Reins: Glutaminase Ammoniogenèse AA le plus abondant dans le plasma Utilisée pour la synthèse de nombreux composés +++ - Substrat pour bases PUR & PYR - Précurseur de Pro, Orn, Arg

IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA IV-3 -2 Elimination de l’AZOTE B- Synthèse de la Glutamine (GLN = Q) Glutamine synthétase Active sous forme désadénylée adénylyl transférase Inactive sous forme adénylée (covalente-AMP) Cascade enzymatique ? - Amplification des signaux - Régulation très fine du flux d’azote dans la cellule Glutamine synthétase

IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA IV-3 -2 Elimination de l’AZOTE B- Synthèse de la Glutamine (GLN = Q) TISSUS PERIPHERIQUES Glutaminogénèse Acide Glutamique NH 3+ GLN synthétase Acide Glutamique Glutamine SANG Glutamine Acide Glutamique Glutaminase NH 3+ Urée Uréogenèse REINS FOIE NH 3+ Acide Glutamique NH 4+ Urines Ammoniogenèse

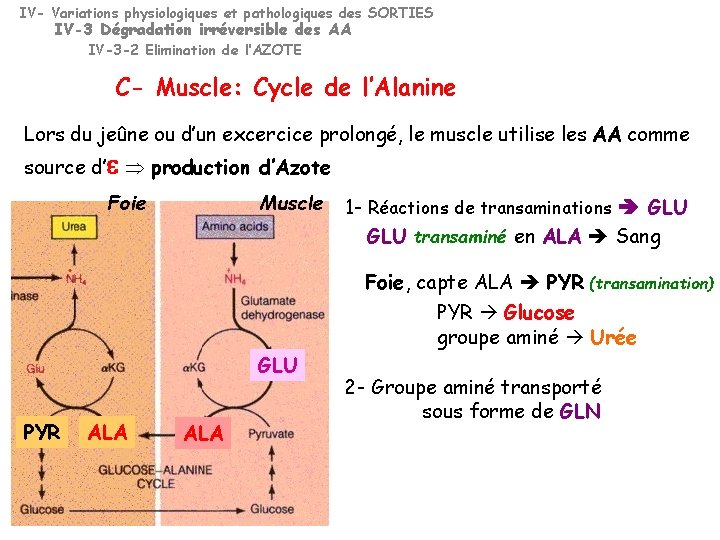
IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA IV-3 -2 Elimination de l’AZOTE C- Muscle: Cycle de l’Alanine Lors du jeûne ou d’un excercice prolongé, le muscle utilise les AA comme source d’ production d’Azote Foie Muscle GLU PYR ALA 1 - Réactions de transaminations GLU transaminé en ALA Sang Foie, capte ALA PYR (transamination) PYR Glucose groupe aminé Urée 2 - Groupe aminé transporté sous forme de GLN

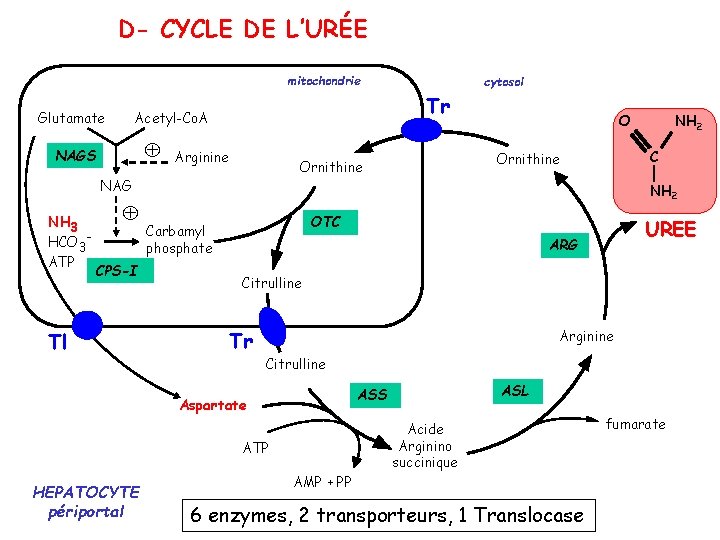
IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA IV-3 -2 Elimination de l’AZOTE D- Cycle de l'urée Présentation générale : le cycle de l'urée prend en charge l'ammoniac issu de la dégradation des groupements azotés des acides aminés il fût élucidé par Hans Krebs et Kurt Henseleit en 1932 peu de temps avant la description du cycle du citrate par Hans Krebs chez les Mammifères ce cycle se déroule uniquement dans le foie deux des cinq réactions ont lieu dans la mitochondrie, les trois autres se déroulent dans le cytosol ainsi le fonctionnement du cycle de l'urée requiert la présence de deux transporteurs entre la matrice mitochondriale et le cytosol : le transporteur citrulline - ornithine et la translocase glutamate - aspartate

IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA IV-3 -2 Elimination de l’AZOTE D- Cycle de l’URÉE Exclusivement dans le FOIE +++ GLN est converti en GLU (Hépatocytes périportaux) Glutaminase GLN GLU + NH 3 Urée contient 2 N/molécule Cycle de l’URÉE 1 er NH 3 2ème ASP Molécule neutre, soluble +++, peu toxique, pas de fonction métabolique Voie préférentielle d’élimination de l’azote en excès

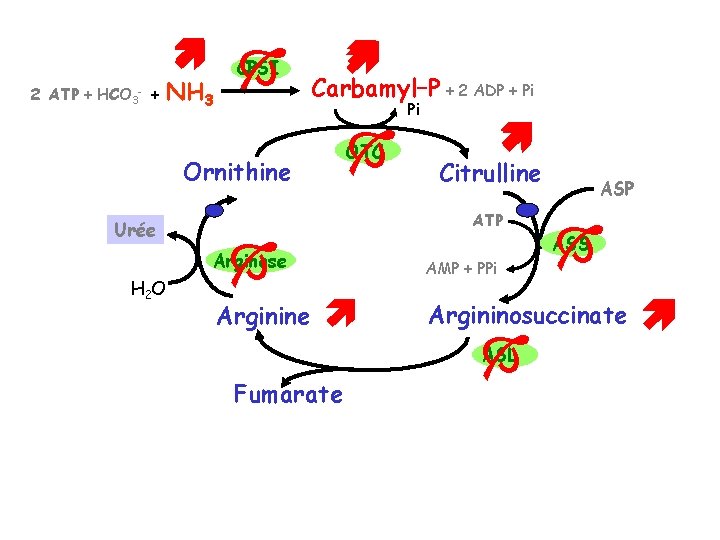
D- CYCLE DE L’URÉE mitochondrie Glutamate Tr Acetyl-Co. A NAGS Arginine CPS-I Tl NH 2 C NH 2 OTC Carbamyl phosphate UREE ARG Citrulline Tr Arginine Citrulline ASL ASS Aspartate Acide Arginino succinique ATP HEPATOCYTE périportal O Ornithine NAG NH 3 HCO 3 ATP cytosol AMP + PP 6 enzymes, 2 transporteurs, 1 Translocase fumarate

D- CYCLE DE L’URÉE : Enzymes et Transporteurs NAGS N Acetyl Glutamate Synthase CPS-I Carbamoyl Phosphate Synthétase I OTC Ornithine Trans Carbamylase ASS Arginino-Succinate Synthase ASL Arginino-Succinate Lyase ARG Argininase 2 réactions ont lieu dans la mitochondrie 3 dans le cytosol Transporteurs: - 2 Transporteurs Citrulline/Ornithine - 1 Translocase Glu-Asp

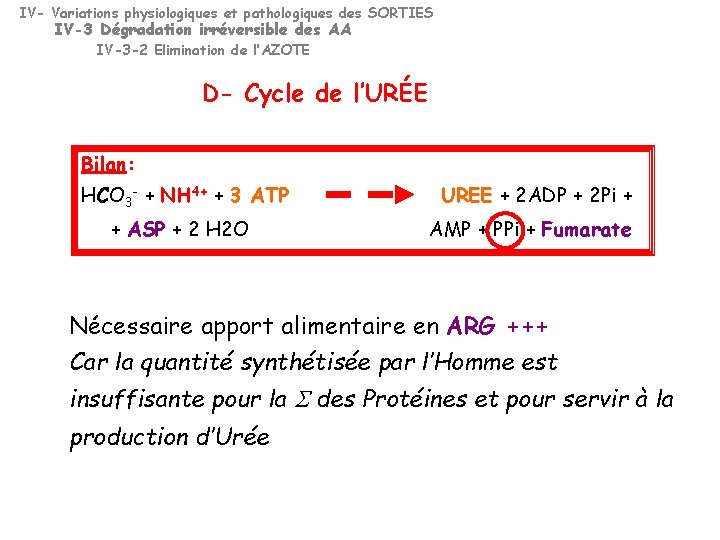
IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA IV-3 -2 Elimination de l’AZOTE D- Cycle de l’URÉE Bilan: HCO 3 - + NH 4+ + 3 ATP + ASP + 2 H 2 O UREE + 2 ADP + 2 Pi + AMP + PPi + Fumarate Nécessaire apport alimentaire en ARG +++ Car la quantité synthétisée par l’Homme est insuffisante pour la des Protéines et pour servir à la production d’Urée

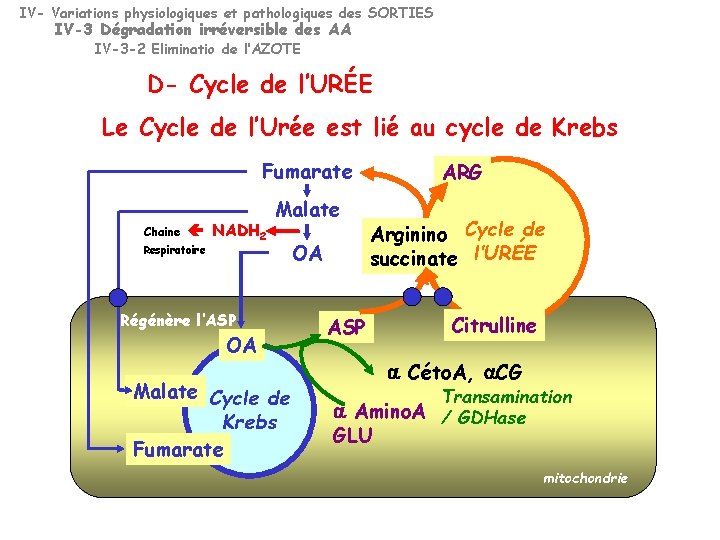
IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA IV-3 -2 Eliminatio de l’AZOTE D- Cycle de l’URÉE Le Cycle de l’Urée est lié au cycle de Krebs Fumarate Chaine NADH 2 Malate Respiratoire Régénère l’ASP OA Malate Cycle de Krebs Fumarate OA ARG Arginino Cycle de succinate l’URÉE ASP Citrulline a Céto. A, a. CG Transamination a Amino. A / GDHase GLU mitochondrie

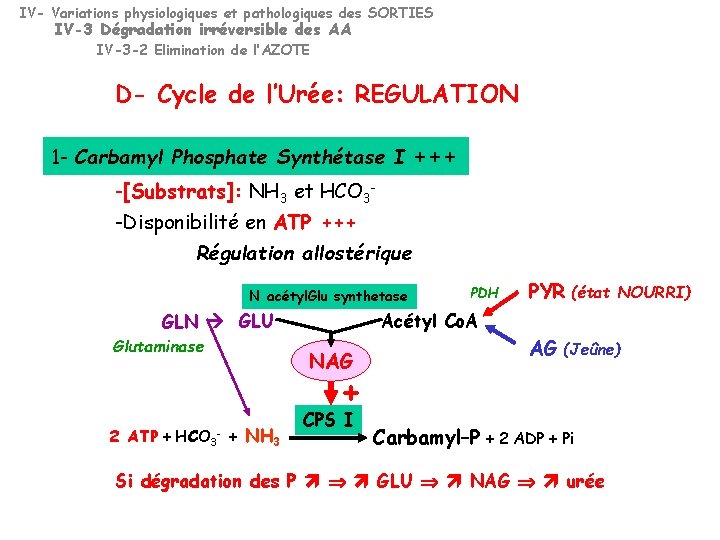
IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA IV-3 -2 Elimination de l’AZOTE D- Cycle de l’Urée: REGULATION 1 - Carbamyl Phosphate Synthétase I +++ -[Substrats]: NH 3 et HCO 3 -Disponibilité en ATP +++ Régulation allostérique N acétyl. Glu synthetase GLN GLU Glutaminase PDH PYR (état Acétyl Co. A NAG AG (Jeûne) + 2 ATP + HCO 3 + NH 3 - NOURRI) CPS I Carbamyl–P + 2 ADP + Pi Si dégradation des P GLU NAG urée

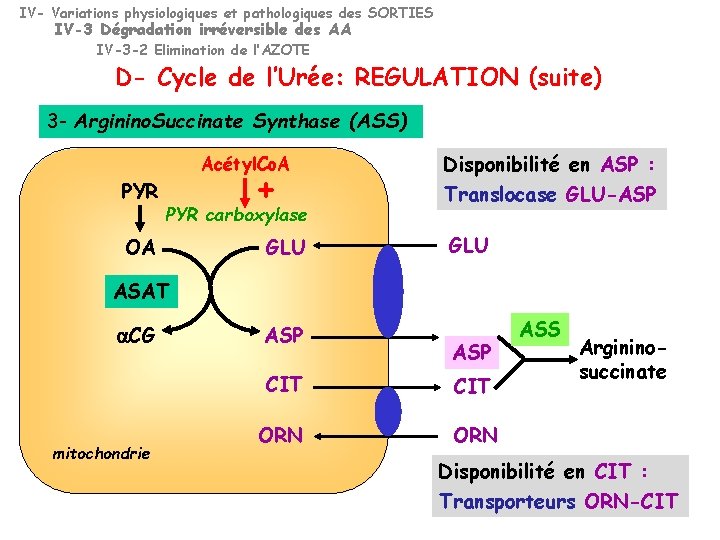
IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA IV-3 -2 Elimination de l’AZOTE D- Cycle de l’Urée: REGULATION (suite) 3 - Arginino. Succinate Synthase (ASS) Acétyl. Co. A PYR + PYR carboxylase OA GLU Disponibilité en ASP : Translocase GLU-ASP GLU ASAT a. CG mitochondrie ASP CIT ORN ASS Argininosuccinate Disponibilité en CIT : Transporteurs ORN-CIT

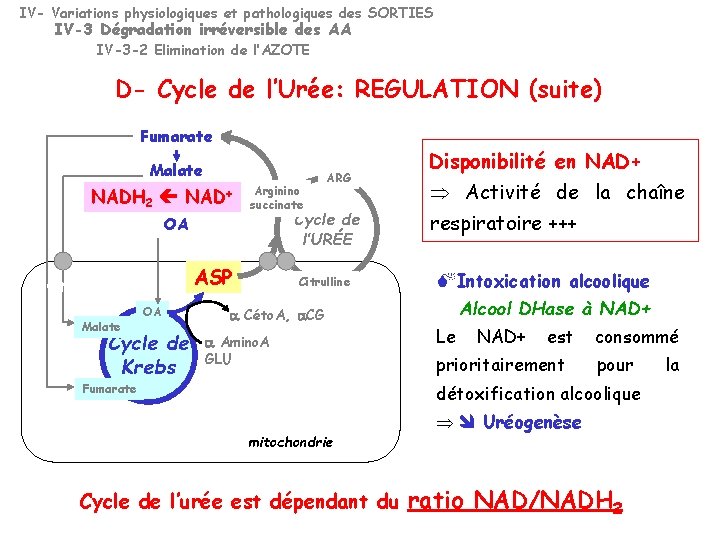
IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA IV-3 -2 Elimination de l’AZOTE D- Cycle de l’Urée: REGULATION (suite) Fumarate Malate NADH 2 NAD+ OA Régénère l’ASP Malate OA Cycle de Krebs Arginino succinate ARG Cycle de l’URÉE ASP Citrulline a Céto. A, a. CG a Amino. A GLU Disponibilité en NAD+ Activité de la chaîne respiratoire +++ Intoxication alcoolique Alcool DHase à NAD+ Le NAD+ est prioritairement consommé pour détoxification alcoolique Fumarate mitochondrie Cycle de l’urée est dépendant du Uréogenèse ratio NAD/NADH 2 la

IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA IV-3 -2 Elimination de l’AZOTE D- Cycle de l’Urée: REGULATION Régulation par le taux de synthèse des enzymes du cycle de l’Urée Synthèse et donc Uréogenèse si: du pool d’AA libres Apports exogènes: Régimes hyperprotidiques Apports endogènes: Etats d’ hypercatabolisme Protéique - Brûlés - Traumatismes

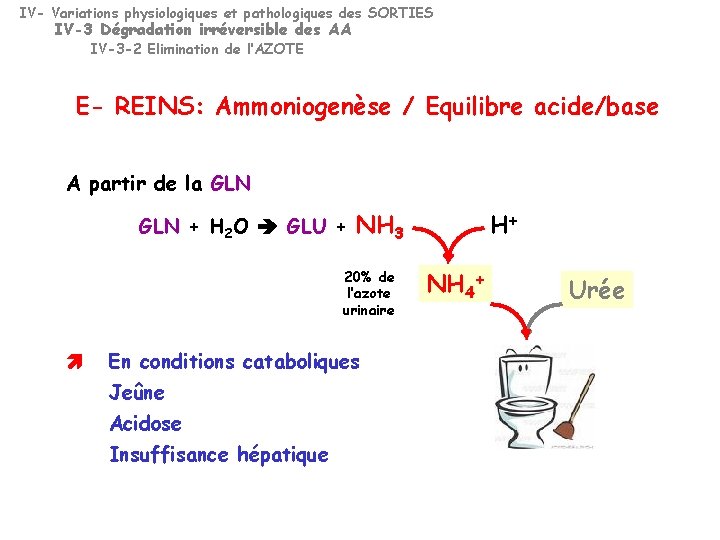
IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA IV-3 -2 Elimination de l’AZOTE E- REINS: Ammoniogenèse / Equilibre acide/base A partir de la GLN + H 2 O GLU + NH 3 20% de l’azote urinaire En conditions cataboliques Jeûne Acidose Insuffisance hépatique H+ NH 4+ Urée

IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA IV-3 -2 Elimination de l’AZOTE F- PATHOLOGIE Ammoniaque (NH 3) dans le sang = hyperammoniémie 1 - Hyperammoniémies secondaires -Insuffisance Hépatique sévère +++ ( urée) " Causes (hépatites aiguës (virales, toxiques…), cirrhose …) SC: Coma, myoclonies métaboliques (flapping tremor) … Cirrhose : saignements digestifs +++ Shunts porto-caves NH 3 Bases thérapeutiques: traitement de la cause +++ Régime pauvre en protéines Cirrhotique +++ Lutte contre le saignement digestif Décontamination digestive

IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA IV-3 -2 Elimination de l’AZOTE F- PATHOLOGIE 1 - Hyperammoniémies secondaires (suite) - Prématurité: immaturité hépatique & défaut de perfusion - Acidose défaut d’élimination urinaire (NH 4+) - Anomalies héréditaires du métabolisme: -Acidurie Organique (+ acidose métabolique) -Déficit b oxydation des AG -Déficit Chaîne Respiratoire

IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA IV-3 -2 Elimination de l’AZOTE F- PATHOLOGIE 2 - Hyperammoniémies PRIMAIRES Maladies héréditaires du métabolisme de l’urée 2 -1 - Déficits en Enzymes du cycle de l’urée OMIM≠ (Online Mendelian Inheritance in Man) 237310 - N acétyl Glutamate synthase 237300 - CPS I 311250 - OCT 215700 – ASS 207900 – ASL 207800 - Arginase Transmission Prévalence Ar Ar 1/ 62000 Lié à l’X 1/ 14000 Ar 1/ 57000 Ar 1/ 70000 Ar 1/ 363000 www. ncbi. nlm. nih. gov/omim

IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA IV-3 -2 Elimination de l’AZOTE F- PATHOLOGIE 2 - Hyperammoniémies PRIMAIRES Maladies héréditaires du métabolisme de l’urée 2 -2 Déficits des Transporteurs OMIM≠ 238970 - ORNT 1 (SLC 25 A 15 ORN/CIT) 603471 - CITRINE (SLC 25 A 13 GLU/ASP) 3 - Déficits en enzymes satellites 138250 - 1 Pyrroline 5 Carboxylate Synthase

IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA IV-3 -2 Elimination de l’AZOTE F- PATHOLOGIE 2 - Hyperammoniémies PRIMAIRES Signes Cliniques: 2 groupes Révélation Neonatale: LETAL (> 24 h) Vomissements, léthargie COMA Hypothermie Révélation Tardive et Adulte: GRAVE Facteurs déclenchants +++ SC chroniques: S digestifs et hépatiques Encéphalopathie chronique S neurologiques récurrents S psychiatriques SC Aigus: S neurologiques +++ S digestifs

IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA IV-3 -2 Elimination de l’AZOTE F- PATHOLOGIE 2 - Hyperammoniémies PRIMAIRES Outils diagnostiques: -Ammoniémie Conditions préanalytiques +++ -Acheminée rapidement au laboratoire -Dans la glace (à T°Ambiante GLN GLU + NH 3) -Alcalose respiratoire -Chromatographie des AA plasmatiques et urinaires -Chromatographie des Ac organiques urinaires -Acide Orotique Urinaire (Carbamyl P Ac orotique Urines) -Tests de Charge -Dosages enzymatiques sur biopsies de foie -Biologie Moléculaire CPS, OTC: muqueuse intestinale ASL, ASS: fibroblastes Arginase: érythrocytes

2 ATP + HCO 3 + - NH 3 CPSI Carbamyl–P + 2 ADP + Pi Pi OTC Ornithine Urée Citrulline ATP Arginase H 2 O Arginine AMP + PPi ASS Argininosuccinate ASL Fumarate ASP

IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA IV-3 -2 Elimination de l’AZOTE F- PATHOLOGIE 2 - Hyperammoniémies PRIMAIRES Diagnostic rapide +++ Prise en charge du patient vivant DPN +++ (villosités choriales, LA) Les gènes de toutes les enzymes sont connus (cf OMIM) Mutations décrites pour toutes les maladies (244 pour OTC) Centres Spécialisés de prise en charge: « Centre de Référence Maladies Rares (CRMR) » (131 CRMR Création Plan National Maladies rares PNMR 2004) -Compétences Cliniques -Compétences Biochimiques (analyses des métabolites, enzymes, Biologie Moléculaire)

Maladies Rares • Une maladie est dite rare lorsqu’elle touche moins d’une personne sur 2 000. • Pour la France, cela équivaut à moins de 30 000 personnes atteintes d’une même maladie. • Le nombre de maladies rares estimé à 7 000 environ. • Il y a plus de 3 millions de personnes atteintes d’une maladie rare en France et plus de 30 millions en Europe. • 80% des maladies rares sont d’origine génétique. • Une maladie est dite « orpheline » quand il n’existe pas de traitement pour la soigner. La définition d’une maladie orpheline n’est donc pas la même que celle d’une maladie rare. • Cependant, une très grande majorité de maladies rares sont des maladies orphelines et inversement. Il s’agit donc de termes qui désignent dans les faits le même groupe de pathologies.

• Les maladies rares sont extrêmement diverses : maladies neuromusculaires, métaboliques, infectieuses, auto-immunes, cancers rares… • 65 % de ces maladies sont graves et invalidantes. • Les maladies rares posent de nombreuses problématiques : ² l’accès à l’information (Sites Web, Orphanet, Eurordis…) ² le suivi médical dans un service expert (CRMR) ² l’absence de traitement ² les moyens et les délais de la recherche ² l’isolement ² la prise en charge sociale ² l’accompagnement dans la vie quotidienne lié en particulier au handicap ² etc.

IV- Variations physiologiques et pathologiques des SORTIES IV-3 Dégradation irréversible des AA F- PATHOLOGIE 2 - Hyperammoniémies PRIMAIRES BASES THERAPEUTIQUES - Production d’Azote Éviter le catabolisme: Apport calorique suffisant Limiter l’apport d’azote: Régime pauvre en protéines Néomycine: production NH 3 intestinal Chélateurs: Phényl-butyrate, Ac Benzoïque (stimulent une voie métabolique alterne) -Apport suffisant en AA essentiels -Apport d’ARG +++ -Épurer l’azote excédentaire: Hémodialyse +++

Mathieu • 1 er enfant de parents non consanguins et sans ATCD • Grossesse, accouchement : N • 3 mois et demi : introduction d’un lait artificiel – Mauvaise prise des biberons – Vomissements irréguliers – Mauvaise prise de poids – Modification du lait • 5 mois : – Hospitalisation pour vomissements, anorexie et cassure de la courbe – Diagnostic : reflux gastro-oesophagien Modification du lait, motilium + polysilane • 8 mois – Fatigué, refuse de manger – Pousse des hurlements, crise généralisée • Hospitalisation – Inconscient avec mouvements de pédalage – Débord hépatique (1, 5 cm) – Convulsions – Bilan : alcalose respiratoire; NH 3 : 410 μmol/l (Normale : 11 à 45 μmol/l) • Evolution : décès 48 heures plus tard (oedème cérébral) Déficit en OCT

François 14 ans • ATCD – Développement staturo-pondéral normal – Céphalées intermittentes – Décès par coma inexpliqué d’un oncle maternel alors âgé de 30 ans • De J 0 à J 5 – Céphalées, flou visuel, anorexie, vomissements – Examen clinique, NFS, iono, transaminases : normaux • J 6 – Hallucinations, confusion – Hospitalisation en pédiatrie puis en réanimation • De J 7 à J 9 – Coma d’aggravation progressive – Scanner, PL, glycémie, iono, toxico : N – Ammoniémie : 344 μmol/l puis 755 μmol/l (Normale : 11 à 45 μmol/l) – Traitement : régime sans protéines, alimentation glucido-lipidique, épurateurs • J 9 : décès Déficit en OCT

Monsieur J… 49 ans • Pas d’ATCD familiaux et personnels évocateurs - coureur de semi marathon • J 0 – Vomissements au retour d’un semi marathon • De J 4 à J 6 – Asthénie physique suivie d ’un épisode de vomissements et de diarrhées – stupeur , ralentissement de la gestuelle, soif – Crises d ’agitation, agressivité verbale, incoordination psychomotrice, obnubilation, désorientation. Appel du médecin traitant : refus des soins, déambulation • J 7 à 0 h 00 – Admission aux urgences puis transfert en Neurologie à 12 h 30 – Obnubilation, somnolence, vomissements, bradypsychie, trouble de l’élocution, fixité du regard, stéréotypie gestuelle, syndrome pyramidal, bâillements – Biologie standard normale, pas de cytolyse hépatique, absence de toxiques, PL normale, alcalose ventilatoire Suspicion d’état de mal épileptique • J 7 à 22 h – Transfert en Réanimation médicale – Glasgow à 5/15, hypertonie pyramidale franche, mydriase bilatérale réactive, oedème cérébral Encéphalopathie d’étiologie indéterminée – Hyperammoniémie à 700 μmol/l ! Aggravation rapide • J 10 – Décès du patient – ammoniémie à 1859 μmol/l (Normale : 11 à 45 μmol/l) Déficit en OCT

Quand doser l’ammoniémie ? 1. Accident aigu neuro-hépato-digestif 2. Association ou succession de symptômes hépatodigestifs et neuropsychiatriques de présentation subaiguë ou chronique 3. Tableau monosymptomatique qui ne fait pas sa preuve • vomissements, anorexie, cassure de courbe • anorexie et atteinte hépatique • retard psychomoteur, épilepsie • accès d’agitation, agressivité • syndrome confusionnel isolé • coma
 Denis diderot biographie
Denis diderot biographie Denis diderot beliefs
Denis diderot beliefs Facult
Facult Montesquieu rousseau voltaire
Montesquieu rousseau voltaire Universit sherbrooke
Universit sherbrooke Erasmus university rotterdam economics
Erasmus university rotterdam economics London universit
London universit Nanterre universit
Nanterre universit Universit
Universit Denis bardin
Denis bardin Denis doyen
Denis doyen Denis
Denis Denis cosperec
Denis cosperec Nico pietroni
Nico pietroni Surface lambertienne
Surface lambertienne Francoski razsvetljenec denis
Francoski razsvetljenec denis Moreau zjevení
Moreau zjevení Denis baričević
Denis baričević Indice de farcy
Indice de farcy Denis mourlane
Denis mourlane Denis stokkink
Denis stokkink Denis vinatier
Denis vinatier Denis deschamps
Denis deschamps Denis sınıflaması
Denis sınıflaması Denis hauchard
Denis hauchard Mr denis aymet
Mr denis aymet Denis paulo rocha ferraz
Denis paulo rocha ferraz Denis kuzmin
Denis kuzmin Denis boytsov
Denis boytsov Denis geels
Denis geels Dennis schlesinger
Dennis schlesinger Blue cross web denis
Blue cross web denis Denis g zill
Denis g zill Denis karanušić
Denis karanušić Denis knaepen
Denis knaepen Dr claire denis
Dr claire denis Danceacise
Danceacise Denis dechandon
Denis dechandon Pembangunan ekonomi menurut prof denis goulet
Pembangunan ekonomi menurut prof denis goulet Denis poussart
Denis poussart Ade planning esiee
Ade planning esiee Denis skrypnik
Denis skrypnik Denis primos
Denis primos Denis genevois
Denis genevois Denis f. villorente
Denis f. villorente T skor
T skor Denis papin parný stroj
Denis papin parný stroj Denis shemilt
Denis shemilt Poisson simon
Poisson simon Omurga neresi
Omurga neresi Denis papin centrifugal pump
Denis papin centrifugal pump Archibald denis leigh
Archibald denis leigh Emergency denis johnson
Emergency denis johnson Hrvoje salopek
Hrvoje salopek Ilfeld brace
Ilfeld brace Archbishop denis o'connor catholic high school
Archbishop denis o'connor catholic high school