Cultivos celulares y sus aplicaciones Instituto de Oncologa















































































- Slides: 94

Cultivos celulares y sus aplicaciones Instituto de Oncología “Angel H. Roffo” Área de Investigación Dpto. Biología Celular

El cultivo celular Téc. Alicia Rivelli

Breve introducción histórica v v v v En 1907 el Dr. Harrison cultivó células del tubo neural de embrión de rana En 1910 el Dr. Burrows cultivó explantos de tejido de embrión de pollo y junto con el Dr. Carrel fueron los primeros investigadores en intentar cultivo de células de mamíferos. Entre 1940 -1945 se logran replicar virus sobre células cultivadas. En 1952 se establece la línea celular He. La (primera línea celular de origen humano) Durante la década del 70 los cultivos celulares se incorporan a la ingeniería genética. En 1975 los Drs. Koehler y Milstein establecen la primera línea celular productora de anticuerpos monoclonales. En los últimos años la aplicación de la tecnología del cultivo celular a permitido grandes avances en la comprensión de los mecanismos implicados en procesos intra e intercelulares.

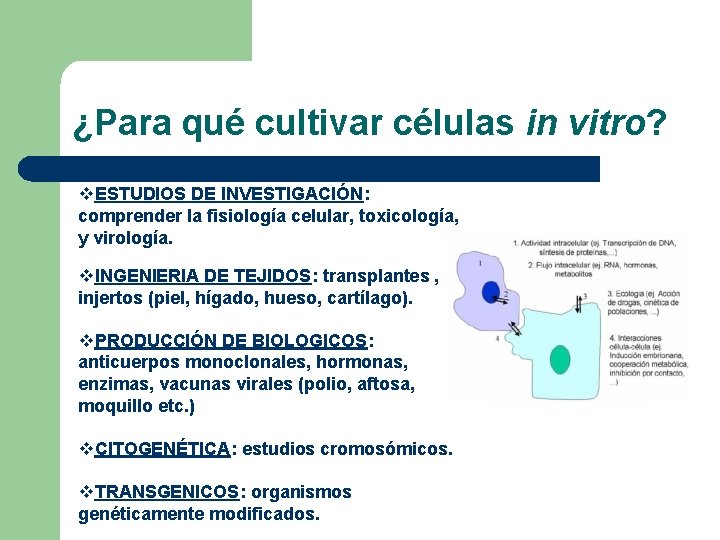
¿Para qué cultivar células in vitro? v. ESTUDIOS DE INVESTIGACIÓN: comprender la fisiología celular, toxicología, y virología. v. INGENIERIA DE TEJIDOS: transplantes , injertos (piel, hígado, hueso, cartílago). v. PRODUCCIÓN DE BIOLOGICOS: anticuerpos monoclonales, hormonas, enzimas, vacunas virales (polio, aftosa, moquillo etc. ) v. CITOGENÉTICA: estudios cromosómicos. v. TRANSGENICOS: organismos genéticamente modificados.

Diferentes tipos de cultivos de tejidos: v Cultivo de órganos: mantenimiento de órganos o parte de órganos in vitro (por ejemplo corazón). v Cultivo de tejidos y explantes: mantenimiento de tejidos in vitro. v Cultivo de células

Cultivo de células: l Se define como el conjunto de técnicas de aislamiento de células y obtención de poblaciones celulares in vitro, manteniendo al máximo sus propiedades fisiológicas, bioquímicas y genéticas.

Diferentes tipos de cultivos celulares Primario: iniciado a partir de células, tejidos u órganos tomados directamente de un organismo. Líneas celulares: se origina del cultivo primario, a partir del primer subcultivo exitoso. Línea celular continua: células que han logrado sobrevivir a muchos subcultivos. Expectativa de vida “infinita”.

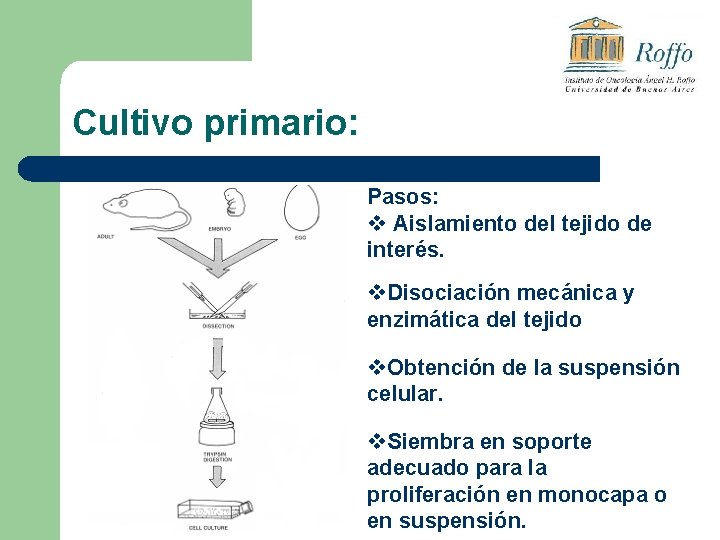
Cultivo primario: Pasos: v Aislamiento del tejido de interés. v. Disociación mecánica y enzimática del tejido v. Obtención de la suspensión celular. v. Siembra en soporte adecuado para la proliferación en monocapa o en suspensión.

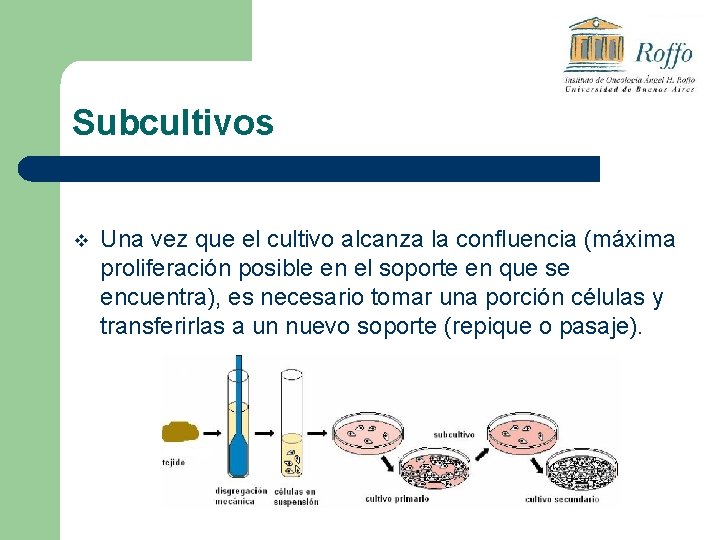
Subcultivos v Una vez que el cultivo alcanza la confluencia (máxima proliferación posible en el soporte en que se encuentra), es necesario tomar una porción células y transferirlas a un nuevo soporte (repique o pasaje).

Crecimiento celular: En monocapa Las células crecen En suspensión

Células en monocapa l Los cultivos cuyas células son dependiente de anclaje crecen formando monocapas de células adheridas al plástico o vidrio. l Para despegar las células se utilizan enzimas que disgregan la matriz extracelular como la tripsina y la colagenasa.

Células en monocapa

Células en suspensión l Las células que proliferan sin necesidad de adherirse al sustrato, independientes de anclaje (característico de células hematopoyéticas) crecen en suspendidas en el medio de cultivo correspondiente. l El repique se realiza mediante una dilución de la suspensión celular.

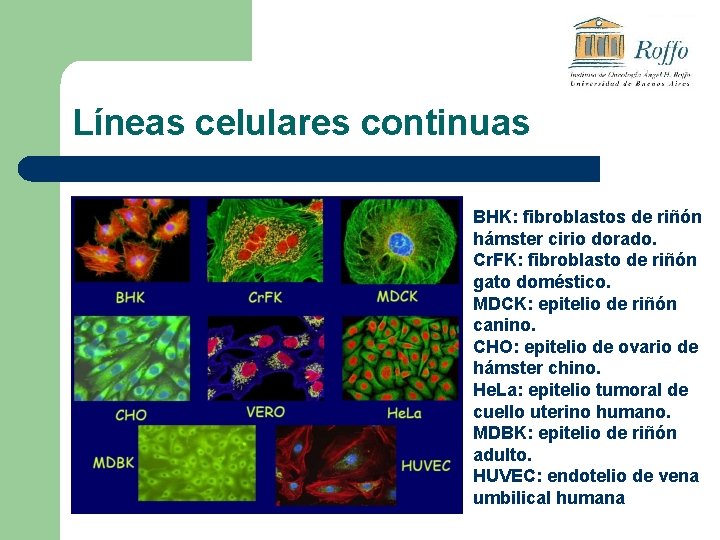
Líneas celulares continuas BHK: fibroblastos de riñón hámster cirio dorado. Cr. FK: fibroblasto de riñón gato doméstico. MDCK: epitelio de riñón canino. CHO: epitelio de ovario de hámster chino. He. La: epitelio tumoral de cuello uterino humano. MDBK: epitelio de riñón adulto. HUVEC: endotelio de vena umbilical humana

Línea celular LM 3 l l l Línea celular establecida a partir de pasajes sucesivos in vitro de un cultivo primario del adenocarcinoma mamario murino M 3. El adenocarcinoma mamario M 3 surgió espontáneamente en una ratona BALB/c endocriada en el bioterio del Instituto de Oncología “Ángel H. Roffo”. Las células LM 3 presentan un fenotipo altamente invasivo y metastásico al ser inoculadas en ratones singeneicos y en cultivo muestran una morfología epitelial poliédrica

ABAC Asociación Banco Argentino de Células Desde 1987 mantiene y administra líneas celulares en distintos centros de investigación, proveyendo células congeladas o en cultivo a cambio de un arancel.

Mantenimiento de líneas celulares q Repique o pasaje: para mantener las células en cultivo. q Congelación (criopreservación): para preservar las células a lo largo del tiempo (años) y mantener un stock para los próximos usos.

Criopreservación l Técnica: Ø Ø Se levanta la monocapa por tripsinización Se obtiene una suspensión celular. Se centrifuga 800 -900 rpm durante 10 min, para separar la fracción celular del medio de cultivo. El pellet celular se resuspende en medio de congelación (SFB o medio enriquecido mas DMSO o Glicerol –anticongelantes-)

Criopreservación Ø Ø Ø Se fraccionan en criotubos. Colocar en recipiente adecuado 20 minutos en heladera y luego se la lleva a freezer -80°C durante 24 -48 hs Se guardan en tanque de nitrógeno líquido

Componentes del medioambiente del cultivo: Medio de cultivo: ( aporta nutrientes, vitaminas etc. ) Suplementos: (ej suero que aporta factores de crecimiento) p. H: ( ej: 7, 4 ) Temperatura: (ej. 37° C) Gas: Dióxido de carbono (ej. 57%) Soportes: materiales adecuados para el crecimiento (ej vidrio, plástico, biológicos etc. )

Medios de cultivo

Suplementos

Atmósfera y temperatura l Estufa de cultivo con atmósfera de Dióxido de carbono

Soportes l l Estériles Generalmente se utiliza material de plástico:

Soportes l Biológicos:

El laboratorio de cultivo celular v Además del equipamiento usual se requiere: Ø Microscopios: invertido contraste de fase, de fluorescencia, etc.

El laboratorio de cultivo celular Ø Flujo Laminar o campana de seguridad biológica: mantienen la esterilidad del área de

El laboratorio de cultivo celular Ø - Espacios fríos: Heladeras (4°C) Freezer (-20, -40, -80 °C) Tanque de Nitrógeno Liquido (- 196°C)

El laboratorio de cultivo celular

Factores críticos l No biológicos: orden, limpieza, vestimenta adecuada para cada sector, etc. l Biológicos: CONTAMINACIONES La contaminación puede ser visible o no, destructiva o no, pero en todos los casos tiene efectos adversos

Contaminaciones Biológicas Ø Microorganismos: Bacterias Hongos/Levaduras Mycoplasmas Ø Otras células

Contaminaciones Biológicas l l l Efectos adversos sobre el metabolismo celular Pobre calidad de resultados experimentales Pérdida de células valiosas Pérdida de productos celulares (por ejemplo producción de antígenos para vacunas, etc. ) Pérdida de tiempo, dinero y esfuerzo

MUCHAS GRACIAS!!!

Aplicaciones en Oncología Téc. Silvina Romero Instituto de Oncología “Angel H. Roffo”

Aplicaciones de los cultivos celulares en la Investigación en cáncer

Investigación en Oncología l Se realizan ensayos tendientes a: ü Caracterizar el comportamiento de las células tumorales in vitro e in vivo. ü Revertir la agresividad tumoral mediante drogas y herramientas genéticas tanto in vitro como in vivo.

Introducción v v v El cáncer es un conjunto de enfermedades en las cuales el organismo produce un exceso de células, con crecimiento y división más allá de los límites normales, invasión del tejido circundante y, a veces, metástasis. La metástasis es la propagación a distancia de las celulas tumorales, por vía linfática o sanguínea, lo que implica el crecimiento de nuevos tumores en un lugar diferente al tumor original (primario). Estas propiedades diferencian a los tumores malignos de los benignos, que son limitados y no producen metástasis.

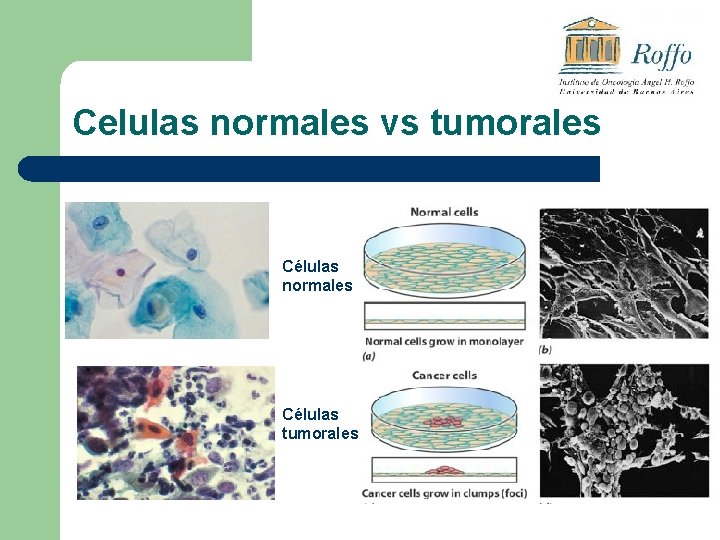
Celulas normales vs tumorales Células normales Células tumorales

Características de las células tumorales l. Cambios en el citoesqueleto: estos cambios afectan: 1. 2. Forma (pleomorfismo): cambio de en la morfología y tamaño del citoplasma. Adhesión/ Movilidad: la reducción de la adhesión entre células y con la matriz celular facilita la movilidad celular favoreciendo la aparición de metástasis

Características de las células tumorales l Cambios nucleares: tiene valor diagnóstico Ø Ø Número: celulas multinucleadas Forma: mas grandes o mas pequeños Organización de los núcleos: (nucleolos prominentes) Hipercromasia: por la presencia de mayor cantidad de ADN.

Características de las células tumorales l Producción de enzimas proteolíticas: permiten invadir los tejidos adyacentes facilitando la migración y la propagación de las células tumorales.

Características de las células tumorales l Grado de diferenciación celular: las células neoplásicas por su alta tasa de proliferación se desdiferencian pareciéndose al tipo celular que le dio origen. l Alteraciones en el crecimiento: crecen de manera desordenada, pierden la polaridad celular y no respetan límites por contacto célula-célula. l Resistencia a la apoptosis: muerte celular programada

Biología Molecular del Cáncer l La transformación maligna implica la adquisición progresiva de una serie de cambios genéticos y bioquímicos específicos que actúan desobedeciendo los fuertes mecanismos antitumorales presentes en las células normales.

Investigación en Oncología l Se trabaja con dos modelos v Celulares: Líneas celulares cancerígenas (in vitro) v Animales de experimentación: Ratones (in vivo) a los cuales por inyección de la celulas tumorales se les genera la enfermedad experimentalmente.

Estudios in vitro

Investigación en Oncología q Lineas celulares tumorales usadas en nuestro laboratorio. – – – LM 3 : Ca mamario murino MCF 7: Ca mamario humano MB 49: Ca de vejiga murino T 24: Ca de vejiga humano LP 07: Ca de pulmón murino Entre otras…

Estudios celulares

Estudios celulares: l Morfológicos l Funcionales l Mixtos l Cromosómicos

Estudios Morfológicos: l Observación en fresco o post fijación (formol neutro) de monocapas celulares, en microscopio óptico invertido, contraste de fase, fluorescencia etc.

Estudios funcionales: Viabilidad celular 2. Adhesión * 3. Ensayos clonogénicos* 4. Migración* 5. Actividad enzimática* 6. Citotoxicidad 1. *evalúan la capacidad invasiva y metastásica.

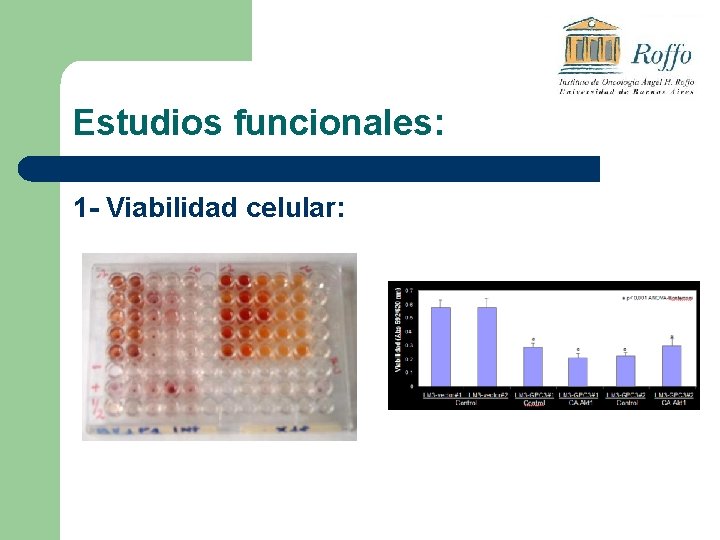
Estudios funcionales: 1 - Viabilidad celular: ü ü Se siembra en placas multipozo una cantidad conocida de células Se las somete a “hambreado” colocando medio de cultivo sin suero (SFB) durante 72 hs Se evalúa la actividad celular (viabilidad) por fotocolorimetría. La producción del color se debe a la metabolización del reactivo (MTS) llevado a cabo por las células vivas.

Estudios funcionales: 1 - Viabilidad celular:

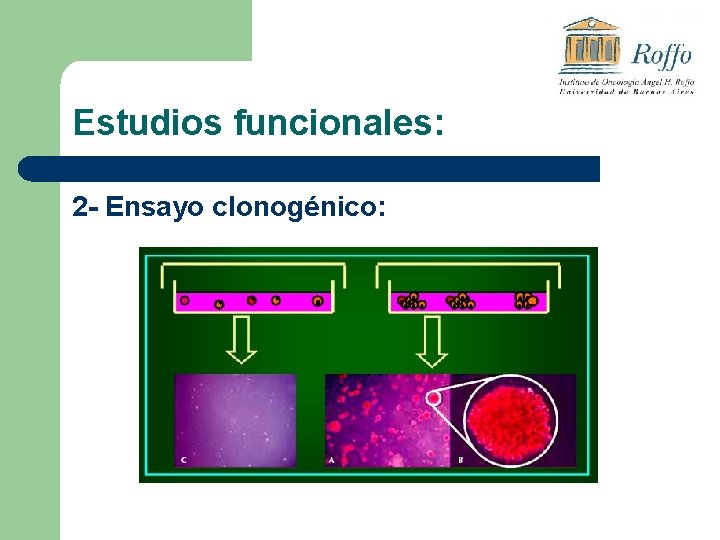
Estudios funcionales: 2 - Ensayo clonogénico en agar: ü Capacidad de crecer en un medio independiente de anclaje. ü Formación de colonias celulares a partir de una única celula.

Estudios funcionales: 2 - Ensayo clonogénico:

Estudios funcionales: 3 - Migración: Ensayo de cicatrización de heridas ü Se realiza una herida en la monocapa y se deja a las células crecer durante un tiempo determinado en presencia de tratamientos o condiciones específicas. ü La migración se evaluará a través del porcentaje de cubrimiento del área inicial.

Estudios funcionales: 3 - Migración: Ensayo de cicatrización de heridas Tipo celular 1 Tipo celular 2 Tipo celular 3

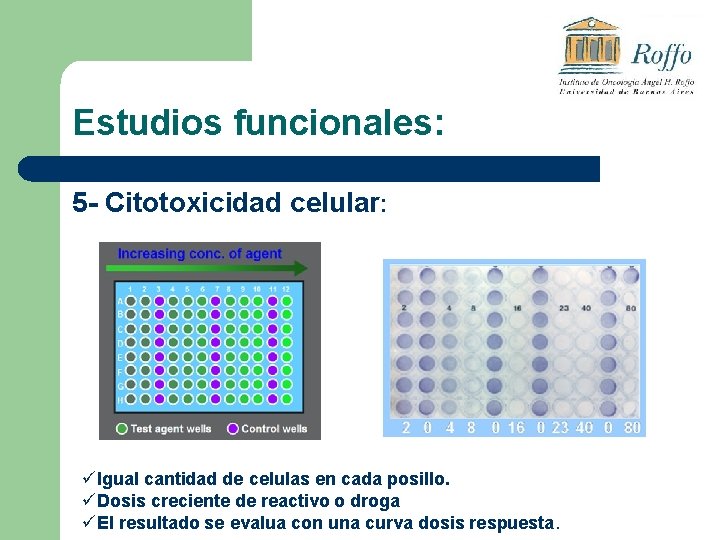
Estudios funcionales: 4 - Citotoxicidad celular: ü Se utiliza para encontrar la dosis justa de drogas o reactivos que generen el efecto deseado sin dañar la monocapa. ü Se puede buscar la muerte de la totalidad de las células (ej. Drogas quimioterápicas).

Estudios funcionales: 5 - Citotoxicidad celular: üIgual cantidad de celulas en cada posillo. üDosis creciente de reactivo o droga üEl resultado se evalua con una curva dosis respuesta.

Estudios mixtos l ü Mofológicos y funcionales: Inmunofluorescencia: empleo de Ac. fluorescentes

Estudios cromosómicos l Cariotipo: estudia la morfología y número de los cromosomas Nos da una idea de la evolución de los cultivos celulares.

Estudios cromosómicos Translocaciones Regiones homogéneamente teñidas

Estudios Moleculares

Estudios Moleculares l Se utiliza: v Lisados celulares: el producto de la destrucción celular y purificación de la fracción a utilizar (proteínas, ácidos nucleicos, etc) v Partes celulares: obtención de núcleos, citoplasmas, membrana celulares etc. v Medios condicionados: se utilizan los medios en los que crecieron las células y se estudian factores de crecimiento, proteínas, etc. secretadas al exterior.

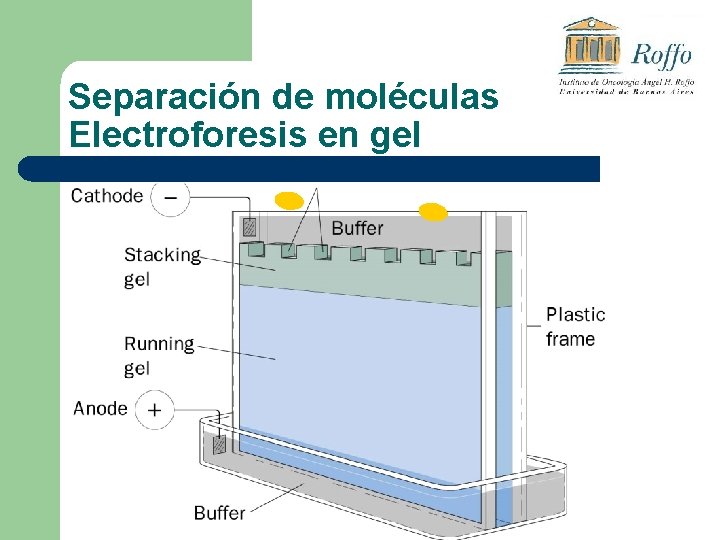
Electroforesis en gel Fundamento: v. Migración de solutos iónicos bajo la influencia de un campo eléctrico estas partículas migran hacia el polo – o positivo+ según la combinación de su carga, peso molecular y estructura tridimensional. Utilidades: v. Separación de mezclas complejas de ácidos nucleicos, proteínas y otras biomoléculas. v. Aportan un potente criterio de pureza

Electroforesis en gel: l Gel de Poliacrilamida: para separar proteínas. l Gel de Agarosa: para separar Ácidos Nucleicos.

Separación de moléculas Electroforesis en gel

Estudios Moleculares v Biomoléculas mas importantes en investigación: q ADN q ARN q PROTEINAS

Estudios del ADN l Electroforesis en gel ü El ADN extraído por lisis celular, se corta con enzimas para obtener diferentes fragmentos. ü Se realiza la corrida electroforética en gel de agarosa para separar fragmentos de ADN e identificarlos según su peso (kb) ü Luego de la electroferesis, se tiñe el gel con colorantes que emiten fluorescencia al ser excitado con luz UV:

Estudios del ADN l Colorantes fluoerescentes q BROMURO DE ETIDIO: altamente tóxico y mutagénico.

Estudios del ADN l Colorantes fluoerescentes SYBR green, SYBR safe, SYBR gold. q No es mutagénico ni tóxico. q

Estudios del ADN l PCR: Reacción en cadena de la Polimerasa Usos: ü Detección de mutaciones ü Amplificación de genes de interés ü Estudios diagnósticos

Estudios del ADN Transfección: Introducción de un fragmento de ADN externo a una célula animal. Para qué? Caracterizar oncogenes Ø Confirmar la identidad de genes Ø Síntesis de ARN Ø Expresión de proteínas, etc Ø Estudio de síntesis y transporte intracelular Ø

Cómo se introduce el ADN a la célula? l l l Una de técnicas es usando virus. El proceso se llama INFECCIÓN Una vez que el virus infecta las células en cultivo: 1. El fragmento de ADN de interés pasa del citoplasma al núcleo celular. 2. Se expresa produciendo el efecto deseado. 3. El ADN puede incorporarse en las células transfectadas de dos formas: v Momentánea: transfección transiente. Llevada a cabo por Adenovirus v Estable: implica la integración del ADN genoma celular. Retrovirus.

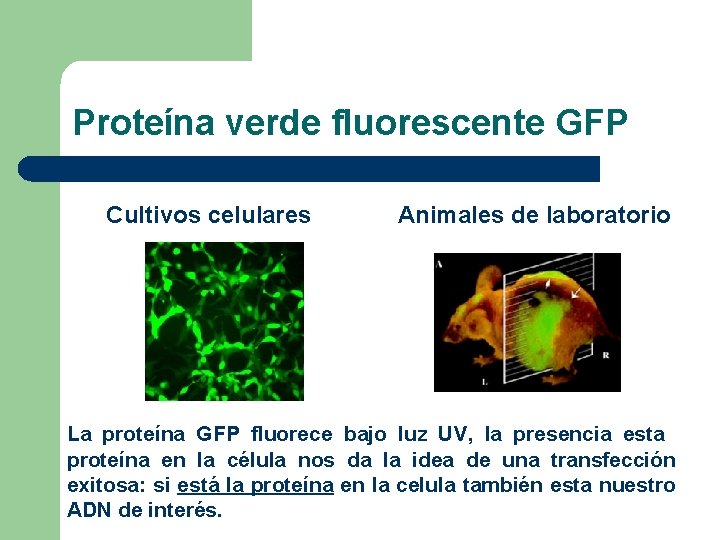
Selección de las células transfectadas Junto con el ADN a insertar se incorporan genes que nos permiten identificar en cultivo a las células transfectadas. Genes mas utilizados: l Resistencia a antibióticos: ü Hygromicina ü G 418 Las células que no incorporaron el ADN durante la transfección mueren al colocar estos atb. l Permiten la expresión de GFP (proteína verde fluorescente)

Proteína verde fluorescente GFP Cultivos celulares Animales de laboratorio La proteína GFP fluorece bajo luz UV, la presencia esta proteína en la célula nos da la idea de una transfección exitosa: si está la proteína en la celula también esta nuestro ADN de interés.

Estudios de ARN l Electroforesis en gel: Gel tenido con Br. Et y mirado con UV

Estudios de ARN l Recientemente: Transfección con ARN interferente Suprime la expresión de un gen en particular. Es un ARN complementario al ADNm y al unirse a éste promueve su degradación.

Estudios de Proteínas l l Se usan lisados celulares Sirve para identificar, cuantificar y evaluar la función de proteínas como: ü ü ü q Enzimas Proteínas estructurales Receptores Sirve para evaluar indirectamente la funciones de genes a través de su producto: Las Proteínas!

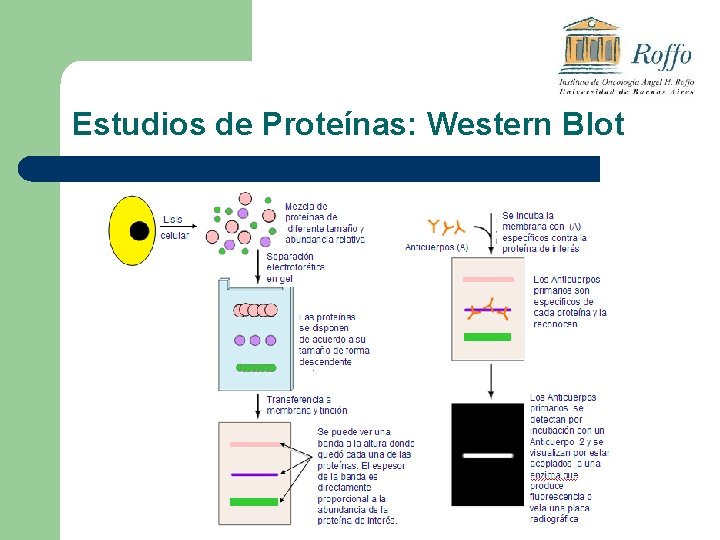
Estudios de Proteínas: Western Blot

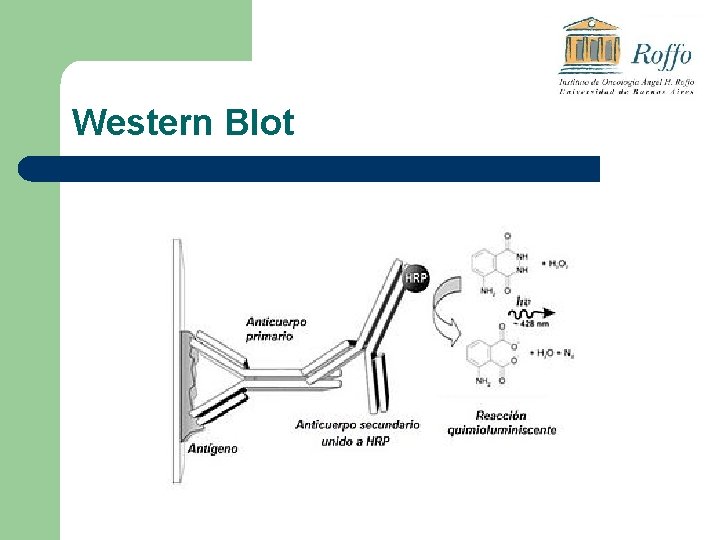
Western Blot

Western Blot l Para la identificación de la proteína de interés se utiliza un “marcador de peso molecular”, que indica PM correspondiente a cada altura del gel.

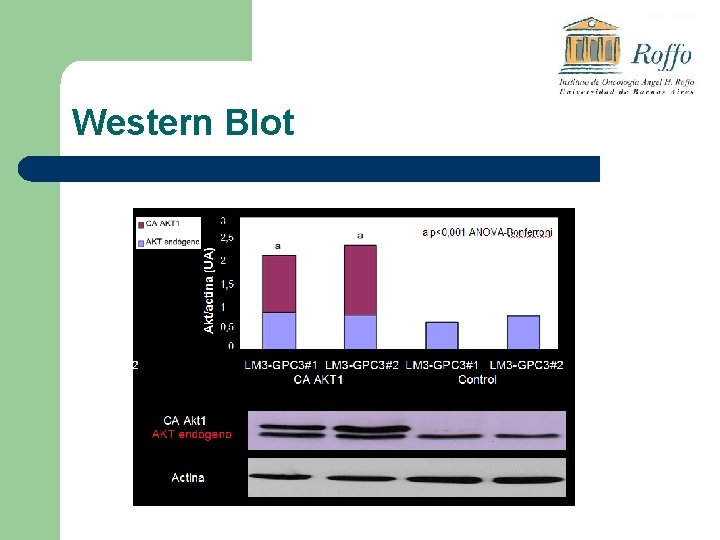
Western Blot

Estudios In vivo

Investigación en Oncología l Animales de experimentación: contamos con un bioterio con cria propia de ratones. Ø BALB/C Ø C 57 B 16/ J-GFP

Estudios in vivo l ü ü Objetivo: Estudiar el comportamiento in vivo de los modelos celulares que generados in vitro. Metodología: Inyección subcutánea, endovenosa, intraperitoneal, etc. , de las células en estudio. Colocación de parches de las drogas en estudio en ratones a los cuales se les provocó experimentalmente la enferemdad.

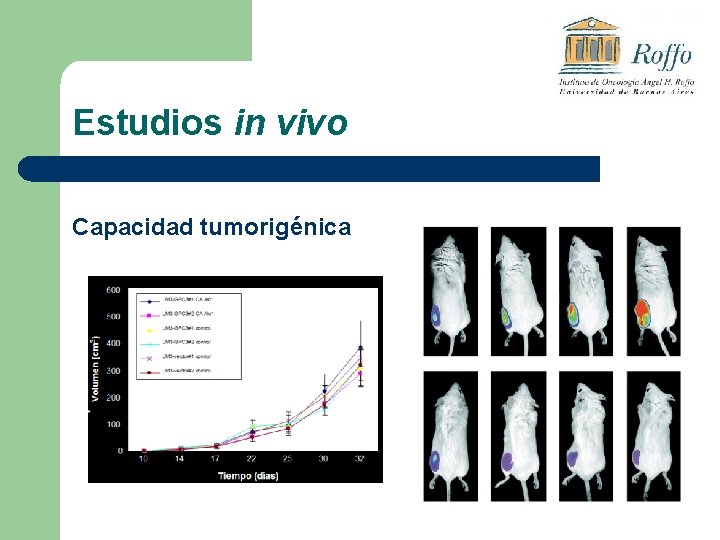
Estudios in vivo l ü ü ü Se evalúa: Capacidad tumorigénica: porcentaje de toma tumoral. Capacidad metastásica espontánea: producción de metástasis por inoculación de celulas tumorales in situ. Capacidad metastásica experimental: producción de metástasis por inoculación ev de las células en estudio.

Estudios in vivo Capacidad tumorigénica

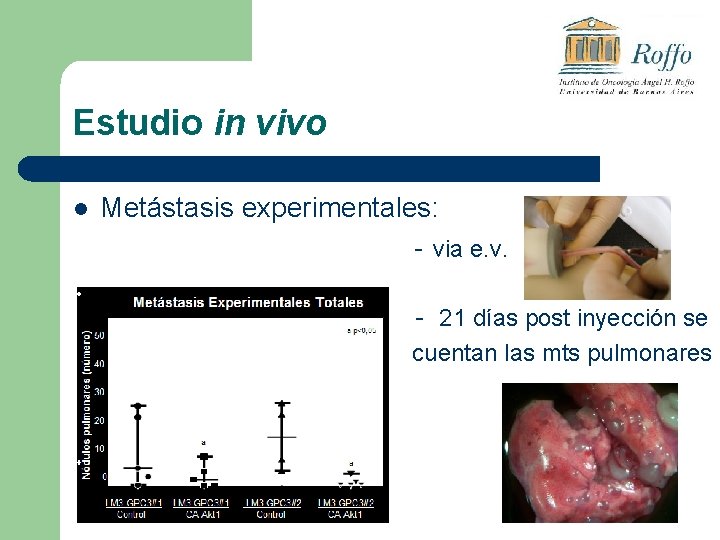
Estudio in vivo l Metástasis experimentales: - via e. v. - 21 días post inyección se cuentan las mts pulmonares

Aplicaciones en otros campos

Otras aplicaciones: l Virología: Ø Ø Ø Aislamiento y multiplicación de virus Producción de vacunas Estudio y producción de antivirales Detección de virus desconocidos Estudios de oncogénesis viral

Otras aplicaciones: l Transplantes/Injertos: Ø Cultivo de piel Ø Cultivo de celulas stem (pluripotentes) Ø Cultivo de islotes pancreaticos, hepatocitos, etc

Otras aplicaciones: l l Fertilización in vitro Producción de biológicos (proteinas, anticuerpos monoclonales, hormonas, enzimas). Producción de transgénicos: GMOs (organismos geneticamente modificados: soja, arroz, ovinos, caprinos, etc. ) Transgenesis parcial: Terapia génica en humanos.

Agradecimientos: l Área de Investigación Instituto Roffo: - Dra Lydia Puricelli - Dr Martin Krasnapolski - Lic. Maria Ines Diaz Bessone - Lic. Denis Belgoroski

MUCHAS GRACIAS!!!
 Competencia comunicativa y sus aplicaciones
Competencia comunicativa y sus aplicaciones Feudo
Feudo Cultivos tropicales
Cultivos tropicales Cultivos integrados
Cultivos integrados Siembra en cultivos líquidos
Siembra en cultivos líquidos Pixabay
Pixabay Tabla kc cultivos
Tabla kc cultivos Cultivos histotípicos y organotípicos
Cultivos histotípicos y organotípicos Olmecas cultivos
Olmecas cultivos Esquema postulado de la teoría celular
Esquema postulado de la teoría celular Pmn
Pmn Cromoplasto
Cromoplasto Fases celulares
Fases celulares Re liso
Re liso Procesos celulares
Procesos celulares Organizacion funcional del cuerpo
Organizacion funcional del cuerpo Adaptaciones celulares
Adaptaciones celulares Organelos celulares
Organelos celulares Brifitas
Brifitas Organelos celulares
Organelos celulares Celulares imagenes
Celulares imagenes Union adherente
Union adherente Uniones gap junction
Uniones gap junction Uniones gap junction
Uniones gap junction Transducción
Transducción Compartimentos celulares
Compartimentos celulares Glucocaliz
Glucocaliz Componentes celulares del sistema nervioso
Componentes celulares del sistema nervioso Formas celulares
Formas celulares Sectorización de celdas celulares
Sectorización de celdas celulares Mila nori
Mila nori Ejercicios sobre el acento
Ejercicios sobre el acento Ejercicios de diptongos e hiatos resueltos
Ejercicios de diptongos e hiatos resueltos Aplicaciones de los resortes
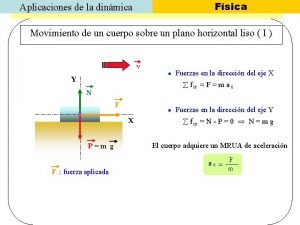
Aplicaciones de los resortes Fisica dinamica
Fisica dinamica Aplicaciones de los materiales ferrosos
Aplicaciones de los materiales ferrosos Características del ácido clorhídrico
Características del ácido clorhídrico Aplicaciones de la pnl
Aplicaciones de la pnl Aplicaciones tecnologicas
Aplicaciones tecnologicas Aplicaciones del valor absoluto
Aplicaciones del valor absoluto Aplicaciones de transporte privado
Aplicaciones de transporte privado Aplicaciones de las redes neuronales
Aplicaciones de las redes neuronales Aplicaciones de la elasticidad
Aplicaciones de la elasticidad Aplicaciones para
Aplicaciones para Valor presente de un flujo continuo de ingresos
Valor presente de un flujo continuo de ingresos Aplicaciones de las funciones lineales
Aplicaciones de las funciones lineales Acoplador optico
Acoplador optico Vida media benzodiacepinas
Vida media benzodiacepinas Lipidos aplicaciones
Lipidos aplicaciones Aplicacion de neon en la vida diaria
Aplicacion de neon en la vida diaria Aplicaciones del plano inclinado
Aplicaciones del plano inclinado Aplicaciones del principio de pascal
Aplicaciones del principio de pascal Materiales compuestos aplicaciones
Materiales compuestos aplicaciones Desarrollo de aplicaciones web con asp.net
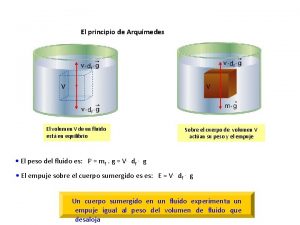
Desarrollo de aplicaciones web con asp.net Aplicaciones del principio de arquímedes.
Aplicaciones del principio de arquímedes. Longitud de arco aplicaciones
Longitud de arco aplicaciones Grafos matriz de adyacencia
Grafos matriz de adyacencia Efecto fotoelectrico
Efecto fotoelectrico Propiedades de los logaritmos
Propiedades de los logaritmos Aplicaciones de ecuaciones diferenciales de primer orden
Aplicaciones de ecuaciones diferenciales de primer orden Evaporadores de pelicula agitada
Evaporadores de pelicula agitada Ejemplos de regresión lineal en la vida cotidiana
Ejemplos de regresión lineal en la vida cotidiana Aplicaciones del eter
Aplicaciones del eter Aplicaciones del boro
Aplicaciones del boro Aplicaciones del magnetismo
Aplicaciones del magnetismo Caracteristicas
Caracteristicas Aplicaciones logica difusa
Aplicaciones logica difusa Multivibrador monoestable con transistores
Multivibrador monoestable con transistores Elementos del bloque d
Elementos del bloque d Aplicación del lenguaje ensamblador
Aplicación del lenguaje ensamblador Para que sirven las derivadas
Para que sirven las derivadas Aplicaciones de la electrólisis
Aplicaciones de la electrólisis Aplicaciones de la polarimetria
Aplicaciones de la polarimetria Para que sirve la raíz cuadrada en la vida diaria
Para que sirve la raíz cuadrada en la vida diaria Materiales compuestos aplicaciones
Materiales compuestos aplicaciones Taller sobre aplicaciones en la administración
Taller sobre aplicaciones en la administración Reduccin
Reduccin Regresion lineal multiple aplicaciones
Regresion lineal multiple aplicaciones Electromagnetismo
Electromagnetismo Trabajo virtual estructuras
Trabajo virtual estructuras Aplicaciones de la energía eólica
Aplicaciones de la energía eólica Las aplicaciones mas usadas
Las aplicaciones mas usadas Diodo detector simbolo
Diodo detector simbolo Aplicaciones de la espectrometría de masas
Aplicaciones de la espectrometría de masas Aplicaciones de la ley de ohm
Aplicaciones de la ley de ohm Integrales impropias mixtas
Integrales impropias mixtas Magnitudes de la termodinamica
Magnitudes de la termodinamica Pila redox
Pila redox Aplicaciones de la derivada concepto
Aplicaciones de la derivada concepto Instituto morelos tacuba
Instituto morelos tacuba Instituto de liderazgo rotario
Instituto de liderazgo rotario Instituto superior de formacion docente santa maria
Instituto superior de formacion docente santa maria Instituto rafael aqueche
Instituto rafael aqueche Instituto lizardi zihuatanejo
Instituto lizardi zihuatanejo Instituto saturnino unzué
Instituto saturnino unzué