CAPTULO 6 Sustancia Pura INDICE Introduccin Superficie PvT













































- Slides: 61

CAPÍTULO 6 Sustancia Pura

INDICE Introducción Superficie P-v-T 7. 1 Superficies Termodinámicas (P-v-T) -Diagramas T-v, P-T. -Puntos Críticos, Puntos Triple. 7. 2 Cambios de fase y estados importantes 7. 3 Calidad de Vapor (x) -Porcentaje de Humedad -Valor específico de una mezcla 7. 4 Uso de tablas de vapor -Tablas de Vapor Sobrecalentado -Tablas de líquido subenfriado

Al finalizar este capítulo ya podremos conocer todas las propiedades y estados de las sustancias. Trabajaremos con Tablas y Software.

Superficie P - v - T

SUSTANCIA PURA Es aquella que tiene una composición química homogénea e invariable que puede existir en más de una fase. Por ejemplo: el agua, una mezcla de hielo y agua; son sustancias puras porque para cada fase tienen la misma composición. En cambio el agua de mar no es sustancia pura porque al producirse la evaporación, el vapor tendría una composición química diferente a la de la fase líquida.

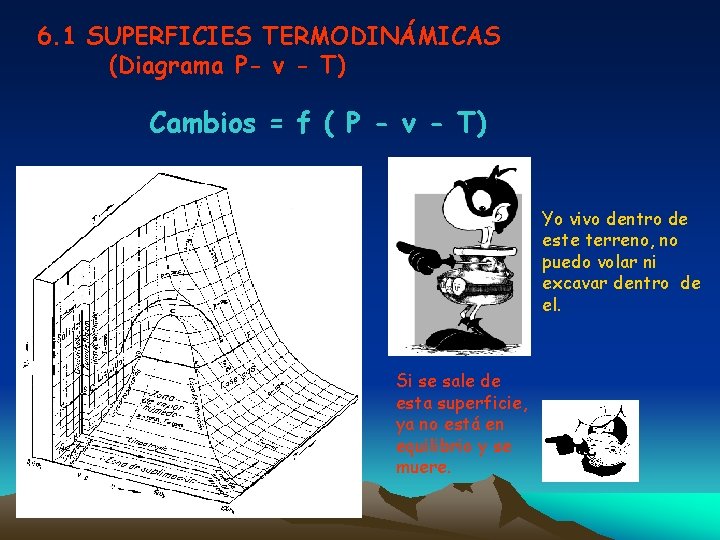
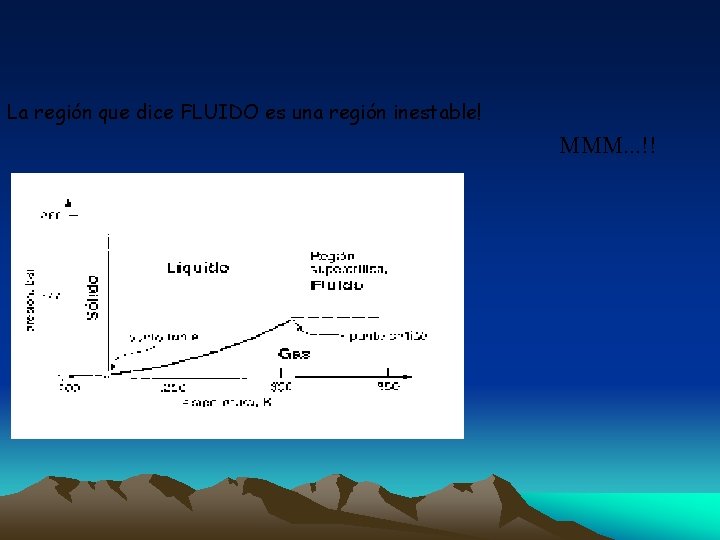
6. 1 SUPERFICIES TERMODINÁMICAS (Diagrama P- v - T) Cambios = f ( P - v - T) Yo vivo dentro de este terreno, no puedo volar ni excavar dentro de el. Si se sale de esta superficie, ya no está en equilibrio y se muere.

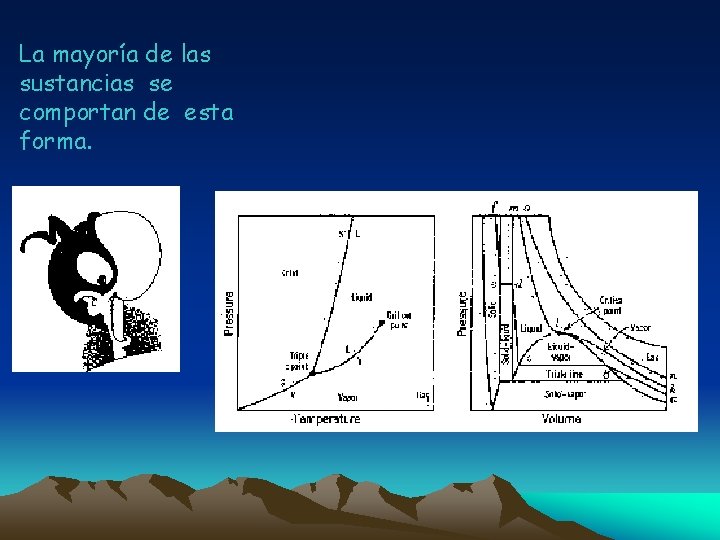
SUPERFICIE P - v T para la mayoría de las sustancias Las que se contraen al enfriarse

La mayoría de las sustancias se comportan de esta forma.

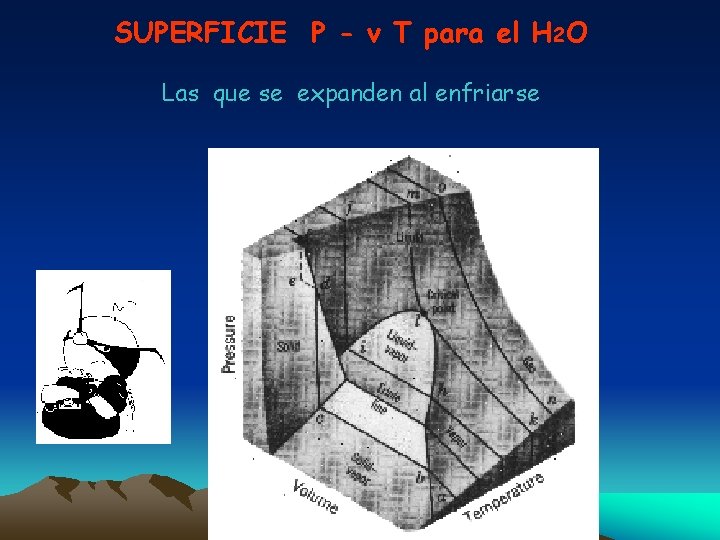
SUPERFICIE P - v T para el H 2 O Las que se expanden al enfriarse

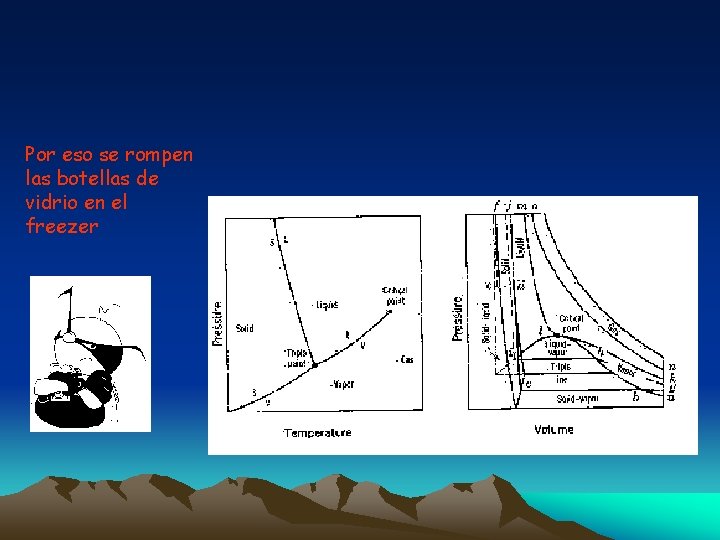
Por eso se rompen las botellas de vidrio en el freezer

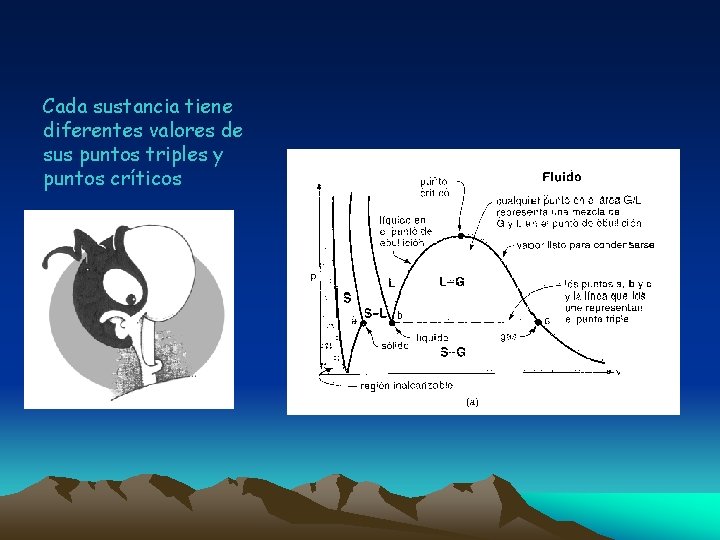
Cada sustancia tiene diferentes valores de sus puntos triples y puntos críticos

La región que dice FLUIDO es una región inestable! MMM. . . !!

Punto Crítico: (PC) Es el estado donde las fases líquida y gaseosa se confunden. Este punto varía dependiendo de la sustancia tratada y se define por: la presión crítica (Pc), la temperatura crítica (Tc), etc. En los procesos que se llevan a cabo a esta Pc y Tc, no se puede establecer un cambio de fase líquido a vapor y no pasan por un estado de equilibrio. Punto Triple: (PT) Es una propiedad característica de las sustancias, en el cual coexisten las tres fases, es decir coexisten los estados sólido líquido y gaseoso.



Qué puede estar mal en estas historietas ?

6. 2 Cambios de Fase y Estados Importantes Supongamos un recipiente cilíndrico, con un pistón móvil sin fricción, que contiene agua. Se le aplica calor hasta vaporizar completamente, la presión es constante (isobárico), y está en equilibrio en cada momento. Se muestran los siguientes estados del proceso:


Para fijar un estado de una sustancia pura es necesario conocer por lo menos dos propiedades intensivas o específicas independientes. El término Temperatura de Saturación designa la temperatura a la cual se efectúa la evaporación a una presión dada, y esta presión se denomina Presión de Saturación. Las condiciones de presión y temperatura en que dos fases coexisten en equilibrio se denominan las condiciones de saturación. La temperatura de saturación depende de la presión, a mayor presión mayor es la temperatura de saturación y viceversa.

( 1 ) Líquido comprimido o sub enfriado: (LC o LSE) Es aquel que tiene una temperatura menor que la de saturación a una presión dada. ( 2 ) Líquido Saturado: (LS) Es cuando un estado es tal que empieza a cambiar de fase líquida a fase gaseosa, es decir se inicia la evaporación. Es aquel que se encuentra a la temperatura de saturación correspondiente a su presión. Todos estados constituyen la línea de líquido saturado. ( 3 ) Vapor Húmedo o mezcla líquido-vapor: (VH) Es aquel que contiene líquido más vapor en equilibrio

( 4 ) Vapor Saturado: (VS) Es cuando un estado es tal que el vapor comienza a cambiar de fase gaseosa a fase líquida (condensación). Como por ejemplo la lluvia o la formación de escarcha. Estos estados forman la línea de vapor saturado. ( 5 ) Vapor Sobrecalentado: (VSC) Es aquel que tiene una temperatura mayor que la de saturación pero a una presión dada

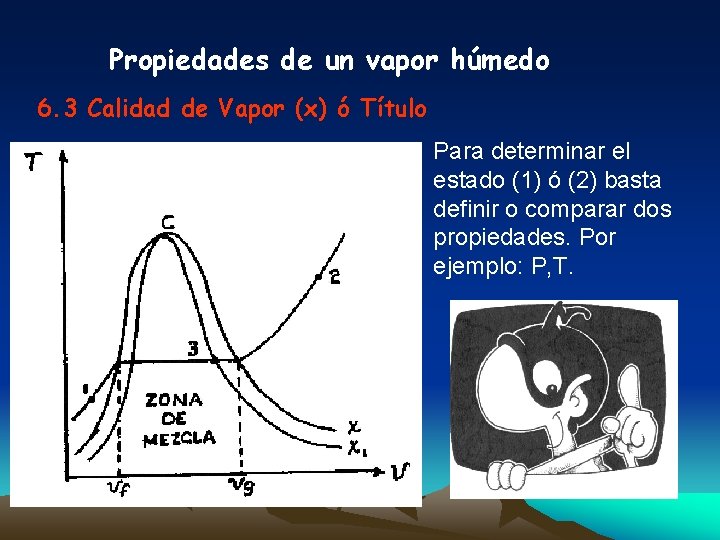
Propiedades de un vapor húmedo 6. 3 Calidad de Vapor (x) ó Título Para determinar el estado (1) ó (2) basta definir o comparar dos propiedades. Por ejemplo: P, T.

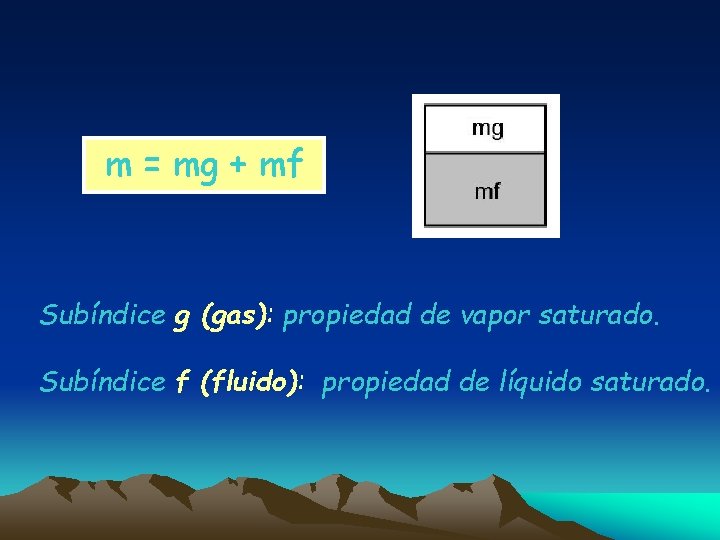
m = mg + mf Subíndice g (gas): propiedad de vapor saturado. Subíndice f (fluido): propiedad de líquido saturado.


Cómo haría Ud. para medir la calidad ? Cómo mide el Calorímetro ?

La calidad solo sirve cuando trabajamos dentro de la campana Si un depósito está con la mitad de líquido y mitad vapor, entonces la calidad será 50 % ?

6. 4 Uso de Tablas de Vapor Estudiaremos el caso del agua, por las siguientes razones: 1. El comportamiento es análogo en sustancias puras 2. Las tablas son similares en cuanto la forma de presentar los datos 3. La importancia del agua en los procesos térmicos

1. Tablas de Vapor Saturado: 2. ( Tabla A. 1. 1 o Tabla A. 1. 2) Dadas la presión o temperatura de saturación, se pueden encontrar las propiedades de líquido y vapor saturado. Ejemplo: Calcular T(°C) para P = 0. 130 MPa. Las 2 tablas son las mismas, sólo es cuestión de escoger con cuál de ellas es más fácil trabajar. . .

Tablas de Vapor Sobrecalentado: (Tabla A. 1. 3) Basta tener definida la P y T para definir el estado de la sustancia. En algunas tablas no se tiene u ó h como datos, en este caso se usa la fórmula:

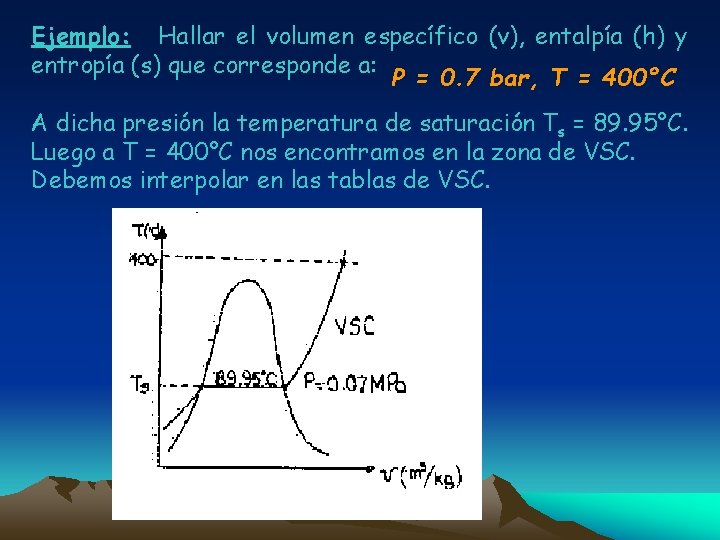
Ejemplo: Hallar el volumen específico (v), entalpía (h) y entropía (s) que corresponde a: P = 0. 7 bar, T = 400°C A dicha presión la temperatura de saturación Ts = 89. 95°C. Luego a T = 400°C nos encontramos en la zona de VSC. Debemos interpolar en las tablas de VSC.

Tablas de Líquido sub-enfriado comprimido : (Tabla A. 1. 4) o El uso de las tablas son similares a la anterior.

1. Indicar el nombre del estado correspondiente, si la sustancia es agua. a) P=10 bar T= 172. 96°C _________ b) T=0°C s=-1. 221 k. J/kg-K _________ c) T=374. 14°C P= 22. 09 MPa _________ d) T=290°C u= 1297. 1 k. J/kg _________ e) x=40% T= 420°C _________ f) P= 75 k. Pa h= 2700 k. J/kg _________ g) P= 1. 2544 MPa s= 2 k. J/kg-K _________ h) T= -20°C u= 2721. 6 k. J/kg _________ i) P= 313 k. Pa v= 0. 6822 m 3/kg _________ j) h= 2500. 6 k. J/kg T= -10°C _________ k) P= 80 k. Pa h= 2700 k. J/kg _________ l) T= 1000°C u= 4045. 4 k. J/kg _________ m) x=0% T= 647. 3 K _________ n) P= 2 MPa s= 6. 4309 k. J/kg-K _________ o) P= 40 MPa h= 2512. 8 k. J/kg-K _________ p) P= 1. 6 MPa s= 8. 2808 k. J/kg-K _________

2. Determinar el valor de la propiedad indicada: a) Mercurio P= 2. 8 MPa hfg= 287. 54 k. J/kg v= _______ b) Freón 12 T= 60°C h= 225. 488 k. J/kg s= _______ c) Freón 12 T= -50°C v= 350 dm 3/kg s= _______ d) Freón 12 T= -30°C s= 0. 7165 k. J/kg-K x= _______ e) Freón 12 T= 30°C h= 209. 16 k. J/kg s= _______ f) Freón 12 P= 2. 0872 MPa sf= 0. 3851 k. J/kg-K vf= _______ g) Freón 12 T= 100°C h= 180 k. J/kg v= _______ h) Amoniaco T= 30°C P= 150 k. Pa h= _______ i) Amoniaco P= 246. 51 k. Pa v= 0. 4168 m 3/kg T= _______ j) Amoniaco T= 30°C v= 1. 68 cm 3/g s= _______ k) Amoniaco T= 40°C v= 1. 2107 m 3/kg h= _______ l) Amoniaco P= 1800 k. Pa s= 4. 9715 k. J/kg-K T= _______ m) Amoniaco P= 190. 22 k. Pa v= 0. 2168 m 3/kg T= _______

n) Oxígeno P= 0. 54339 MPa s= 3. 2823 k. J/kg-K T= _______ o) Oxígeno T= 225°C h= 204. 007 k. J/kg P= _______ p) Oxígeno P= 8 MPa v= 9. 351 dm 3/kg T= _______ q) H 2 O T= 124°C v= 0. 7933 m 3/kg P= _______ r) H 2 O T= 260°C u= 1470. 6 k. J/kg P= _______ s) H 2 O P= 7 MPa T= 300°C s= _______

3. Determinar el valor de la propiedad indicada y el nombre del estado correspondiente, si la sustancia es agua: a) T= 172. 96°C P=10 bar h=_______ ESTADO: ____ b) P= 200 k. Pa h=2706. 7 k. J/kg v=_______ ESTADO: ____ c) T= 250°C s=3. 2802 k. J/kg-K u=_______ ESTADO: ____ d) P= 1. 6 MPa v=0. 14184 m 3/kg T=_______ ESTADO: ____ e) P=30. 6 bar u=1009. 89 k. J/kg h=_______ ESTADO: ____ f) T=162°C h=2500 k. J/kg v=_______ ESTADO: ____ g) P=0. 5 MPa s=9. 4224 k. J/kg-K u=_______ ESTADO: ____ h) T=124°C v=0. 7933 m 3/kg P=_______ ESTADO: ____ I) T=300°C P=15 bar v=_______ ESTADO: ____ j) P=10 Mpa T=120°C h=_______ ESTADO: ____

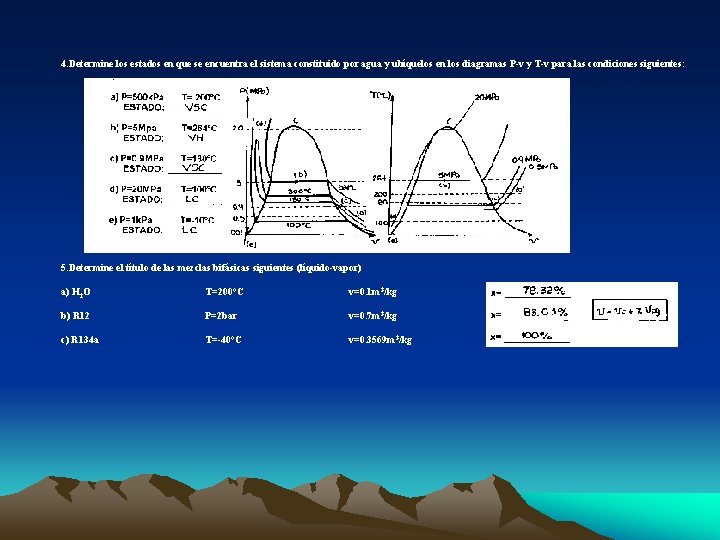
4. Determine los estados en que se encuentra el sistema constituido por agua y ubíquelos en los diagramas P-v y T-v para las condiciones siguientes: a) P=500 k. Pa T= 200°C ESTADO: ______ b) P=5 Mpa T=264°C ESTADO: ______ c) P=0. 9 MPa T=180°C ESTADO: ______ d) P=20 MPa T=100°C ESTADO: ______ e) P=1 k. Pa T=-10°C ESTADO: ______ 5. Determine el título de las mezclas bifásicas siguientes (líquido-vapor) a) H 2 O T=200°C v=0. 1 m 3/kg x= ______ b) R 12 P=2 bar v=0. 7 m 3/kg x= ______ c) R 134 a T=-40°C v=0. 3569 m 3/kg x= ______

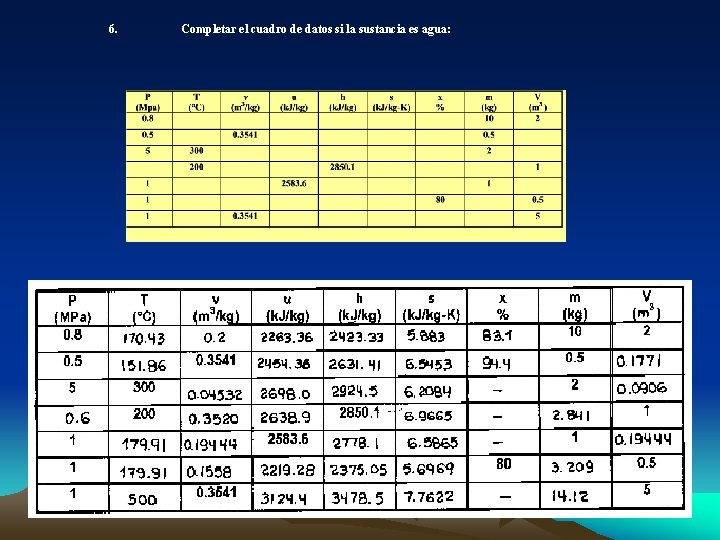
6. Completar el cuadro de datos si la sustancia es agua:

7. Para el Nitrógeno: Determine el título de 22 kg de mezcla bifásica líquido-vapor a 100 K en un tanque de 0. 5 m 3, sabiendo que: vf= 1. 452 10 -3 m 3/kg y vg=31. 31 10 -3 m 3/kg

8. Determine el volumen en m 3, ocupado por 2 kg de H 2 O a 4 MPa y 420°C.

9. Un recipiente cerrado de 0. 018 m 3, contiene 1. 2 kg de Freón 12 a 10 bar. Determine T, u, v, h, s, x.

10. Calcúlese el volumen en m 3, ocupados por 2 kg de una mezcla líquido-vapor de Freón 12 a – 10°C cuyo título es de 80%.

11. Una mezcla líquido-vapor de agua tiene una temperatura de 300°C y un título de 75%. La mezcla ocupa un volumen de 0. 05 m 3. Determine las masas de liquido y vapor de agua presentes en kg.

12. Vapor de agua sobrecalentado se encuentra a 460°C y 1. 25 MPa. Hallar: v, h y u.

13. Vapor de agua sobrecalentado se encuentra a 260°C y 4. 2 MPa. Hallar: v, h y u.

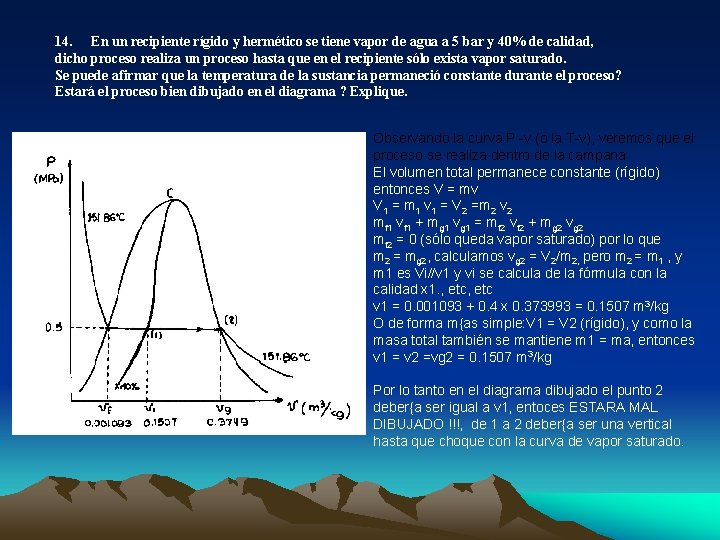
14. En un recipiente rígido y hermético se tiene vapor de agua a 5 bar y 40% de calidad, dicho proceso realiza un proceso hasta que en el recipiente sólo exista vapor saturado. Se puede afirmar que la temperatura de la sustancia permaneció constante durante el proceso? Estará el proceso bien dibujado en el diagrama ? Explique. Observando la curva P -v (o la T-v), veremos que el proceso se realiza dentro de la campana El volumen total permanece constante (rígido) entonces V = mv V 1 = m 1 v 1 = V 2 =m 2 v 2 mf 1 vf 1 + mg 1 vg 1 = mf 2 vf 2 + mg 2 vg 2 mf 2 = 0 (sólo queda vapor saturado) por lo que m 2 = mg 2, calculamos vg 2 = V 2/m 2, pero m 2 = m 1 , y m 1 es Vi//v 1 y vi se calcula de la fórmula con la calidad x 1. , etc v 1 = 0. 001093 + 0. 4 x 0. 373993 = 0. 1507 m 3/kg O de forma m{as simple: V 1 = V 2 (rígido), y como la masa total también se mantiene m 1 = ma, entonces v 1 = v 2 =vg 2 = 0. 1507 m 3/kg Por lo tanto en el diagrama dibujado el punto 2 deber{a ser igual a v 1, entoces ESTARA MAL DIBUJADO !!!, de 1 a 2 deber{a ser una vertical hasta que choque con la curva de vapor saturado.

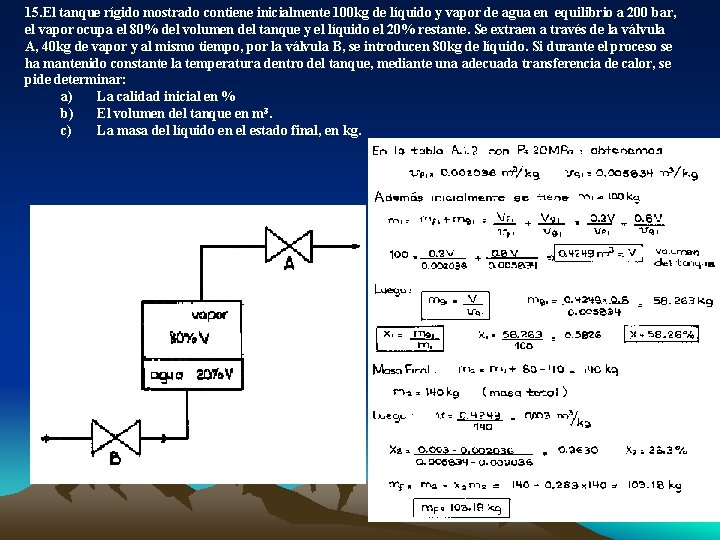
15. El tanque rígido mostrado contiene inicialmente 100 kg de líquido y vapor de agua en equilibrio a 200 bar, el vapor ocupa el 80% del volumen del tanque y el líquido el 20% restante. Se extraen a través de la válvula A, 40 kg de vapor y al mismo tiempo, por la válvula B, se introducen 80 kg de líquido. Si durante el proceso se ha mantenido constante la temperatura dentro del tanque, mediante una adecuada transferencia de calor, se pide determinar: a) La calidad inicial en % b) El volumen del tanque en m 3. c) La masa del líquido en el estado final, en kg.

16. En la figura mostrada el pistón es sin fricción y el resorte es perfectamente elástico cuya constante es de 306. 35 k. N /m. El agua se encuentra inicialmente a 110°C y 14. 32% de calidad. Se transfiere calor al agua hasta que la temperatura sea de 300°C. Si la masa de agua contenida en el recipiente es de 0. 5 kg, se pide: a) La presión del agua en el estado final, en k. Pa. b) La temperatura del agua en °C, en el instante en que el pistón alcance los topes. c) La temperatura del agua en °C en el instante en que exista sólo vapor saturado dentro del recipiente. d)Graficar los procesos en el diagrama P-v


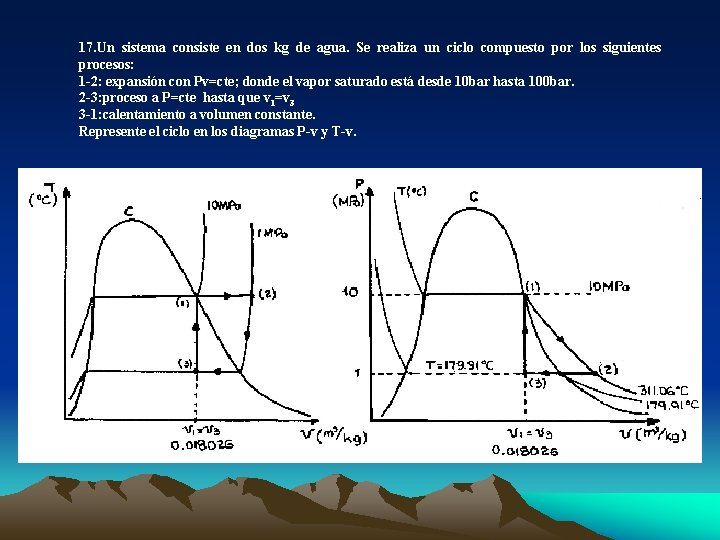
17. Un sistema consiste en dos kg de agua. Se realiza un ciclo compuesto por los siguientes procesos: 1 -2: expansión con Pv=cte; donde el vapor saturado está desde 10 bar hasta 100 bar. 2 -3: proceso a P=cte hasta que v 1=v 3 3 -1: calentamiento a volumen constante. Represente el ciclo en los diagramas P-v y T-v.

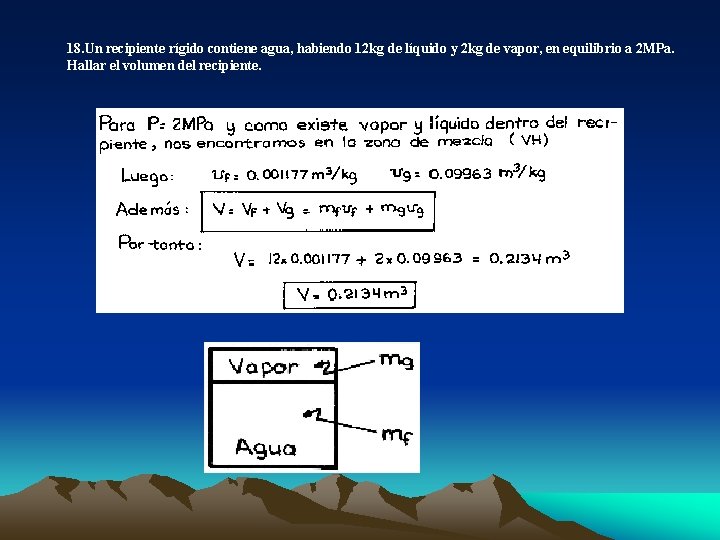
18. Un recipiente rígido contiene agua, habiendo 12 kg de líquido y 2 kg de vapor, en equilibrio a 2 MPa. Hallar el volumen del recipiente.

19. Un tanque de paredes rígidas contiene 300 kg de vapor y líquido de agua en equilibrio, a 280°C. En estas condiciones, el líquido ocupa el 70% del volumen del tanque. Cual es el volumen del tanque en m 3?

20. Se tiene agua en su punto triple, las masas se encuentran en las siguientes proporciones: 40% líquido, 58% sólido y 2% vapor. Calcule el volumen específico de la mezcla.

21. Un recipiente rígido de 5 m 3 contiene vapor y líquido de agua en equilibrio a 100 k. Pa y 70% de calidad. Se enfría el contenido del recipiente hasta – 10°C. Determine el volumen ocupado por el vapor a – 10°C.

22. Se tiene un cilindro rígido cuya base tiene 0. 2 m 2 de superficie. El cilindro contiene inicialmente líquido y vapor de agua en equilibrio a 360°C. Mediante una válvula colocada en la parte inferior del cilindro, se extrae líquido. Si durante el proceso la temperatura se mantiene constante y el nivel del líquido en el interior del tanque desciende 0. 3 m. Calcular la masa del líquido extraído en kg.

23. 5 kg de vapor saturado de agua a 400 k. Pa son expandidos hasta una presión de 75 k. Pa, de tal modo que su volumen final es 1. 2 veces su volumen inicial. Determine la masa de vapor que se ha condensado, en kg.

24. En el dispositivo mostrado se tiene 15 kg de agua ocupando inicialmente un volumen de 2. 07 m 3 a una presión de 100 k. Pa. Se transfiere calor al agua hasta que esta alcanza una presión de 1 MPa. Si la presión necesaria para equilibrar el pistón es de 150 k. Pa, se pide: a)El volumen específico del agua cuando el pistón choca con el tope superior. b)La presión de saturación en el instante en que el agua se encuentra como vapor saturado. c)La temperatura final del agua. d)Graficar los procesos en los diagramas P-v, P-T y v-T.


25. Dentro de un cilindro cerrado por un pistón sin fricción de 0. 2 m 2 de sección, se tienen 10 kg de agua en estado de líquido saturado a 0. 15 MPa. se transfiere calor al agua hasta que dentro del cilindro exista únicamente vapor saturado. Para este proceso se pide: a)Calcular la calidad, si es vapor húmedo y la temperatura si es VSC, en el instante en que el pistón toque el tope superior. b)Calcular la presión final del vapor en k. Pa. c)Trazar los procesos en los diagramas P-v y T-v.


26. Considere el sistema cilindro-pistón sin fricción mostrado en la figura. El área de la sección transversal del pistón es 0. 2 m 2. Inicialmente el pistón descansa sobre el tope inferior del cilindro. Se sabe que la presión atmosférica es de 100 k. Pa y que el peso del pistón es de 20 k. N. Se transfiere energía al agua contenida en el cilindro, hasta que la presión sea de 8 MPa. Cuando el pistón toca el resorte el agua ocupa un volumen de 0. 0747 m 3. Si el cilindro contiene inicialmente 4 kg de líquido saturado a 35°C, se pide: a) La temperatura final del agua. b) La altura que se eleva el pistón. c) La ecuación del proceso durante el cual actúa el resorte, P = f(v). d) Graficar el proceso o procesos en el diagrama P-v. Constante del resorte: 4 MN/m

 Sustancias
Sustancias Ingravida definicion
Ingravida definicion Diagrama p-t de una sustancia pura
Diagrama p-t de una sustancia pura Cambios de fase
Cambios de fase Cobre sustancia
Cobre sustancia Https://slidetodoc.com/captulo-2-o-sudeste-e-o-sul-do/
Https://slidetodoc.com/captulo-2-o-sudeste-e-o-sul-do/ Conceito de judaismo
Conceito de judaismo Superficie p-v-t
Superficie p-v-t Pv/t = pv/t units
Pv/t = pv/t units Que diferencia hay entre filosofia y ciencia
Que diferencia hay entre filosofia y ciencia Enzimas introducción
Enzimas introducción Introduccin
Introduccin Introduccin
Introduccin Introduccin
Introduccin Induccin
Induccin Como se llama esta
Como se llama esta Cono axonico
Cono axonico Medula osea roja funcion
Medula osea roja funcion Sustancia
Sustancia Es una sustancia blanda untuosa de color negro brillante
Es una sustancia blanda untuosa de color negro brillante Tracto espinotalamico anterior
Tracto espinotalamico anterior Demcrito
Demcrito Neurona
Neurona Tejido cartilaginoso
Tejido cartilaginoso Tejido sanguineo
Tejido sanguineo Sustancia simple molecular
Sustancia simple molecular Sustancia cromatofilica
Sustancia cromatofilica Sustancia de nissl
Sustancia de nissl Sustancia líquida sin olor color ni sabor
Sustancia líquida sin olor color ni sabor Sustancia blanca y gris
Sustancia blanca y gris Polarimetro funcionamiento
Polarimetro funcionamiento Sustancia de dios
Sustancia de dios Sustancia polar y no polar
Sustancia polar y no polar Ventajas de la corriente alterna
Ventajas de la corriente alterna Come si risolve equazione pura
Come si risolve equazione pura Equazione pur
Equazione pur Venta conjunta pura
Venta conjunta pura Generacion del 27 contexto historico
Generacion del 27 contexto historico Carta sostanza pura o miscuglio
Carta sostanza pura o miscuglio Poesía negra ejemplos
Poesía negra ejemplos Copetes de noticias
Copetes de noticias Pura qleen
Pura qleen Colangiolos
Colangiolos Hemiparesia motora pura
Hemiparesia motora pura Schema critica della ragion pura
Schema critica della ragion pura Uma joia de prata pura homogenea e maciça
Uma joia de prata pura homogenea e maciça Curva di raffreddamento zanichelli
Curva di raffreddamento zanichelli Ufg um determinado volume de agua foi colocado
Ufg um determinado volume de agua foi colocado Esempio equazione spuria
Esempio equazione spuria Schema riassuntivo kant
Schema riassuntivo kant Noumeno kant
Noumeno kant Pura connectivity
Pura connectivity Esempio equazione spuria
Esempio equazione spuria Apele naturale
Apele naturale Juan ramon jimenez poesia pura
Juan ramon jimenez poesia pura Substancias puras e simples
Substancias puras e simples Momento fletor e força cortante
Momento fletor e força cortante Pura visibilità
Pura visibilità Brenda paola cano
Brenda paola cano Vino primero pura vestida de inocencia
Vino primero pura vestida de inocencia Condensação
Condensação Equazione di secondo grado spuria
Equazione di secondo grado spuria