TERMODINMICA UNIDAD 2 PROPIEDADES DE UNA SUSTANCIA PURA










- Slides: 25

TERMODINÁMICA UNIDAD 2: PROPIEDADES DE UNA SUSTANCIA PURA, SIMPLE Y COMPRESIBLE. PARTE A

Indice temático • • Definición de sustancia pura, simple y compresible Estados de la materia. Termodinámica macroscópica y/o microscópica Fases Transiciones de fase. Superficie de estado. Digrama de fases P-v, T-v y P-T Tablas de saturación. Aclaración: los recuadros en color amarillo contienen preguntas, planteos, experiencias que se recomiendan contestar y/o hacer para un mayor entendimiento del tema.

SUSTANCIA PURA SIMPLE COMPRESIBLE Composición química única Tiene compresibilidad no nula. (no tiene que estar formada por un solo elemento o compuesto químico, Ej: aire ) Responde a un aumento de la presión externa reduciendo su volumen específico. Postulado de estado para sustancias simples P = P(T, v) E = E(T, v)

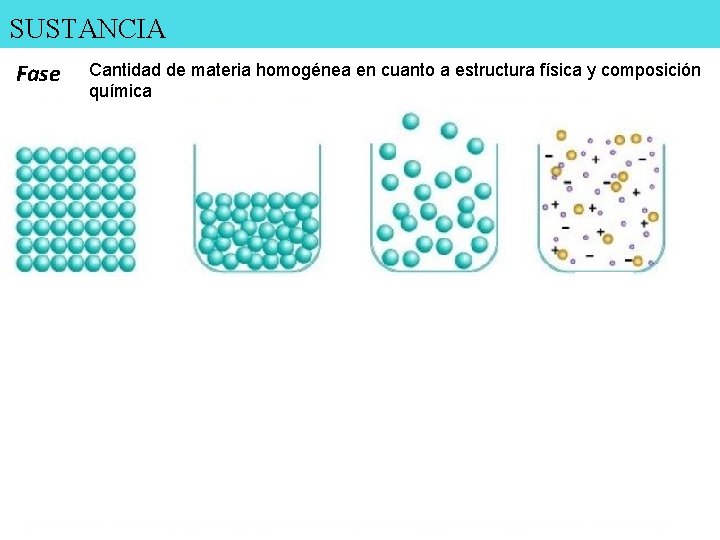
SUSTANCIA Fase Cantidad de materia homogénea en cuanto a estructura física y composición química

MACROSCÓPICO O MICROSCÓPICO Los sistemas pueden ser estudiados desde un punto de vista macroscópico o microscópico. El estudio macroscópico, llamado a veces termodinámica clásica, estudia al sistema como un todo. A pesar que el comportamiento del mismo es afectado por la estructura molecular de la materia, la termodinámica clásica permite evaluar las propiedades generales desde la observación del sistema total. El punto de vista microscópico, es conocido con el nombre de termodinámica estadística. Está relacionado directamente con la estructura de la materia y su objetivo es caracterizar estadísticamente el comportamiento medio de las partículas y relacionar esa información con el comportamiento macroscópico del sistema. Una gran variedad de las aplicaciones de la termodinámica en la ingeniería pueden ser estudiadas desde el punto de vista macroscópico, y esa es la visión que se utilizará en la cátedra. Sin embargo, para el estudio de los cambios de fase es muy esclarecedor tener presente la composición molecular de la materia. El texto “Cambio de Fases” tiene el objetivo de hacer un paréntesis en el tratamiento del sistema como un todo y mirar un poco más de cerca… Como ayuda se sugiere abrir la simulación http: //web. visionlearning. com/custom/chemistry/animations/CHE 1. 1 -an-threestates. shtml

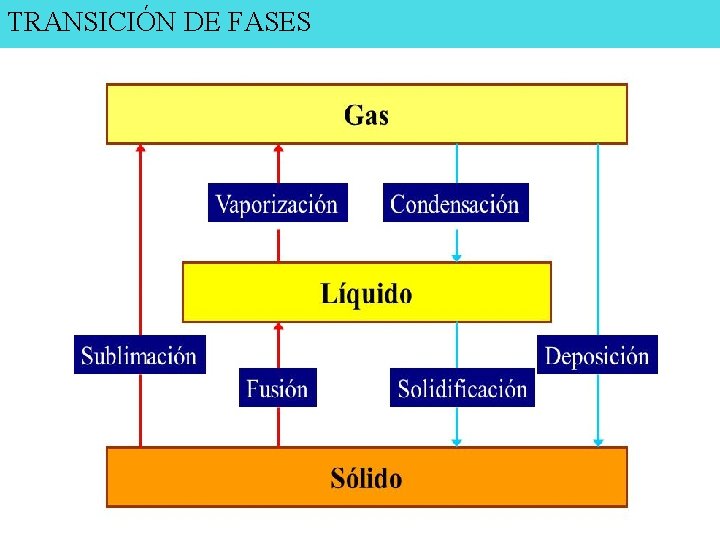
TRANSICIÓN DE FASES

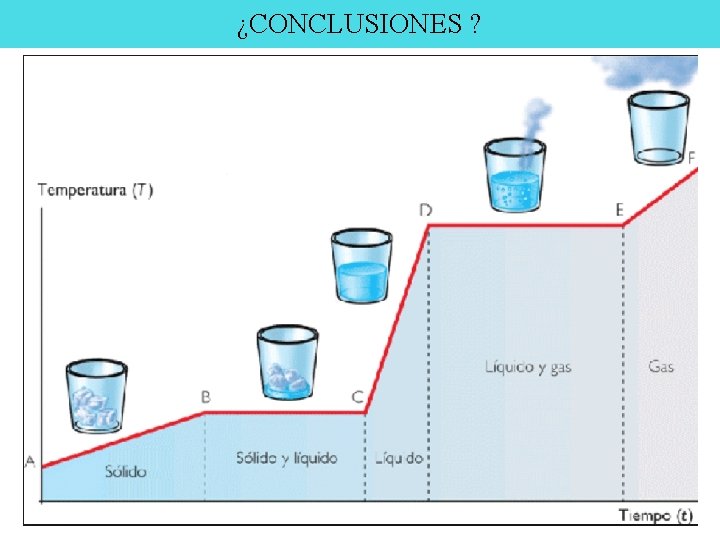
Actividad En base a lo que observa en la animación: http: //concurso. cnice. mec. es/cnice 2005/93_iniciacion_interactiva_materia/curso/material es/estados/cambios. htm Responder: ¿Cuál es la presión de la sustancia en el estado inicial? ¿Qué sucede cuándo se le comienza a entregar calor? ¿Cuál es el estado de la sustancia cuando la temperatura varía entre 0 y 100 o. C? ¿Cuál es el estado de la sustancia cuando la temperatura supera los 100 o. C? ¿Cuál es la presión de la sustancia en el estado final? ¿Cuál es la variación de la presión durante el proceso completo? Realizar un diagrama Temperatura vs tiempo que describa el proceso.

¿CONCLUSIONES ?

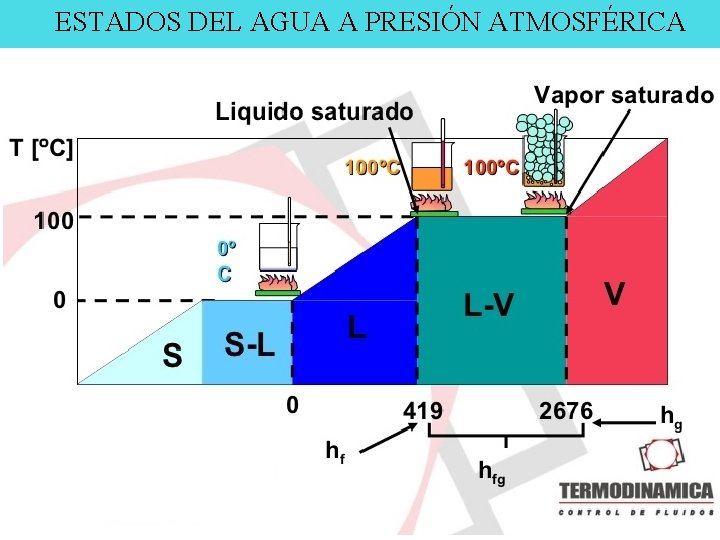
ESTADOS DEL AGUA A PRESIÓN ATMOSFÉRICA

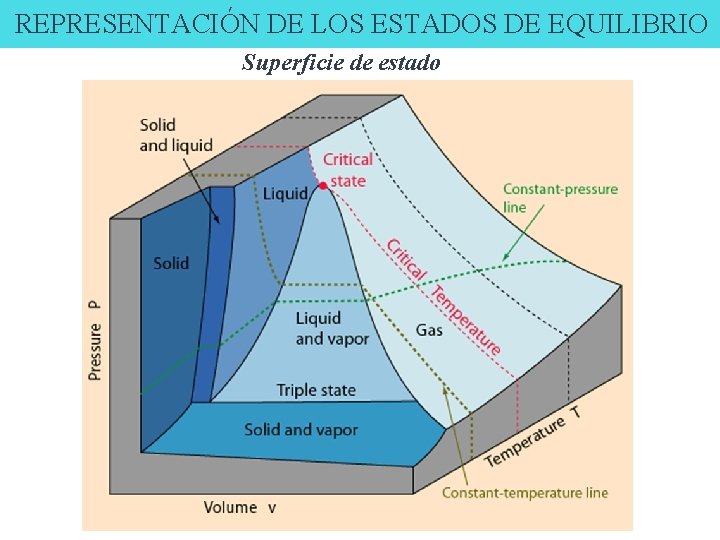
REPRESENTACIÓN DE LOS ESTADOS DE EQUILIBRIO Superficie de estado

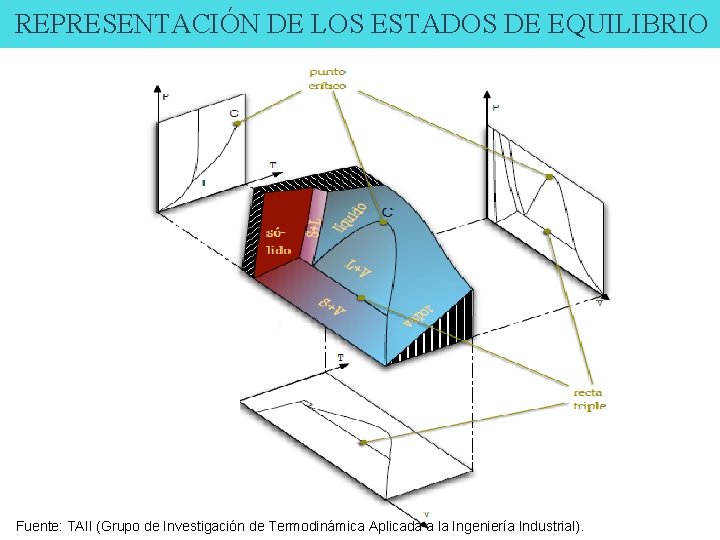
REPRESENTACIÓN DE LOS ESTADOS DE EQUILIBRIO Fuente: TAII (Grupo de Investigación de Termodinámica Aplicada a la Ingeniería Industrial).

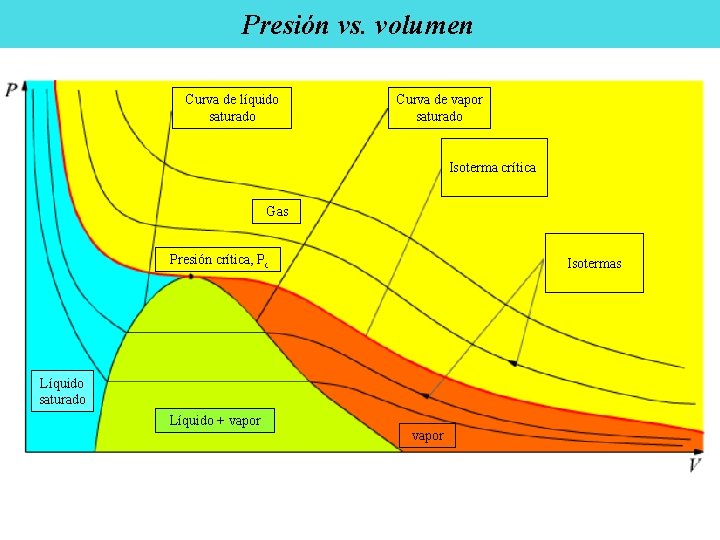
Presión vs. volumen Curva de líquido saturado Curva de vapor saturado Isoterma crítica Gas Presión crítica, Pc Isotermas Líquido saturado Líquido + vapor

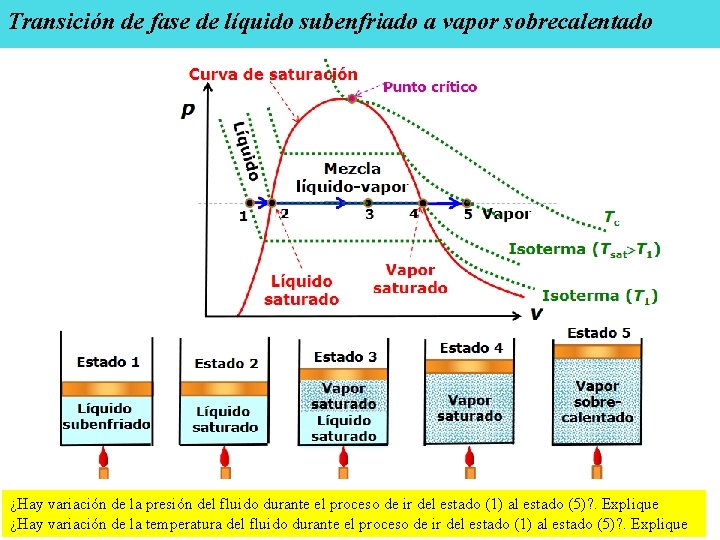
Transición de fase de líquido subenfriado a vapor sobrecalentado ¿Hay variación de la presión del fluido durante el proceso de ir del estado (1) al estado (5)? . Explique ¿Hay variación de la temperatura del fluido durante el proceso de ir del estado (1) al estado (5)? . Explique

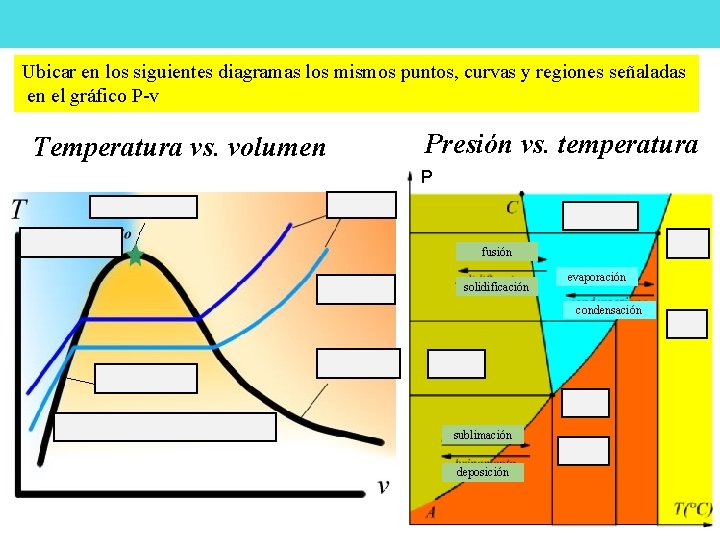
Ubicar en los siguientes diagramas los mismos puntos, curvas y regiones señaladas en el gráfico P-v Temperatura vs. volumen Presión vs. temperatura P fusión solidificación evaporación condensación sublimación deposición

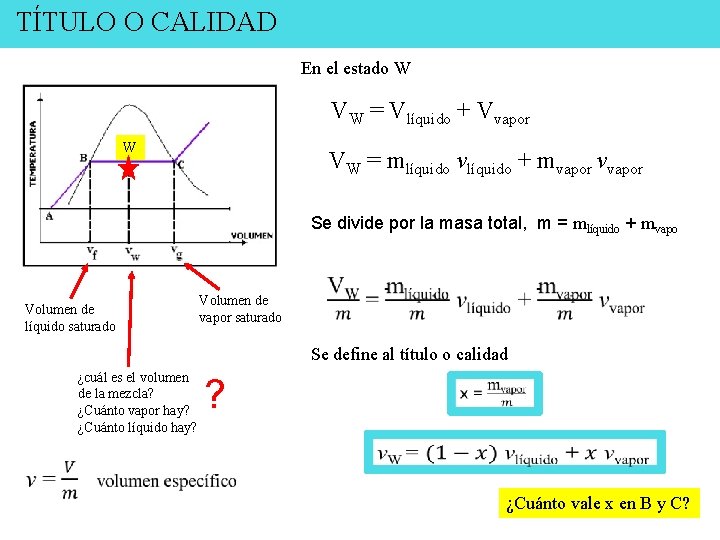
TÍTULO O CALIDAD En el estado W VW = Vlíquido + Vvapor W VW = mlíquido vlíquido + mvapor vvapor Se divide por la masa total, m = mlíquido + mvapo Volumen de líquido saturado Volumen de vapor saturado Se define al título o calidad ¿cuál es el volumen de la mezcla? ¿Cuánto vapor hay? ¿Cuánto líquido hay? ? ¿Cuánto vale x en B y C?

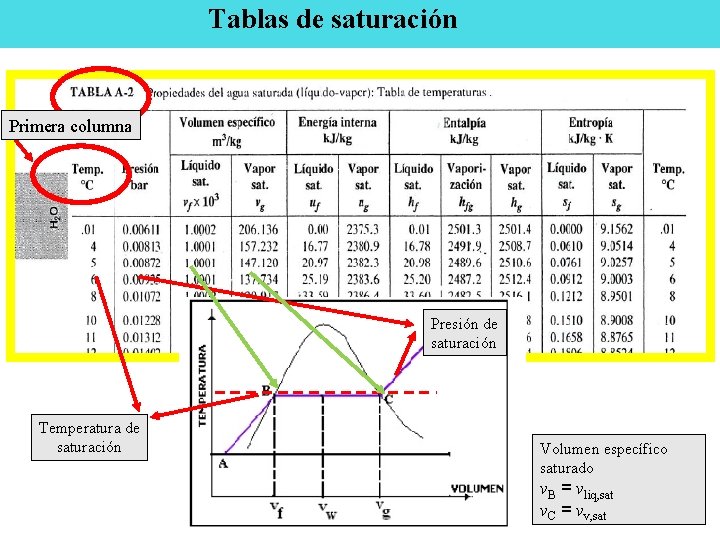
Tablas de saturación Primera columna Presión de saturación Temperatura de saturación Volumen específico saturado v. B = vliq, sat v. C = vv, sat

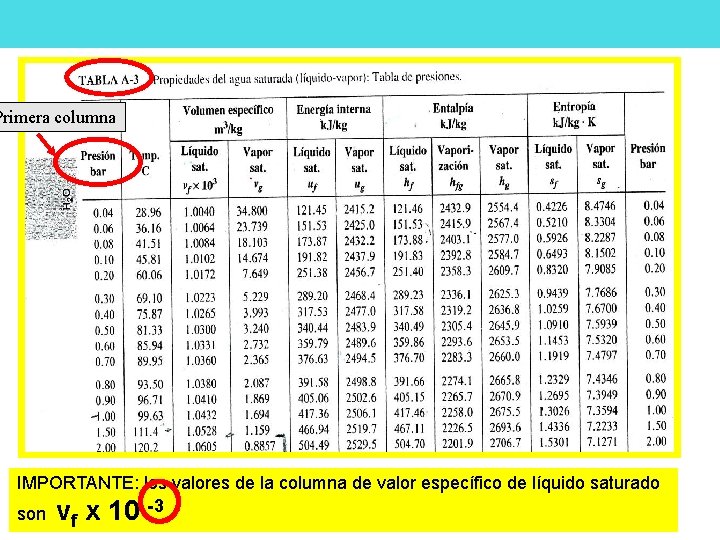
Primera columna IMPORTANTE: los valores de la columna de valor específico de líquido saturado son vf x 10 -3



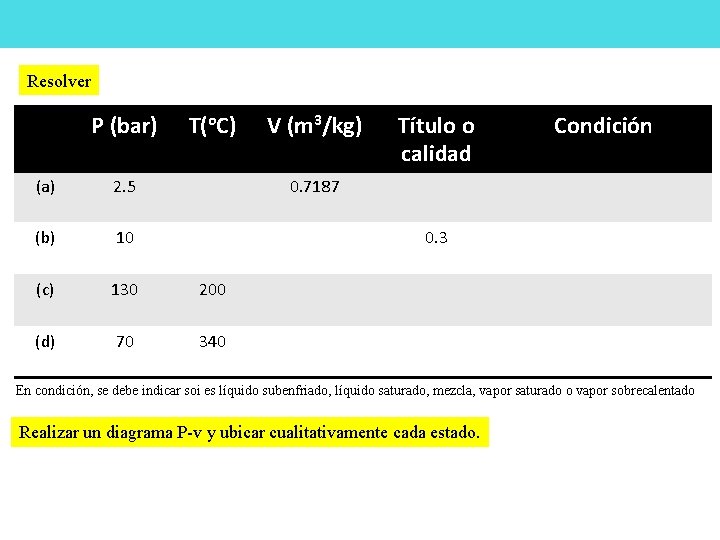
Resolver P (bar) T(o. C) (a) 2. 5 (b) 10 (c) 130 200 (d) 70 340 V (m 3/kg) Título o calidad Condición 0. 7187 0. 3 En condición, se debe indicar soi es líquido subenfriado, líquido saturado, mezcla, vapor saturado o vapor sobrecalentado Realizar un diagrama P-v y ubicar cualitativamente cada estado.

¿Qué es vapor saturado? ¿Qué es líquido saturado?

Problema 1: La presión atmosférica promedio en cierta ciudad (altura 1610 m) es 83. 4 k. Pa. Determinar la temperatura a la que el agua en una cacerola descubierta hervirá en dicha ciudad Problema 2: Un dispositivo de cilindro-émbolo contiene 0. 005 m 3 de agua líquida y 0. 9 m 3 de vapor de agua, en equilibrio a 600 k. Pa. Se transmite calor a presión constante, hasta que la temperatura llega a 200 °C. a) ¿Cuál es la temperatura inicial del agua? b) Calcule la masa total de agua. c) Calcule el volumen final. d) Indique el proceso en un diagrama P-v con respecto a las líneas de saturación. Problema 3: Un recipiente rígido con un volumen de 2. 5 m 3 contiene 15 kg de una mezcla saturada líquido-vapor de agua a 75 o. C. El agua se calienta lentamente. Determinar la temperatura a la que el líquido en el recipiente se evapora por completo y mostrar el proceso en un diagrama P-v

¿Cuál es el punto de ebullición del agua? El agua hierve a 100 o. C a 1 atm de presión ¿Cuál es la respuesta correcta ?

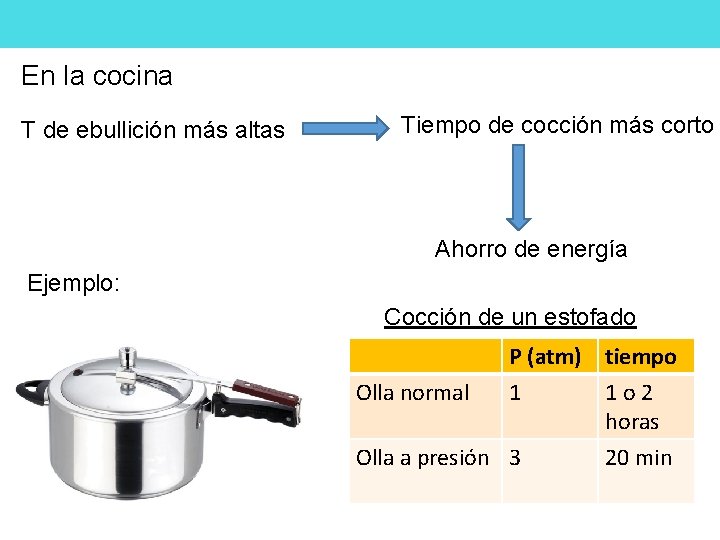
En la cocina T de ebullición más altas Tiempo de cocción más corto Ahorro de energía Ejemplo: Cocción de un estofado P (atm) tiempo Olla normal 1 Olla a presión 3 1 o 2 horas 20 min

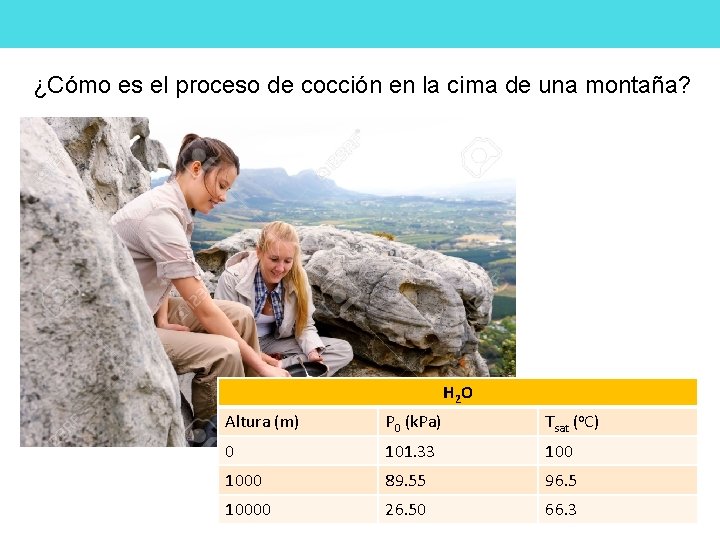
¿Cómo es el proceso de cocción en la cima de una montaña? H 2 O Altura (m) P 0 (k. Pa) Tsat (o. C) 0 101. 33 1000 89. 55 96. 5 10000 26. 50 66. 3
 Sustancias puras
Sustancias puras Diagrama p-t de una sustancia pura
Diagrama p-t de una sustancia pura Diagrama p-t de una sustancia pura
Diagrama p-t de una sustancia pura Diagrama de fases de sustancias puras
Diagrama de fases de sustancias puras El lubricante es una sustancia pura
El lubricante es una sustancia pura El es una sustancia blanda untuosa de color negro brillante
El es una sustancia blanda untuosa de color negro brillante Unidad decena centena unidad de mil
Unidad decena centena unidad de mil Para que sirve la energía potencial
Para que sirve la energía potencial Equilibrio termodinamico
Equilibrio termodinamico Procesos termodinamicos
Procesos termodinamicos Ley de gay lussac
Ley de gay lussac Equilíbrio termico exemplo
Equilíbrio termico exemplo Termodinmica
Termodinmica 1 lei da termodinamica
1 lei da termodinamica Termodinmica
Termodinmica Termodinmica
Termodinmica 2 principio della termodinamica formula
2 principio della termodinamica formula Termodinmica
Termodinmica Calor latente del aluminio
Calor latente del aluminio Teoria cinetico molecolare zanichelli
Teoria cinetico molecolare zanichelli Come risolvere equazione pura
Come risolvere equazione pura Curva di riscaldamento zanichelli
Curva di riscaldamento zanichelli Carta sostanza pura o miscuglio
Carta sostanza pura o miscuglio Sustancia puras elementos
Sustancia puras elementos Cromatolisis retrógrada y degeneración walleriana
Cromatolisis retrógrada y degeneración walleriana Sustancia de nissl
Sustancia de nissl