UNIVERSIDAD NACIONAL DE ASUNCIN FACULTAD DE CIENCIAS QUMICAS








































































- Slides: 80

UNIVERSIDAD NACIONAL DE ASUNCIÓN FACULTAD DE CIENCIAS QUÍMICAS CÁTEDRA DE INMUNOLOGÍA CLÍNICA UNIDAD TEMÁTICA: INMUNOLOGÍA DE LOS PROCESOS INFECCIOSOS

OBJETIVOS Conocer los aspectos básicos de las infecciones Identificar y caracterizar los mecanismos propios de la inmunidad innata y adaptativa que median la defensa frente a las infecciones. Comprender los conceptos centrales vinculados a la inmunidad antimicrobiana Conocer los diferentes mecanismos que utilizan los microorganismos para evadir el ataque del sistema inmunitario

CONTENIDOS � 5. 3 Respuesta inmune frente a las infecciones virales. 1. Plasticidad de la respuesta en función de las características del virus. 2. Respuestas inductoras y efectoras. Protección a largo plazo. 3. Mecanismos de evasión inmune.

INTRODUCCIÓN �LAS INFECCIONES VIRALES TIENEN UN GRAN IMPACTO EN LA SALUD HUMANA. �Las infecciones del tracto respiratorio y las gastroenteritis virales se encuentran en las enfermedades infecciosas de mayor incidencia. �Otros virus causan anomalías congénitas, como virus de la rubéola y el citomegalovirus. Asimismo, se han identificado virus asociados con el desarrollo de tumores, a veces malignos, como ocurre con el papiloma y ciertos retrovirus.

�Las hepatitis virales son infecciones frecuentes y actualmente, la pandemia del SIDA afecta a millones de personas. �Para la mayoría de las enfermedades de origen viral no se dispone de tratamiento específico debido a las estrategias de replicación, porque utilizan componentes de la célula que infectan.

�Cuando se produce una infección viral, el sistema inmunitario del hospedador pone en juego diversos mecanismos capaces de eliminar a estos microorganismos. Los virus, a su vez utilizan diversas estrategias con el objeto de evadir la respuesta inmunitaria, replicarse y finalmente transmitirse a otros individuos.

EL DAÑO CAUSADO POR LOS VIRUS �Los virus pueden inducir diferentes efectos sobre las células que infectan, aún cuando no se repliquen. �El daño celular puede ser inducido por el propio virus o por el sistema inmune en respuesta a la infección.

MECANISMOS DE DAÑO DIRECTO �Involucran la alteración de procesos celulares esenciales como: �Síntesis de proteínas �Síntesis de DNA-RNA y transporte vesicular �Inducción o inhibición de la apoptosis �Inducción de alteraciones en la permeabilidad de la membrana celular Grandes cantidades de componentes virales que se acumulan en la célula en los últimos estadios del ciclo de replicación, sobre todo los componentes de las cápside, suelen resultar tóxicos para la célula.

MECANISMOS DE DAÑO INDIRECTO Están mediados por la acción de: �Células TCD 8: virus de la hepatitis B y C �Células TCD 4: virus del sarampión �Anticuerpos: virus del dengue

MODELOS DE INFECCIÓN VIRAL Para poder persistir en la naturaleza, los virus deben infectar un huésped y multiplicarse hasta alcanzar niveles suficientes en órganos o secreciones que permitan su transmisión posterior. Las infecciones virales pueden cursar de dos formas: �Aguda �Persistente

INFECCIONES PERSISTENTES �Crónicas: producción continua de virus. Ej Virus de la Hepatitis B �Latentes: el virus es producido intermitentemente. Ej. Herpes virus �Lentas: se caracteriza por un largo período transcurrido entre el contacto inicial con el virus hasta la aparición de síntomas. Ej virus del sarampión �Transformantes: alteran los mecanismos que regulan el crecimiento celular. Ej virus del papiloma

Inmunidad Innata �El primer paso en el desarrollo de la respuesta inmunitaria antiviral es el reconocimiento de componentes virales por la inmunidad innata mediante RRP. �Este reconocimiento temprano pone en marcha un conjunto de respuestas, entre las que se destacan…

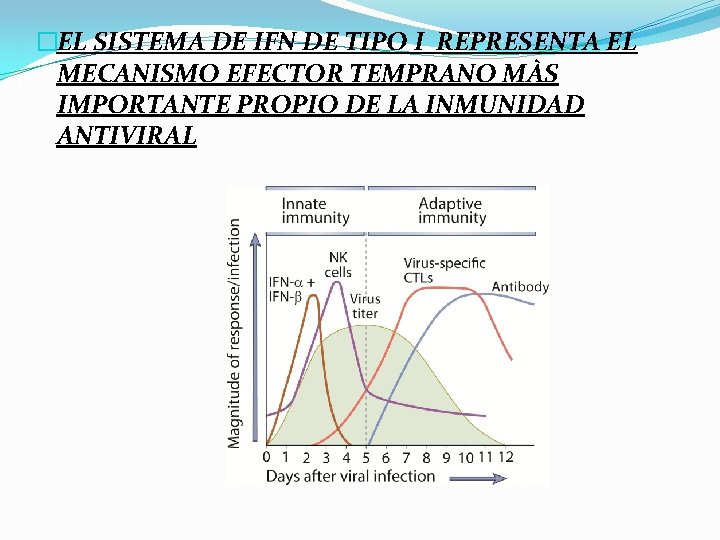
Interferones de tipo I �Activan cientos de genes que inhiben la replicación viral y ejercen mecanismos inmunorreguladores �Son producidos luego del reconocimiento de moléculas virales en el citosol o en el compartimiento endosómico y actúan de forma autocrina y paracrina induciendo la activación de genes antivirales.

�La producción de estos genes inhiben la replicación viral, inducen la apoptosis de las células infectadas y pueden modular la respuesta inmune adaptativa

�EL SISTEMA DE IFN DE TIPO I REPRESENTA EL MECANISMO EFECTOR TEMPRANO MÀS IMPORTANTE PROPIO DE LA INMUNIDAD ANTIVIRAL

�El reconocimiento de los virus por los RRP pone en marcha, además, la producción de citocinas proinflamatorias, las cuales reclutan células inmunitarias como las células dendríticas plasmocitoides, capaces de secretar enormes cantidades de IFN de tipo I y las células NK, capaces de inducir la apoptosis de las células infectadas. �Estos mecanismos efectores de la inmunidad innata no sólo intentaran contener las infecciones virales rápidamente; también modularán el curso de la respuesta adaptativa

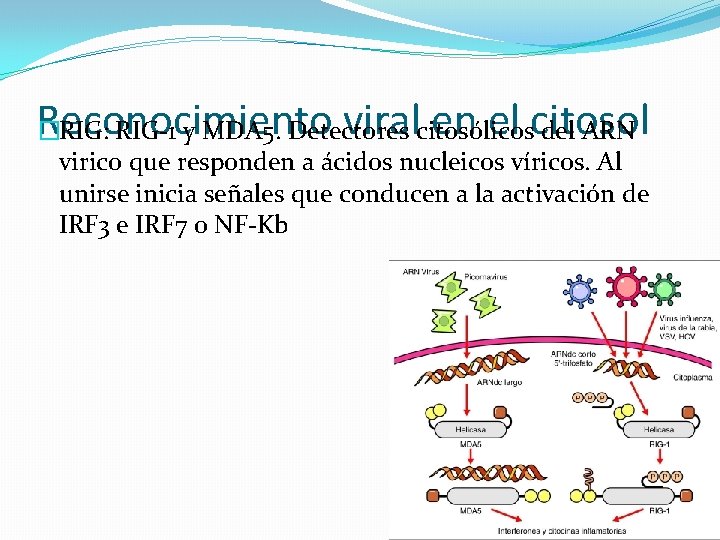
Reconocimiento viral por los RRP �La activación del sistema de los IFN de tipo I, la secreción de citocinas proinflamatorias con el consecuente reclutamiento de las células inmunitarias, la inducción de la endocitosis de virus por CDC y su maduración fenotípica y funcional, requieren el reconocimiento viral por los RRP. �Pueden ser reconocidos por células inmunitarias como no inmunitarias. �Los RPP se distribuyen en los diferentes compartimientos celulares: citosol, endosomas y membrana plasmática.

�La distribución le permite a cualquier célula infectada, reconocer PAMP virales mediante receptores citosólicos, mientras que las células inmunitarias son capaces, además , de activarse mediante receptores de membrana, luego del reconocimiento del virus en el espacio extracelular o mediante receptores endosómicos después de la endocitosis de las partículas virales.



Reconocimiento viralcitosólicos en el citosol �RIG: RIG-1 y MDA 5. Detectores del ARN virico que responden a ácidos nucleicos víricos. Al unirse inicia señales que conducen a la activación de IRF 3 e IRF 7 o NF-Kb

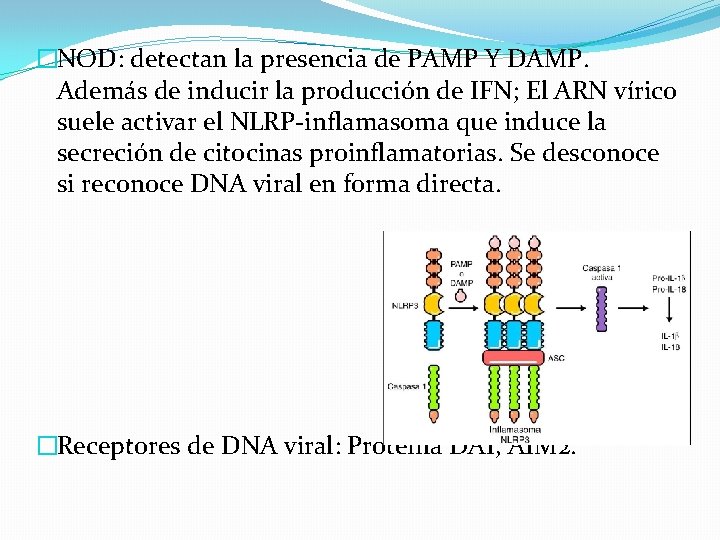
�NOD: detectan la presencia de PAMP Y DAMP. Además de inducir la producción de IFN; El ARN vírico suele activar el NLRP-inflamasoma que induce la secreción de citocinas proinflamatorias. Se desconoce si reconoce DNA viral en forma directa. �Receptores de DNA viral: Proteína DAI, AIM 2.

RECEPTORES DE TIPO TOLL �La mayoría de los virus atraviesan, el compartimiento endosómico de las células que infectan. �En consecuencia, existe un grupo de receptores en la membrana endosómica que reconocen la presencia de ácidos nucleícos virales: los receptores TLR 3, TLR 7 y TLR 9 �TLR 7 y TLR 9 se expresan el CDP e inducen la secreción de grandes cantidades de IFN tipo I luego del reconocimiento de Ac. Nucleicos virales


�TRL 3 se distribuye en forma más amplia que el resto. Se encuentra en CD, MQ, NK, Mastocitos y en células no hematopoyéticas. �Puede activarse luego de la endocitosis de virus con genomas compuestos por RNA bicatenario o células necróticas o apoptóticas infectadas. �No sólo induce la secreción de IFN tipo I en células dendríticas, sino también la maduración y favorece la presentación cruzada de antìgenos


RECEPTORES DE LECTINA TIPO C �Reconocen hidratos de carbono, su función principal es mediar la endocitosis de antígenos para que sean degradados en compartimientos lisosómicos y presentados a LT. �Se expresan mayormente en células dendríticas convencionales inmaduras y en los macrófagos �Algunos de estos son empleados por ciertos virus para infectar células y favorecer su diseminación (DC-SING)

CELULAS NATURAL KILLER �Cumplen un papel muy importante en la inmunidad antiviral. En los primeros momentos de la infección se extravasan al foco infeccioso, inducen a la apoptosis de las células infectadas y producen citocinas inflamatorias IFN-γ y TNF-α �Se activan por acción de citocinas inflamatorias o por el contacto con células infectadas, a través de un complejo juego que se establece entre receptores activadores e inhibidores expresados por la propia célula

MODULACION DE NK Y SU CAPACIDAD DE PRODUCIR IFN-γ �Se destaca la actividad estimuladora mediada por los IFN de tipo I, IL-12, IL-15 e IL-18. �La baja expresión de moléculas de MHC I convierte a las células infectadas en dianas o blancos de las NK. �Expresión de ligandos para receptores activadores de las células NK. �Aumento en la expresión de ligandos endógenos para receptores activadores.


CÉLULAS DENDRÍTICAS PLASMOCITOIDES �Son reclutadas en los tejidos infectados por virus donde mediante las secreción de grandes cantidades de IFN de tipo I, median una importante acción antiviral. �Se extravasan al tejido inflamado durante la infección viral y pueden activarse mediante el reconocimiento de ac. nucleicos virales, fundamentalmente TLR 7 Y TLR 9.

�Secretan IFN de tipo I entre 100 y 1000 veces más que la mayoría de las células infectadas y expresan en forma constitutiva altos niveles de IRF 7. �También producen TNF-β, IL-6 e IL-12, y quimiocinas inflamatorias. �Expresan RIG-1 y MDA-5 que reconocen intermediarios de RNA pero no desempeñan ningún papel en su activación.

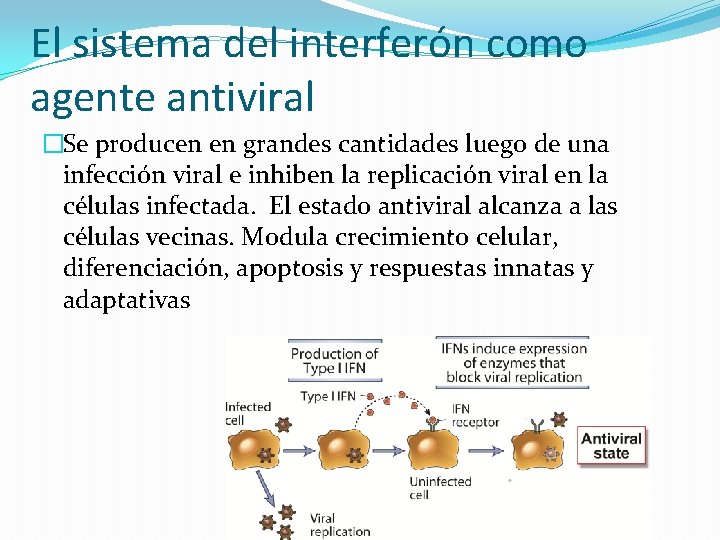
El sistema del interferón como agente antiviral �Se producen en grandes cantidades luego de una infección viral e inhiben la replicación viral en la células infectada. El estado antiviral alcanza a las células vecinas. Modula crecimiento celular, diferenciación, apoptosis y respuestas innatas y adaptativas

�IFN TIPO I: IFN-α, INF-β y otros como IFN-ϖ, IFN-ε, IFN-κ, IFN-τ, IFN-ο e IFN-δ. Median en forma directa una poderosa acción antiviral. �IFN TIPO II: IFN-γ se destaca en función de su capacidad de modular las respuesta innata y adaptativa y su capacidad de inducir la activación del macrófago. Es sintetizado por células NK, linfocitos TH 1 y T CD 8+

REGULACIÓN TRANSCRIPCIONAL DEL SISTEMA IFN (α/β) �Es inducida fundamentalmente, a través de dos familias de RRP: TLR y NOD. �TLR 3 reconoce RNA bicatenario e induce la transcripción de los promotores de IFN-β e incrementan la expresión de moléculas coestimulatorias CD 80 y CD 86, cambios que indican un proceso de maduración.

�TLR 7 reconoce RNA monocatenario y TLR 9 reconoce DNA que contiene motivos Cp. G no metilados inducen a los IFN (α/β) �TLR 4 expresado en la membrana reconoce proteinas de la envoltura de virus induce el promotor de IFN-β �TLR 2: necesario para la producción de IL-6 en respuesta a la hemaglutinina del virus del sarampión. El CMV también activa este receptor y dispara la producción de IL-6 e IL-8 en los macrófagos.

�El reconocimiento conduce al reclutamiento de moléculas adaptadoras con dominios TIR: My. D 88, TIRAP, TRAM, TRIF; que disparan una cascada de señales que dan lugar a la activación de NF-k. B, IRF-3 e IRF-7, los cuales promueven la activación del promotor de IFN-β y posibilitan su transcripción. �También puede ser activado por los RLR: RIG-1 y MDA 5 que activan a NF-k. B, IRF-3

�Entre los factores inducidos por RNA viral bicatenario. IRF-3 tendría un papel central. �El IRF-3 fosforilado se transloca al núcleo e interactúa con la proteína de unión a CREB y p 300 y forma un complejo llamado DRAF 1, que activa al promotor de IFN-β.

�Una vez producido el IFN-β interactúa con su receptor de membrana y desencadenan señales que conducen a la activación de un complejo formado por STAT 1/STAT 2/IRF-9 llamado factor génico 3 estimulado por interferón (ISGF 3) que induce a la expresión de IRF 7 por unión a secuencias específicas de DNA que contienen un motivo en común, el elemento de respuesta al IFN: ISRE


�El IRF 7 fosforilado, en forma similar al IRF 3 activa los promotores para los IFN (α/β) Este mecanismo de retroalimentación positiva permite la producción masiva de IFN de tipo I (α/β)


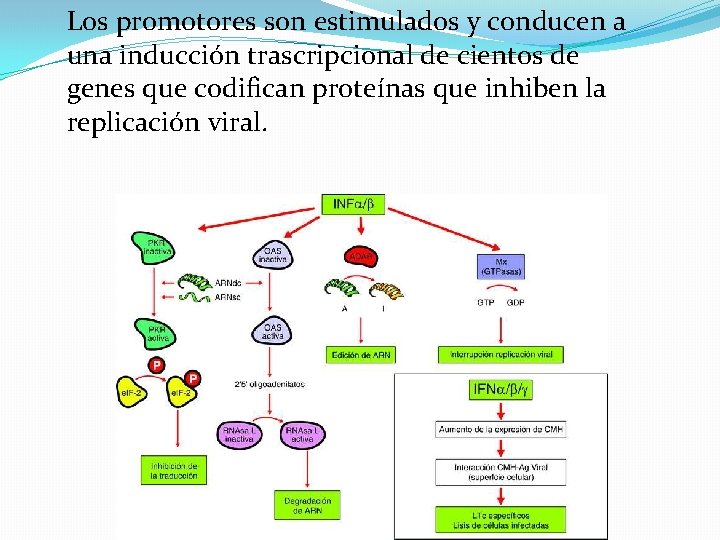
Transducción de señales y activación transcripcional de genes inducidos por IFN de tipo I �El INF-α y INF-β utilizan el mismo receptor IFNAR e interactúan con éste en la superficie de las células infectadas y en células vecinas. Los extremos citoplasmáticos de las subunidades del receptor están asociadas a tirosincinasas JAK. La unión produce la activación de estas cinasas, las cuales fosforilan los factores de transcripción STAT que luego se translocan al núcleo asociados con IRF 9 que se une a secuencias específicas de DNA que contienen un motivo común ISRE. Los promotores son estimulados y conducen a una inducción trascripcional de cientos de genes que codifican proteínas que inhiben la replicación viral.

Los promotores son estimulados y conducen a una inducción trascripcional de cientos de genes que codifican proteínas que inhiben la replicación viral.

� La activación de la PKR durante la infección viral, inducida principalmente por RNA de doble cadena, provoca la fosforilación e inactivación del factor de traducción e. IF 2α. � En consecuencia se produce el bloqueo de la síntesis de proteínas y la inhibición de la replicación viral. � Además puede conducir a la fosforilación de otros factores de transcripción. Lo que podría explicar la actividad proapoptótica de la PKR, actividad que puede contribuir a sus propiedades antivirales

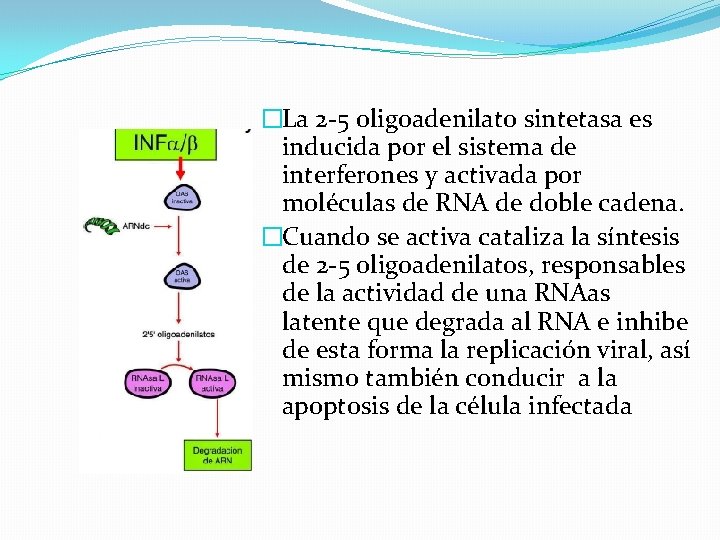
�La 2 -5 oligoadenilato sintetasa es inducida por el sistema de interferones y activada por moléculas de RNA de doble cadena. �Cuando se activa cataliza la síntesis de 2 -5 oligoadenilatos, responsables de la actividad de una RNAas latente que degrada al RNA e inhibe de esta forma la replicación viral, así mismo también conducir a la apoptosis de la célula infectada

�Otro de los genes inducidos transcripcionalmente por INF tipo I es el que codifica una adenosindesaminasa específica de RNA que edita el RNA y modifica las secuencias de RNA celular y viral, aumentando de este modo el número de proteínas mutadas en las células infectadas. �P 56 es un inhibidor de la traducción con capacidad para unirse al factor de iniciación de traducción.

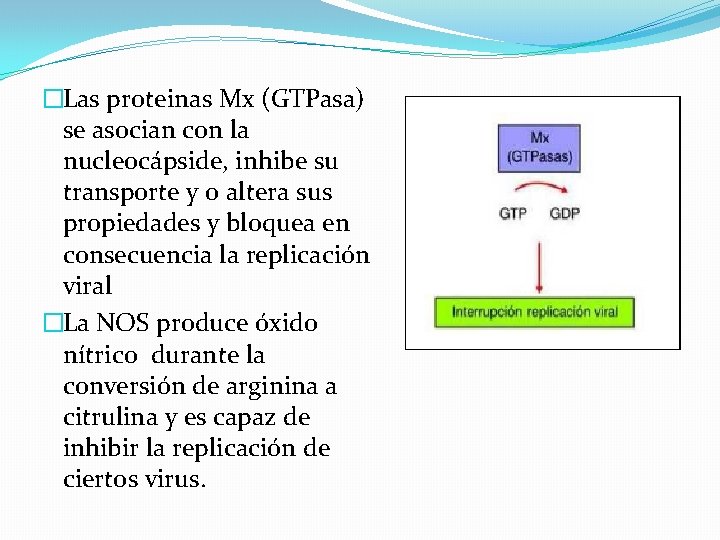
�Las proteinas Mx (GTPasa) se asocian con la nucleocápside, inhibe su transporte y o altera sus propiedades y bloquea en consecuencia la replicación viral �La NOS produce óxido nítrico durante la conversión de arginina a citrulina y es capaz de inhibir la replicación de ciertos virus.

MODULACIÓN DE LA FUNCIONALIDAD DE CELULAS INMUNES �La activación de células NK �La diferenciación de células TCD 4 en un perfil TH 1 �La activación de células TCD 8 citotóxicas �El incremento de la expresión de moléculas del MHC de clases I y II, facilitando la presentación antigénica a células T por CPA profesionales y no profesionales. �Memoria inmunitaria en las respuestas mediadas tanto por células T CD 4 como TCD 8

INMUNIDAD ADAPTATIVA �Mientras la inmunidad innata enfrenta al proceso infeccioso, comienza a generarse la respuesta adaptativa, llevada a cabo por linfocitos efectores y por plasmocitos productores de anticuerpos específicos. �Los componentes críticos de la inmunidad adaptativa en la respuesta antiviral son: 1. Linfocitos T citotóxicos 2. Anticuerpos neutralizantes

�Los LT CD 8 citotóxicos reconocen y eliminan células infectadas y además secretan citocinas con actividad inmunomoduladora y antiviral IFN-γ y TNF-α. La respuesta desempeña un papel crítico en la erradicación de infecciones virales.


�Los anticuerpos neutralizantes previenen la infección de las células diana y promueven la eliminación de las partículas virales desde los compartimientos extracelulares. �La presencia de anticuerpos neutralizantes es capaz de modificar el curso de una infección en su etapa temprana, e incluso de evitar que esta se produzca. �En infecciones persistentes, los anticuerpos neutralizantes contribuyen a la inmunidad antiviral eliminando en forma continua virus presentes en el compartimiento extracelular; de esta manera contienen el curso de infecciones.

Inicio dedendríticas la respuesta adaptativa �La células son las encargadas de iniciar la respuesta adaptativa mediante la captura, el procesamiento y la presentación de antígenos virales. �Luego de establecida la infección en un tejido periférico, las células dendríticas inmaduras son las encargadas de reconocer y capturar al virus, procesar sus proteínas, migrar a los ganglios linfáticos regionales y, ya como células dendríticas maduras, presentan sus péptidos antigénicos a través de moléculas MHC, a los linfocitos T.

INDUCCIÓN DE LA MADURACIÓN DE LAS CÉLULAS DENDRÍTICAS �Los virus pueden inducir la maduración de estas células de diferentes formas: 1. Infectándolas 2. Interactuando con receptores de la célula dendrítica 3. Induciendo la liberación de citocinas por células del tejido infectado, como los IFN de tipo I o el TNF-α


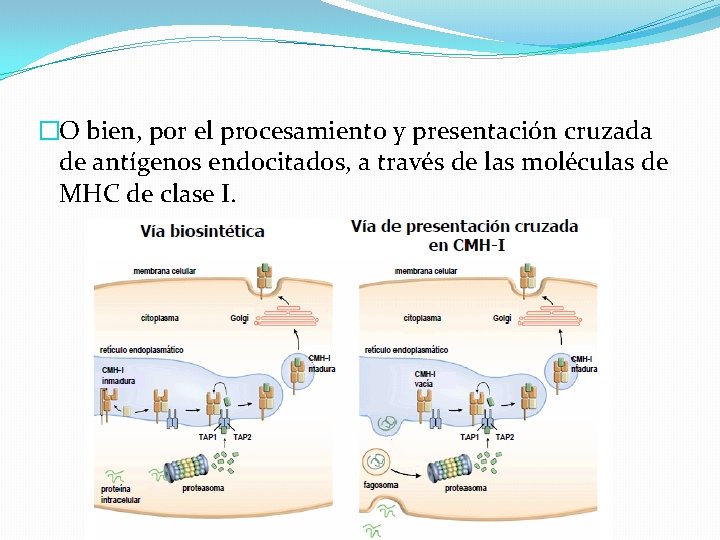
Procesamiento y presentación de antígenos virales �Se produce en los órganos linfáticos secundarios a los LT CD 8 y CD 4 por moléculas de MHC expresadas por CD maduras. �LTCD 4 específicos son activados por CD que han endocitado antígenos virales y los han procesado por la vía exógena. �La activación de LTCD 8 puede producirse en respuesta al procesamiento, por la vía endógena, de antígenos que se encuentran en el citosol de una CD infectada.

�O bien, por el procesamiento y presentación cruzada de antígenos endocitados, a través de las moléculas de MHC de clase I.

�Una vez que ingresan en el ganglio, las células dendríticas permanecen en el área paracortical y presentan los péptidos virales procesados. �En esta zona se produce el encuentro de las CD con los LTCD 8 vírgenes que arriban luego de extravasarse

ACTIVACION DE LTCD 8+ �Se produce por el reconocimiento de un péptido específico presentado por moléculas de clase I del MHC al TCR y por la interacción de las moléculas coestimulatorias con CD 28. �El tenor de coestimulación requerido es mayor que para una célula T CD 4+. En la mayoría de las infecciones virales este tenor es insuficiente por lo que requieren la interacción con las células T CD 4+ específicas, además ser necesaria para el desarrollo de células TCD 8+ de memoria.


MECANISMOS EFECTORES �SECRETORIO (granzimas y perforinas) �NO SECRETORIO (sistema Fas/Fas. L) �Conduce a la apoptosis de la célula infectada y a su rápida eliminación, junto con los virus contenidos en ella, por células fagocíticas profesionales o no.

�Se pueden mediar una acción antiviral sin inducir la muerte de células infectadas, mediante la producción de citocinas como el IFN-γ y TNF-α. �Estas citocinas facilitan el reclutamiento y la activación de macrófagos, células NK y linfocitos T y promueven el procesamiento y la presentación antigénica.

Respuesta mediada por LB �Los anticuerpos neutralizantes desempeñan un papel crítico en la respuesta inmune antiviral que el huésped desarrolla a lo largo del curso natural de la infección. �Los antígenos virales en su forma nativa, son reconocidos por el BCR de los linfocitos B vírgenes en los órganos linfoides secundarios.

�Los linfocitos B activados o se expanden clonalmente, se diferencian en plasmocitos y comienzan a producir Ig. M específica, o participan en la formación del centro germinal que permite la maduración de afinidad, cambio de isotipo, diferenciación de plasmocitos de vida media larga y la generación de memoria inmunitaria que son dependientes de la colaboración de linfocitos TH 2.

La neutralización es la función efectora más importante de los anticuerpos en la respuesta antiviral �Algunos anticuerpos pueden unirse al virus de forma tal que impiden la infección de células susceptibles y, por lo tanto, la producción de progenie viral. Este proceso se denomina neutralización y es el mayor aporte de los anticuerpos a la inmunidad antiviral. �Los diferentes mecanismos de acción de los anticuerpos neutralizantes son los siguientes: .

1. El bloqueo de la interacción de un receptor celular con su ligando viral. 2. El bloqueo de la interacción contra el ligando que expresa el virus para la molécula receptora que sirve para fusionar ambas membranas. 3. Retraso o impedimento del ingreso del virus en el citosol lo que conduce a la degradación en el compartimiento lisosómico. 4. Inducción a la fagocitosis del virus y su ingreso al compartimiento endosómico mediante interacciones entre los fragmentos Fc y sus receptores de membrana.

�Los anticuerpos Ig. G pueden mediar la citotoxicidad celular dependiente de anticuerpos CCDA contra las células infectadas. �Las células efectoras más importantes están representadas por cel. NK, MQ y PMN. �Ig. M o Ig. G asociados a los antígenos virales activan la vía clásica del complemento y la inducción de la respuesta inflamatoria en el tejido infectado �Ig. G puede activar a los MQ induciendo la producción de citocinas inflamatorias.

Mecanismos de evasión de la respuesta inmune antiviral �Interferencia en la actividad mediada por citocinas �Inhibición de la actividad de las células NK �Interferencia en la expresión y función de las moléculas de MHC �Modulación de la apoptosis por productos virales �Variación antigénica

INTERFERENCIA EN LA ACTIVIDAD MEDIADA POR CITOCINAS Evasión del sistema IFN: Producción de proteínas homólogas al receptor de los interferones IFN tipo I, Inhibición de las vías de señalización Producción de antagonistas de producto de genes inducidos por los IFN de tipo I Interferencia con otras citocinas: Inhibición de la producción de citocinas, Producción de proteínas homólogas de receptores de citocinas, Producción de proteínas homólogas de citocinas


Inhibición de la actividad de NK: Producción de proteína homólogas a moléculas de MHC de clase I Interferencia en la expresión y función de las moléculas del MHC 1. Modulación de la expresión de MHC de clase I: Inhibición de la expresión de moléculas de clase I Interferencia en la función del complejo transportador TAP 1/2 2. Modulación de la expresión de las moléculas de clase II e interferencia en la vía endocítica.


Modulación de la apoptosis por productos virales �Inhibición de los receptores de muerte: FAS, TNFR 1. �Inhibidores de caspasas �Homólogos de BCL-2 �La inhibiciòn de la apoptosis no es una estrategia de elección para la supervivencia de todos los virus. Diferentes virus inducen la apoptosis en particular de las células que median la inmunidad antiviral

Variación antigénica �Los virus pueden mutar las secuencias que codifican los epítopos reconocidos por las células T. �La pérdida de estos epítopos hacen que las células efectoras y de memoria generadas en la infección primaria no reconozcan a las nuevas variantes virales. �También pueden mutar epítopos reconocidos por célula B, lo que lleva a que los anticuerpos ya producidos sea incapaces de reconocer a los que originalmente indujeron la activación B


VARIACIONES ANTIGÉNICAS Mutación de secuencias que codifican epítopos reconocidos por células T Reasociación de segmentos de distintos luego de una coinfección Recombinación ESTRATEGIAS DE EVASION DEL COMPLEMENTO Proteínas análogas a los RFcy Proteínas reguladoras Utilización de C 3 b facilita la infección de macrófagos

INFECCION DE SITIOS INMUNOLOGICAMENTE PRIVILEGIADOS A LA RESPUESTA INMUNE �Neuronas PRODUCCIÓN DE ANALOGOS DE RECEPTORES PARA EL FRAGMENTO FC DE LA Ig. G Y RETENCION DE VIRUS INFECCIOSOS POR CELULA FOLICULARES DENDRÍTICAS DISMINUCIÓN DE LA EXPRESIÓN DE LA MOLÉCULA CD 4

bibliografia �Inmunología Celular y Molecular. Abbas – Litchman- Pillai. 7 ma Edición. Año 2012. Elsevier- Saunders. �Introducción a la Inmunología Humana. Fainboim y Geffner. 6 ta Edición. Año 2011. Editorial Médica Panamericana. �Immunobiology: Janeway´s immunobiology. Murphy K. , Travers P, Walport M. 7 th edition. Año 2007. Garland Science Publisher (en inglés). �Roitt Inmunología - Fundamentos. 12º Ed. Año 2012. Editorial Médica Panamericana. �Murray P, Rosental K, Pfaller M. Mirobiologia Médica 6 ta Ed. Elsevier Mosby, 2009.

NOS VEMOS LA SIGUIENTE CLASE……………………. . .
 Facultad de ciencias universidad mayor
Facultad de ciencias universidad mayor Universidad de el salvador facultad de ciencias economicas
Universidad de el salvador facultad de ciencias economicas Universidad de los andes facultad de ciencias
Universidad de los andes facultad de ciencias Unionpyme easy software contable gratuito
Unionpyme easy software contable gratuito Universidad de el salvador facultad de ciencias economicas
Universidad de el salvador facultad de ciencias economicas Qumicas
Qumicas Facultad de ciencias médicas y biológicas umsnh
Facultad de ciencias médicas y biológicas umsnh Bangolou
Bangolou Facultad de ciencias economicas tucuman
Facultad de ciencias economicas tucuman Facultad de ciencias economicas tucuman
Facultad de ciencias economicas tucuman Facultad de ciencias agricolas uce
Facultad de ciencias agricolas uce Ciencias quimicas unach
Ciencias quimicas unach Facultad de ciencias físicas ucm
Facultad de ciencias físicas ucm Thin and thick smear
Thin and thick smear Facultad de arquitectura universidad de panama
Facultad de arquitectura universidad de panama Universidad de carabobo facultad de odontologia
Universidad de carabobo facultad de odontologia Signo de puño percusion
Signo de puño percusion Facultad de informatica universidad de panama
Facultad de informatica universidad de panama Universidad austral medicina
Universidad austral medicina Universidad de carabobo facultad de derecho
Universidad de carabobo facultad de derecho Universidad javeriana - facultad de medicina
Universidad javeriana - facultad de medicina Casosclinicosnn
Casosclinicosnn Facultad de medicina universidad de la sabana
Facultad de medicina universidad de la sabana Universidad san martin de porres facultad de derecho
Universidad san martin de porres facultad de derecho Universidad de ciencias medicas sancti spiritus
Universidad de ciencias medicas sancti spiritus Colegio de ciencias y humanidades plantel sur clave
Colegio de ciencias y humanidades plantel sur clave Universidad nacional de ingeniera
Universidad nacional de ingeniera Universidad nacional de piura maestrias
Universidad nacional de piura maestrias Universidad nacional de ingenieria
Universidad nacional de ingenieria Universidad de trujillo diplomados
Universidad de trujillo diplomados Beca 18 pucp
Beca 18 pucp Universidad nacional intercultural de la amazonía
Universidad nacional intercultural de la amazonía Universidad nacional de tumbes segunda especialidad
Universidad nacional de tumbes segunda especialidad Universidad nacional de loja
Universidad nacional de loja Himno de la universidad nacional mayor de san marcos
Himno de la universidad nacional mayor de san marcos Universidad nacional de cuyo derecho
Universidad nacional de cuyo derecho Universidad nacional de loja
Universidad nacional de loja Siu preinscripción unsa
Siu preinscripción unsa Logo universidad maritima del caribe
Logo universidad maritima del caribe David hume teoría del conocimiento
David hume teoría del conocimiento Universidad nacional
Universidad nacional Universidad nacional experimental de la seguridad sigla
Universidad nacional experimental de la seguridad sigla Universidad nacional experimental de yaracuy
Universidad nacional experimental de yaracuy Universidad nacional banner
Universidad nacional banner Universidad nacional de azuero
Universidad nacional de azuero Tesis universidad nacional abierta
Tesis universidad nacional abierta Francisco luis espinoza pineda
Francisco luis espinoza pineda Universidad nacional experimental francisco de miranda
Universidad nacional experimental francisco de miranda Universidad nacional de piura postgrado
Universidad nacional de piura postgrado Universidad nacional de piura postgrado
Universidad nacional de piura postgrado Facultades de la unge
Facultades de la unge Universidad nacional de azuero
Universidad nacional de azuero Artes plasticas universidad nacional
Artes plasticas universidad nacional Universidad nacional de ingenieria
Universidad nacional de ingenieria Foda de una universidad nacional
Foda de una universidad nacional Portada facultad de derecho
Portada facultad de derecho Universidad veracruzana campus xalapa
Universidad veracruzana campus xalapa Servicio social facultad de arquitectura
Servicio social facultad de arquitectura Facultad miguel enriquez
Facultad miguel enriquez Vestidos griegos
Vestidos griegos Antrofilicos
Antrofilicos Facultad natural
Facultad natural Facultad de arquitectura escolares
Facultad de arquitectura escolares Facultad de economia oruro
Facultad de economia oruro Libertad jurídica ejemplos
Libertad jurídica ejemplos Facultad de derecho ufm
Facultad de derecho ufm Facultad de turismo en san marcos
Facultad de turismo en san marcos Horaris uab psicologia
Horaris uab psicologia Universidad de arquitectura san juan
Universidad de arquitectura san juan Facultad de psicologia
Facultad de psicologia Reglamento de admision docente uto
Reglamento de admision docente uto Universidad veracruzana minatitlan
Universidad veracruzana minatitlan Facultad de auditoria
Facultad de auditoria Campus virtual ingenieria usac
Campus virtual ingenieria usac Facultad farmacia ull
Facultad farmacia ull Que es la voluntad
Que es la voluntad Plan de estudios lmad
Plan de estudios lmad Facultad de lenguas ccia registro
Facultad de lenguas ccia registro Facultad de odontologia usac
Facultad de odontologia usac Organigrama de la facultad de ingeniería.
Organigrama de la facultad de ingeniería. Facultad de bioanalisis
Facultad de bioanalisis








































































































