Qumica Analtica III ESPECTROSCOPIA ESPECTRO ELECTROMAGNTICO ESPECTROSCOPIA Para








































- Slides: 55

Química Analítica III

ESPECTROSCOPIA

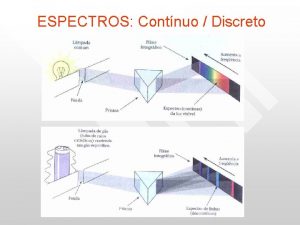
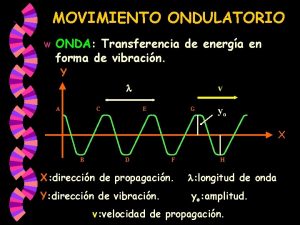
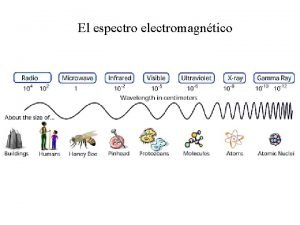
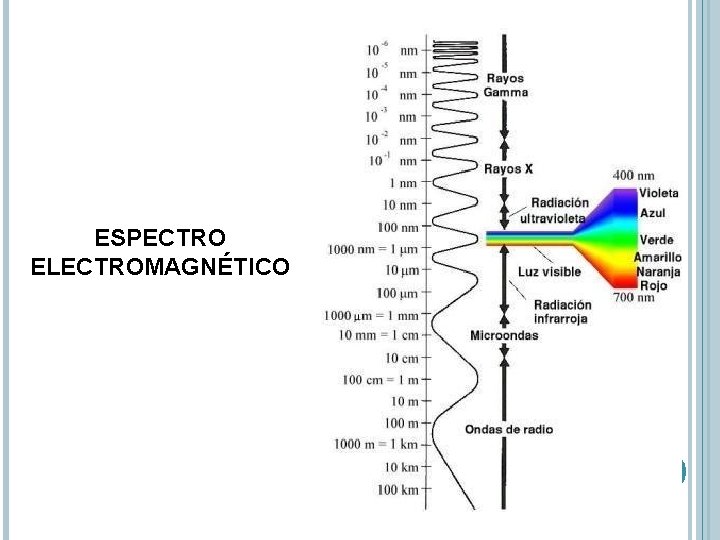
ESPECTRO ELECTROMAGNÉTICO

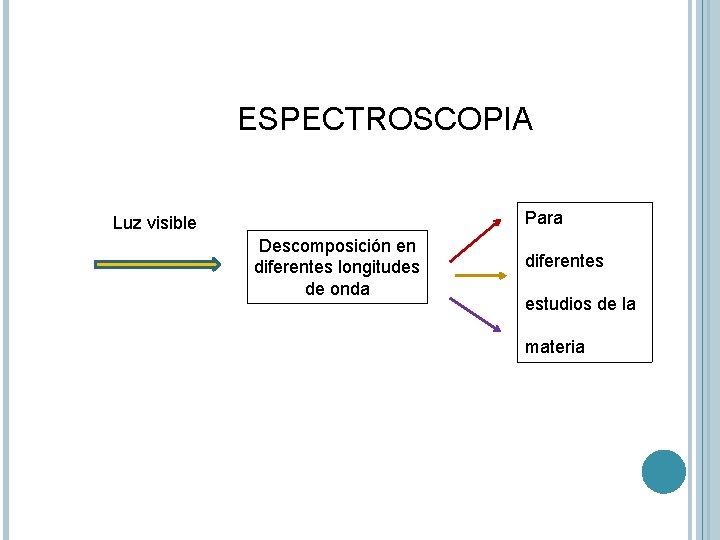
ESPECTROSCOPIA Para Luz visible Descomposición en diferentes longitudes de onda diferentes estudios de la materia

FUNDAMENTO analito


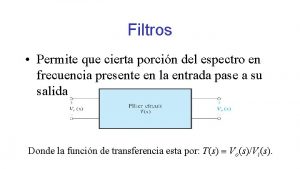
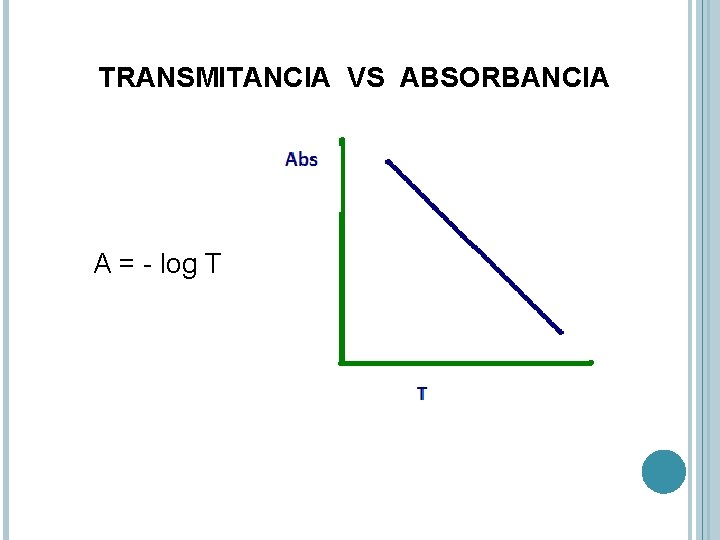
TRANSMITANCIA VS ABSORBANCIA A = - log T


ABSORTIVIDAD MOLAR

APLICACIÓN DE LA LEY DE BEER EN MEZCLAS

LIMITACIONES DE LA LEY DE BEER

DESVIACIONES

DESVIACIONES INSTRUMENTALES

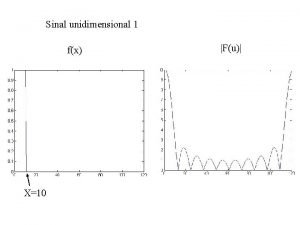
ESPECTROS DE ABSORCION

TEORIA DE LA ABSORCION MOLECULAR


TIPOS DE TRANSICIONES MOLECULARES



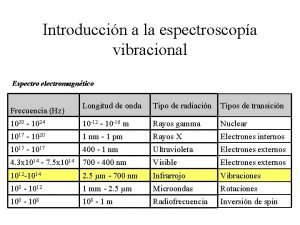
ABSORCION EN EL INFRARROJO

UV - VISIBLE



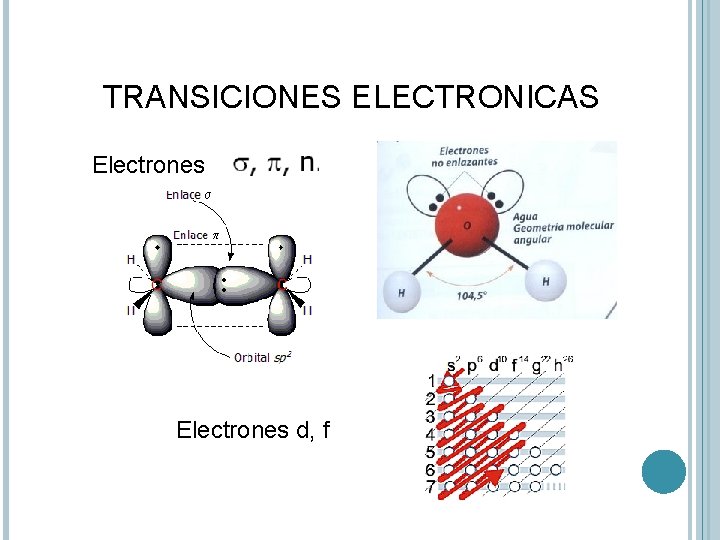
TRANSICIONES ELECTRONICAS Electrones d, f



Los electrones que contribuyen a la absorción en el UV-VIS son los compartidos que participan en la formación del enlace entre átomos y los que están unidos a más de un átomo.


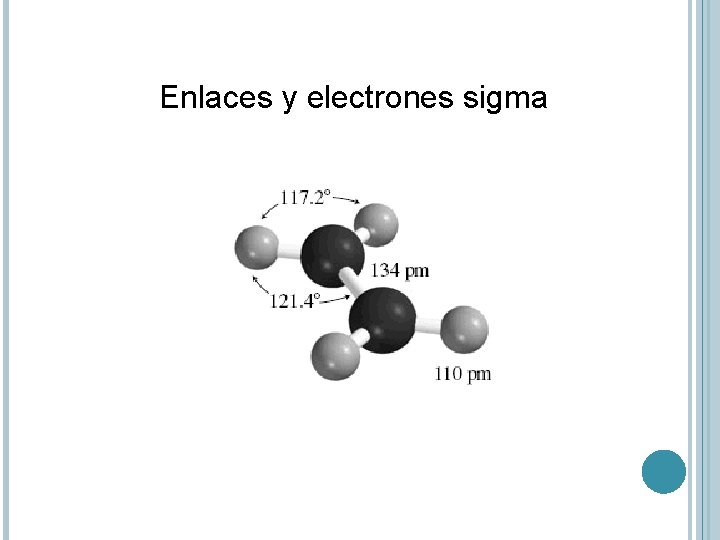
Enlaces y electrones sigma

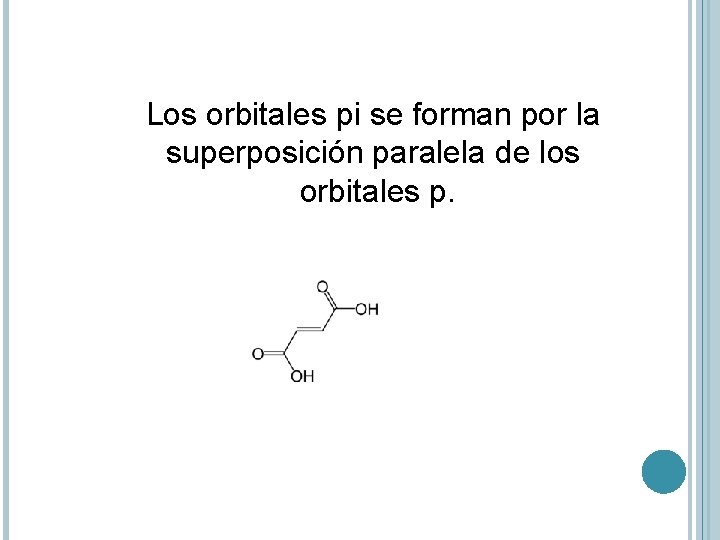
Los orbitales pi se forman por la superposición paralela de los orbitales p.




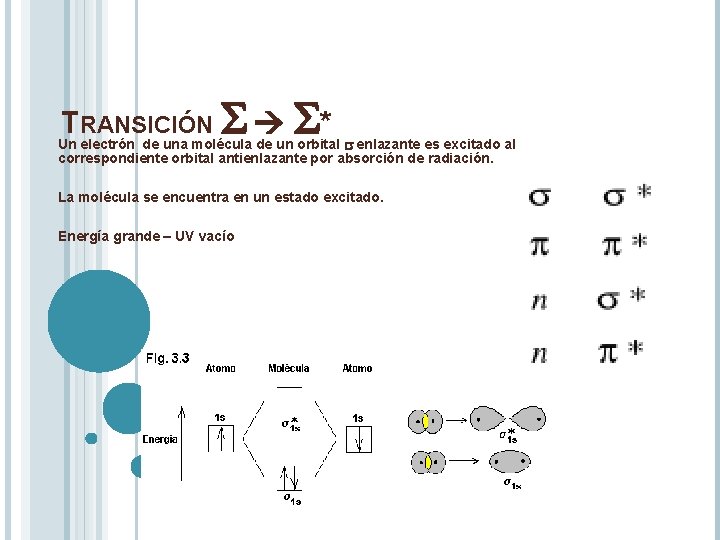
TRANSICIÓN S S* Un electrón de una molécula de un orbital s enlazante es excitado al correspondiente orbital antienlazante por absorción de radiación. La molécula se encuentra en un estado excitado. Energía grande – UV vacío

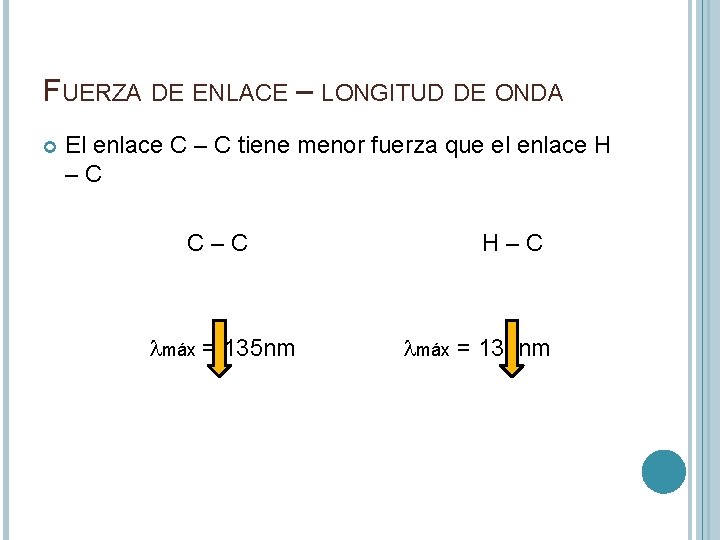
FUERZA DE ENLACE – LONGITUD DE ONDA El enlace C – C tiene menor fuerza que el enlace H –C C–C lmáx = 135 nm H–C lmáx = 135 nm

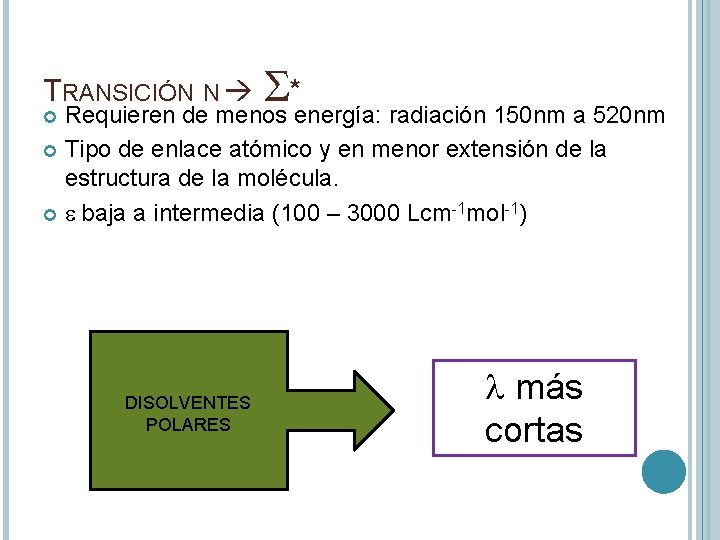
TRANSICIÓN N S* Requieren de menos energía: radiación 150 nm a 520 nm Tipo de enlace atómico y en menor extensión de la estructura de la molécula. e baja a intermedia (100 – 3000 Lcm-1 mol-1) DISOLVENTES POLARES l más cortas

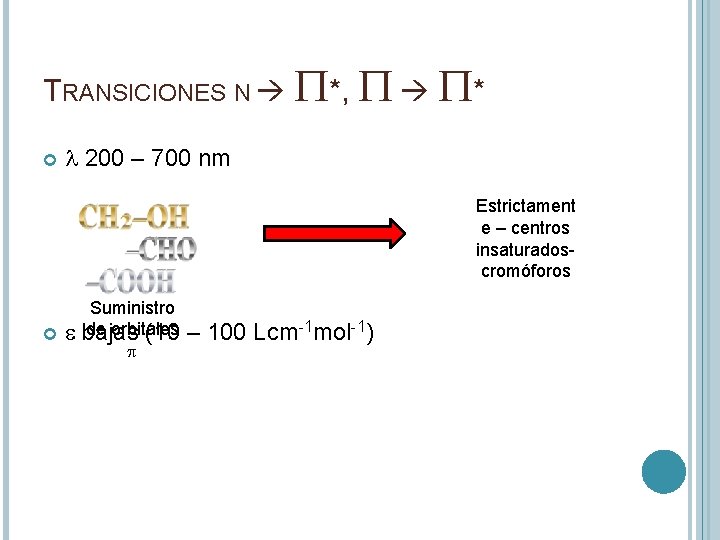
TRANSICIONES N P*, P P* l 200 – 700 nm Estrictament e – centros insaturadoscromóforos e Suministro de orbitales bajas (10 p – 100 Lcm-1 mol-1)

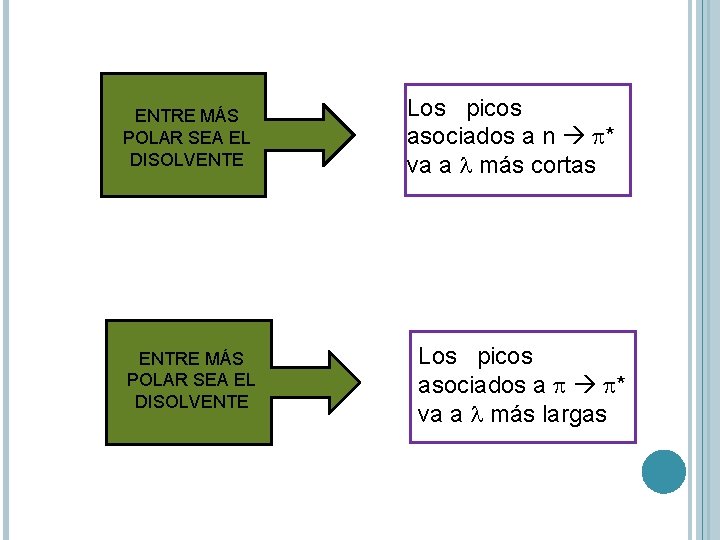
ENTRE MÁS POLAR SEA EL DISOLVENTE Los picos asociados a n p* va a l más cortas Los picos asociados a p p* va a l más largas

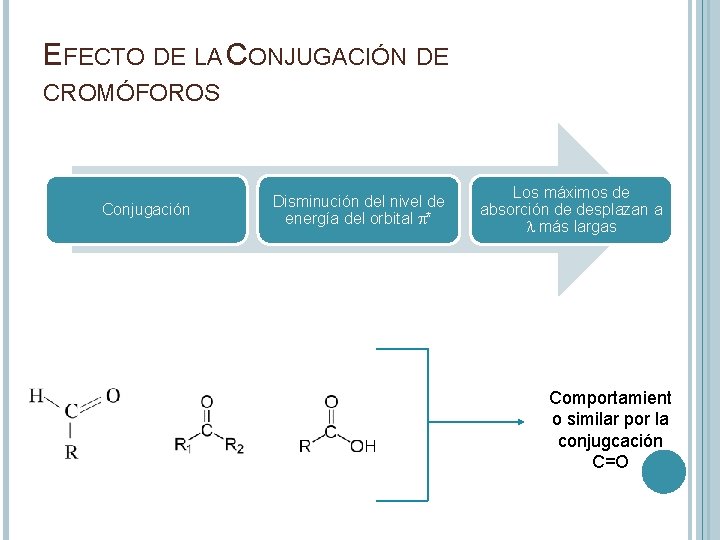
EFECTO DE LA CONJUGACIÓN DE CROMÓFOROS Conjugación Disminución del nivel de energía del orbital p* Los máximos de absorción de desplazan a l más largas Comportamient o similar por la conjugcación C=O

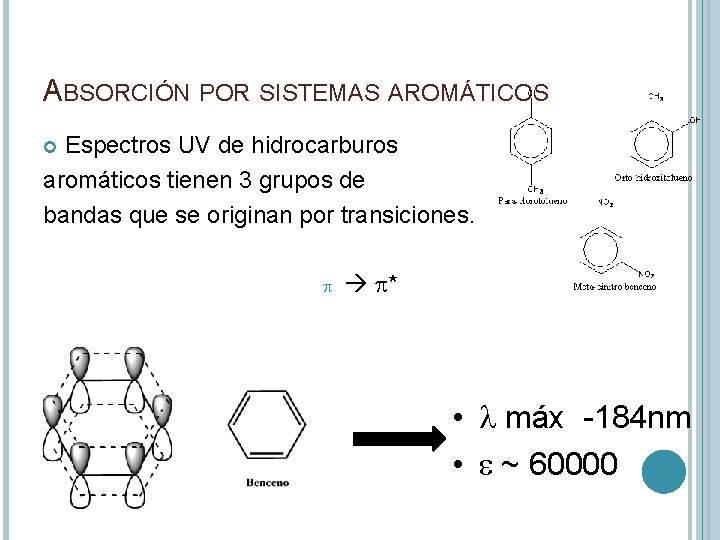
ABSORCIÓN POR SISTEMAS AROMÁTICOS Espectros UV de hidrocarburos aromáticos tienen 3 grupos de bandas que se originan por transiciones. p p* • l máx -184 nm • e ~ 60000

AUXOCROMO Grupo funcional que no absorbe por si los en la región UV Tiene el efecto de desplazar a los picos de los cromóforos hacia l largas. Aumenta sus intensidades Par de e- n son capaces de interaccionar con e- p del anillo Disminuye la energía de p* por efecto estabilizante

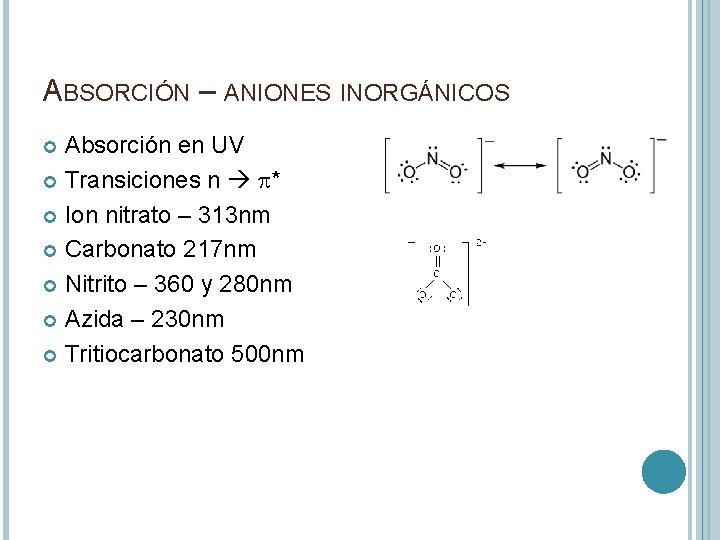
ABSORCIÓN – ANIONES INORGÁNICOS Absorción en UV Transiciones n p* Ion nitrato – 313 nm Carbonato 217 nm Nitrito – 360 y 280 nm Azida – 230 nm Tritiocarbonato 500 nm

Iones de lantánidos (e- 4 f) y actínidos (e- 5 f) Absorben en regiones UV –VIS -- Picos de absorción: estrechos característicos poco afectados por ligando asociado con el ion metálico

ABSORCIÓN POR ESPECIES INORGÁNICAS Iones y complejos de elementos de las 2 primeras series de transición Absorben bandas anchas de radiación visible al menos en uno de sus estados de oxidación Son coloreados electrones 3 d y 4 d











GRACIAS POR SU ATENCIÓN
 Espectroscopia raman instrumentacion
Espectroscopia raman instrumentacion Espectroscopia rmn
Espectroscopia rmn Analtica
Analtica Geometria
Geometria Analtica
Analtica Analtica
Analtica Referencial ortonomado
Referencial ortonomado Analtica
Analtica Analtica
Analtica Hamlet act iii scene ii
Hamlet act iii scene ii Espectro del arcoiris
Espectro del arcoiris Ecuacion de balmer
Ecuacion de balmer Espectro de legrand du saulle
Espectro de legrand du saulle Espectro electromagnetico
Espectro electromagnetico Condensacin
Condensacin Espectro equimótico
Espectro equimótico Espectro ir de acidos carboxilicos
Espectro ir de acidos carboxilicos Espectro atômico
Espectro atômico Espectro economico
Espectro economico Wagner de sousa gurgel
Wagner de sousa gurgel Espectro amikacina
Espectro amikacina Espectro amikacina
Espectro amikacina Espectro amikacina
Espectro amikacina Espectro ir ester
Espectro ir ester Antipseudomonas orales
Antipseudomonas orales Espectro de luz visivel
Espectro de luz visivel Espectro vocal
Espectro vocal Sintomas positivos e negativos da esquizofrenia
Sintomas positivos e negativos da esquizofrenia Densidad espectral de energia
Densidad espectral de energia Espectro de emissão
Espectro de emissão Radiação
Radiação Gaussiano
Gaussiano Espectro luminoso
Espectro luminoso Deutrio
Deutrio Espectro de frecuencia
Espectro de frecuencia Espectro eletromagnético
Espectro eletromagnético Dsm-5 autismo
Dsm-5 autismo Electromagnetic waves scale
Electromagnetic waves scale Espectro continuo
Espectro continuo Espectro infrarrojo del acetato de isoamilo
Espectro infrarrojo del acetato de isoamilo Aspenguer
Aspenguer Espectro electromagnetico
Espectro electromagnetico Fourier
Fourier Ch3-ch-ch2-ch-ch3
Ch3-ch-ch2-ch-ch3 Qumica moderna
Qumica moderna Geometria sp2
Geometria sp2 Qumica
Qumica Hidrocarbonetos
Hidrocarbonetos Qumica
Qumica Qumica
Qumica Entalpia
Entalpia Carbonos primarios secundarios y terciarios ejemplos
Carbonos primarios secundarios y terciarios ejemplos (ch3)3cch3 tipo de hidrocarburo
(ch3)3cch3 tipo de hidrocarburo Ionização
Ionização Tabla qumica
Tabla qumica Qumica
Qumica