Pharmacologie et thrapeutiques UE 2 11 IFSI 1re






































- Slides: 53

Pharmacologie et thérapeutiques UE 2. 11 IFSI 1ère année Principe de la chimie pertinent à la pharmacologie F. Bengeloun – 0 ct. 2014

Plan �Introduction �Les fondamentaux de la chimie ◦ ◦ Liaisons chimiques Eau et solutions aqueuses Acidité et basicité des solutions ioniques Hydrophilie et lipophilie �Application en pharmacologie ◦ Caractères physico-chimiques des médicaments

Introduction : la chimie � La chimie étudie o les éléments chimiques à l'état libre, atomes ou ions atomiques oles associations par liaisons chimiques o les interactions � La chimie est en lien avec ◦ la biologie ◦ la physique ◦ la pharmacie …

Introduction : la chimie �La réaction chimique est un processus au cours duquel on observe un changement de composition de la matière : il y a transformation �Loi de conservation de la matière (Antoine de Lavoisier , 1789) Au cours d’une réaction chimique, il y a conservation de la matière. C’est-à-dire qu’un élément peut apparaître sous différentes formes au début et à la fin d’une réaction mais en aucun cas il ne sera perdu.

Introduction � Qu’est ce que le médicament? = Molécule chimique active + Excipients � Quelle est la composition du milieu biologique? ◦ Molécules biochimiques: �Ions �Protéines �Sucres �Lipides ◦ Environnement biologique � Fluides (suc, sang, urine, …) � Tissus (sanguin, Osseux, musculaire, nerveux…) � Cellules (cellules nerveuses, cellules musc. …. )

Les fondamentaux de la chimie � L’atome ◦est le constituant élémentaire de la matière ◦est le fragment le plus petit qui permet de différencier un élément chimique d’un autre ◦est formé d’un noyau (nucléon), concentrant toute sa masse, autour duquel gravitent les électrons (nuage électronique)

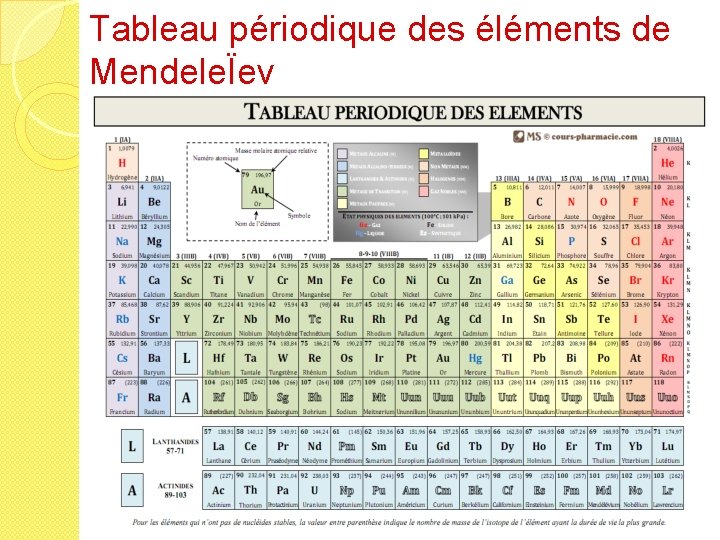
Les fondamentaux de la chimie �Un atome contient autant de protons que d’électrons il est électriquement neutre �Un élément chimique se définit comme l'ensemble des atomes dont le noyau comporte un nombre donné de protons. Ce nombre est le numéro atomique, noté Z �Chaque élément chimique est représenté par un symbole qui permet de l’identifier (Na = Sodium, Cl = Chlore…)

Tableau périodique des éléments de MendeleÏev

Liaison chimiques Les atomes ont tendance à s’associer pour donner différents types d’édifices chimiques ou molécules Les atomes vont établir entre eux des interactions ou des liaisons chimiques LIAISON COVALENTE LIAISONS NON COVALENTES Interactions électrostatiques Interactions de Vander Waals Liaisons Hydrogènes Effets Hydrophobes

Liaison chimiques LIAISON COVALENTE Est le résultat de la mise en commun de deux électrons, un de chacun des deux atomes qui se lient. Le terme de covalence signifie que la liaison résulte de la mise en commun d'une valence de chaque atome. La valence dépend de l'organisation des électrons de l'atome. LIAISON IONIQUE La liaison ionique résulte de l’attraction entre une espèce positive (cation) et une espèce négative (anion). La stabilité de la liaison est assurée par l'interaction électrostatique

Liaison chimiques La réaction chimique est caractérisée par la rupture de liaisons entre les éléments (= force de cohésion ou énergie qu'il faudra apporter pour casser la liaison)

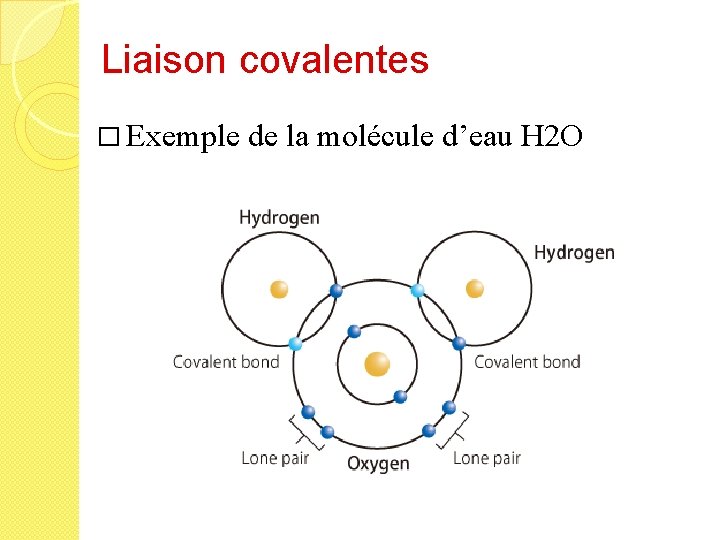
Liaison covalentes � Exemple de la molécule d’eau H 2 O

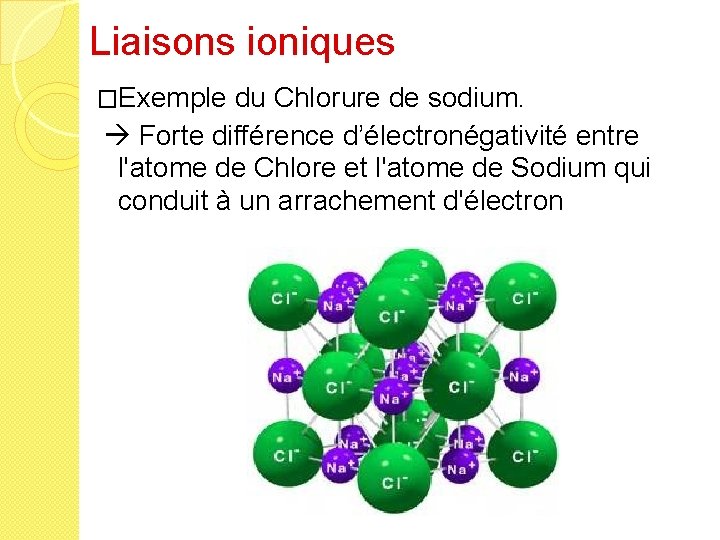
Liaisons ioniques �Exemple du Chlorure de sodium. Forte différence d’électronégativité entre l'atome de Chlore et l'atome de Sodium qui conduit à un arrachement d'électron

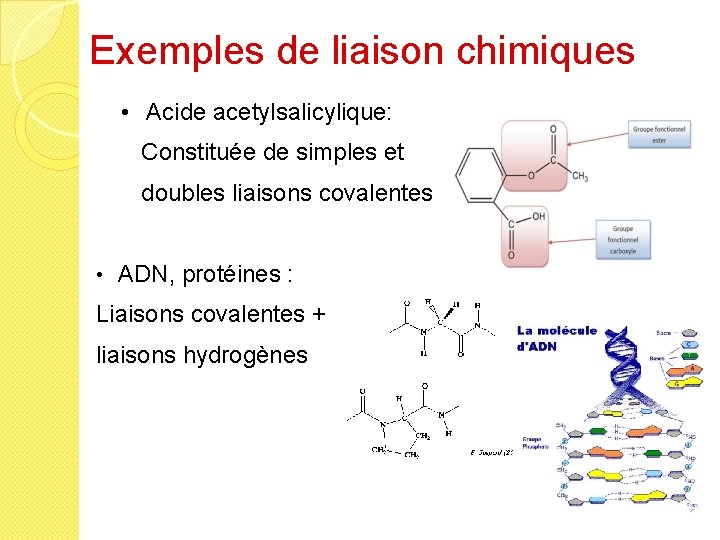
Exemples de liaison chimiques • Acide acetylsalicylique: Constituée de simples et doubles liaisons covalentes • ADN, protéines : Liaisons covalentes + liaisons hydrogènes

Eau et solution aqueuse : l’eau • Composé inorganique le plus abondant du système vivant (60 à 80% du volume des cellules vivantes) • L’eau est un solvant : �capable de dissocier les cristaux ioniques �capable de transporter diverses molécules (nutriments, gaz respiratoires, déchets métaboliques) �Milieu de réactions chimiques dont l’hydrolyse : décomposition de l’eau en ions (H+ et OH-)

Eau et solution aqueuse Une solution est un mélange liquide homogène dans lequel un des constituants ( le solvant) est en gros excès par rapport aux autres constituants du mélange ( les solutés). Si le solvant est de l'eau on obtient une solution aqueuse La concentration exprime la quantité de soluté présent dans la solution.

Eau et solution aqueuse Calcul de la quantité de soluté en solution Concentration = rapport entre quantité de matière et quantité de solvant �La concentration massique ( en g / litre) C = m (en gramme) = en g. L-1 V (en litre) �La concentration molaire ou molarité n (en môle) = en môle. L-1 C = V (en litre)

Eau et solution aqueuse Exemple de calcul: solution de Chlorure de Sodium à 0, 9% Formule brute: Na. Cl Na (23); Cl (35) donc Na. Cl = 23+35 Soit une masse molaire(M) = 58 M= m/n 0, 9% signifie 0, 9 g de Na. Cl pour 100 ml ce qui correspond à la dissolution de 9 g de Na. Cl dans 1000 ml soit 1 litre d'eau. n =9/58=0, 155 soit 155 mmol/l On parle de solution d'électrolytes car il se forme des cations et des anions

Eau et solution aqueuse En médecine : • Perfusion avec : ◦ Solutions aqueuses salines (Na. Cl) ◦ Solutions aqueuses glucosées (G 5) �Les milieux biologiques naturels sont des milieux aqueux

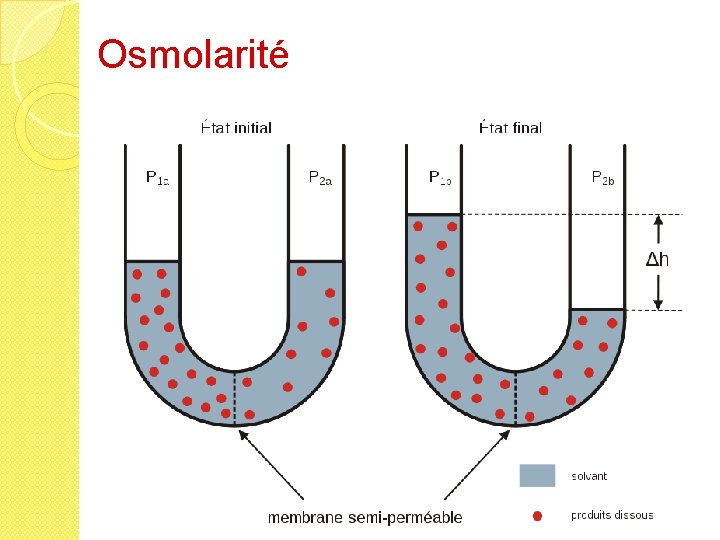
Osmolarité L'osmolarité est la concentration d'un milieu. Ceci fait appel à la notion d'osmose, qui est le transfert d'une certaine quantité d'eau d'une solution qui est diluée (que l'on appelle alors hypotonique) vers une solution qui est concentrée (appelée hypertonique) au travers d'une membrane semi-perméable. Equilibre = milieux isotoniques

Osmolarité

Osmolarité � Permet de classer les solvants par rapport au plasma(300 m. Osm) ◦Hypo-osmolaire / hypotonique ◦ Iso-osmolaire / isotonique ◦ Hyperosmolaire / hypertonique � En pratique : ◦Perfusion de solutions isotoniques uniquement (en théorie) ◦Hypertonique possible (surtout en voie centrale) ◦Hypotonique proscrit +++

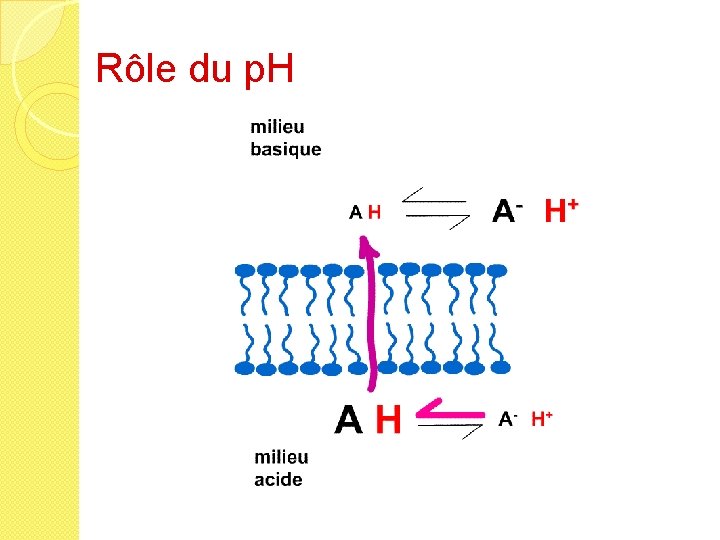
Acide et bases : Acides = Composé susceptible de céder un proton H+ en solution aqueuse. La concentration de protons détermine la force de l’acide Ex: HCL + H 2 O Cl- + H+ + H 2 O Cl- + H 3 O+ NB : H+ n’existe pas à l’état libre en solution aqueuse. Il se combine à la molécule d’eau pour former l’ion H 3 O+

Acide et bases : Bases = Composé susceptible de libérer des ions OH- après réaction avec l’eau. eau Ex: Na. OH Na+ + OHLes ions hydroxyles (OH- ) se lieront aux protons H+ libres de la solution => formation de H 2 O Diminution de H+ = augmentation du p. H

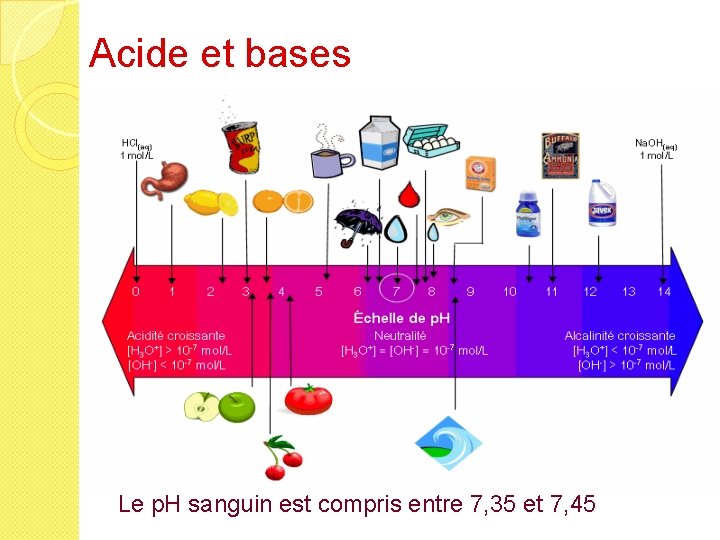
Acide et bases �p. H = potentiel hydrogène �La mesure de la concentration en H 3 O+ permet de définir le caractère acide ou basique d’une solution p. H = -log [H 3 O+] �Dans l’eau pure : [H 3 O+] = 10 -7 mol. L-1 = [OH- ] donc le p. H de l’eau pure = -log [H 3 O+] = -log [10 -7 ] = 7

Acide et bases Le p. H sanguin est compris entre 7, 35 et 7, 45

Acide et bases

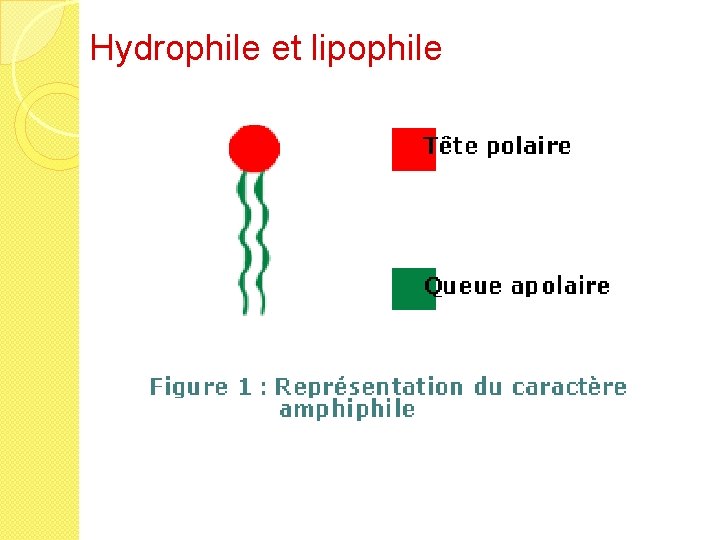
Hydrophile et lipophile : Composé hydrophile • Qui aime l’eau • Grande affinité pour les solutions aqueuses • Capacité à réaliser des liaisons chimiques faibles avec le solvant aqueux. (constituant polaires : OH, CO) • Solubles dans le milieu aqueux • Ex: ions (et composés ionisés), acide acétique, paracétamol, etc…

Hydrophile et lipophile Dissolution : Que se passe t-il? Un composé est solide car les liaisons entre les atomes, molécules ou ions créent la cohésion = forces de cohésions Introduction dans l’eau Les molécules du solvant vont rompre les forces de cohésions

Hydrophile et lipophile Na. Cl = solide ionique • La cohésion du cristal est assurée par des forces électrostatiques. Les molécules d’eau doivent vaincre ces forces pour s’immiscer dans le cristal • Chaque molécule d’eau entoure un ion solvatation des molécules du cristal et dissolution du sel

Hydrophile et lipophile : composé lipophile • Qui aime les lipides • Grande affinité pour les solutions huileuses • Capacité à réaliser des liaisons chimiques faibles avec le solvant huileux (via des constituants apolaires : CH) • Solubles dans le milieu huileux Ex: Hydrocarbures, acides gras, molécules non ionisées… •

Hydrophile et lipophile Le principe de dissolution est identique: Les molécules du solvant vont rompre les liaisons intramoléculaires d’une substance (soluté) et créer des liaisons intermoléculaire avec le soluté. Les composés à longue chaîne carboné seront lipophiles (acide palmitique, acide oléique) • La membrane d’une cellule: �Bicouche lipidique � Milieu de dissolution pour des substances lipophiles

Hydrophile et lipophile Mais…. Tout n’est pas si bien tranché Certaines molécules sont à la fois hydrophiles et lipophiles = molécules amphiphiles 2 pôles au sein de la même molécule: � Pôle polaire: capable de réaliser des liaison avec l’eau (hydrophile) � Pôle apolaire: capable de réaliser des liaisons avec « l’huile » (hydrophobe) Ex: esters d’acide gras (stéroïdes), tensioactifs (polysorbates)

Hydrophile et lipophile

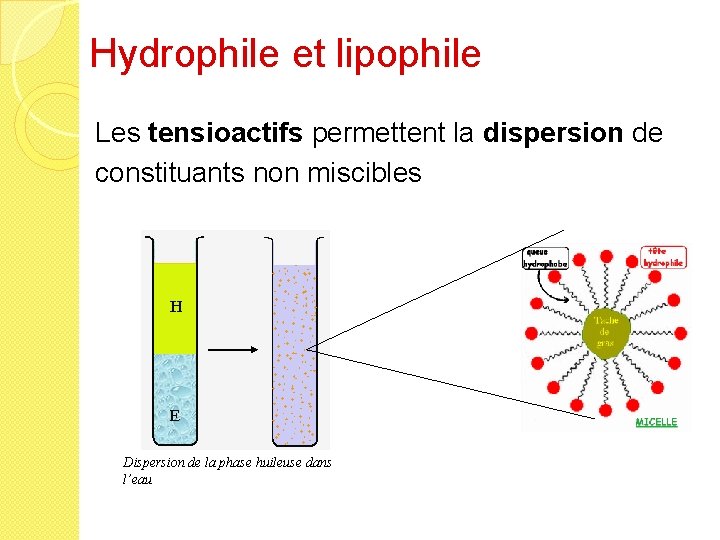
Hydrophile et lipophile Dans un milieu aqueux, les molécules amphiphiles se réorganisent et forment des micelles Les têtes polaires (hydrophiles) sont orientées vers l’extérieur (où se trouve le solvant = eau = hydrophile)

Hydrophile et lipophile Les tensioactifs permettent la dispersion de constituants non miscibles Dispersion de la phase huileuse dans l’eau

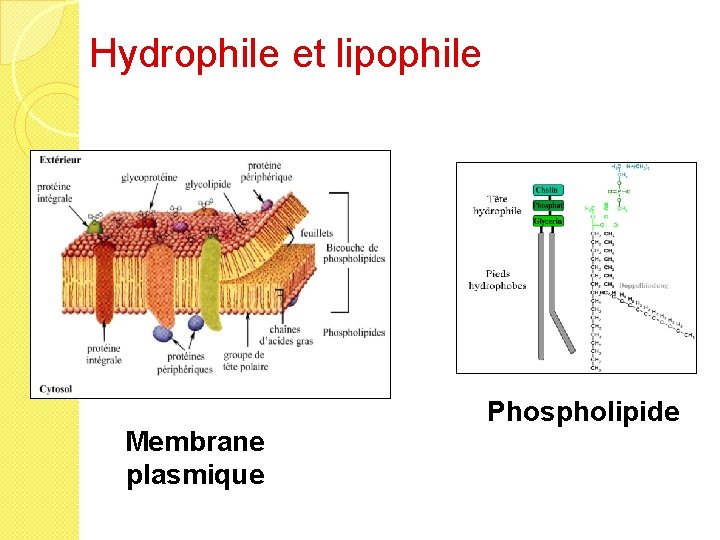
Hydrophile et lipophile Membrane plasmique Phospholipide

Application en pharmacologie Et en pratique? …. Faire le lien avec les médicaments et leur devenir dans l’organisme Leur mécanisme d’action

Caractères physico-chimiques des médicaments • Médicament • Substance active chimique ou biologique = principe actif • Excipients: diluants, tensioactifs, colorants… • Voie d’administration • Per os • Injection… • Milieu général d’action: milieu aqueux

Caractères physico-chimiques des médicaments En général, la structure chimique des médicaments contient beaucoup d’hydrogènes � Liaisons H possible � Phénomène de chélations possible avec des ions => Peut influencer l’absorption

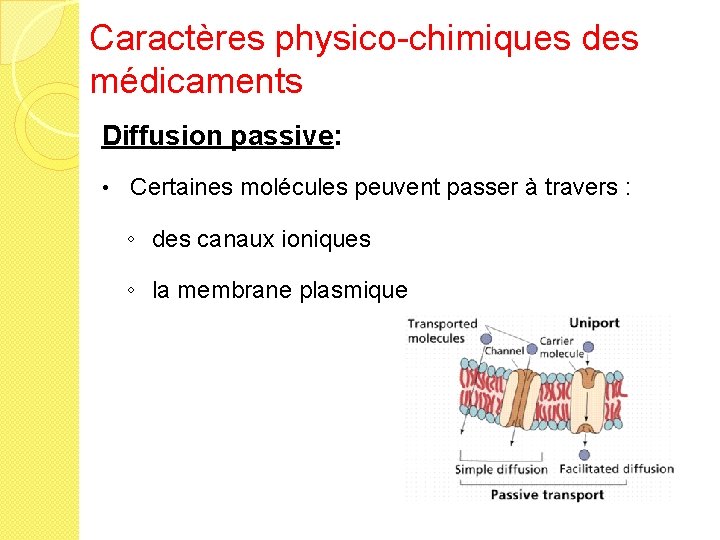
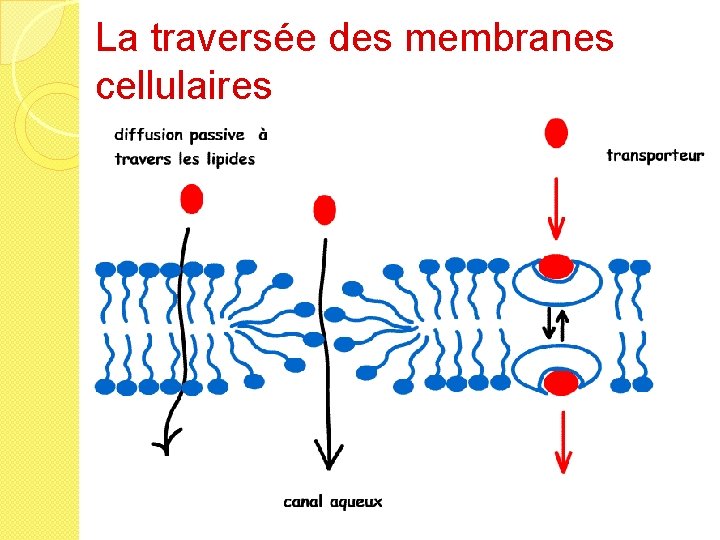
Caractères physico-chimiques des médicaments Diffusion passive: • Certaines molécules peuvent passer à travers : ◦ des canaux ioniques ◦ la membrane plasmique

Caractères physico-chimiques des médicaments � Les principes actifs sont : � Bases faibles ou acides faibles � Peu nocifs chimiquement pour l’organisme � Sous forme ionisé ou sous forme non ionisé dans le milieu biologique • Lieu d’absorption différent : estomac (p. H acide) ou intestin (p. H basique) • Seront transportés (acides faibles) par l’albumine dans le sang (forme de réserve)

Caractères physico-chimiques des médicaments • Sont hydrosolubles: � Lieu de distribution immédiat: sang!!! � Cas où le principe actif est incompatible utilisations de surfactifs

Caractères physico-chimiques des médicaments Le plus souvent hydrophiles mais… Certains sont constitués d’une partie liposoluble plus ou moins importante Passage facilité dans le cerveau Passage transmembranaire rapide Distribution du médicament dans les compartiments osseux, dans le tissus graisseux, …)

Caractères physico-chimiques des médicaments Sont des molécules de synthèse chimique � Constitués d’atomes reliés par des liaisons covalentes (simple, double, triple) � Sont capable de réagir chimiquement avec l’environnement o Formation de nouvelles liaisons o Dégradation par exposition aux acides, chaleur, lumière, oxydants….

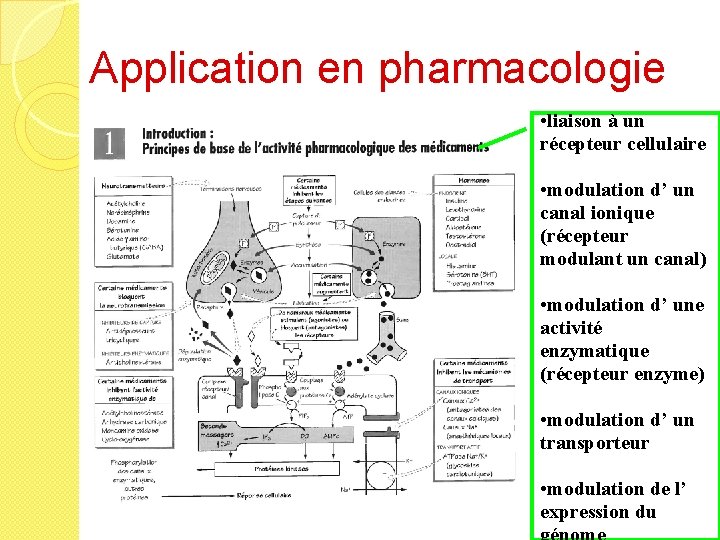
Application en pharmacologie Mode d’actions du médicament (cf pharmacodynamie) �Interactions chimiques avec sa cible ◦ Récepteurs ◦ Enzymes �Liaisons de faibles énergies (en général) �Nécessité de passage transmembranaire � Nécessité de transport vers la cible

Application en pharmacologie • liaison à un récepteur cellulaire • modulation d’ un canal ionique (récepteur modulant un canal) • modulation d’ une activité enzymatique (récepteur enzyme) • modulation d’ un transporteur • modulation de l’ expression du

La traversée des membranes cellulaires

Rôle du p. H

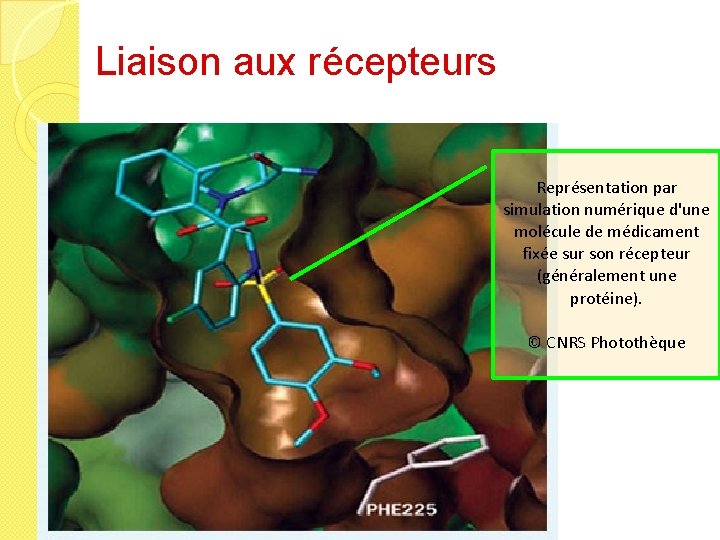
Liaison aux récepteurs Représentation par simulation numérique d'une molécule de médicament fixée sur son récepteur (généralement une protéine). © CNRS Photothèque

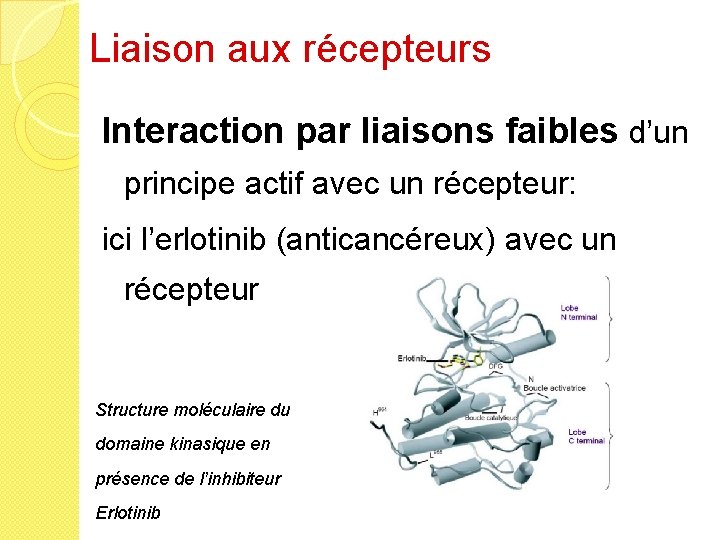
Liaison aux récepteurs Interaction par liaisons faibles d’un principe actif avec un récepteur: ici l’erlotinib (anticancéreux) avec un récepteur Structure moléculaire du domaine kinasique en présence de l’inhibiteur Erlotinib

Conclusion �Milieu biologique humain = milieu aqueux � Principes actifs = molécules chimiques capables d’interaction avec les constituants du milieu biologique � Interactions dépendent du caractères intrinsèque du principe actif et de l’environnement entourant ce principe actif � La capacité d’un principe actif à interagir avec sa cible définit sa propriété thérapeutique

Merci pour votre attention
 Ceh pharmacologie
Ceh pharmacologie Ceh pharmacologie
Ceh pharmacologie Ifsi martinique
Ifsi martinique Identito vigilance def
Identito vigilance def Ifsi bichat
Ifsi bichat Ifsi evreux
Ifsi evreux Ifsi prémontré
Ifsi prémontré Ifsi charles foix
Ifsi charles foix Pneumothorax ifsi
Pneumothorax ifsi Les 5 fonctions de la peau
Les 5 fonctions de la peau Soutenance mémoire infirmier exemple
Soutenance mémoire infirmier exemple Ifsi chr metz thionville
Ifsi chr metz thionville Ifsi des hus
Ifsi des hus Ifsi prefms
Ifsi prefms La psychologie clinique
La psychologie clinique Ifsidijon
Ifsidijon Méthode alarm ifsi
Méthode alarm ifsi Psychologie analytique ifsi
Psychologie analytique ifsi Jugement inique
Jugement inique Ifsi carcassonne
Ifsi carcassonne Les tissus ifsi
Les tissus ifsi Doc ifsi chaumont
Doc ifsi chaumont Elffe theia.fr
Elffe theia.fr Ifsi carcassonne
Ifsi carcassonne Ifsi martinique
Ifsi martinique Aiguille hubert
Aiguille hubert Les anticoagulants ifsi
Les anticoagulants ifsi Ifsi bichat
Ifsi bichat Concept vulnérabilité ifsi
Concept vulnérabilité ifsi Ifsi tenon
Ifsi tenon Ifsi de pau
Ifsi de pau Chu martinique ifsi
Chu martinique ifsi Tissus épithéliaux
Tissus épithéliaux Ifsi rene auffray
Ifsi rene auffray Pharmacodynamie ifsi
Pharmacodynamie ifsi Ifsi saint joseph marseille
Ifsi saint joseph marseille Exemple transmissions ciblées
Exemple transmissions ciblées Ifsi leblanc
Ifsi leblanc Ifsi sainte marguerite
Ifsi sainte marguerite Les anticoagulants cours ifsi
Les anticoagulants cours ifsi Ifsi douai
Ifsi douai Equilibre alimentaire ifsi
Equilibre alimentaire ifsi Circuit du linge definition
Circuit du linge definition Carssonne
Carssonne Système endocrinien ifsi
Système endocrinien ifsi Vih cours ifsi
Vih cours ifsi