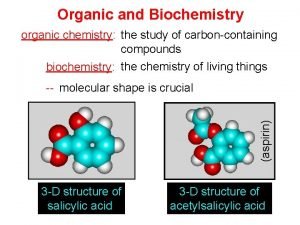
Organic Chemistry Second Edition Janice Gorzynski Smith University

















![Carboidrati Reazioni del gruppo carbonilico-Ossidazione e riduzione [1] Ossidazione dell’aldeide ad acido carbossilico Tre Carboidrati Reazioni del gruppo carbonilico-Ossidazione e riduzione [1] Ossidazione dell’aldeide ad acido carbossilico Tre](https://slidetodoc.com/presentation_image_h/07c1c7da45e9929c18608aa6a1e07572/image-45.jpg)
![Carboidrati Reazioni del gruppo carbonilico-Ossidazione e riduzione [1] Ossidazione dell’aldeide ad acido carbossilico 46 Carboidrati Reazioni del gruppo carbonilico-Ossidazione e riduzione [1] Ossidazione dell’aldeide ad acido carbossilico 46](https://slidetodoc.com/presentation_image_h/07c1c7da45e9929c18608aa6a1e07572/image-46.jpg)
![Carboidrati Reazioni del gruppo carbonilico-Ossidazione e riduzione [2] Ossidazione dell’aldeide e dell’alcol 1° a Carboidrati Reazioni del gruppo carbonilico-Ossidazione e riduzione [2] Ossidazione dell’aldeide e dell’alcol 1° a](https://slidetodoc.com/presentation_image_h/07c1c7da45e9929c18608aa6a1e07572/image-48.jpg)








- Slides: 61

Organic Chemistry, Second Edition Janice Gorzynski Smith University of Hawai’i Chapter 27 Lecture Outline Prepared by Rabi Ann Musah State University of New York at Albany Copyright © The Mc. Graw-Hill Companies, Inc. Permission required for reproduction or display. 1

Carboidrati Introduzione • I carboidrati, communemente definiti zuccheri ed amidi, sono poliidrossi aldeidi e chetoni, o composti che possono trasformarsi in essi per idrolisi. Figure 27. 1 Some examples of carbohydrates 2

Carboidrati Introduzione • I carboidrati sono depositi di energia chimica. • Vengono sintetizzati nelle piante verdi e nelle alghe per mezzo della fotosintesi, un processo che usa l’energia solare per convertire il biossido di carbonio e l’acqua in glucosio ed ossigeno. • Questa energia viene rilasciata quando il glucosio viene metabolizzato. • L’ossidazione del glucosio è un processo a più stadi che porta alla formazione di biossido di carbonio, acqua, ed una grande quantità di energia. 3

Carboidrati Monosaccaridi • I carboidrati più semplici sono definiti monosaccaridi, o zuccheri semplici. • Hanno da tre a sette atomi di carbonio nella catena, e un gruppo carbonilico localizzato sul carbonio terminale (C 1) o sul carbonio adiacente (C 2). • Nella maggior parte dei carboidrati, ciascuno degli atomi di carbonio adiacenti contiene un gruppo ossidrilico. • I monosaccaridi vengono di solito disegnati verticalmente, con il gruppo carbonilico in alto. 4

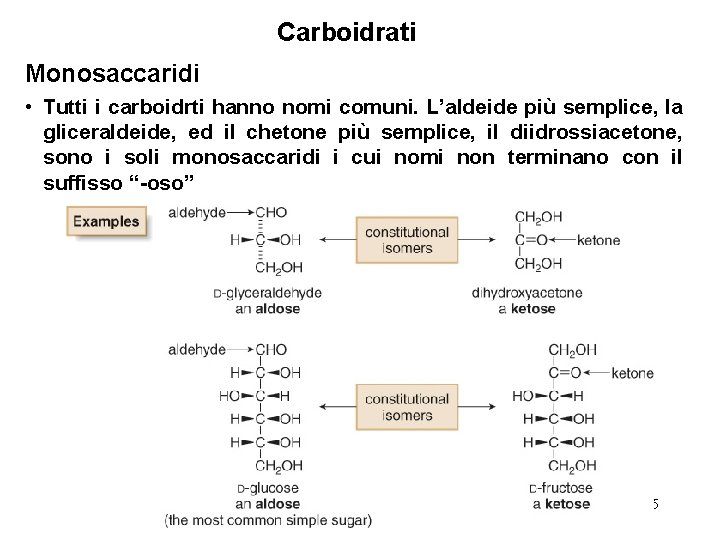
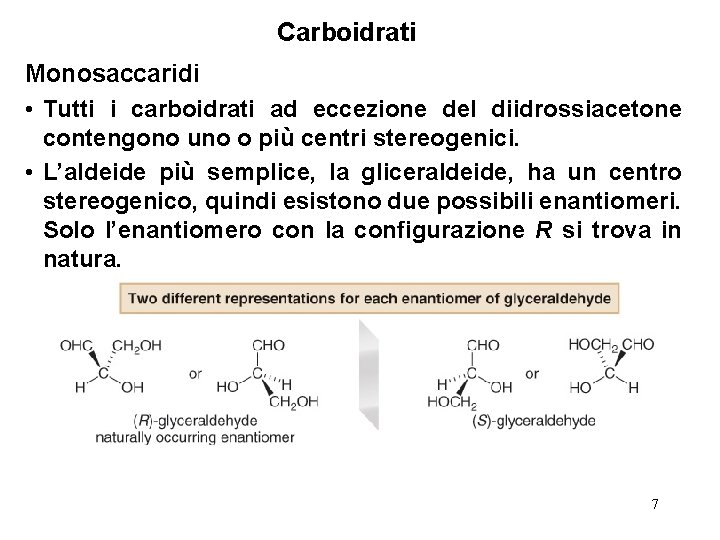
Carboidrati Monosaccaridi • Tutti i carboidrti hanno nomi comuni. L’aldeide più semplice, la gliceraldeide, ed il chetone più semplice, il diidrossiacetone, sono i soli monosaccaridi i cui nomi non terminano con il suffisso “-oso” 5

Carboidrati Monosaccaridi • Un monosaccaride è definito: • Questi termini sono combinati con la parola aldoso e chetoso per indicare il numero di atomi di carbonio nel monosaccaride, e se contiene un’aldeide o un chetone. • Quindi la gliceraldeide è un aldotrioso, il glucosio è un aldoesoso, ed il fruttosio è un chetoesoso. 6

Carboidrati Monosaccaridi • Tutti i carboidrati ad eccezione del diidrossiacetone contengono uno o più centri stereogenici. • L’aldeide più semplice, la gliceraldeide, ha un centro stereogenico, quindi esistono due possibili enantiomeri. Solo l’enantiomero con la configurazione R si trova in natura. 7

Carboidrati Monosaccaridi • I centri stereogenici presenti negli zuccheri sono spesso raffigurati utilizzando una convenzione diversa rispetto a quella che si usa di solito per gli altri centri stereogenici. • Invece di disegnare un tetraedro con due legami nel piano uno davanti al piano e uno dietro, il tetraedro viene inclinato in modo tale che i legami orizzontali siano orientati in avanti (disegnati con cunei) e i legami verticali siano orientati dietro (con linee tratteggiate). • Questa struttura viene poi abbreviata con una formula a croce, chiamata formula di proiezione di Fischer. 8

Carboidrati Monosaccaridi • In una formula di proiezione di Fischer : • Notare che non si può ruotare una formula di proiezione di Fischer nel piano della pagina, perché inavvertitamente si potrebbe convertire un composto 9 nel suo enantiomero.

Carboidrati Monosaccaridi • Il numero dei possibili stereoisomeri di un monosaccaride aumenta esponenzialmente con il numero dei centri stereogenici presenti. • Un aldoesoso ha quattro centri stereogenici, e quindi ha 24 = 16 possibili stereoisomeri, o otto coppie di enantiomeri. 10

Carboidrati Monosaccaridi • Le formule di proiezione di Fischer vengono anche usate per composti come gli aldoesosi che contengono molti centri stereogenici. In questo caso, la molecula viene disegnata ponendo lo scheletro di atomi di carbonio in verticale ed i centri stereogenici messi in fila in successione. • Usando questa convenzione, tutti i legami orizzontali si rivolgono in avanti (con cunei). 11

Carboidrati Monosaccaridi • Benchè le proiezioni di Fischer siano comunemente usate per rappresentare i monosaccaridi con molti centri stereogenici, bisogna fare attenzione nel loro uso poiché non danno una rappresentazione corretta della struttura 3 -D che rappresentano. • Poiché ogni centro stereogenico è rappresentato nella conformazione eclissata meno stabile, la proiezione di Fischer del glucosio rappresenta la molecola in una conformazione cilindrica. Figure 27. 2 A Fischer projection and the 3 -D structure of glucose 12

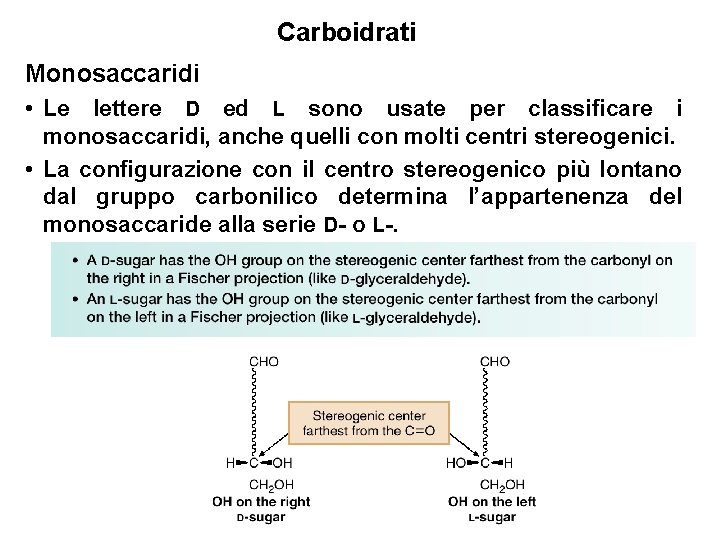
Carboidrati Monosaccaridi • Anche se i prefissi R ed S possono essere usati per attribuire la configurazione assoluta dei centri stereogenici dei monosaccaridi, un sistema di nomenclatura più antico invece usa i prefissi D- ed L-. • La gliceraldeide naturale ha la configurazione R e viene chiamata isomero D. Il suo enantiomero, la (S)gliceraldeide, viene chiamata isomero L. 13

Carboidrati Monosaccaridi • Le lettere D ed L sono usate per classificare i monosaccaridi, anche quelli con molti centri stereogenici. • La configurazione con il centro stereogenico più lontano dal gruppo carbonilico determina l’appartenenza del monosaccaride alla serie D- o L-. 14

Carboidrati Monosaccaridi • Il glucosio e tutti gli altri zuccheri naturali sono zuccheri della serie D. L’ L-glucosio, un composto che non esiste in natura, è l’enantiomero del D-glucosio. L’ L-glucosio ha configurazione opposta su ciascun centro stereogenico. • Notare che le due definizioni (D ed L e d ed l) si riferiscono a fenomeni molto diversi—il primo designa la configurazione attorno ad un centro stereogenico, mentre il secondo si riferisce alla direzione in cui viene ruotato il piano della luce 15 polarizzata.

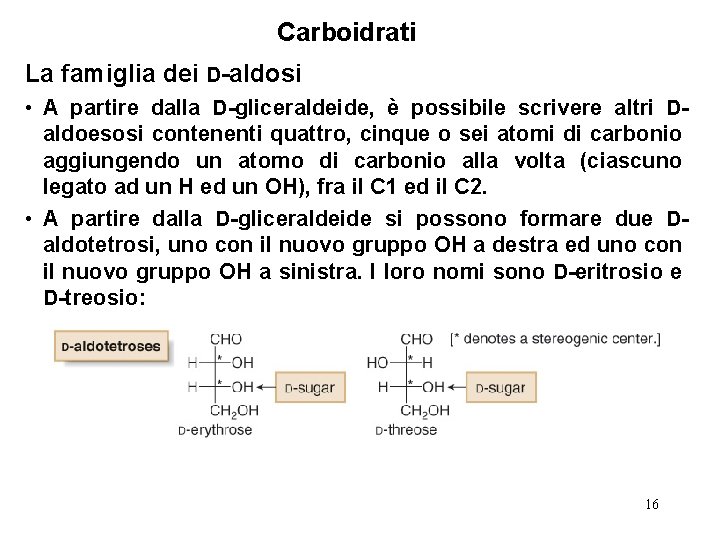
Carboidrati La famiglia dei D-aldosi • A partire dalla D-gliceraldeide, è possibile scrivere altri Daldoesosi contenenti quattro, cinque o sei atomi di carbonio aggiungendo un atomo di carbonio alla volta (ciascuno legato ad un H ed un OH), fra il C 1 ed il C 2. • A partire dalla D-gliceraldeide si possono formare due Daldotetrosi, uno con il nuovo gruppo OH a destra ed uno con il nuovo gruppo OH a sinistra. I loro nomi sono D-eritrosio e D-treosio: 16

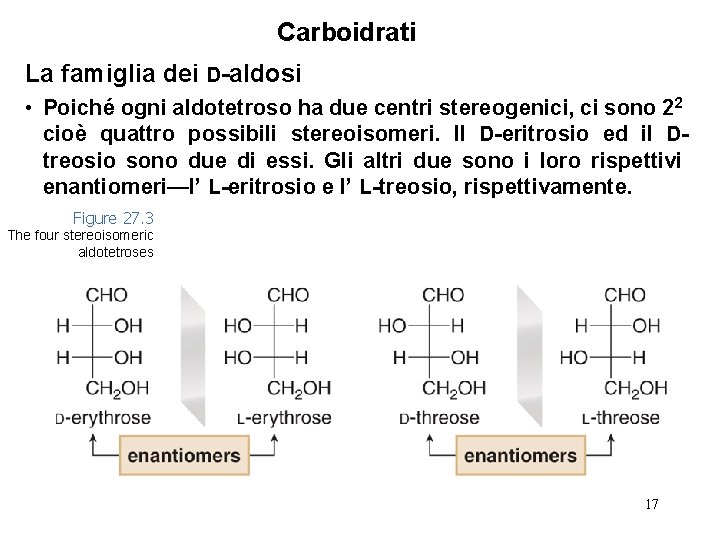
Carboidrati La famiglia dei D-aldosi • Poiché ogni aldotetroso ha due centri stereogenici, ci sono 22 cioè quattro possibili stereoisomeri. Il D-eritrosio ed il Dtreosio sono due di essi. Gli altri due sono i loro rispettivi enantiomeri—l’ L-eritrosio e l’ L-treosio, rispettivamente. Figure 27. 3 The four stereoisomeric aldotetroses 17

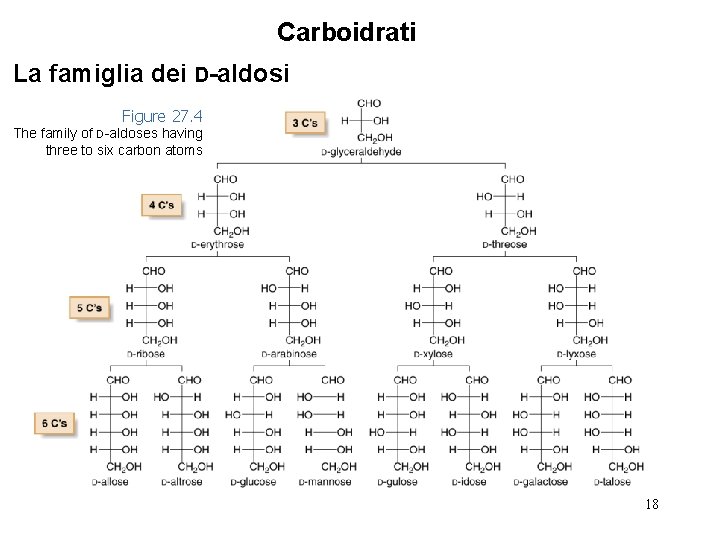
Carboidrati La famiglia dei D-aldosi Figure 27. 4 The family of D-aldoses having three to six carbon atoms 18

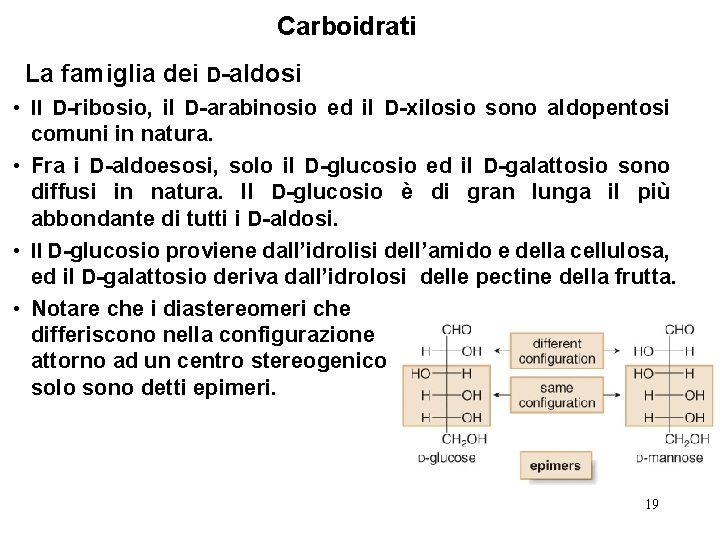
Carboidrati La famiglia dei D-aldosi • Il D-ribosio, il D-arabinosio ed il D-xilosio sono aldopentosi comuni in natura. • Fra i D-aldoesosi, solo il D-glucosio ed il D-galattosio sono diffusi in natura. Il D-glucosio è di gran lunga il più abbondante di tutti i D-aldosi. • Il D-glucosio proviene dall’idrolisi dell’amido e della cellulosa, ed il D-galattosio deriva dall’idrolosi delle pectine della frutta. • Notare che i diastereomeri che differiscono nella configurazione attorno ad un centro stereogenico solo sono detti epimeri. 19

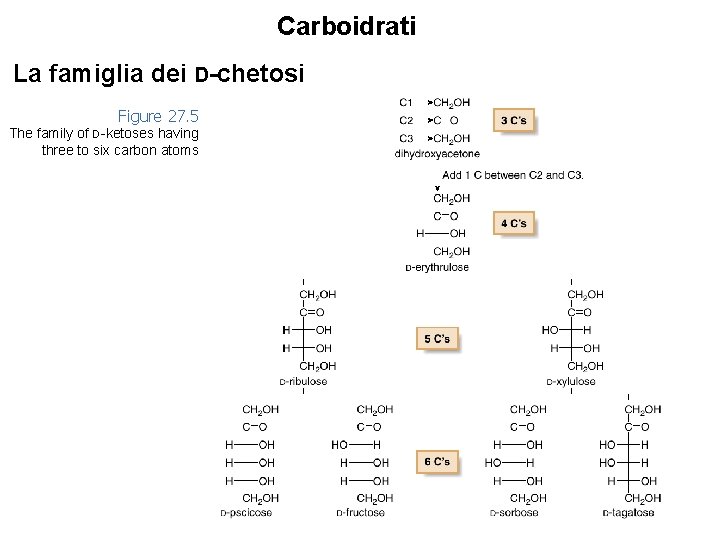
Carboidrati La famiglia dei D-chetosi Figure 27. 5 The family of D-ketoses having three to six carbon atoms 20

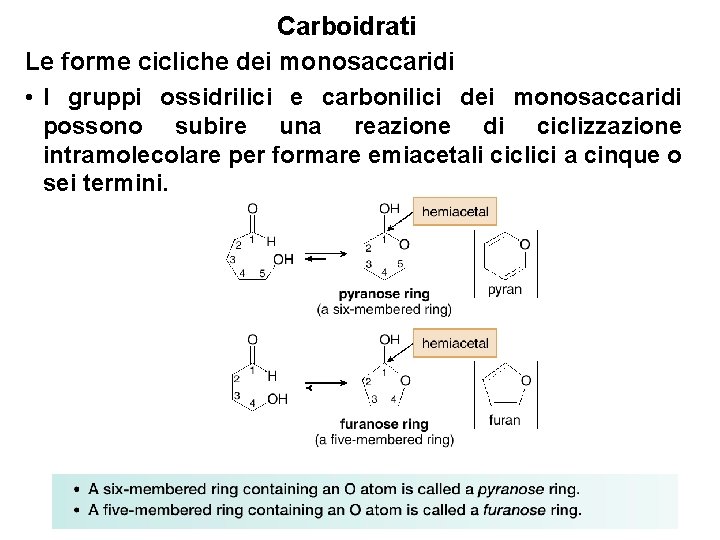
Carboidrati Le forme cicliche dei monosaccaridi • I gruppi ossidrilici e carbonilici dei monosaccaridi possono subire una reazione di ciclizzazione intramolecolare per formare emiacetali ciclici a cinque o sei termini. 21

Carboidrati Le forme cicliche dei monosaccaridi • La ciclizzazione di un composto idrossicarbonilico forma sempre un centro stereogenico al carbonio emiacetalico, chiamato carbonio anomerico. • La ciclizzazione porta alla formazione dell’anello più stabile di una certa molecola. I monosaccaridi più comuni, gli aldoesosi come il glucosio, formano di solito 22 un anello piranosico.

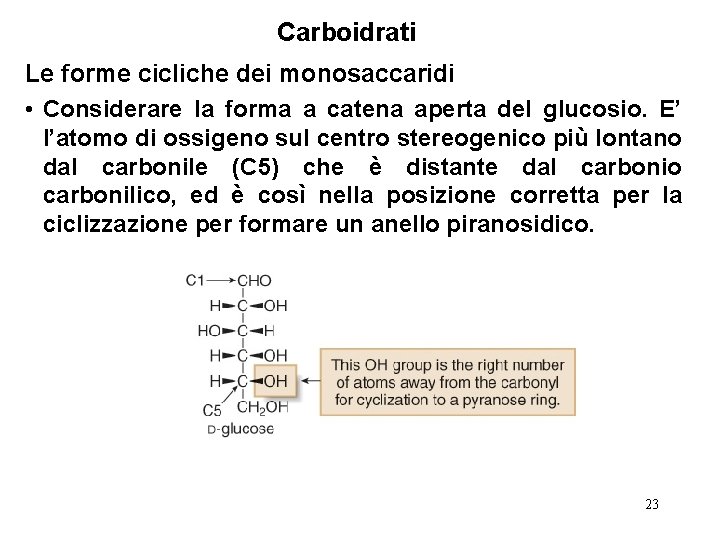
Carboidrati Le forme cicliche dei monosaccaridi • Considerare la forma a catena aperta del glucosio. E’ l’atomo di ossigeno sul centro stereogenico più lontano dal carbonile (C 5) che è distante dal carbonio carbonilico, ed è così nella posizione corretta per la ciclizzazione per formare un anello piranosidico. 23

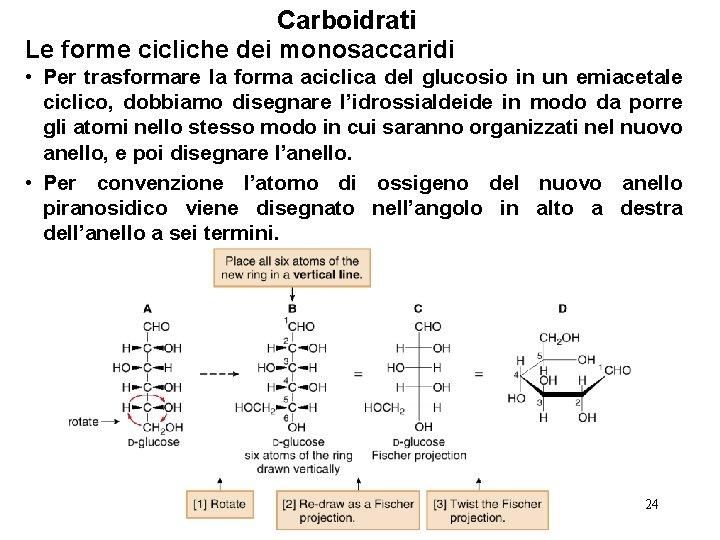
Carboidrati Le forme cicliche dei monosaccaridi • Per trasformare la forma aciclica del glucosio in un emiacetale ciclico, dobbiamo disegnare l’idrossialdeide in modo da porre gli atomi nello stesso modo in cui saranno organizzati nel nuovo anello, e poi disegnare l’anello. • Per convenzione l’atomo di ossigeno del nuovo anello piranosidico viene disegnato nell’angolo in alto a destra dell’anello a sei termini. 24

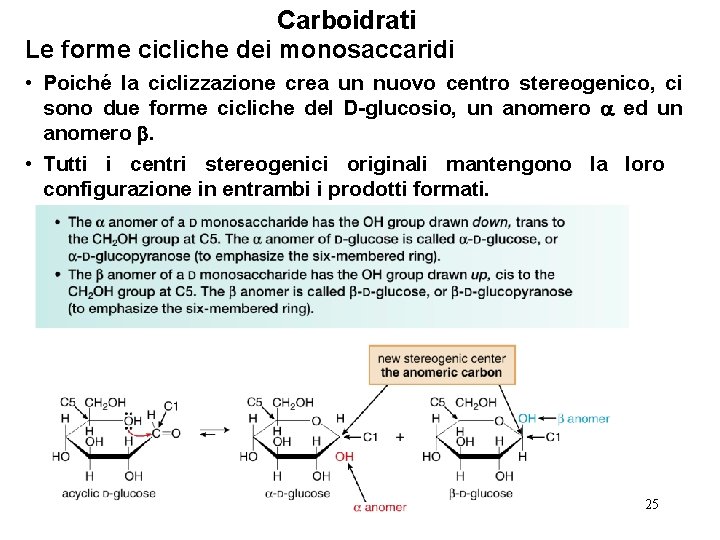
Carboidrati Le forme cicliche dei monosaccaridi • Poiché la ciclizzazione crea un nuovo centro stereogenico, ci sono due forme cicliche del D-glucosio, un anomero ed un anomero . • Tutti i centri stereogenici originali mantengono la loro configurazione in entrambi i prodotti formati. 25

Carboidrati Le forme cicliche dei monosaccaridi • Questi anelli piatti a sei termini usati per rappresentare gli emiacetali ciclici del glucosio e di altri zuccheri vengono chiamati proiezioni di Haworth. • L’ -D-glucosio ed il -D-glucosio sono diastereomeri perché solo il carbonio anomerico ha configurazione diversa. • Le forme cicliche del glucosio hanno ora cinque centri stereogenici—quattro provengono dall’idrossialdeide di partenza ed uno dal carbonio anomerico. • L’anomero ha il gruppo OH anomerico ed il gruppo CH 2 OH trans. L’ anomero ha il gruppo OH ed il gruppo CH 2 OH cis. 26

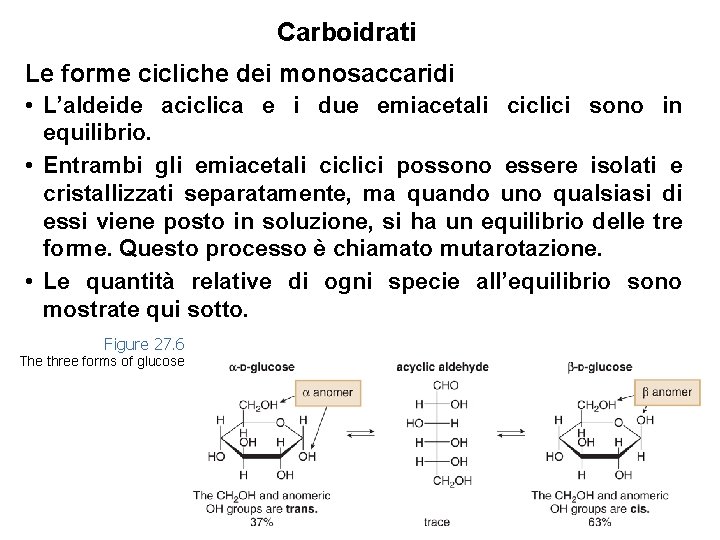
Carboidrati Le forme cicliche dei monosaccaridi • L’aldeide aciclica e i due emiacetali ciclici sono in equilibrio. • Entrambi gli emiacetali ciclici possono essere isolati e cristallizzati separatamente, ma quando uno qualsiasi di essi viene posto in soluzione, si ha un equilibrio delle tre forme. Questo processo è chiamato mutarotazione. • Le quantità relative di ogni specie all’equilibrio sono mostrate qui sotto. Figure 27. 6 The three forms of glucose 27

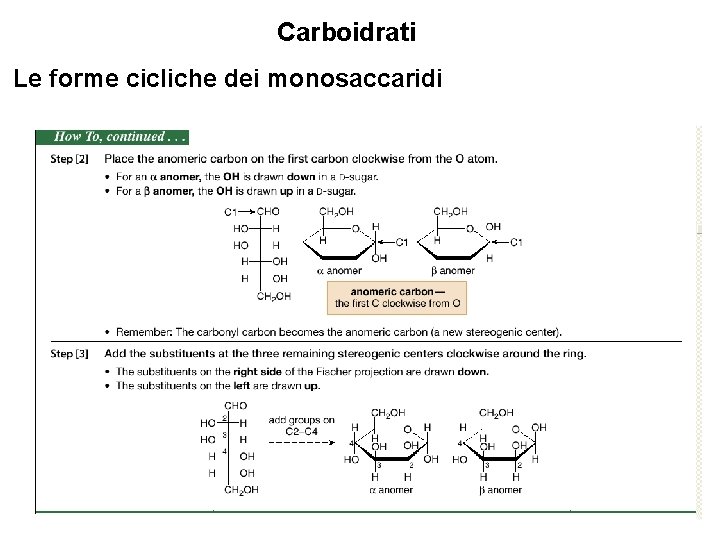
Carboidrati Le forme cicliche dei monosaccaridi Per convertire un monosaccaride aciclico nella proiezione di Haworth, seguire una procedura graduale: 28

Carboidrati Le forme cicliche dei monosaccaridi 29

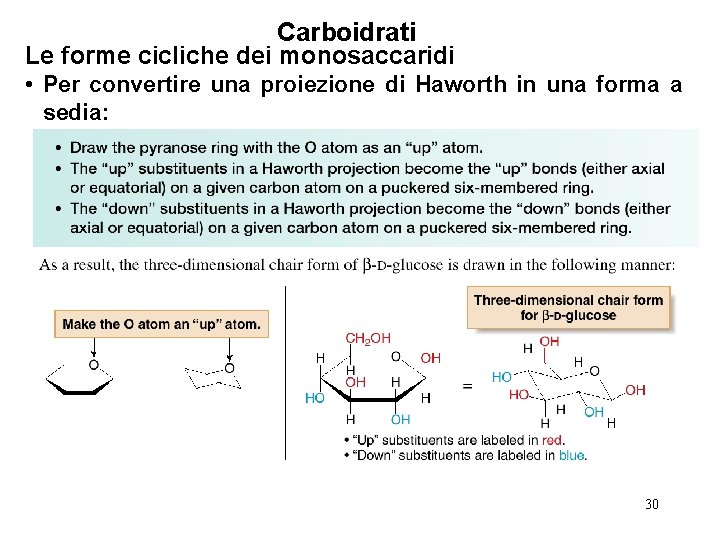
Carboidrati Le forme cicliche dei monosaccaridi • Per convertire una proiezione di Haworth in una forma a sedia: 30

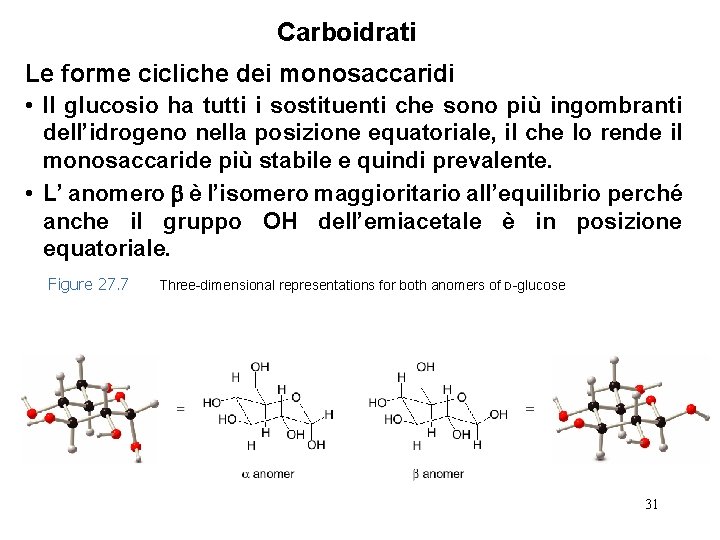
Carboidrati Le forme cicliche dei monosaccaridi • Il glucosio ha tutti i sostituenti che sono più ingombranti dell’idrogeno nella posizione equatoriale, il che lo rende il monosaccaride più stabile e quindi prevalente. • L’ anomero è l’isomero maggioritario all’equilibrio perché anche il gruppo OH dell’emiacetale è in posizione equatoriale. Figure 27. 7 Three-dimensional representations for both anomers of D-glucose 31

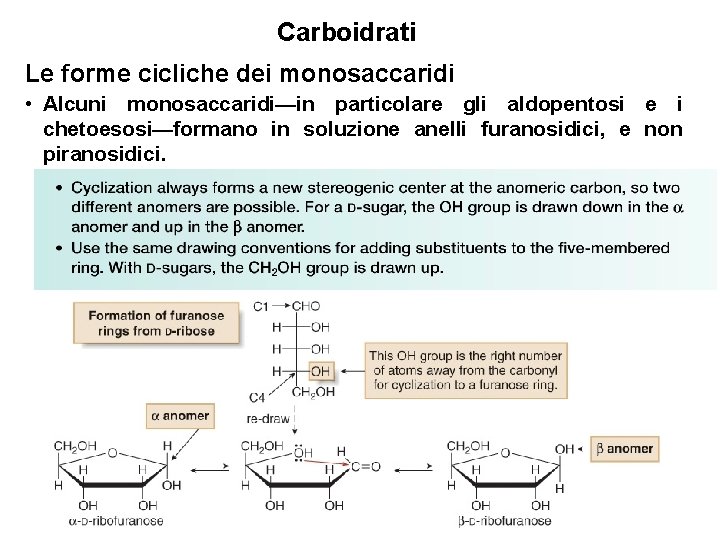
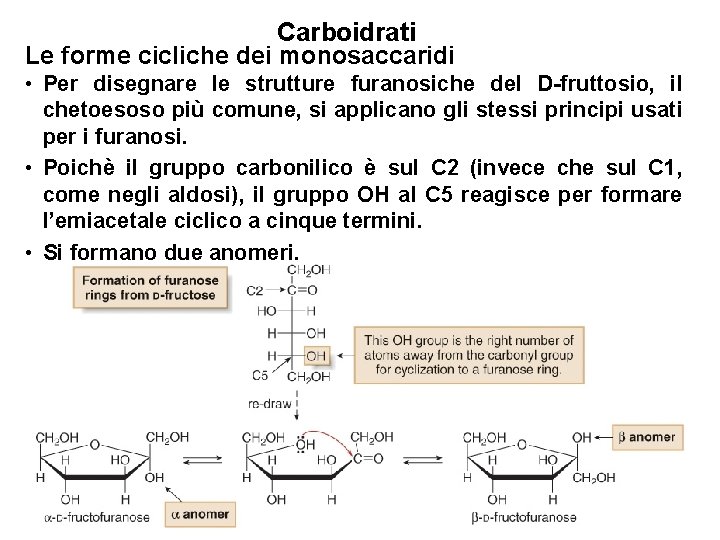
Carboidrati Le forme cicliche dei monosaccaridi • Alcuni monosaccaridi—in particolare gli aldopentosi e i chetoesosi—formano in soluzione anelli furanosidici, e non piranosidici. 32

Carboidrati Le forme cicliche dei monosaccaridi • Per disegnare le strutture furanosiche del D-fruttosio, il chetoesoso più comune, si applicano gli stessi principi usati per i furanosi. • Poichè il gruppo carbonilico è sul C 2 (invece che sul C 1, come negli aldosi), il gruppo OH al C 5 reagisce per formare l’emiacetale ciclico a cinque termini. • Si formano due anomeri. 33

Carboidrati Glicosidi • Poiché i monosaccaridi esistono in soluzione in un equilibrio tra forme cicliche e acicliche, possono dare tipi differenti di reazioni: [1] Reazione dell’emiacetale [2] Reazione dei gruppi ossidrilici [3] Reazioni del gruppo carbonilico • Anche se la forma aciclica di un monosaccaride può essere presente solo in tracce, l’ equilibrio può essere spostato in suo favore se il gruppo carbonilico della forma aciclica reagisce con un reagente. In queste condizioni, la concentrazione all’equilibrio della forma aciclica verrà diminuita, spostando l’equilibrio verso destra per compensare la perdita, formando nuovamente la forma aciclica. • Notare che i monosaccaridi hanno due diversi tipi di gruppi 34 OH— OH alcolici ed OH emiacetalici.

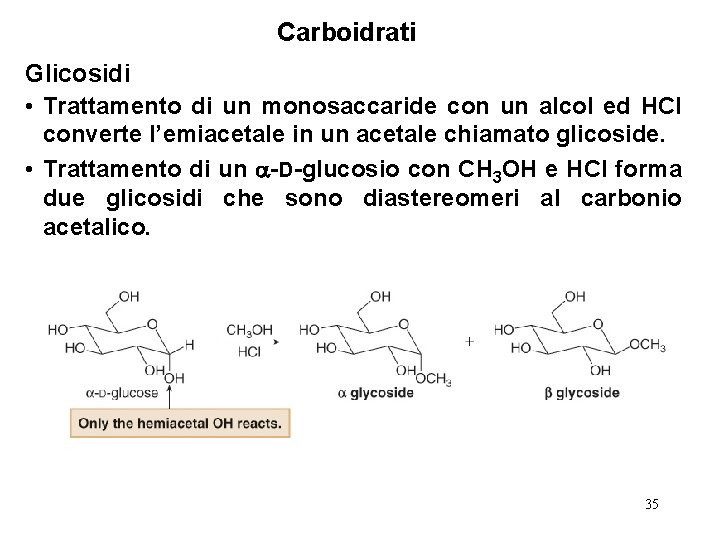
Carboidrati Glicosidi • Trattamento di un monosaccaride con un alcol ed HCl converte l’emiacetale in un acetale chiamato glicoside. • Trattamento di un -D-glucosio con CH 3 OH e HCl forma due glicosidi che sono diastereomeri al carbonio acetalico. 35

Carboidrati Glicosidi 36

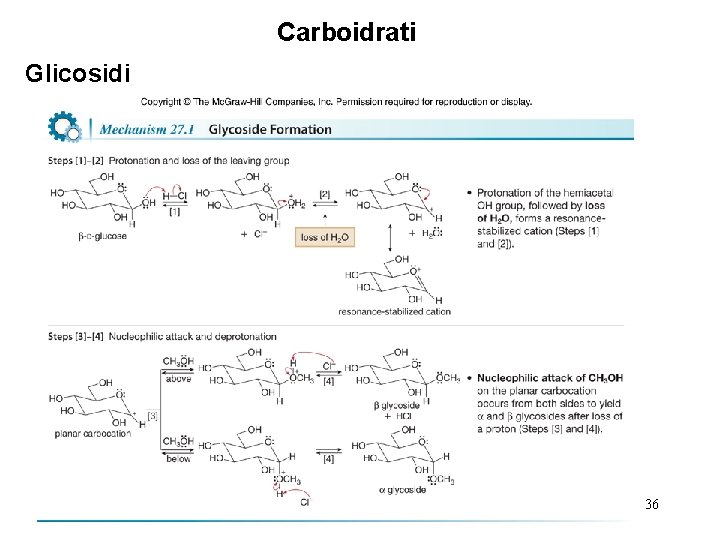
Carboidrati Glicosidi • Il meccanismo spiega perché reagisce solo il gruppo OH emiacetalico. Protonazione dell’OH emiacetalico, seguita da perdita di H 2 O, forma un carbocatione stabilizzato per risonanza. Un carbocatione stabilizzato per risonanza non si può formare perdita di H 2 O da parte di qualsiasi altro gruppo OH. • Diversamente dagli emiacetali ciclici, i glicosidi sono acetali, e così essi non danno mutarotazione. Quando un singolo glicoside viene sciolto in acqua, non è convertito in una miscela in equilibrio di glicosidi e . • I glicosidi sono acetali con un gruppo alcossi (OR) legato al carbonio 37 anomerico.

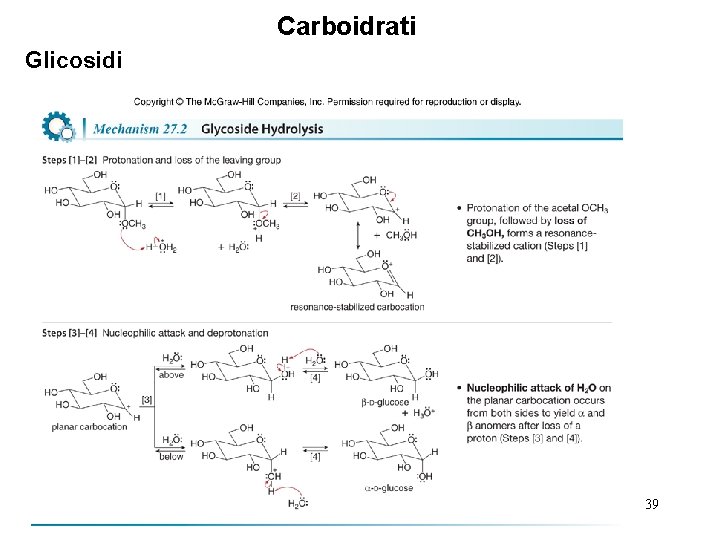
Carboidrati Glicosidi • Poiché i glicosidi sono acetali, sono idrolizzati con acido ed acqua ad emiacetali ciclici ed una olecula di alcol. • Da un singolo glicoside si forma una miscela di due anomeri. • Il meccanismo di idrolisi dei glicosidi è esattamente l’inverso della loro formazione. 38

Carboidrati Glicosidi 39

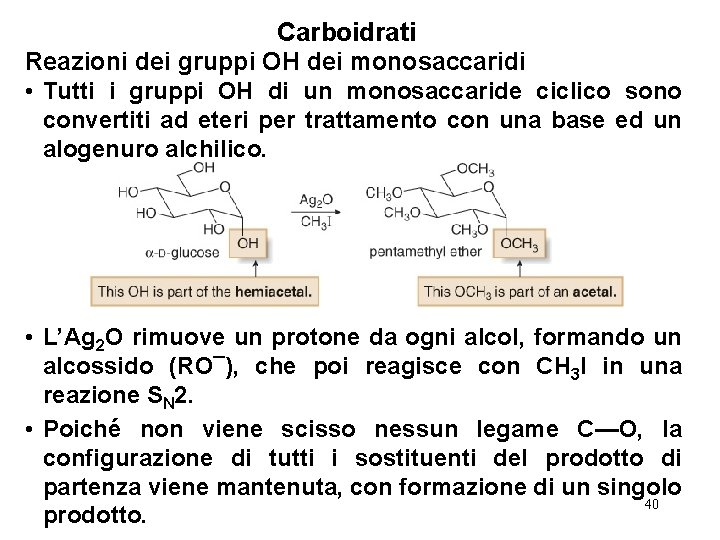
Carboidrati Reazioni dei gruppi OH dei monosaccaridi • Tutti i gruppi OH di un monosaccaride ciclico sono convertiti ad eteri per trattamento con una base ed un alogenuro alchilico. • L’Ag 2 O rimuove un protone da ogni alcol, formando un alcossido (RO¯), che poi reagisce con CH 3 I in una reazione SN 2. • Poiché non viene scisso nessun legame C—O, la configurazione di tutti i sostituenti del prodotto di partenza viene mantenuta, con formazione di un singolo 40 prodotto.

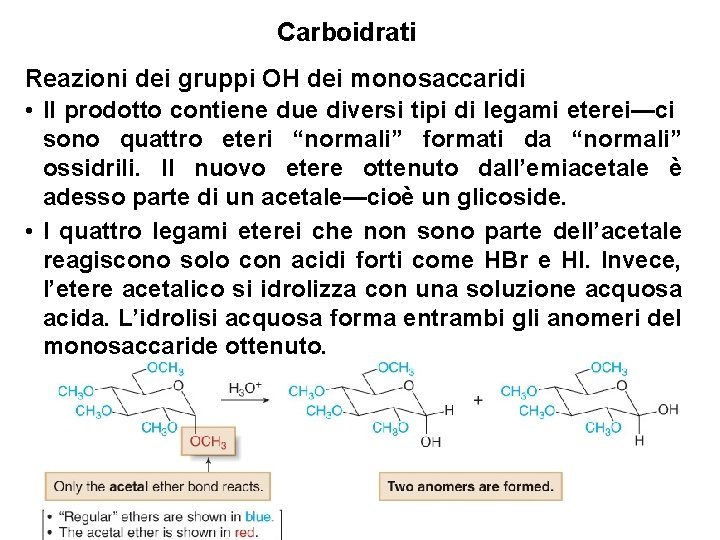
Carboidrati Reazioni dei gruppi OH dei monosaccaridi • Il prodotto contiene due diversi tipi di legami eterei—ci sono quattro eteri “normali” formati da “normali” ossidrili. Il nuovo etere ottenuto dall’emiacetale è adesso parte di un acetale—cioè un glicoside. • I quattro legami eterei che non sono parte dell’acetale reagiscono solo con acidi forti come HBr e HI. Invece, l’etere acetalico si idrolizza con una soluzione acquosa acida. L’idrolisi acquosa forma entrambi gli anomeri del monosaccaride ottenuto. 41

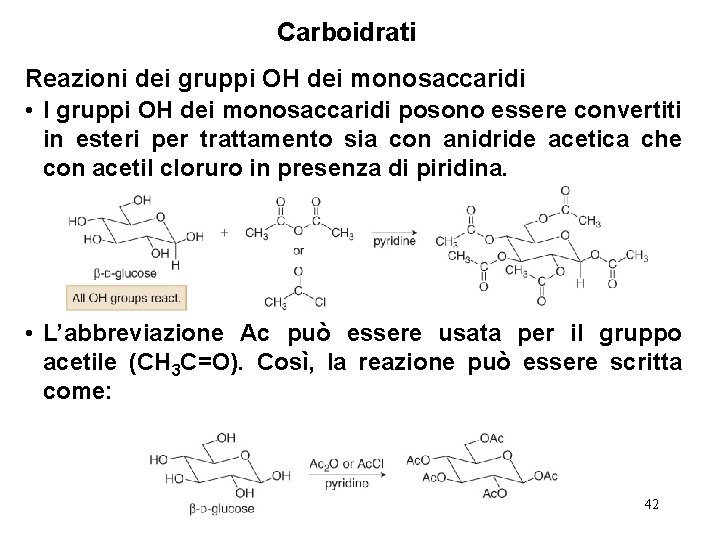
Carboidrati Reazioni dei gruppi OH dei monosaccaridi • I gruppi OH dei monosaccaridi posono essere convertiti in esteri per trattamento sia con anidride acetica che con acetil cloruro in presenza di piridina. • L’abbreviazione Ac può essere usata per il gruppo acetile (CH 3 C=O). Così, la reazione può essere scritta come: 42

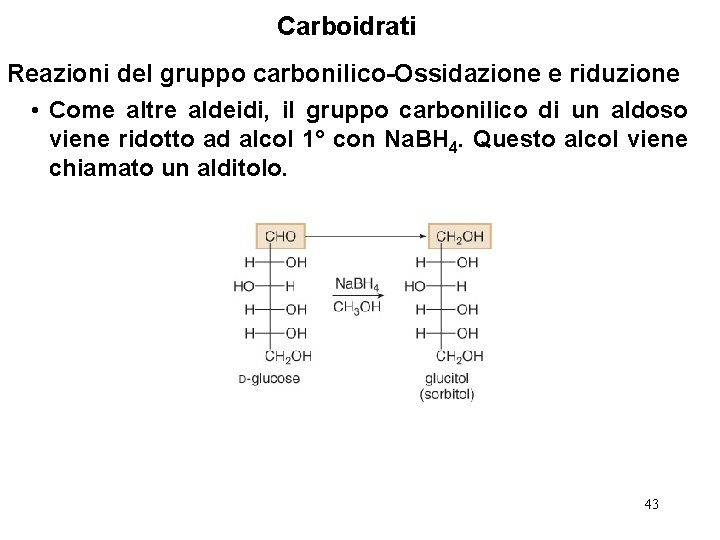
Carboidrati Reazioni del gruppo carbonilico-Ossidazione e riduzione • Come altre aldeidi, il gruppo carbonilico di un aldoso viene ridotto ad alcol 1° con Na. BH 4. Questo alcol viene chiamato un alditolo. 43

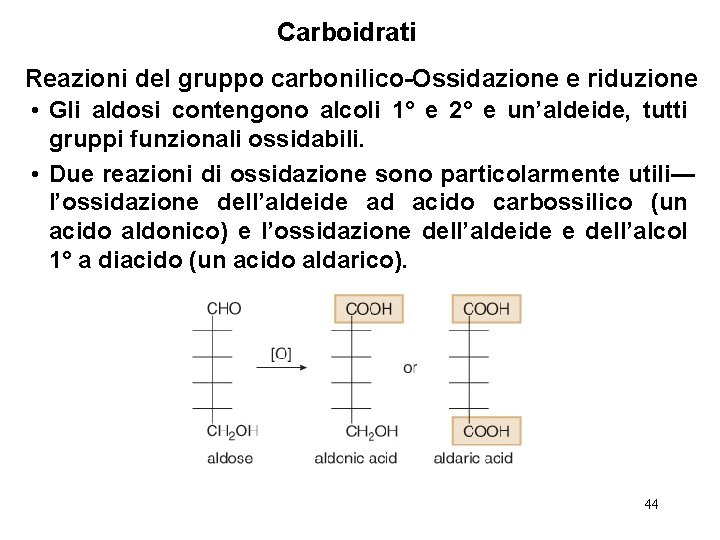
Carboidrati Reazioni del gruppo carbonilico-Ossidazione e riduzione • Gli aldosi contengono alcoli 1° e 2° e un’aldeide, tutti gruppi funzionali ossidabili. • Due reazioni di ossidazione sono particolarmente utili— l’ossidazione dell’aldeide ad acido carbossilico (un acido aldonico) e l’ossidazione dell’aldeide e dell’alcol 1° a diacido (un acido aldarico). 44
![Carboidrati Reazioni del gruppo carbonilicoOssidazione e riduzione 1 Ossidazione dellaldeide ad acido carbossilico Tre Carboidrati Reazioni del gruppo carbonilico-Ossidazione e riduzione [1] Ossidazione dell’aldeide ad acido carbossilico Tre](https://slidetodoc.com/presentation_image_h/07c1c7da45e9929c18608aa6a1e07572/image-45.jpg)
Carboidrati Reazioni del gruppo carbonilico-Ossidazione e riduzione [1] Ossidazione dell’aldeide ad acido carbossilico Tre reagenti usati per questo processo producono un caratteristico cambiamento di colore perché l’agente ossidante viene ridotto ad un prodotto colorato visibile. • Il reagente di Tollens (Ag 2 O, NH 4 OH) forma uno specchio d’argento (Ag). • I reagenti di Benedict e Fehling usano il Cu 2+ blu che è ridotto ad un solido rosso mattone (Cu 2 O) in un test positivo. Sfortunatamente, nessuno di questi reagenti fornisce alte rese dell’acido aldonico. Quando è necessario ottenere l’acido aldonico per ulteriori reazioni, si usa come agente ossidante Br 2 + H 2 O. 45
![Carboidrati Reazioni del gruppo carbonilicoOssidazione e riduzione 1 Ossidazione dellaldeide ad acido carbossilico 46 Carboidrati Reazioni del gruppo carbonilico-Ossidazione e riduzione [1] Ossidazione dell’aldeide ad acido carbossilico 46](https://slidetodoc.com/presentation_image_h/07c1c7da45e9929c18608aa6a1e07572/image-46.jpg)
Carboidrati Reazioni del gruppo carbonilico-Ossidazione e riduzione [1] Ossidazione dell’aldeide ad acido carbossilico 46

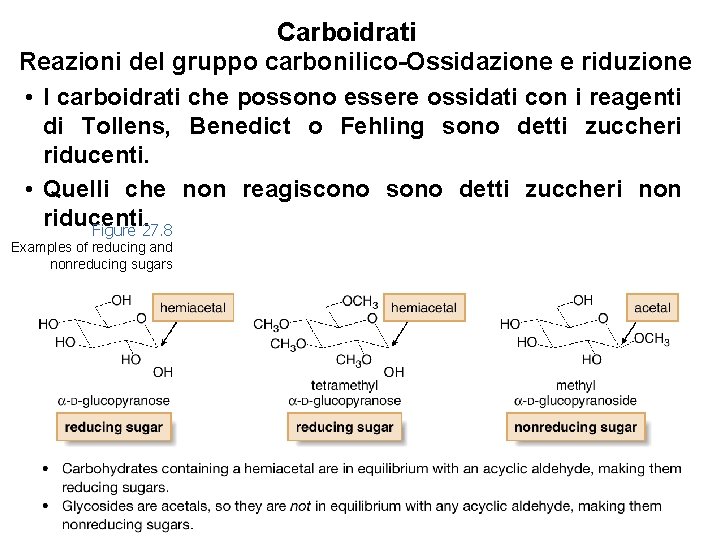
Carboidrati Reazioni del gruppo carbonilico-Ossidazione e riduzione • I carboidrati che possono essere ossidati con i reagenti di Tollens, Benedict o Fehling sono detti zuccheri riducenti. • Quelli che non reagiscono sono detti zuccheri non riducenti. Figure 27. 8 Examples of reducing and nonreducing sugars 47
![Carboidrati Reazioni del gruppo carbonilicoOssidazione e riduzione 2 Ossidazione dellaldeide e dellalcol 1 a Carboidrati Reazioni del gruppo carbonilico-Ossidazione e riduzione [2] Ossidazione dell’aldeide e dell’alcol 1° a](https://slidetodoc.com/presentation_image_h/07c1c7da45e9929c18608aa6a1e07572/image-48.jpg)
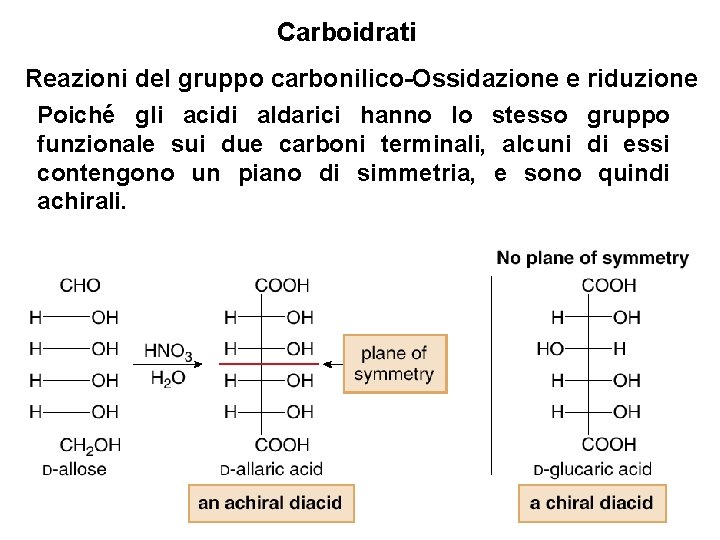
Carboidrati Reazioni del gruppo carbonilico-Ossidazione e riduzione [2] Ossidazione dell’aldeide e dell’alcol 1° a un diacido Il gruppo aldeidico e l’alcol 1° di un aldoso vengono ossidati ad acidi carbossilici per trattamento con acido nitrico tiepido, formando un acido aldarico. 48

Carboidrati Reazioni del gruppo carbonilico-Ossidazione e riduzione Poiché gli acidi aldarici hanno lo stesso gruppo funzionale sui due carboni terminali, alcuni di essi contengono un piano di simmetria, e sono quindi achirali. 49

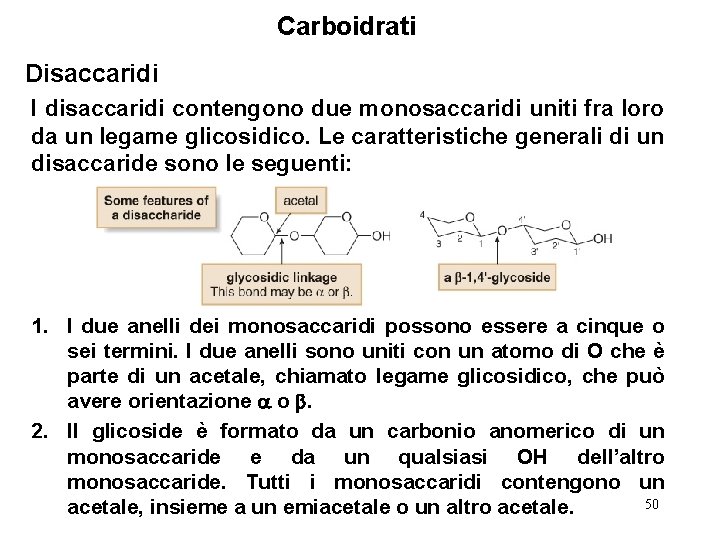
Carboidrati Disaccaridi I disaccaridi contengono due monosaccaridi uniti fra loro da un legame glicosidico. Le caratteristiche generali di un disaccaride sono le seguenti: 1. I due anelli dei monosaccaridi possono essere a cinque o sei termini. I due anelli sono uniti con un atomo di O che è parte di un acetale, chiamato legame glicosidico, che può avere orientazione o . 2. Il glicoside è formato da un carbonio anomerico di un monosaccaride e da un qualsiasi OH dell’altro monosaccaride. Tutti i monosaccaridi contengono un 50 acetale, insieme a un emiacetale o un altro acetale.

Carboidrati Disaccaridi 3. ciascun anello si numerano partendo dal carbonio anomerico. Gli apici (’) vengono usati per indicare gli atomi dell’anello che non contiene il glicoside. I disaccaridi più comuni sono formati con il gruppo OH 4’. I tre disaccaridi più abbondanti sono il maltosio, il lattosio ed il saccarosio. 51

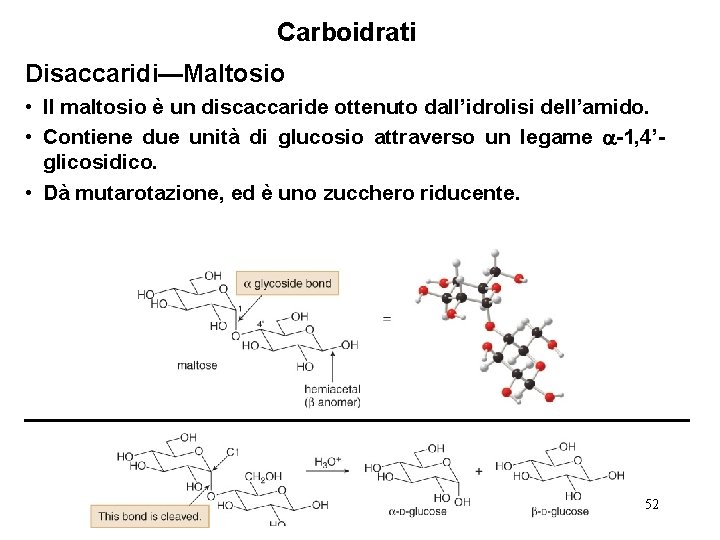
Carboidrati Disaccaridi—Maltosio • Il maltosio è un discaccaride ottenuto dall’idrolisi dell’amido. • Contiene due unità di glucosio attraverso un legame -1, 4’glicosidico. • Dà mutarotazione, ed è uno zucchero riducente. 52

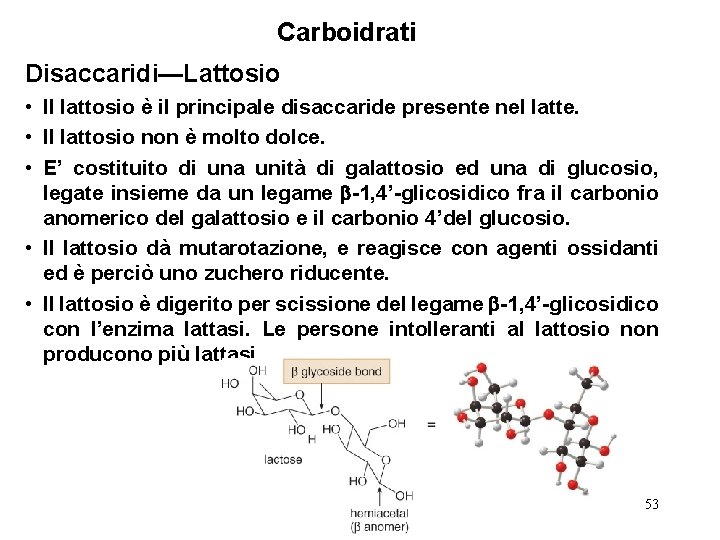
Carboidrati Disaccaridi—Lattosio • Il lattosio è il principale disaccaride presente nel latte. • Il lattosio non è molto dolce. • E’ costituito di una unità di galattosio ed una di glucosio, legate insieme da un legame -1, 4’-glicosidico fra il carbonio anomerico del galattosio e il carbonio 4’del glucosio. • Il lattosio dà mutarotazione, e reagisce con agenti ossidanti ed è perciò uno zuchero riducente. • Il lattosio è digerito per scissione del legame -1, 4’-glicosidico con l’enzima lattasi. Le persone intolleranti al lattosio non producono più lattasi. 53

Carboidrati Disaccaridi—Saccarosio • Il saccarosio è il disaccaride che si trova nella canna da zucchero. E’ il disaccaride più comune in natura. • Il saccarosio contiene una unità di glucosio ed una di fruttosio. Quindi, contiene un’anello a sei termini ed uno a cinque. • L’anello a sei termini è legato attraverso un legame glicosidico al carbonio 2’ di un anello fruttofuranosico. • La numerazione dell’anello fruttofuranosico è differente da quella dell’anello piranosico. In questo caso il carbonio anomerico è definito C 2, così i carboni anomerici del glucosio e del fruttosio sono utilizzati entrambi per formare il legame glicosidico. • Il saccarosio contiene due acetali e nessun emiacetale. Quindi, è uno zucchero non riducente, e non dà mutarotazione. 54

Carboidrati Polisaccaridi • I polisaccaridi contengono tre o più monosaccaridi legati insieme. • I tre poisaccaridi più diffusi in natura sono la cellulosa, l’amido e il glicogeno, ciascuno dei quali è costituito di unità di glucosio che si ripetono e che sono unite con legami glicosidici diversi. Cellulosa • La cellulosa si trova nella parete cellulare di quasi tutte le piante e conferisce supporto e rigidità al legno ed al tronco delle piante. Il cotone è cellulosa praticamente pura. 55

Carboidrati Polisaccaridi—Cellulosa • La cellulosa è un polimero non ramificato composto da unità di glucosio che si ripetono e che sono unite con un legame -1, 4’-glicosidico. • Le lunghe catene lineari si ammassno in strati, creando un’estesa struttura tridimensionale. • Una rete di legami a idrogeno intermolecolari fra le catene e gli strati lascia sulla superficie solo pochi gruppi OH disponibili per formare ponti a idrogeno con l’acqua, rendendo questo composto molto polare ed insolubile in acqua. • La cellulosa può essere idrolizzata a glucosio per scissione dei legami -glicosidici, e fornisce entrambi gli anomeri del glucosio. 56

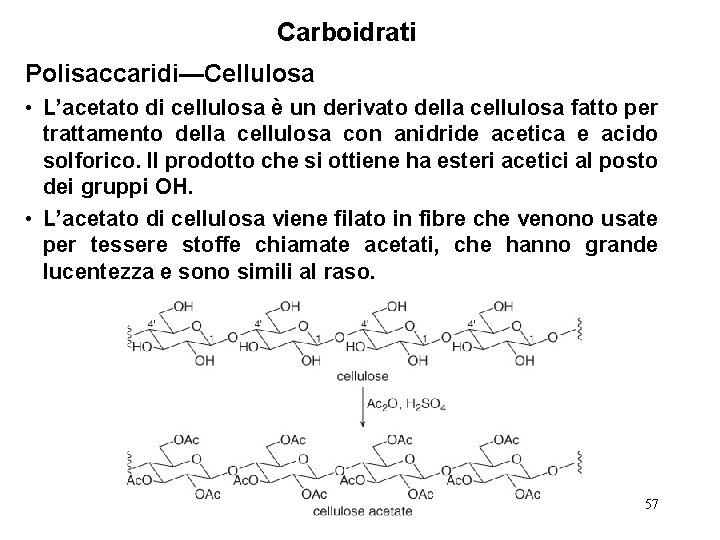
Carboidrati Polisaccaridi—Cellulosa • L’acetato di cellulosa è un derivato della cellulosa fatto per trattamento della cellulosa con anidride acetica e acido solforico. Il prodotto che si ottiene ha esteri acetici al posto dei gruppi OH. • L’acetato di cellulosa viene filato in fibre che venono usate per tessere stoffe chiamate acetati, che hanno grande lucentezza e sono simili al raso. 57

Carboidrati Polisaccaridi—Cellulosa • Nelle cellule, l’idrolisi della cellulosa viene fatta per opera di un enzima che si chiama -glucosidasi, che scinde tutti i legami -glucosidici formati dal glucosio. • Gli esseri umani non possiedono questo enzima, e quindi non possono digerire la cellulosa. • Invece i ruminanti, come i bovini, i cervi e i cammelli hanno nel loro apparato digerente dei batteri che contengono la -glucosidasi, e quindi possono trarre benefici nutrizionali mangiando l’erba e le foglie. 58

Carboidrati Polisaccaridi—Amido • L’amido è il carboidrato più diffuso nei semi e nelle radici delle piante. • L’amido è un polimero composto da unità di glucosio che si ripetono unite da legami -glicosidici. • Le due forme comuni dell’amido sono l’amilosio e l’amilopectina. 59

Carboidrati Polisaccaridi—Amido • L’amilosio costituisce ~ 20% delle molecole di amido. Ha uno sheletro non ramificato di molecole di glucosio con legami -1, 4’-glicosidici. • A causa di questo legame, l’amilosio adotta una struttura elicoidale. • L’amilopectina costituisce ~ 80% delle molecole di amido. Oltre ad avere uno scheletro di unità di glucosio unite da legami -1, 4’-glicosidici, contiene anche una quantità considerevole di ramificazioni lungo la catena. Le ramificazioni sono legate alla catena con legami -1, 6’-glicosidici. • Entrambe le forme di amido sono idrosolubili. • L’apparato digerente umano ha gli enzimi 60 glucosidasi necessari per idrolizare l’amido ad unità

Carboidrati Polisaccaridi—Glicogeno • Il glicogeno è la forma più diffusa per immagazzinare i polisaccaridi negli animali. • E’ un polimero del glucosio contenente legami glicosidici. Ha la struttura ramificata simile all’amilopectina, ma con molte più ramificazioni. • Il glicogeno viene immagazzinato principalmente nel fegato e nei muscoli. Quando è necessario il glucosio fornisce energia alle cellule, dalla coda del polimero di glicogeno vengono idrolizzate delle unità di glucosio, che vengono poi ulteriormente metabolizzate con produzione di energia. 61
 Janice gorzynski smith
Janice gorzynski smith Organic chemistry
Organic chemistry Organic chemistry david klein 3rd edition
Organic chemistry david klein 3rd edition Organic chemistry (3rd) edition chapter 1 problem 16s
Organic chemistry (3rd) edition chapter 1 problem 16s Is alkane an organic compound
Is alkane an organic compound Acid chloride + grignard reagent
Acid chloride + grignard reagent Nomenclature of ethers
Nomenclature of ethers Organic chemistry third edition david klein
Organic chemistry third edition david klein Halohydrin
Halohydrin John wiley & sons, inc.
John wiley & sons, inc. Janice smith
Janice smith Ib organic chemistry functional groups
Ib organic chemistry functional groups Inorganic chemistry vs organic chemistry
Inorganic chemistry vs organic chemistry Founder of organic chemistry
Founder of organic chemistry Chemistry of soap making
Chemistry of soap making Ester organic chemistry
Ester organic chemistry Alkene family
Alkene family Ee organic chemistry
Ee organic chemistry Ario organic chemistry
Ario organic chemistry What is the leveling effect organic chemistry
What is the leveling effect organic chemistry What functional group is ch3
What functional group is ch3 Objective lab report example
Objective lab report example Organic chemistry conversion chart
Organic chemistry conversion chart Organic chemistry grade 10
Organic chemistry grade 10 Organic chemistry
Organic chemistry Organic vs inorganic compounds
Organic vs inorganic compounds Organic chemistry wade
Organic chemistry wade Met et prop but pent hex hept oct
Met et prop but pent hex hept oct Alkane cracking
Alkane cracking Eth meth prop but pent
Eth meth prop but pent Organic chemistry myanmar
Organic chemistry myanmar Hhcchh
Hhcchh M+2 mass spec
M+2 mass spec Hono organic chemistry
Hono organic chemistry Leaving group ability
Leaving group ability Organic chemistry topic 11
Organic chemistry topic 11 Chapter 22 review organic chemistry section 1 answers
Chapter 22 review organic chemistry section 1 answers Organic chemistry reaction pathways
Organic chemistry reaction pathways Alkene alcohol naming
Alkene alcohol naming What is organic chemistry like
What is organic chemistry like Organic vs inorganic molecules
Organic vs inorganic molecules Organic chemistry vocabulary
Organic chemistry vocabulary Separation scheme of caffeine from vivarin tablets
Separation scheme of caffeine from vivarin tablets A level chemistry ocr organic synthesis
A level chemistry ocr organic synthesis Fatty acids definition
Fatty acids definition Ario acidity
Ario acidity How to calculate yield in chemistry
How to calculate yield in chemistry Polarimetry organic chemistry
Polarimetry organic chemistry Radicals
Radicals Hammond's postulate organic chemistry
Hammond's postulate organic chemistry Organic chemistry chapter 9
Organic chemistry chapter 9 Chemistry-ethics case studies
Chemistry-ethics case studies What functional group is ch3
What functional group is ch3 This name
This name Organic chemistry chapter 1 problem 59pp
Organic chemistry chapter 1 problem 59pp Hammond's postulate organic chemistry
Hammond's postulate organic chemistry Structure and bonding in organic chemistry
Structure and bonding in organic chemistry Conformation of sugars ppt
Conformation of sugars ppt Organic chemistry
Organic chemistry Organic chemistry
Organic chemistry Organic chemistry
Organic chemistry Organic chemistry
Organic chemistry