Organic Chemistry Second Edition Janice Gorzynski Smith University





- Slides: 40

Organic Chemistry, Second Edition Janice Gorzynski Smith University of Hawai’i Chapter 23 Lecture Outline Prepared by Rabi Ann Musah State University of New York at Albany Copyright © The Mc. Graw-Hill Companies, Inc. Permission required for reproduction or display. 1

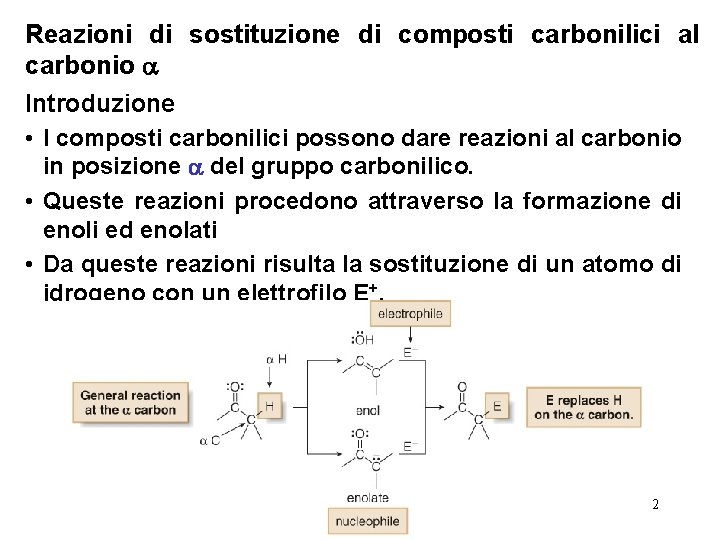
Reazioni di sostituzione di composti carbonilici al carbonio Introduzione • I composti carbonilici possono dare reazioni al carbonio in posizione del gruppo carbonilico. • Queste reazioni procedono attraverso la formazione di enoli ed enolati • Da queste reazioni risulta la sostituzione di un atomo di idrogeno con un elettrofilo E+. 2

Reazioni di sostituzione di composti carbonilici al carbonio Enoli • Ricordare che la forma enolica e la forma chetonica sono tautomeri del gruppo carbonilico che differiscono per la posizione del doppio legame e di un protone. • Questi isomeri costituzionali sono in equilibrio tra di loro. 3

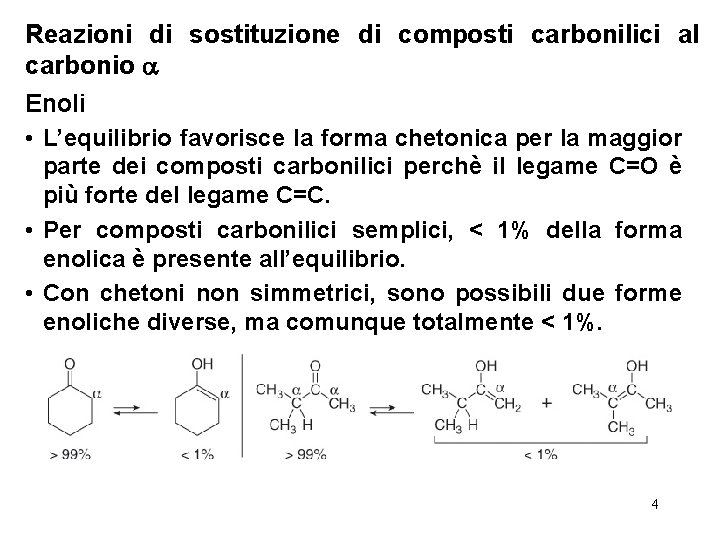
Reazioni di sostituzione di composti carbonilici al carbonio Enoli • L’equilibrio favorisce la forma chetonica per la maggior parte dei composti carbonilici perchè il legame C=O è più forte del legame C=C. • Per composti carbonilici semplici, < 1% della forma enolica è presente all’equilibrio. • Con chetoni non simmetrici, sono possibili due forme enoliche diverse, ma comunque totalmente < 1%. 4

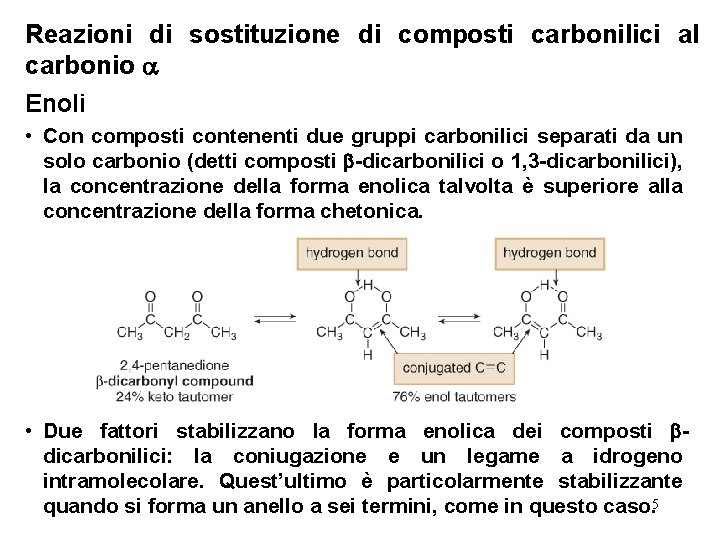
Reazioni di sostituzione di composti carbonilici al carbonio Enoli • Con composti contenenti due gruppi carbonilici separati da un solo carbonio (detti composti -dicarbonilici o 1, 3 -dicarbonilici), la concentrazione della forma enolica talvolta è superiore alla concentrazione della forma chetonica. • Due fattori stabilizzano la forma enolica dei composti dicarbonilici: la coniugazione e un legame a idrogeno intramolecolare. Quest’ultimo è particolarmente stabilizzante quando si forma un anello a sei termini, come in questo caso. 5

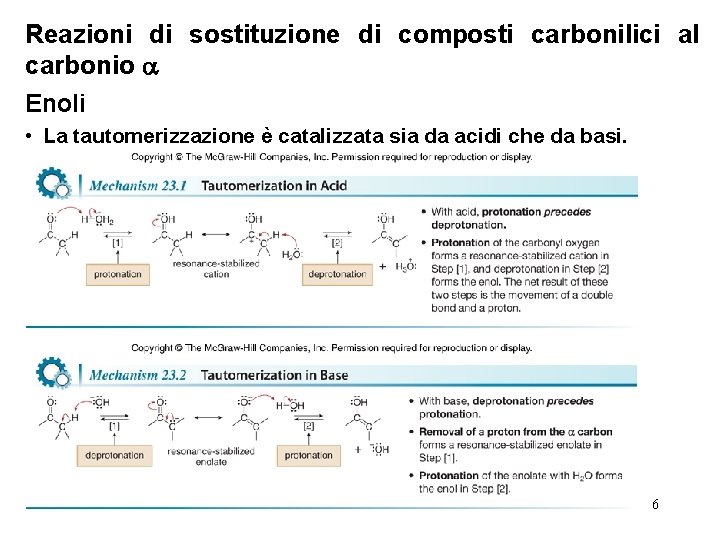
Reazioni di sostituzione di composti carbonilici al carbonio Enoli • La tautomerizzazione è catalizzata sia da acidi che da basi. 6

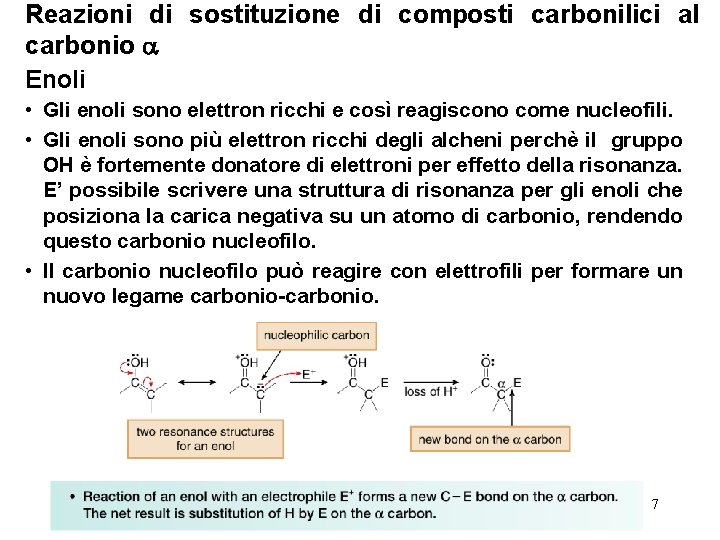
Reazioni di sostituzione di composti carbonilici al carbonio Enoli • Gli enoli sono elettron ricchi e così reagiscono come nucleofili. • Gli enoli sono più elettron ricchi degli alcheni perchè il gruppo OH è fortemente donatore di elettroni per effetto della risonanza. E’ possibile scrivere una struttura di risonanza per gli enoli che posiziona la carica negativa su un atomo di carbonio, rendendo questo carbonio nucleofilo. • Il carbonio nucleofilo può reagire con elettrofili per formare un nuovo legame carbonio-carbonio. 7

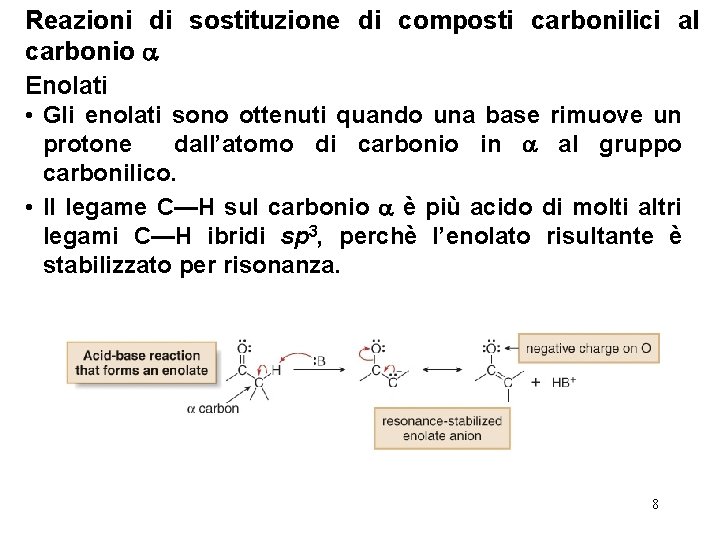
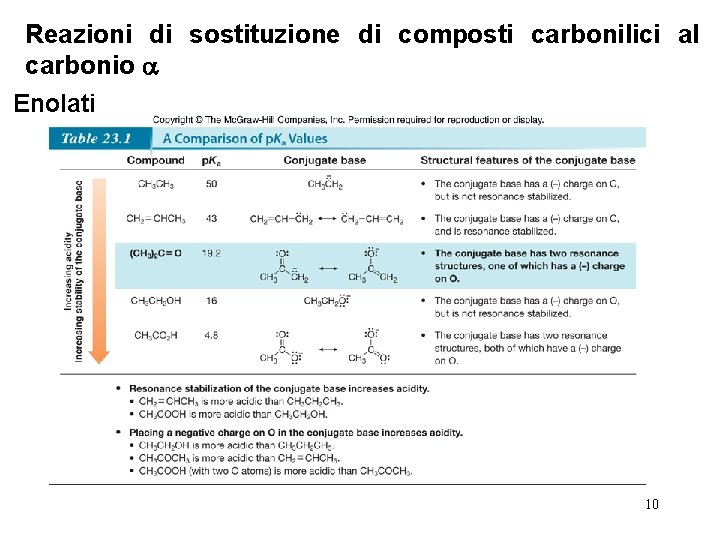
Reazioni di sostituzione di composti carbonilici al carbonio Enolati • Gli enolati sono ottenuti quando una base rimuove un protone dall’atomo di carbonio in al gruppo carbonilico. • Il legame C—H sul carbonio è più acido di molti altri legami C—H ibridi sp 3, perchè l’enolato risultante è stabilizzato per risonanza. 8

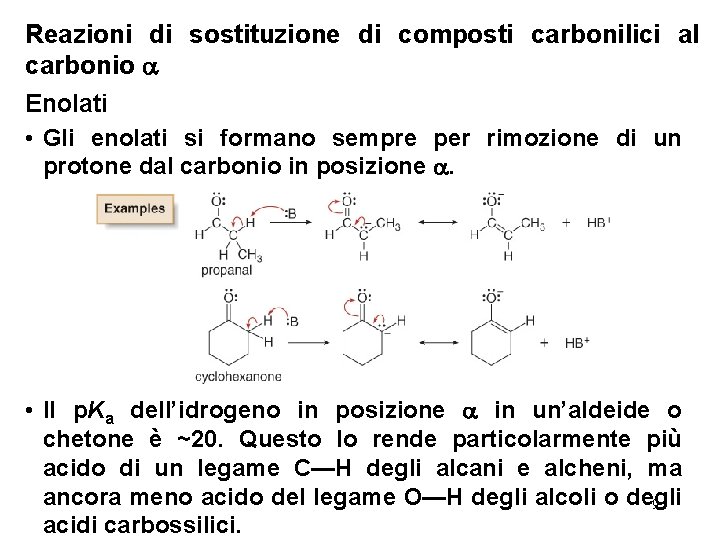
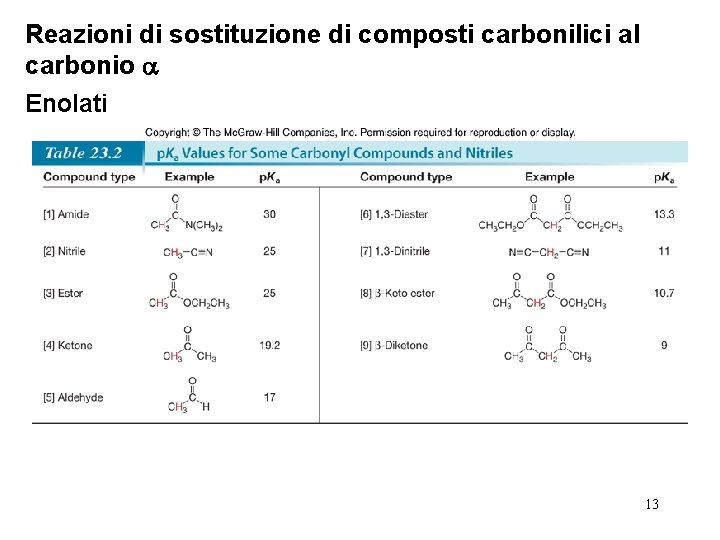
Reazioni di sostituzione di composti carbonilici al carbonio Enolati • Gli enolati si formano sempre per rimozione di un protone dal carbonio in posizione . • Il p. Ka dell’idrogeno in posizione in un’aldeide o chetone è ~20. Questo lo rende particolarmente più acido di un legame C—H degli alcani e alcheni, ma ancora meno acido del legame O—H degli alcoli o degli 9 acidi carbossilici.

Reazioni di sostituzione di composti carbonilici al carbonio Enolati 10

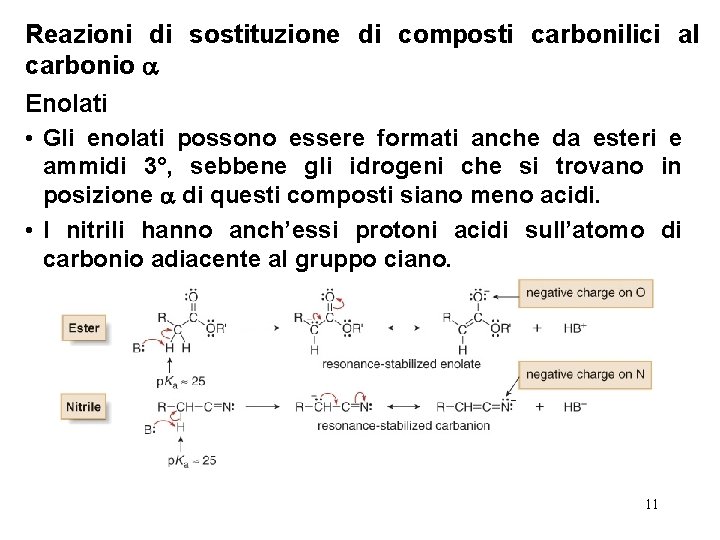
Reazioni di sostituzione di composti carbonilici al carbonio Enolati • Gli enolati possono essere formati anche da esteri e ammidi 3°, sebbene gli idrogeni che si trovano in posizione di questi composti siano meno acidi. • I nitrili hanno anch’essi protoni acidi sull’atomo di carbonio adiacente al gruppo ciano. 11

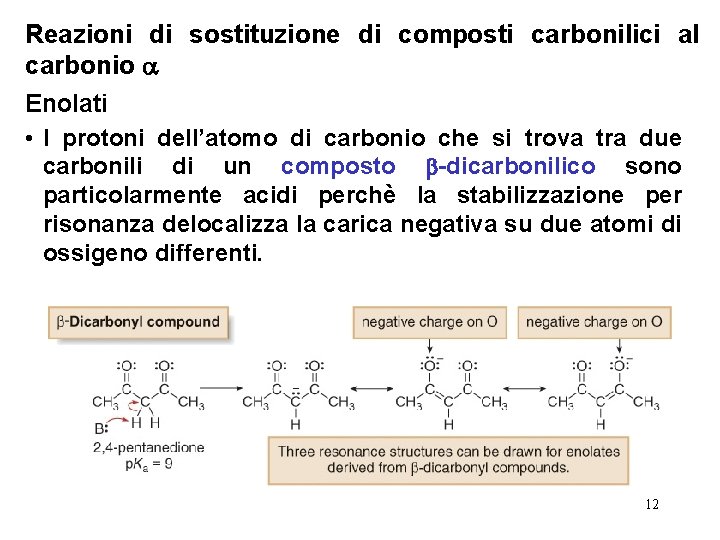
Reazioni di sostituzione di composti carbonilici al carbonio Enolati • I protoni dell’atomo di carbonio che si trova tra due carbonili di un composto -dicarbonilico sono particolarmente acidi perchè la stabilizzazione per risonanza delocalizza la carica negativa su due atomi di ossigeno differenti. 12

Reazioni di sostituzione di composti carbonilici al carbonio Enolati 13

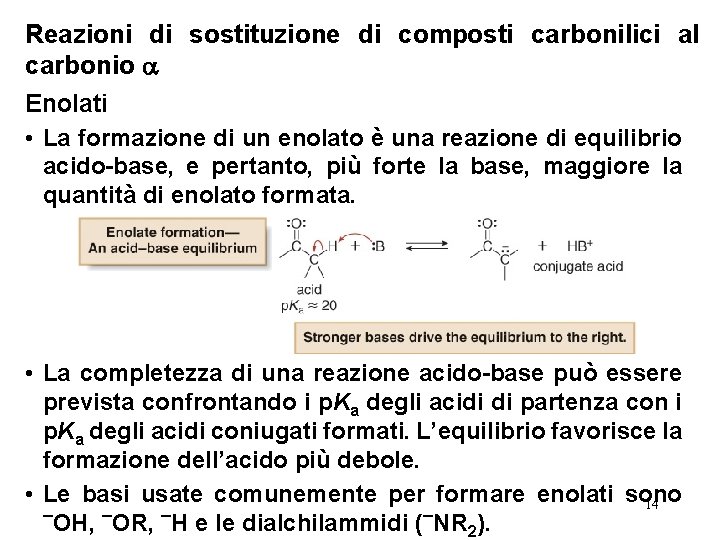
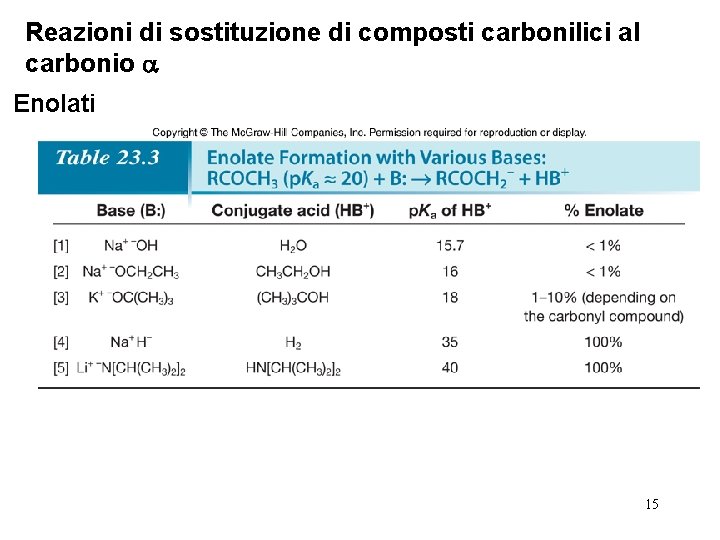
Reazioni di sostituzione di composti carbonilici al carbonio Enolati • La formazione di un enolato è una reazione di equilibrio acido-base, e pertanto, più forte la base, maggiore la quantità di enolato formata. • La completezza di una reazione acido-base può essere prevista confrontando i p. Ka degli acidi di partenza con i p. Ka degli acidi coniugati formati. L’equilibrio favorisce la formazione dell’acido più debole. • Le basi usate comunemente per formare enolati sono 14 ¯OH, ¯OR, ¯H e le dialchilammidi (¯NR 2).

Reazioni di sostituzione di composti carbonilici al carbonio Enolati 15

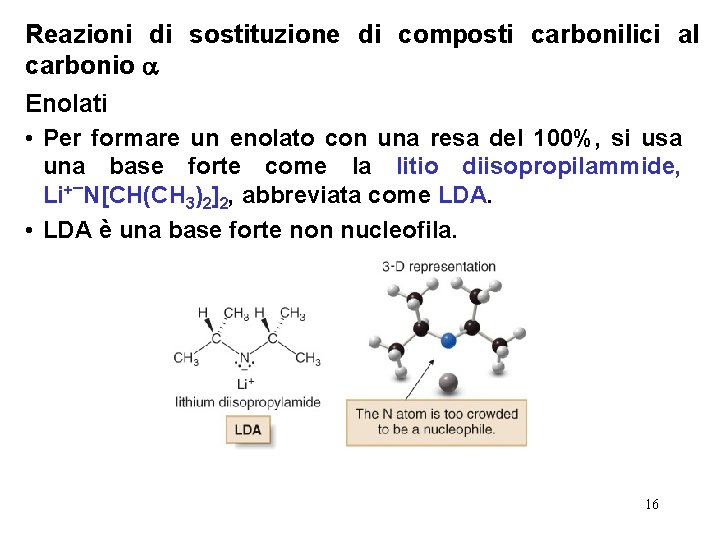
Reazioni di sostituzione di composti carbonilici al carbonio Enolati • Per formare un enolato con una resa del 100%, si usa una base forte come la litio diisopropilammide, Li+¯N[CH(CH 3)2]2, abbreviata come LDA. • LDA è una base forte non nucleofila. 16

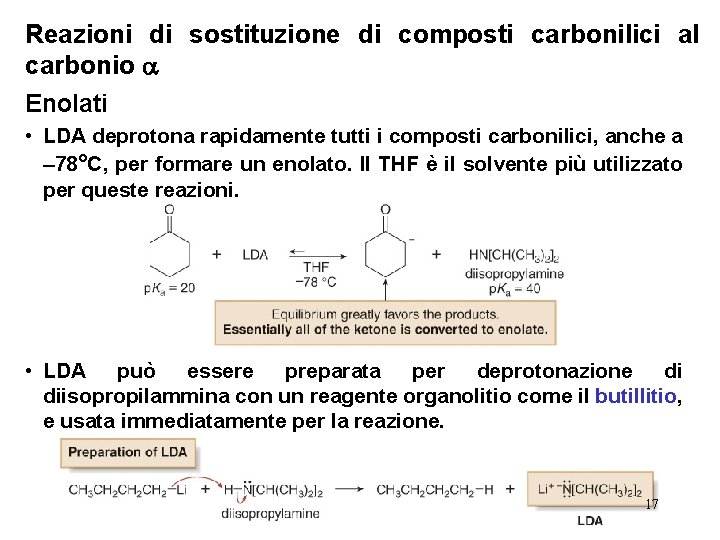
Reazioni di sostituzione di composti carbonilici al carbonio Enolati • LDA deprotona rapidamente tutti i composti carbonilici, anche a – 78°C, per formare un enolato. Il THF è il solvente più utilizzato per queste reazioni. • LDA può essere preparata per deprotonazione di diisopropilammina con un reagente organolitio come il butillitio, e usata immediatamente per la reazione. 17

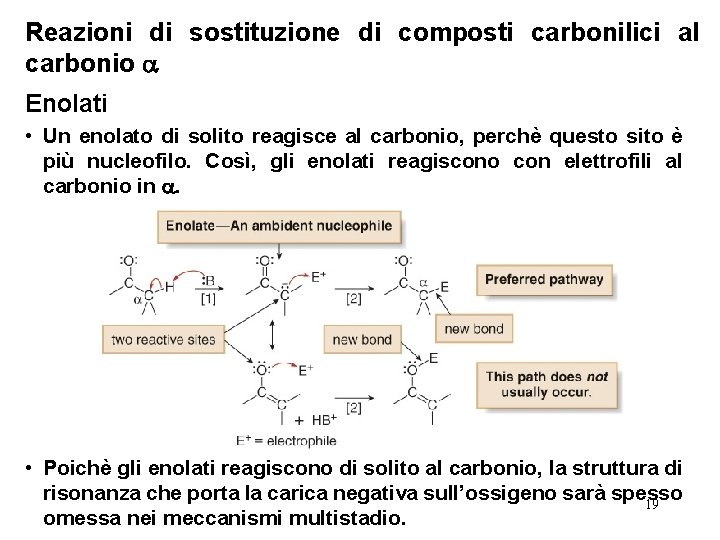
Reazioni di sostituzione di composti carbonilici al carbonio Enolati • Gli enolati sono nucleofili, e come tali, essi reagiscono con molti elettrofili. • Poichè un enolato è stabilizzato dalla risonanza, ha due siti reattivi—l’atomo di carbonio e l’atomo di ossigeno che portano la carica negativa. • Un nucleofilo che possiede due siti reattivi si chiama nucleofilo bidentato. • In teoria, entrambi gli atomi potrebbero reagire con un elettrofilo per formare due prodotti diversi, uno con un nuovo legame carbonio-carbonio, ed uno con un nuovo legame in cui è coinvolto l’atomo di ossigeno. 18

Reazioni di sostituzione di composti carbonilici al carbonio Enolati • Un enolato di solito reagisce al carbonio, perchè questo sito è più nucleofilo. Così, gli enolati reagiscono con elettrofili al carbonio in . • Poichè gli enolati reagiscono di solito al carbonio, la struttura di risonanza che porta la carica negativa sull’ossigeno sarà spesso 19 omessa nei meccanismi multistadio.

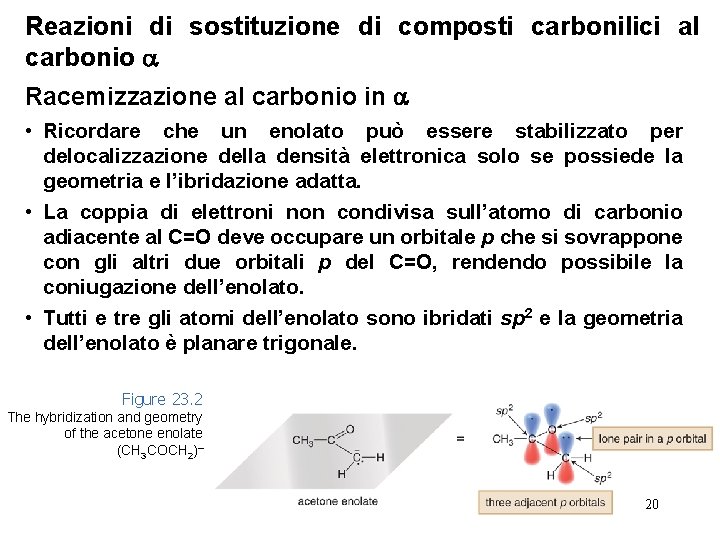
Reazioni di sostituzione di composti carbonilici al carbonio Racemizzazione al carbonio in • Ricordare che un enolato può essere stabilizzato per delocalizzazione della densità elettronica solo se possiede la geometria e l’ibridazione adatta. • La coppia di elettroni non condivisa sull’atomo di carbonio adiacente al C=O deve occupare un orbitale p che si sovrappone con gli altri due orbitali p del C=O, rendendo possibile la coniugazione dell’enolato. • Tutti e tre gli atomi dell’enolato sono ibridati sp 2 e la geometria dell’enolato è planare trigonale. Figure 23. 2 The hybridization and geometry of the acetone enolate (CH 3 COCH 2)– 20

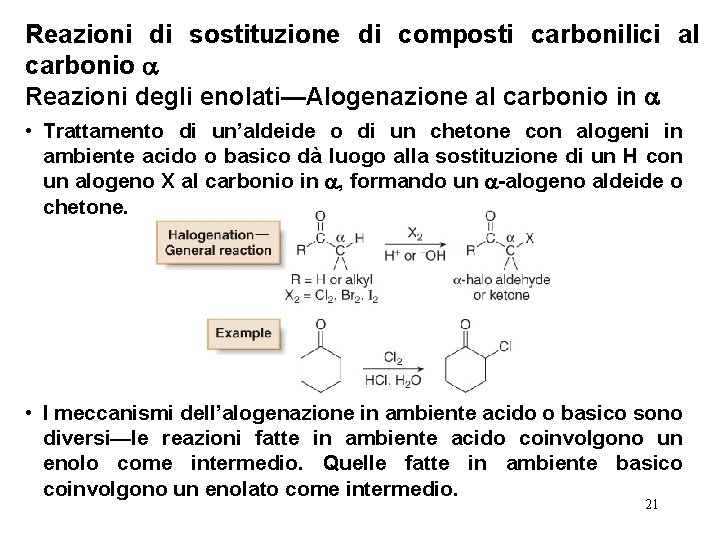
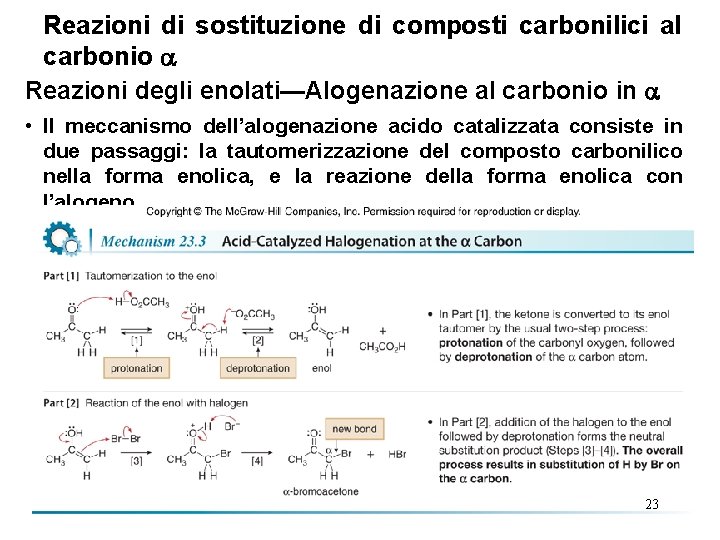
Reazioni di sostituzione di composti carbonilici al carbonio Reazioni degli enolati—Alogenazione al carbonio in • Trattamento di un’aldeide o di un chetone con alogeni in ambiente acido o basico dà luogo alla sostituzione di un H con un alogeno X al carbonio in , formando un -alogeno aldeide o chetone. • I meccanismi dell’alogenazione in ambiente acido o basico sono diversi—le reazioni fatte in ambiente acido coinvolgono un enolo come intermedio. Quelle fatte in ambiente basico coinvolgono un enolato come intermedio. 21

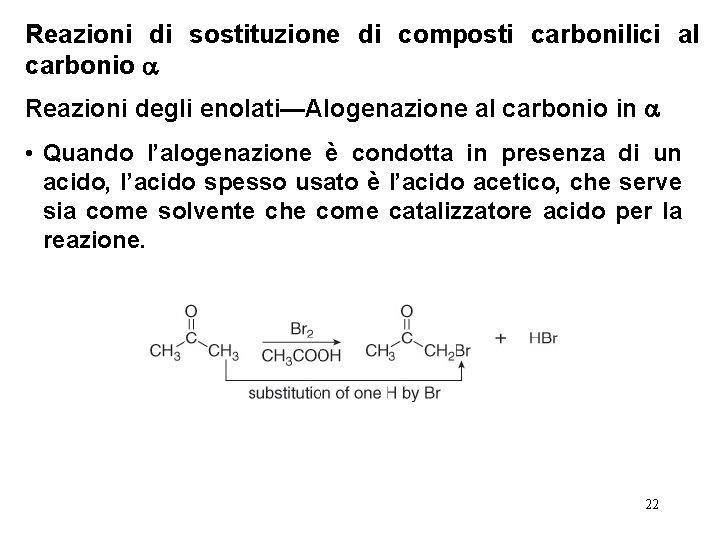
Reazioni di sostituzione di composti carbonilici al carbonio Reazioni degli enolati—Alogenazione al carbonio in • Quando l’alogenazione è condotta in presenza di un acido, l’acido spesso usato è l’acido acetico, che serve sia come solvente che come catalizzatore acido per la reazione. 22

Reazioni di sostituzione di composti carbonilici al carbonio Reazioni degli enolati—Alogenazione al carbonio in • Il meccanismo dell’alogenazione acido catalizzata consiste in due passaggi: la tautomerizzazione del composto carbonilico nella forma enolica, e la reazione della forma enolica con l’alogeno. 23

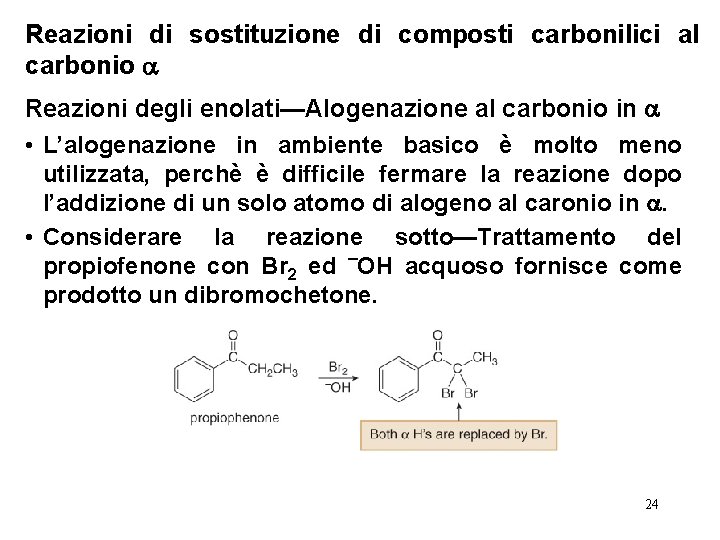
Reazioni di sostituzione di composti carbonilici al carbonio Reazioni degli enolati—Alogenazione al carbonio in • L’alogenazione in ambiente basico è molto meno utilizzata, perchè è difficile fermare la reazione dopo l’addizione di un solo atomo di alogeno al caronio in . • Considerare la reazione sotto—Trattamento del propiofenone con Br 2 ed ¯OH acquoso fornisce come prodotto un dibromochetone. 24

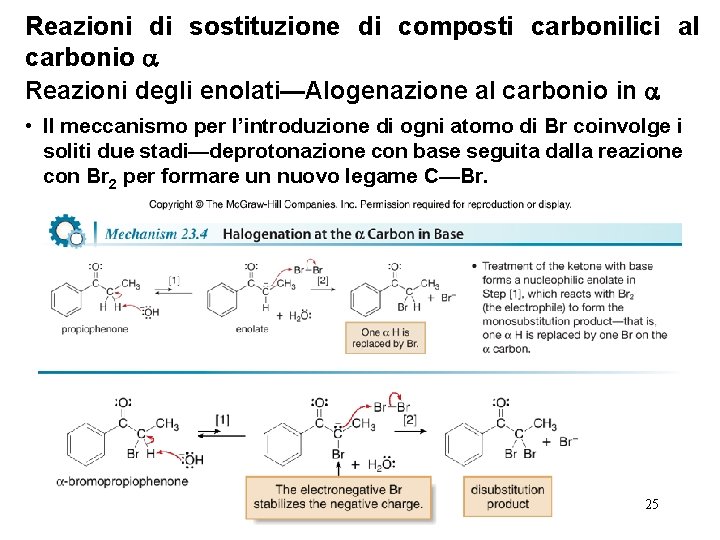
Reazioni di sostituzione di composti carbonilici al carbonio Reazioni degli enolati—Alogenazione al carbonio in • Il meccanismo per l’introduzione di ogni atomo di Br coinvolge i soliti due stadi—deprotonazione con base seguita dalla reazione con Br 2 per formare un nuovo legame C—Br. 25

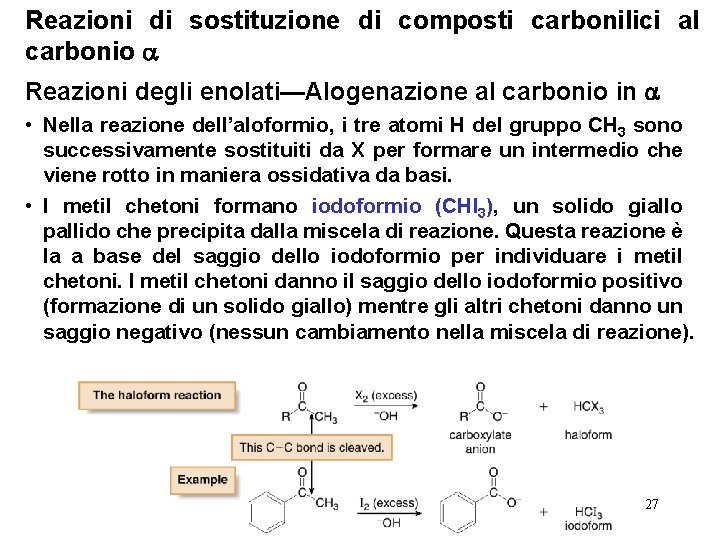
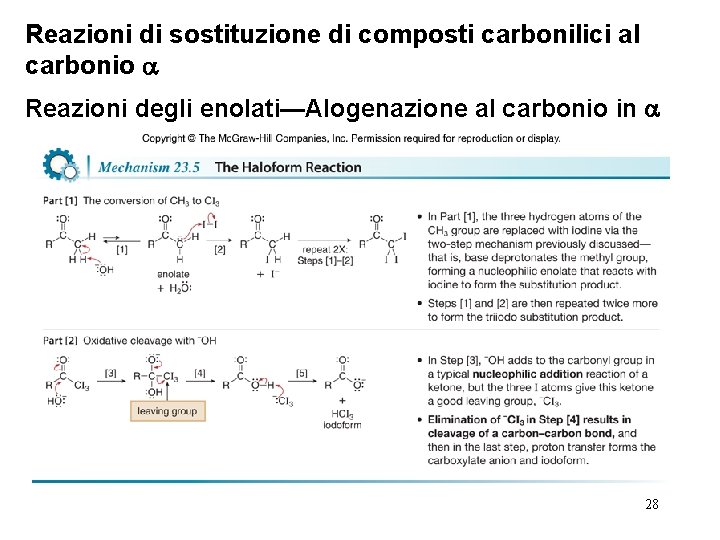
Reazioni di sostituzione di composti carbonilici al carbonio Reazioni degli enolati—Alogenazione al carbonio in • E’ difficile formare questa reazione dopo l’addizione di un atomo di Br perchè l’effetto elettron attrattore dell’atomo di Br stabilizza l’enolato e favorisce la formazione di un secondo enolato. Come risultato, il protone in H dell’ -bromopropiofenone è più acido del il protone in H del propiofenone, il che rende più facile la sua rimozione ad opera di basi. • L’alogenazione di un metil chetone con un eccesso di alogeno, è detta reazione dell’aloformio, e porta come risultato alla rottura di un legame C—C e la formazione di due prodotti, un anione carbossilato e CHX 3 (noto comunemente come aloformio). 26

Reazioni di sostituzione di composti carbonilici al carbonio Reazioni degli enolati—Alogenazione al carbonio in • Nella reazione dell’aloformio, i tre atomi H del gruppo CH 3 sono successivamente sostituiti da X per formare un intermedio che viene rotto in maniera ossidativa da basi. • I metil chetoni formano iodoformio (CHI 3), un solido giallo pallido che precipita dalla miscela di reazione. Questa reazione è la a base del saggio dello iodoformio per individuare i metil chetoni. I metil chetoni danno il saggio dello iodoformio positivo (formazione di un solido giallo) mentre gli altri chetoni danno un saggio negativo (nessun cambiamento nella miscela di reazione). 27

Reazioni di sostituzione di composti carbonilici al carbonio Reazioni degli enolati—Alogenazione al carbonio in 28

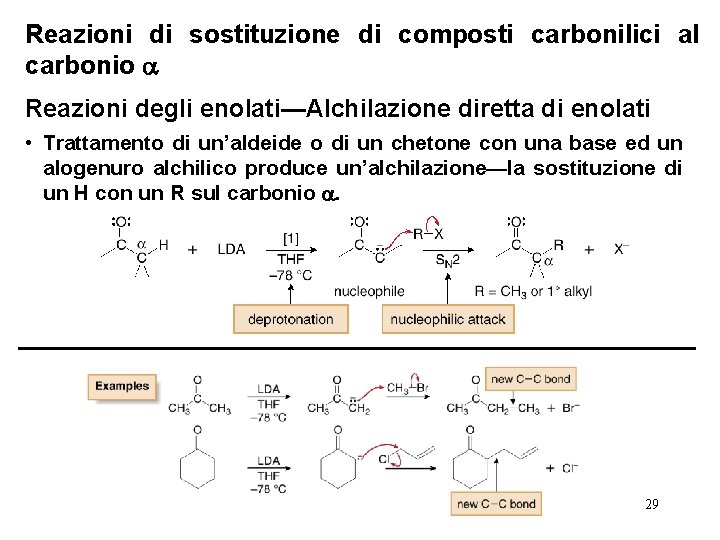
Reazioni di sostituzione di composti carbonilici al carbonio Reazioni degli enolati—Alchilazione diretta di enolati • Trattamento di un’aldeide o di un chetone con una base ed un alogenuro alchilico produce un’alchilazione—la sostituzione di un H con un R sul carbonio . 29

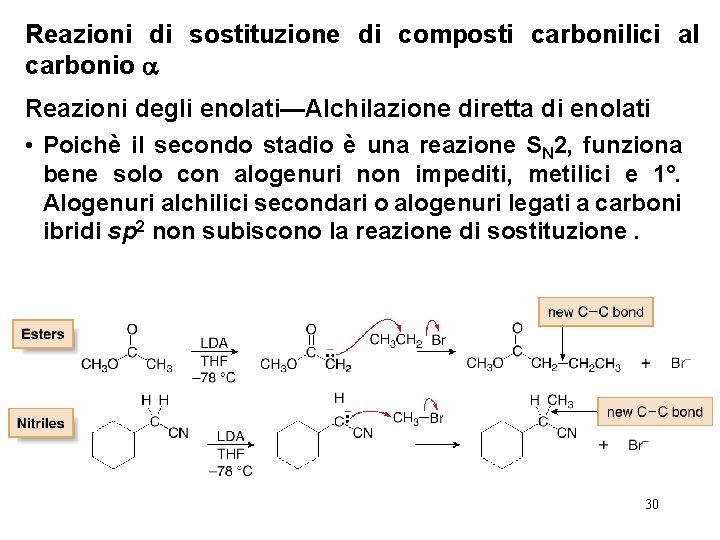
Reazioni di sostituzione di composti carbonilici al carbonio Reazioni degli enolati—Alchilazione diretta di enolati • Poichè il secondo stadio è una reazione SN 2, funziona bene solo con alogenuri non impediti, metilici e 1°. Alogenuri alchilici secondari o alogenuri legati a carboni ibridi sp 2 non subiscono la reazione di sostituzione. 30

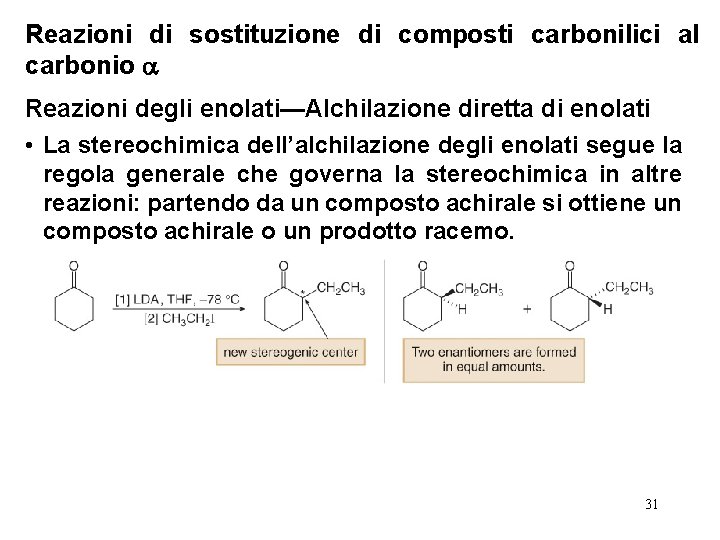
Reazioni di sostituzione di composti carbonilici al carbonio Reazioni degli enolati—Alchilazione diretta di enolati • La stereochimica dell’alchilazione degli enolati segue la regola generale che governa la stereochimica in altre reazioni: partendo da un composto achirale si ottiene un composto achirale o un prodotto racemo. 31

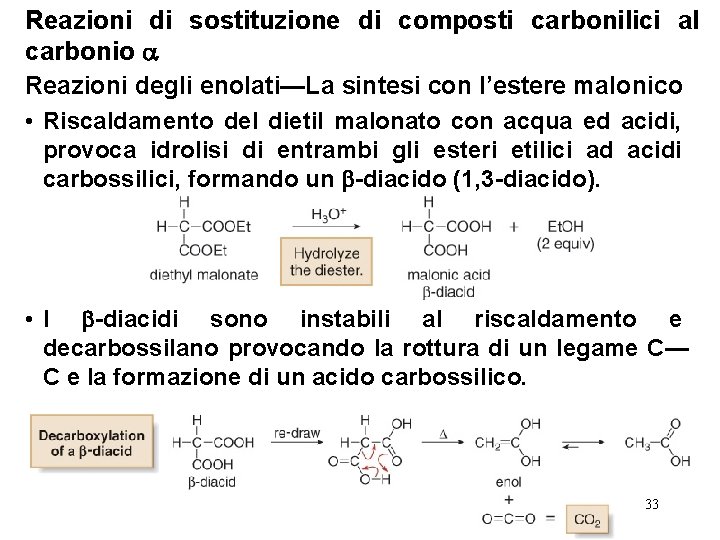
Reazioni di sostituzione di composti carbonilici al carbonio Reazioni degli enolati—La sintesi con l’estere malonico • La sintesi con l’estere malonico fornisce la preparazione di acidi carbossilici con le due strutture generali: • La sintesi con l’estere malonico è un metodo a stadi per convertire il dietil malonato in un acido carbossilico che possiede uno o due gruppi alchilici legati al carbonio in . 32

Reazioni di sostituzione di composti carbonilici al carbonio Reazioni degli enolati—La sintesi con l’estere malonico • Riscaldamento del dietil malonato con acqua ed acidi, provoca idrolisi di entrambi gli esteri etilici ad acidi carbossilici, formando un -diacido (1, 3 -diacido). • I -diacidi sono instabili al riscaldamento e decarbossilano provocando la rottura di un legame C— C e la formazione di un acido carbossilico. 33

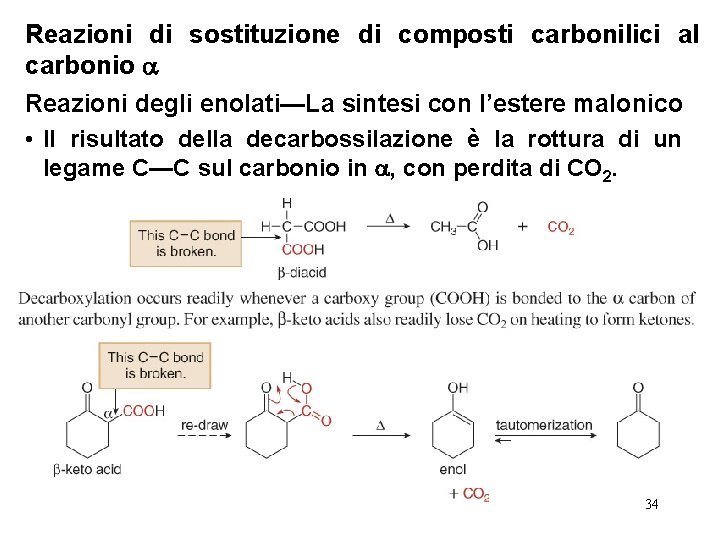
Reazioni di sostituzione di composti carbonilici al carbonio Reazioni degli enolati—La sintesi con l’estere malonico • Il risultato della decarbossilazione è la rottura di un legame C—C sul carbonio in , con perdita di CO 2. 34

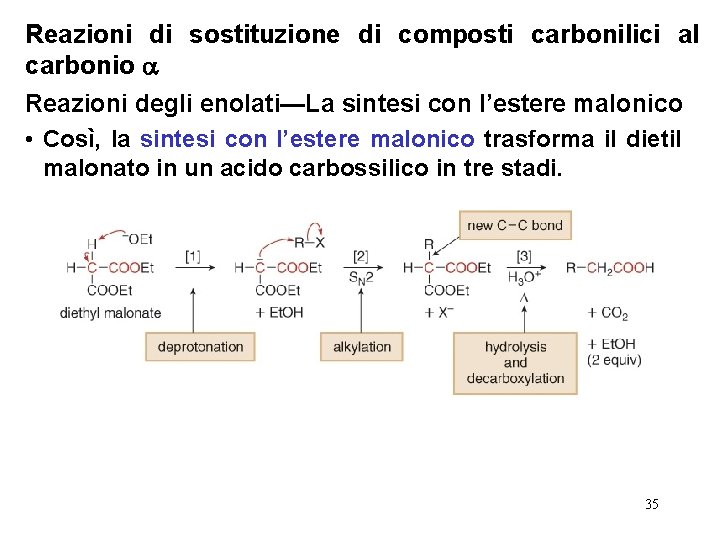
Reazioni di sostituzione di composti carbonilici al carbonio Reazioni degli enolati—La sintesi con l’estere malonico • Così, la sintesi con l’estere malonico trasforma il dietil malonato in un acido carbossilico in tre stadi. 35

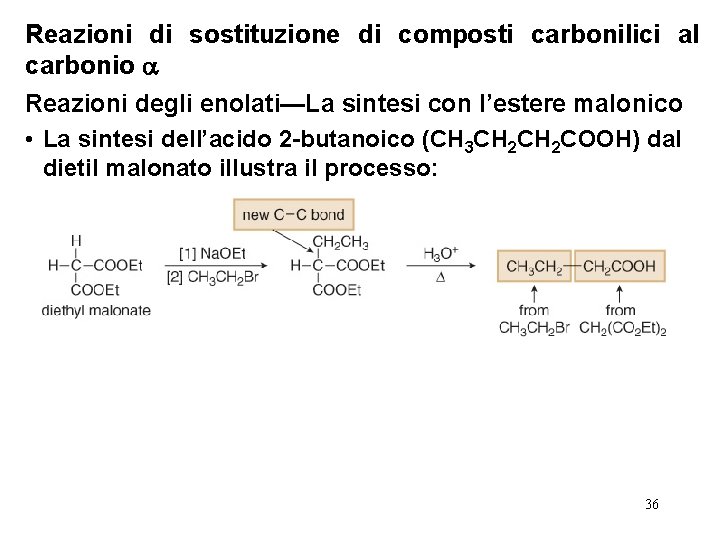
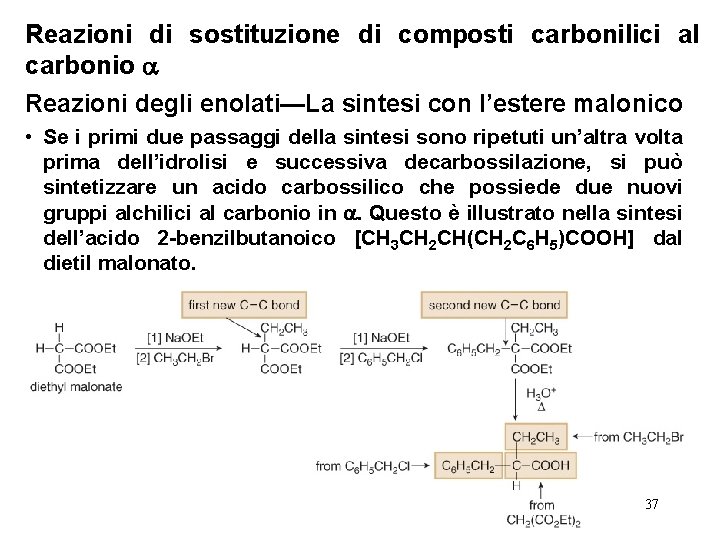
Reazioni di sostituzione di composti carbonilici al carbonio Reazioni degli enolati—La sintesi con l’estere malonico • La sintesi dell’acido 2 -butanoico (CH 3 CH 2 COOH) dal dietil malonato illustra il processo: 36

Reazioni di sostituzione di composti carbonilici al carbonio Reazioni degli enolati—La sintesi con l’estere malonico • Se i primi due passaggi della sintesi sono ripetuti un’altra volta prima dell’idrolisi e successiva decarbossilazione, si può sintetizzare un acido carbossilico che possiede due nuovi gruppi alchilici al carbonio in . Questo è illustrato nella sintesi dell’acido 2 -benzilbutanoico [CH 3 CH 2 CH(CH 2 C 6 H 5)COOH] dal dietil malonato. 37

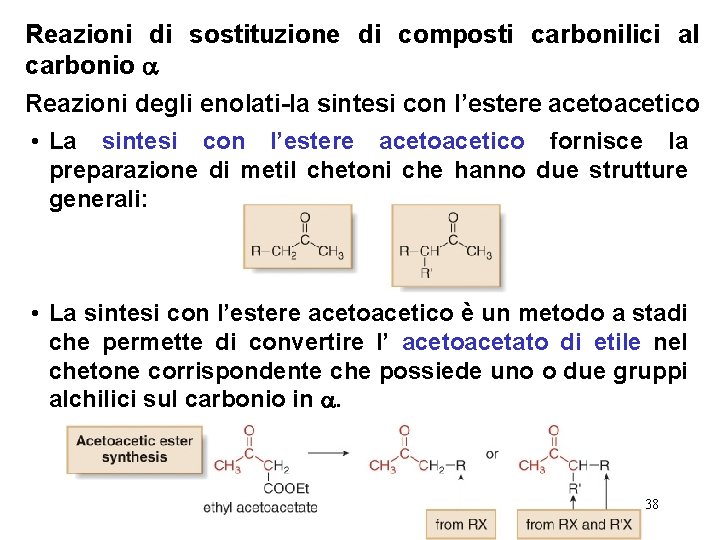
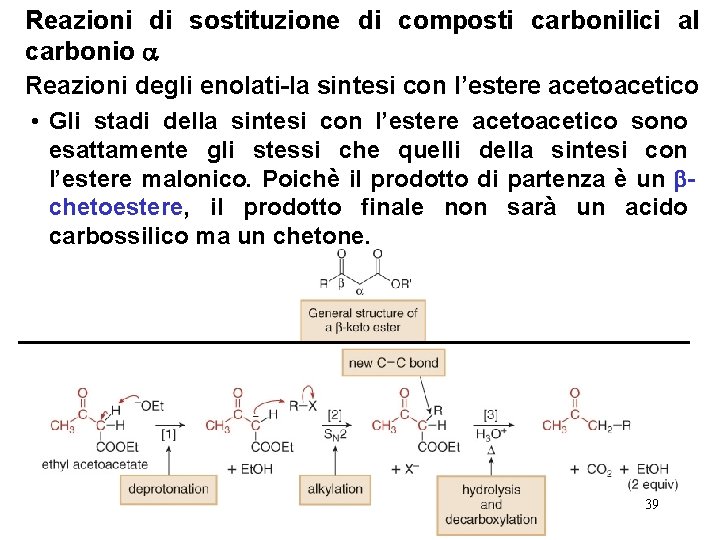
Reazioni di sostituzione di composti carbonilici al carbonio Reazioni degli enolati-la sintesi con l’estere acetoacetico • La sintesi con l’estere acetoacetico fornisce la preparazione di metil chetoni che hanno due strutture generali: • La sintesi con l’estere acetoacetico è un metodo a stadi che permette di convertire l’ acetoacetato di etile nel chetone corrispondente che possiede uno o due gruppi alchilici sul carbonio in . 38

Reazioni di sostituzione di composti carbonilici al carbonio Reazioni degli enolati-la sintesi con l’estere acetoacetico • Gli stadi della sintesi con l’estere acetoacetico sono esattamente gli stessi che quelli della sintesi con l’estere malonico. Poichè il prodotto di partenza è un chetoestere, il prodotto finale non sarà un acido carbossilico ma un chetone. 39

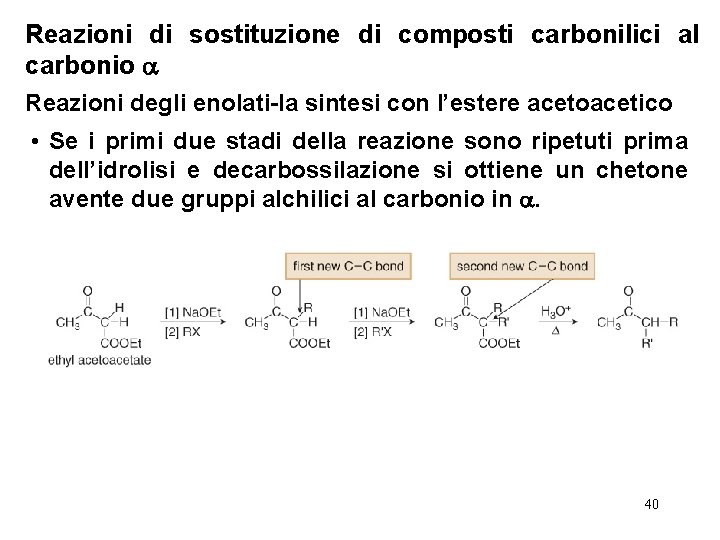
Reazioni di sostituzione di composti carbonilici al carbonio Reazioni degli enolati-la sintesi con l’estere acetoacetico • Se i primi due stadi della reazione sono ripetuti prima dell’idrolisi e decarbossilazione si ottiene un chetone avente due gruppi alchilici al carbonio in . 40
 Janice gorzynski smith
Janice gorzynski smith Organic chemistry
Organic chemistry Rearranged most stable carbocation is
Rearranged most stable carbocation is Organic chemistry (3rd) edition chapter 1 problem 16s
Organic chemistry (3rd) edition chapter 1 problem 16s Organic chemistry 2nd edition klein
Organic chemistry 2nd edition klein Organic chemistry third edition david klein
Organic chemistry third edition david klein David klein organic chemistry 3rd edition
David klein organic chemistry 3rd edition Organic chemistry third edition david klein
Organic chemistry third edition david klein Halohydrin formation
Halohydrin formation Organic chemistry 2nd edition klein
Organic chemistry 2nd edition klein Janice smith
Janice smith Functional groups ib chemistry
Functional groups ib chemistry Inorganic chemistry vs organic chemistry
Inorganic chemistry vs organic chemistry Father of organic chemistry
Father of organic chemistry Canola oil
Canola oil Ester organic chemistry
Ester organic chemistry Alcohol formula
Alcohol formula Ee organic chemistry
Ee organic chemistry Leveling effect organic chemistry
Leveling effect organic chemistry Ario practice problems
Ario practice problems Oxo functional group
Oxo functional group Organic chemistry lab report example
Organic chemistry lab report example Britannica.com
Britannica.com Grade 10 organic chemistry
Grade 10 organic chemistry Organic chemistry
Organic chemistry Organic chemistry chapter 1
Organic chemistry chapter 1 Kiliani fischer synthesis
Kiliani fischer synthesis Met eth prop
Met eth prop Fractional distillation of petroleum
Fractional distillation of petroleum Met et prop but pent hex hept oct non dec undec
Met et prop but pent hex hept oct non dec undec Organic chemistry myanmar
Organic chemistry myanmar Hhcchh
Hhcchh Mass spec of chlorine
Mass spec of chlorine Hono organic chemistry
Hono organic chemistry Leaving group ability
Leaving group ability Organic chemistry topic 11
Organic chemistry topic 11 Chapter 22 review organic chemistry section 1 answers
Chapter 22 review organic chemistry section 1 answers Organic chemistry reaction pathways
Organic chemistry reaction pathways Organic chemistry nomenclature
Organic chemistry nomenclature What is organic chemistry like
What is organic chemistry like Is ch4o organic or inorganic
Is ch4o organic or inorganic