Metallorganische Chemie der 4 Hauptgruppe Unterschiede KohlenstoffSilizium SN






















- Slides: 61

Metallorganische Chemie der 4. Hauptgruppe

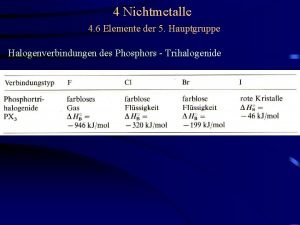
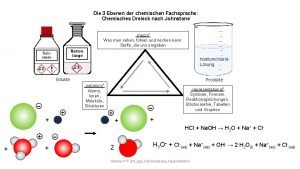
Unterschiede Kohlenstoff-Silizium • SN Reaktionen am Si schneller als am C • Doppelbindungen zu Si sind schwach • Hohe Bindungsstärke von Einfachbindungen Si-X (X = O, Cl, F. . . ) Bindungsenergie (k. J/mol) C–Cl 81 Si–F 135 Si–Cl 90 Si–O 110


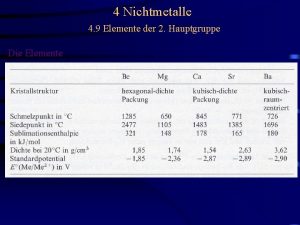
Unterschiede Kohlenstoff-Silizium • Geringe Bindungsstärke von Einfachbindungen Si-H und Si-Si • Wasserstoff am Si ist negativ polarisiert • Sterische Effekte am Si schwächer ausgeprägt Bindungsenergie (k. J/mol) C–C 83 H–C 99 Si–Si 52 H–Si 75

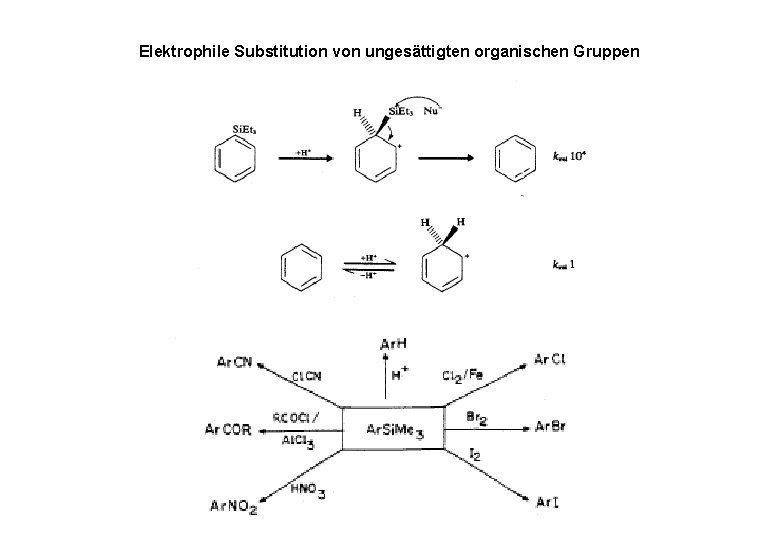
Si-X- Bindungsspaltung • Si-C-Bindungen sind nucleophil und elektrophil spaltbar • Reaktivität hängt vom Substart und von den Substituenten am Si ab

Elektrophile Substitution von ungesättigten organischen Gruppen

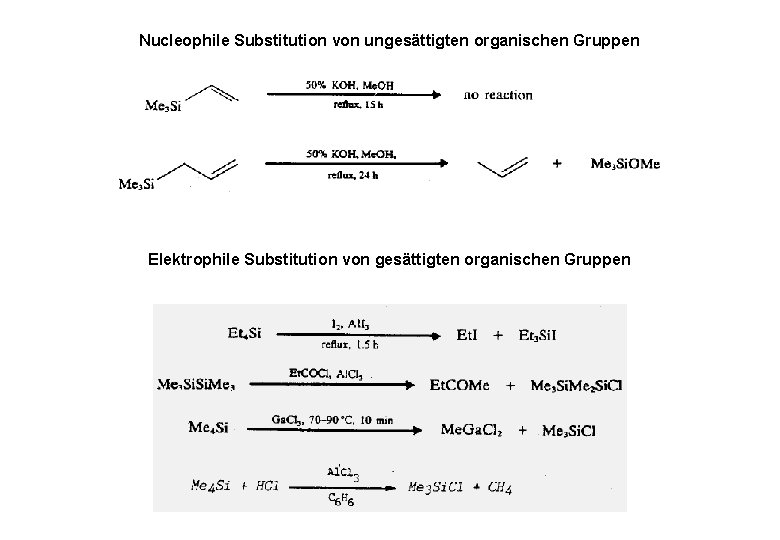
Nucleophile Substitution von ungesättigten organischen Gruppen Elektrophile Substitution von gesättigten organischen Gruppen


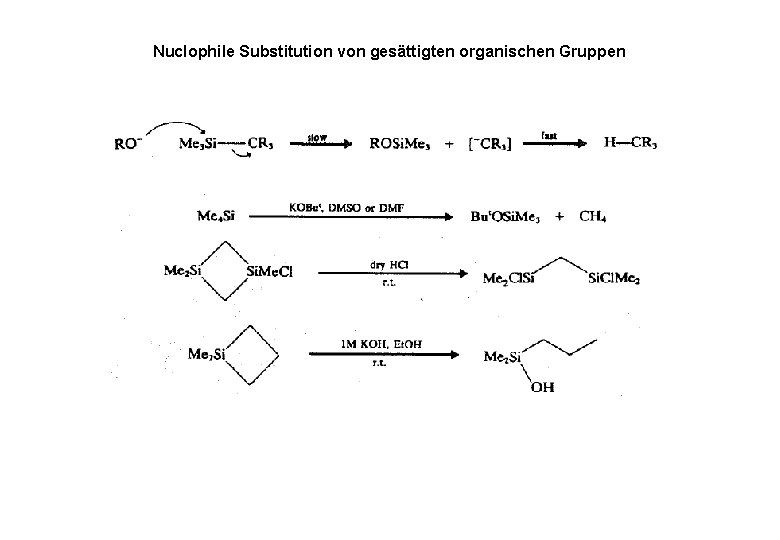
Nuclophile Substitution von gesättigten organischen Gruppen

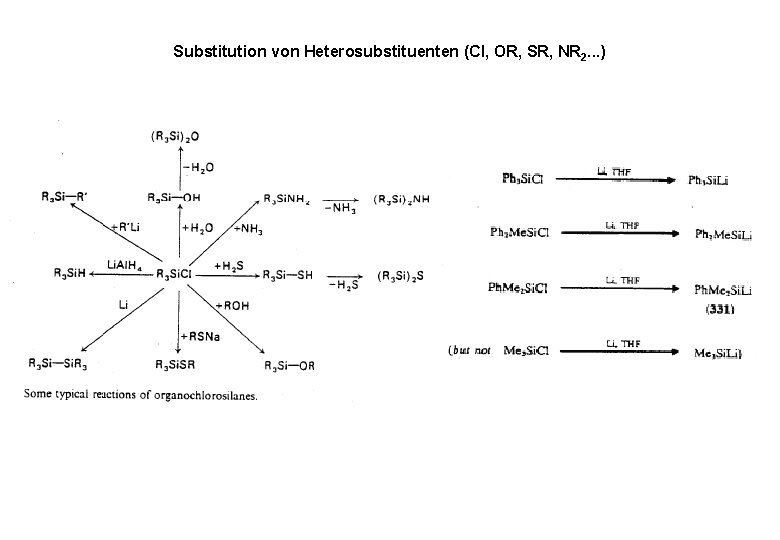
Substitution von Heterosubstituenten (Cl, OR, SR, NR 2. . . )


Niedervalente Gruppe(IV) Verbindungen • Silylene R 2 Si: • Silene R 2 Si=CR 2 • Disilene R 2 Si=Si. R 2 • Heterosilene X=Si. R 2 • Polysilylene (Polysilane) • Analoge Verbindungen von Ge, Sn, Pb

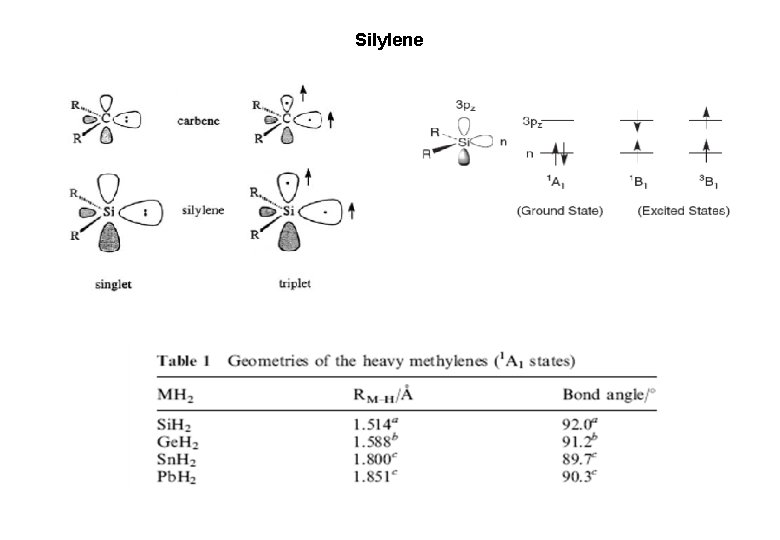
Silylene


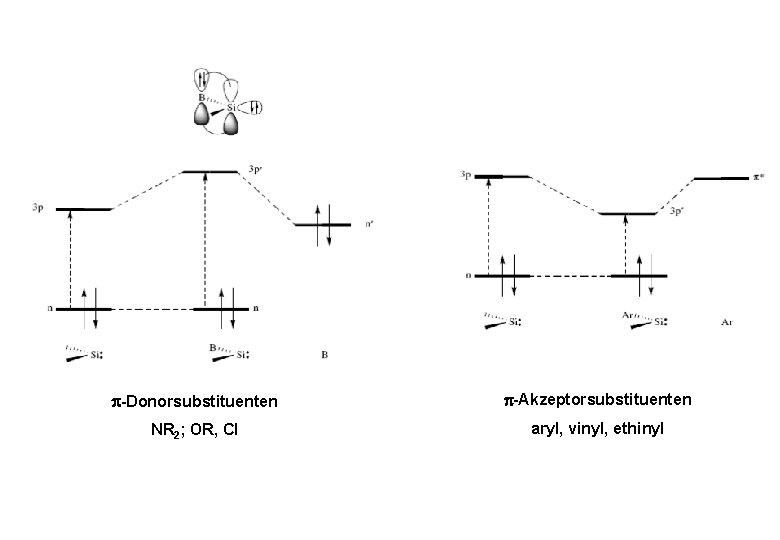
-Donorsubstituenten -Akzeptorsubstituenten NR 2; OR, Cl aryl, vinyl, ethinyl

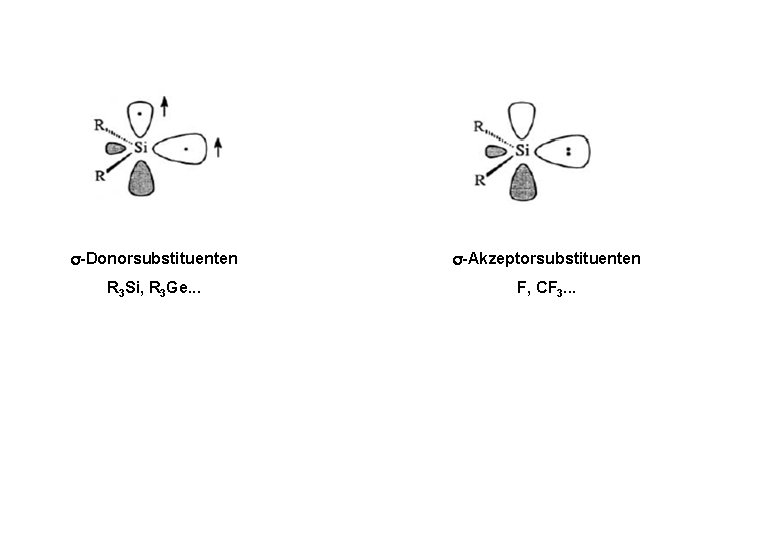
-Donorsubstituenten -Akzeptorsubstituenten R 3 Si, R 3 Ge. . . F, CF 3. . .

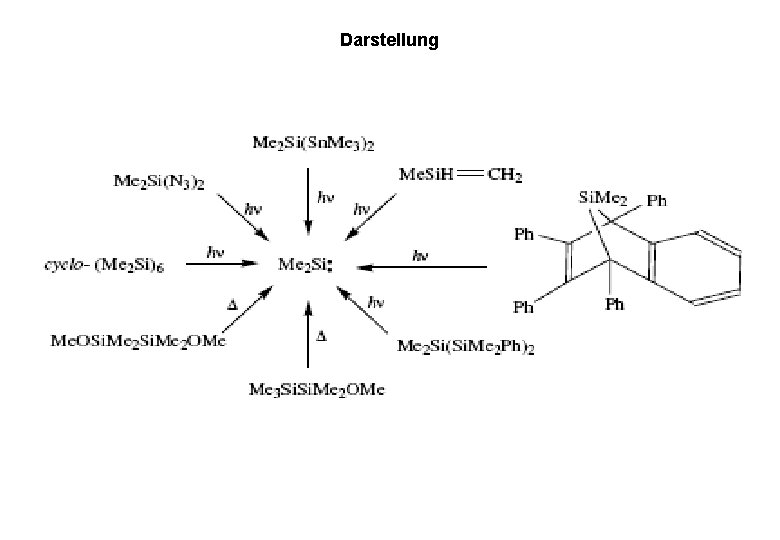
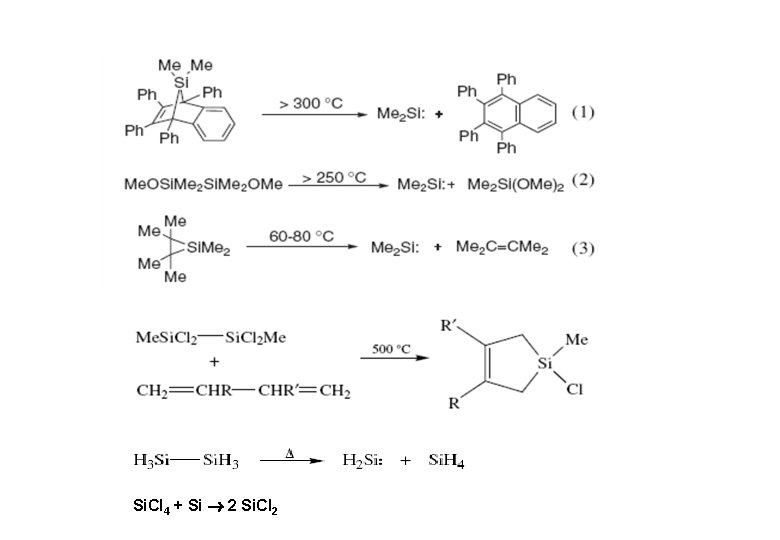
Darstellung

Si. Cl 4 + Si 2 Si. Cl 2




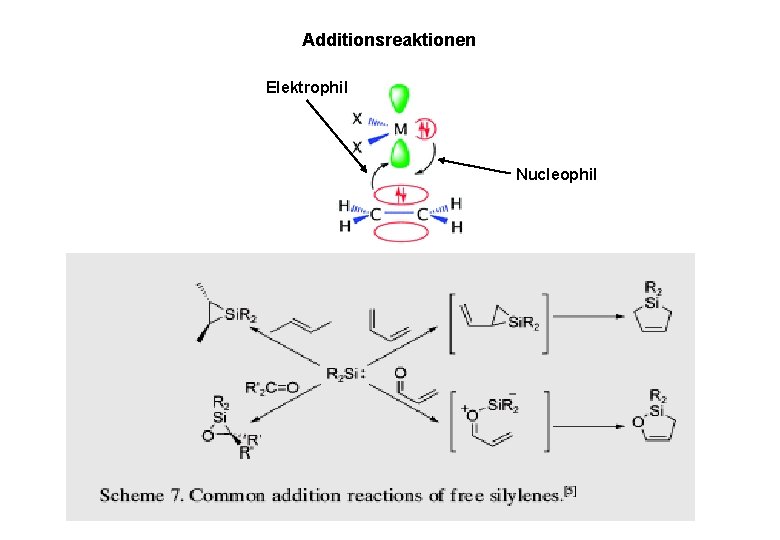
Additionsreaktionen Elektrophil Nucleophil

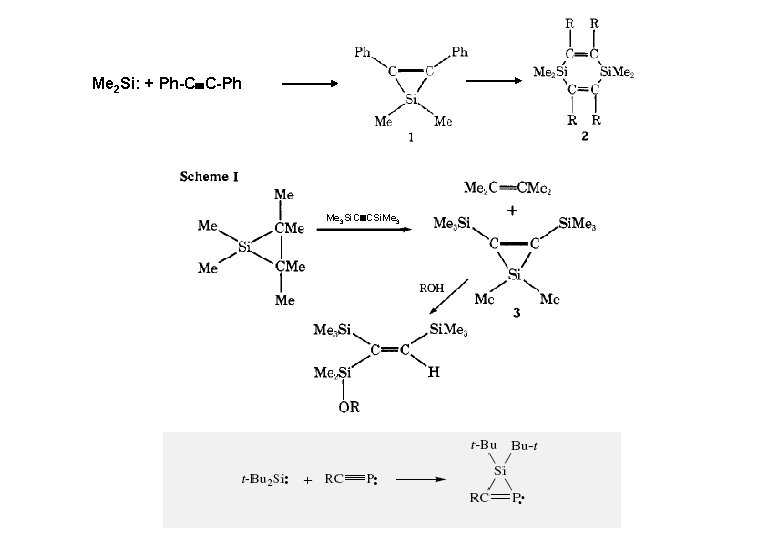
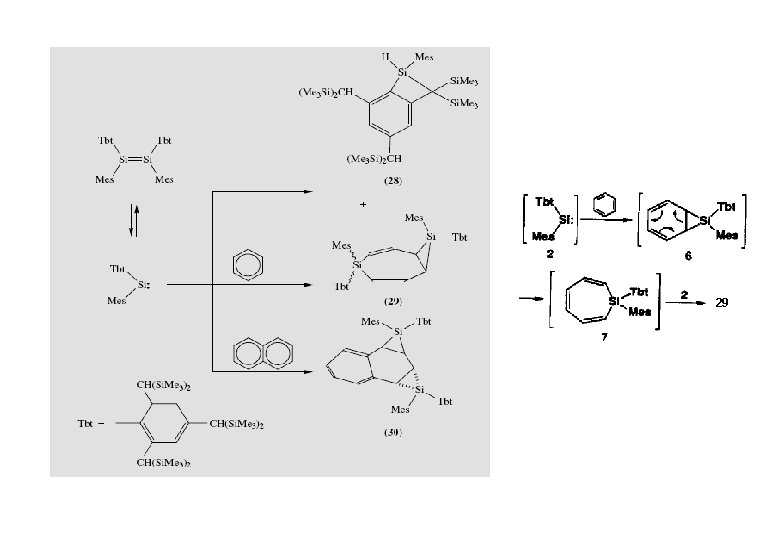
Me 2 Si: + Ph-C C-Ph Me 3 Si. C CSi. Me 3

29

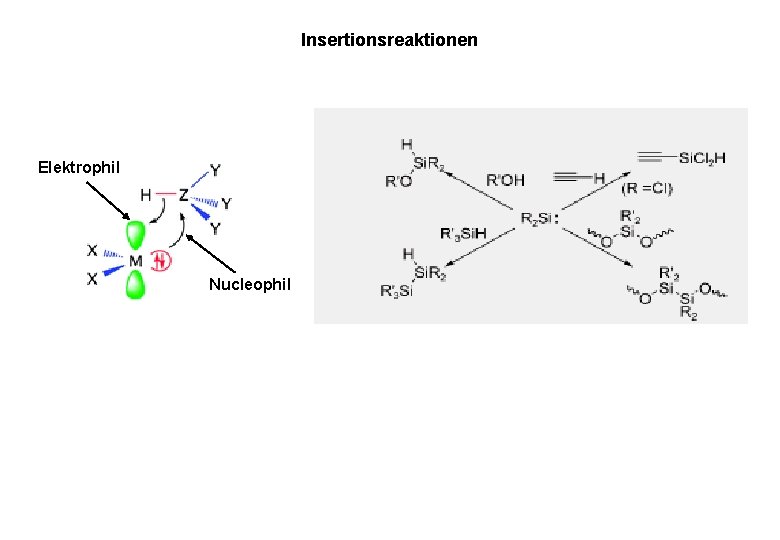
Insertionsreaktionen Elektrophil Nucleophil




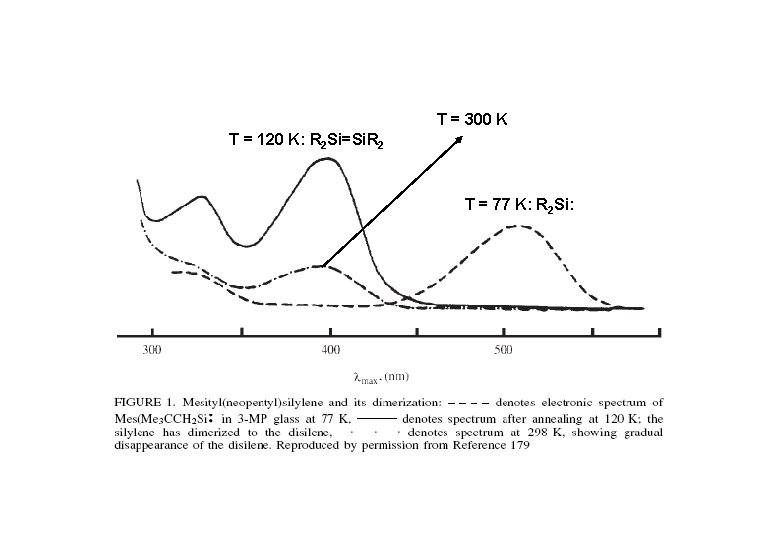
T = 300 K T = 120 K: R 2 Si=Si. R 2 T = 77 K: R 2 Si:




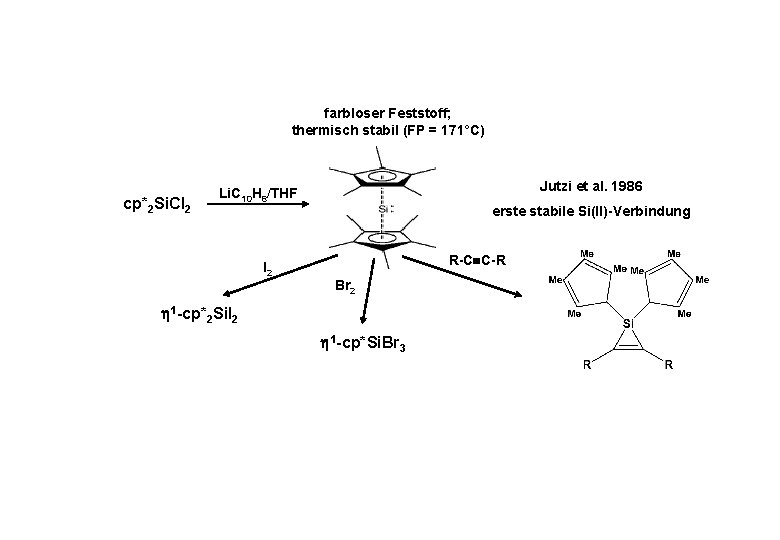
farbloser Feststoff; thermisch stabil (FP = 171°C) cp*2 Si. Cl 2 Jutzi et al. 1986 Li. C 10 H 8/THF erste stabile Si(II)-Verbindung R-C C-R I 2 Br 2 1 -cp*2 Si. I 2 1 -cp*Si. Br 3

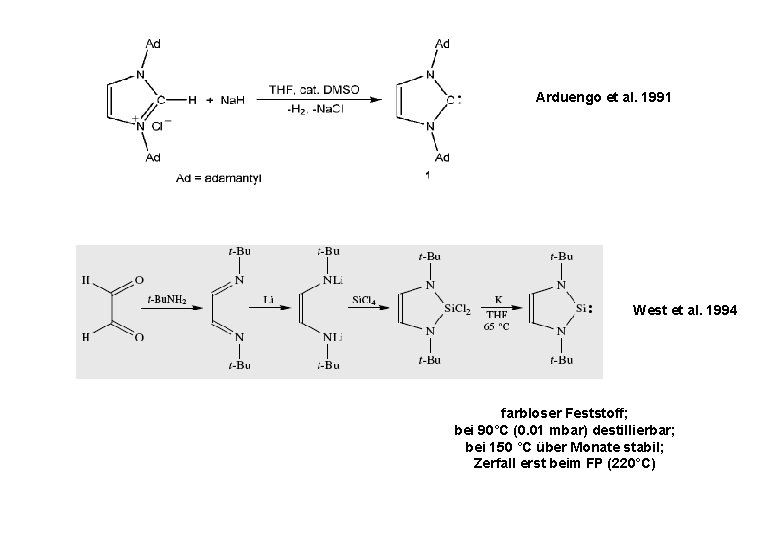
Arduengo et al. 1991 West et al. 1994 farbloser Feststoff; bei 90°C (0. 01 mbar) destillierbar; bei 150 °C über Monate stabil; Zerfall erst beim FP (220°C)

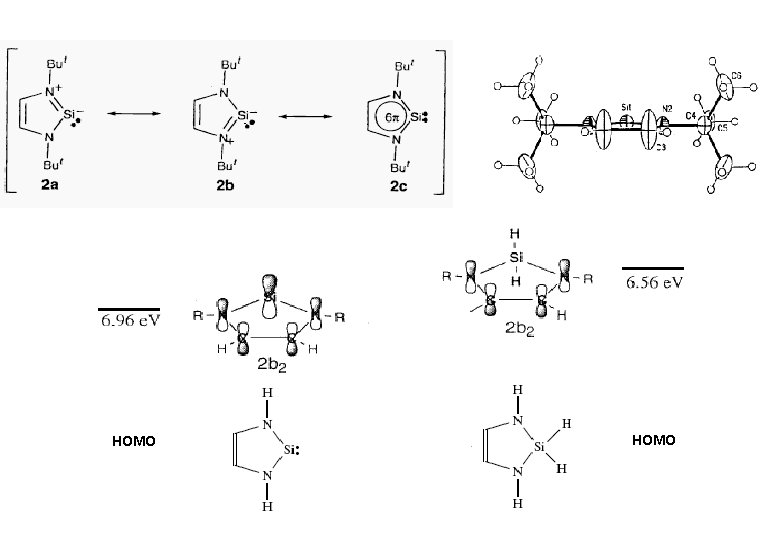
HOMO

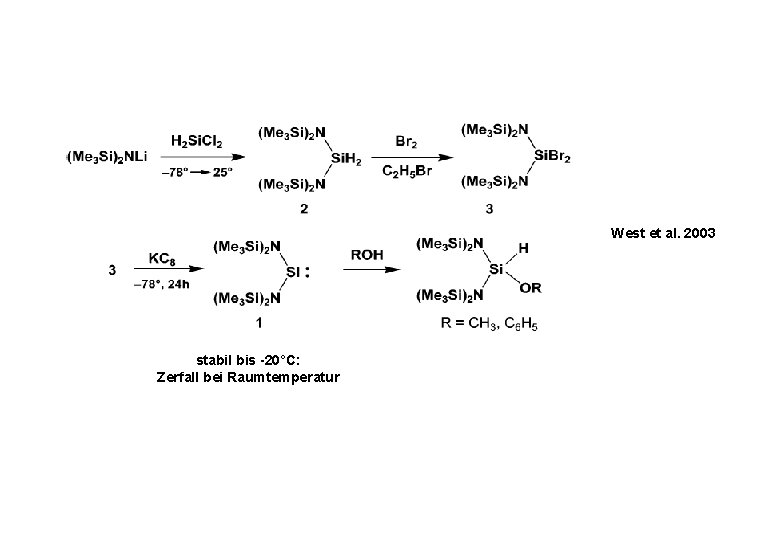
West et al. 2003 stabil bis -20°C: Zerfall bei Raumtemperatur

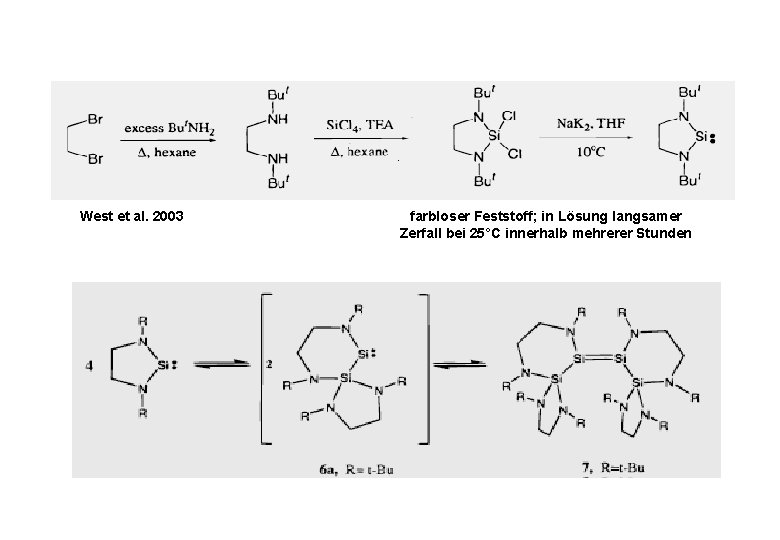
West et al. 2003 farbloser Feststoff; in Lösung langsamer Zerfall bei 25°C innerhalb mehrerer Stunden

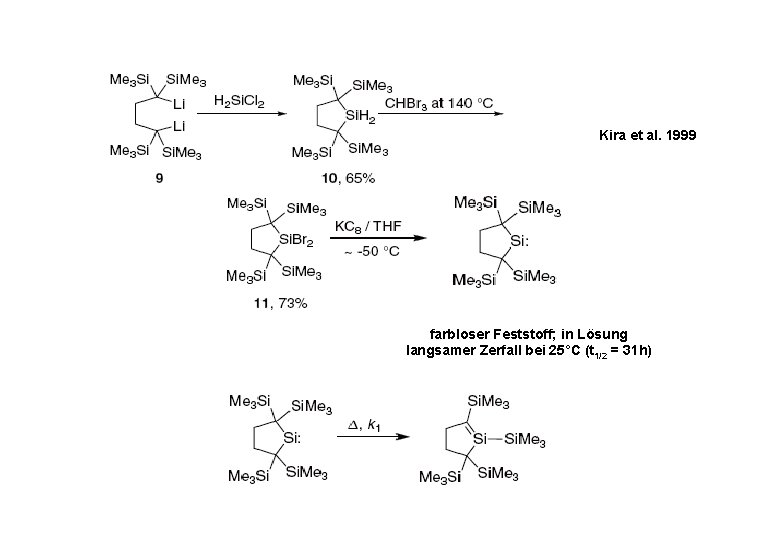
Kira et al. 1999 farbloser Feststoff; in Lösung langsamer Zerfall bei 25°C (t 1/2 = 31 h)


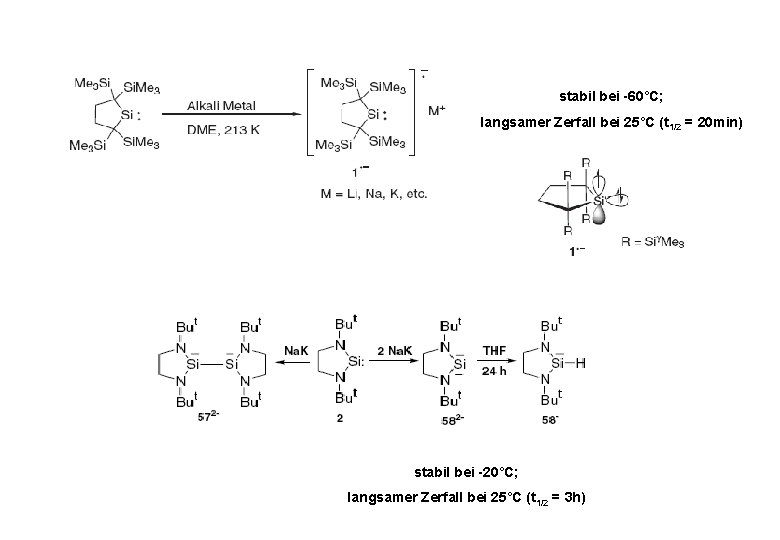
stabil bei -60°C; langsamer Zerfall bei 25°C (t 1/2 = 20 min) stabil bei -20°C; langsamer Zerfall bei 25°C (t 1/2 = 3 h)

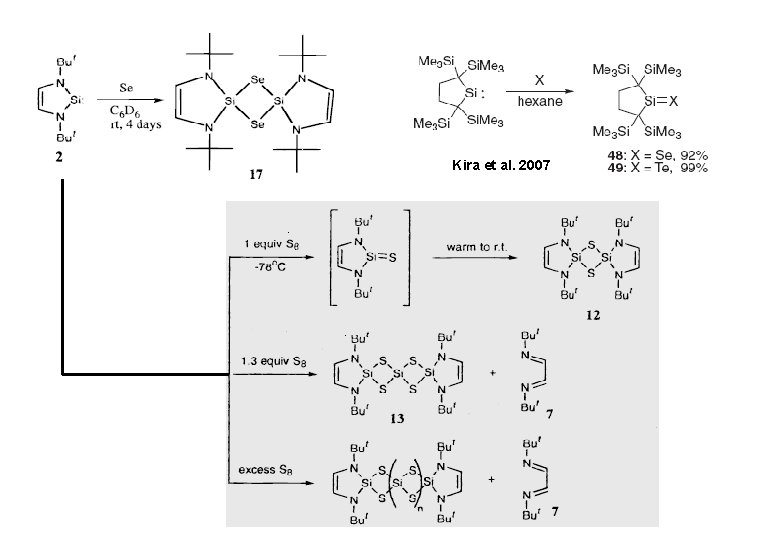
Kira et al. 2007

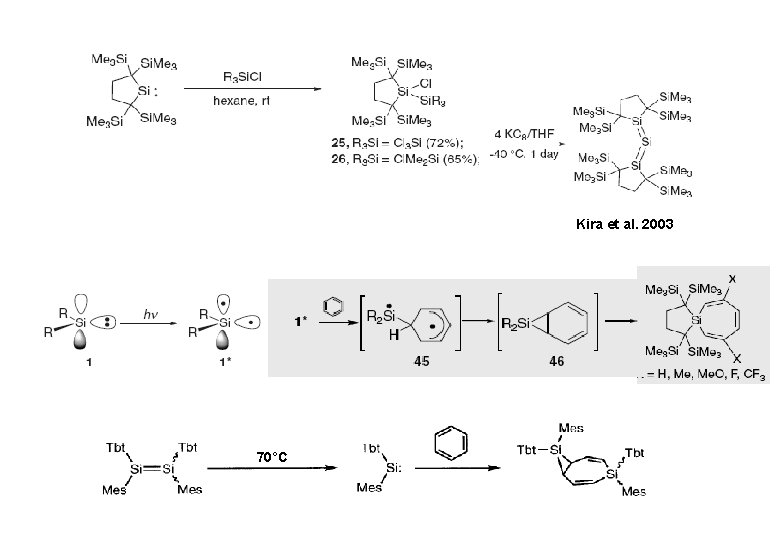
Kira et al. 2003 70°C

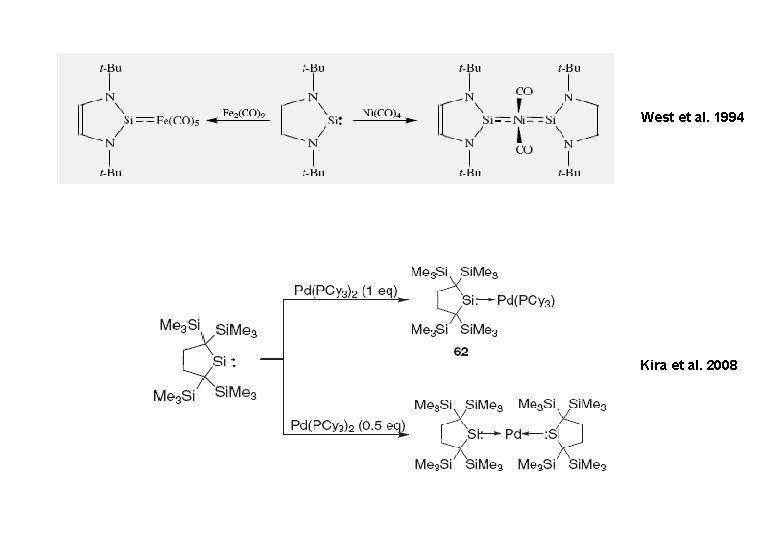
West et al. 1994 Kira et al. 2008

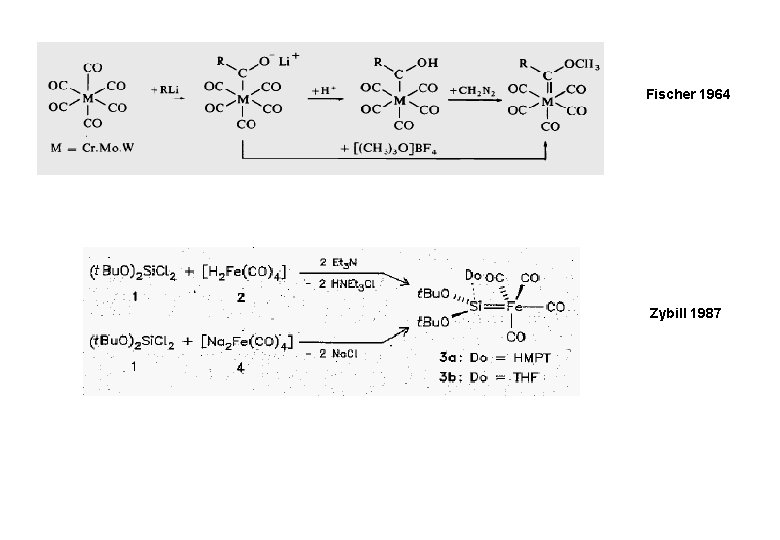
Fischer 1964 Zybill 1987

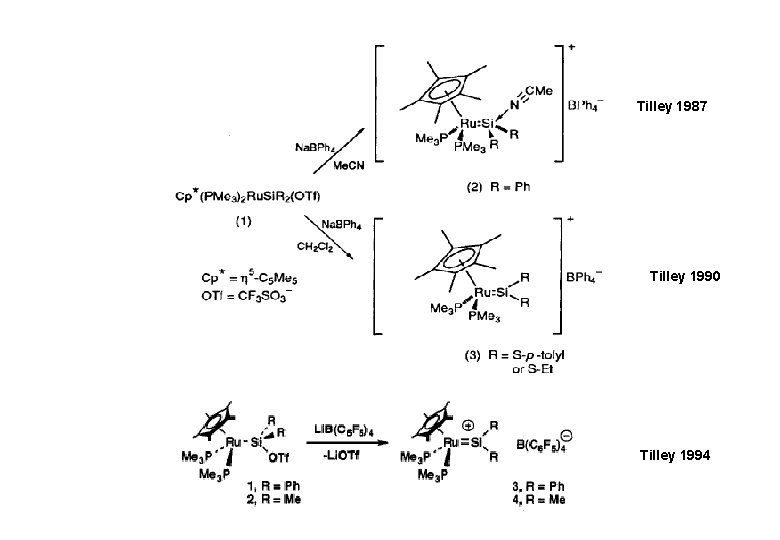
Tilley 1987 Tilley 1990 Tilley 1994



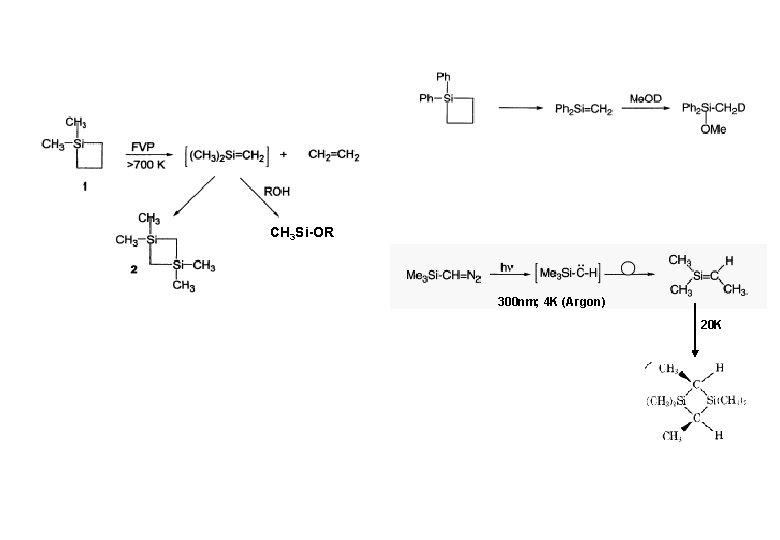
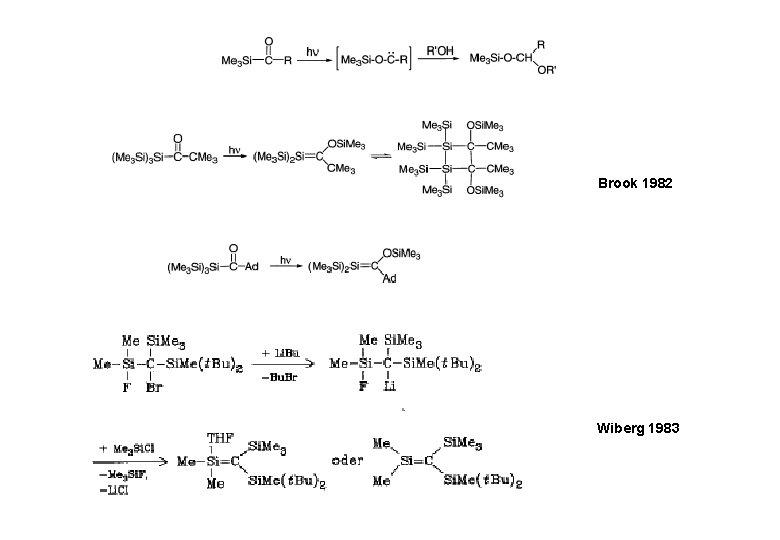
CH 3 Si-OR 300 nm; 4 K (Argon) 20 K

Brook 1982 Wiberg 1983

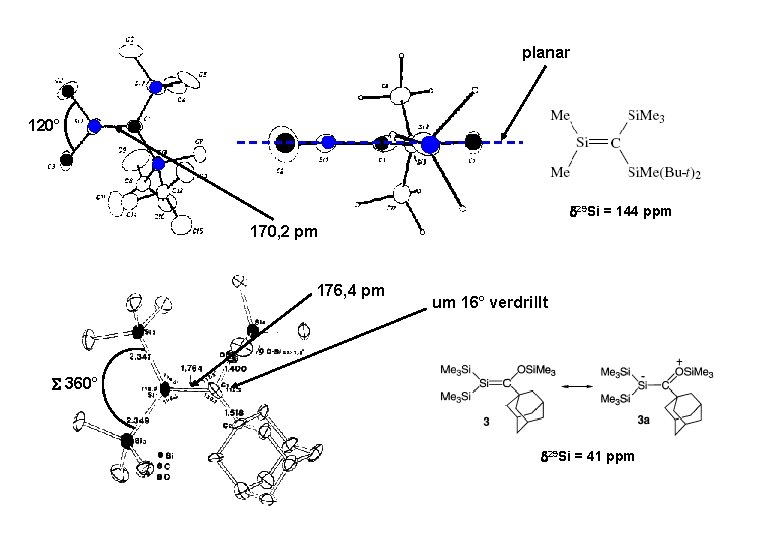
planar 120° 29 Si = 144 ppm 170, 2 pm 176, 4 pm um 16° verdrillt 360° 29 Si = 41 ppm

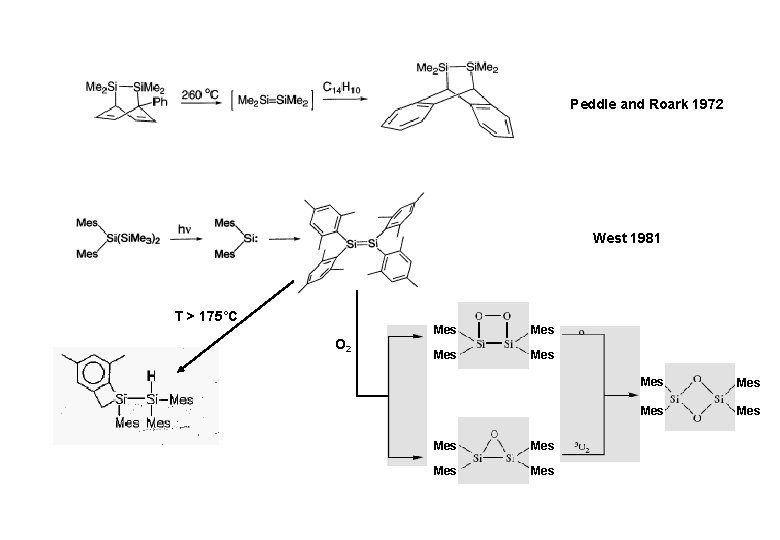
Peddle and Roark 1972 West 1981 T > 175°C O 2 Mes Mes Mes

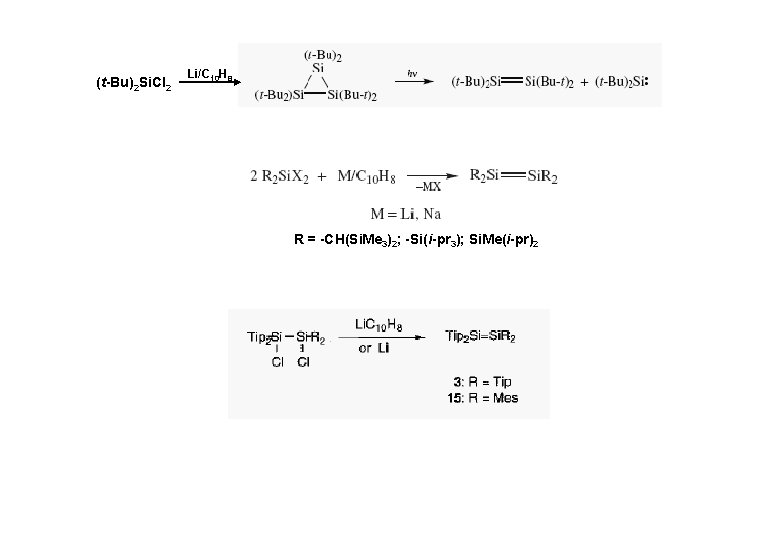
(t-Bu)2 Si. Cl 2 Li/C 10 H 8 R = -CH(Si. Me 3)2; -Si(i-pr 3); Si. Me(i-pr)2

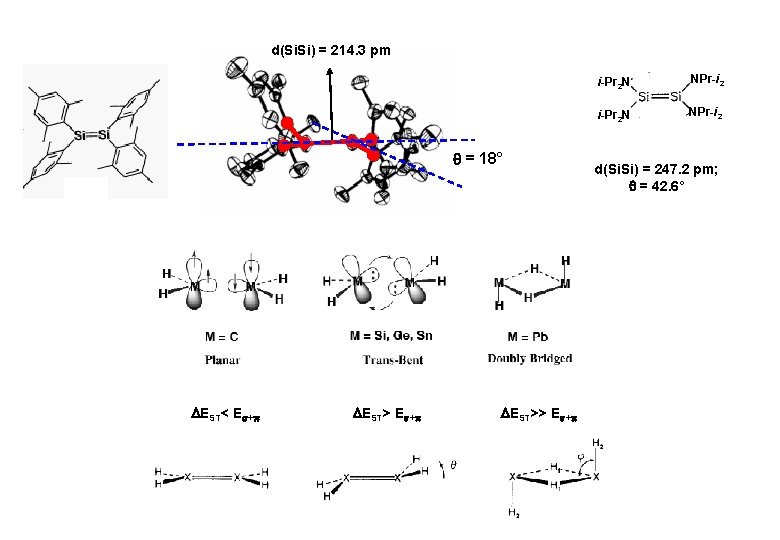
d(Si. Si) = 214. 3 pm = 18° EST< E + EST>> E + i-Pr 2 N NPr-i 2 d(Si. Si) = 247. 2 pm; = 42. 6°

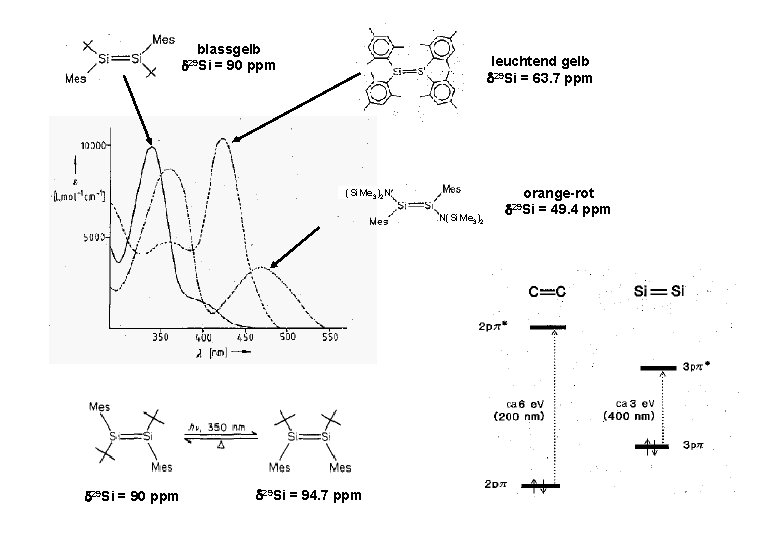
blassgelb = 90 ppm leuchtend gelb 29 Si = 63. 7 ppm 29 Si (Si. Me 3)2 N N(Si. Me 3)2 29 Si = 90 ppm 29 Si = 94. 7 ppm orange-rot = 49. 4 ppm 29 Si


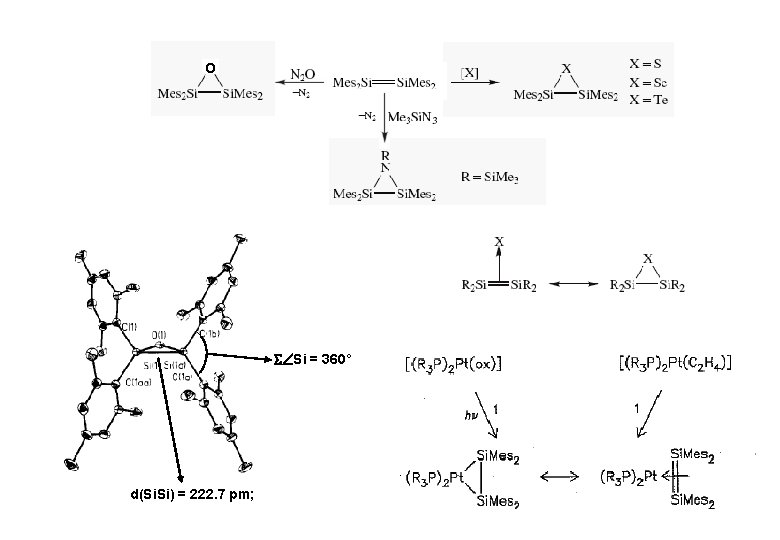
O Si = 360° d(Si. Si) = 222. 7 pm;

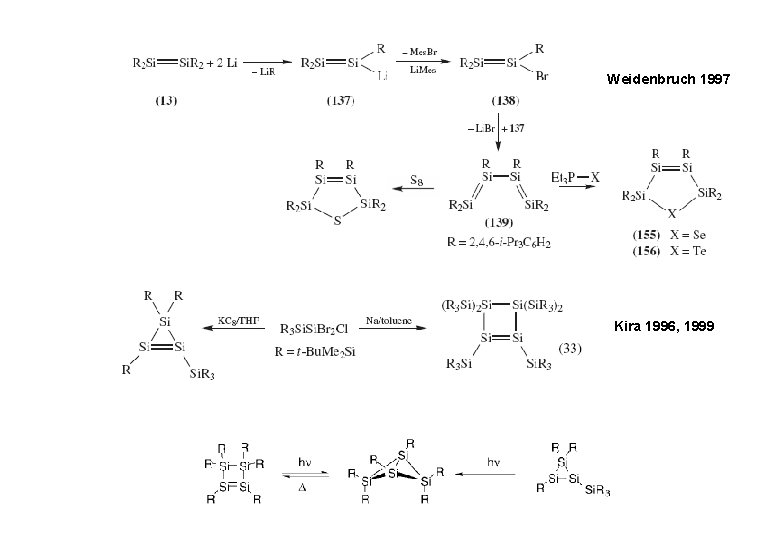
Weidenbruch 1997 Kira 1996, 1999

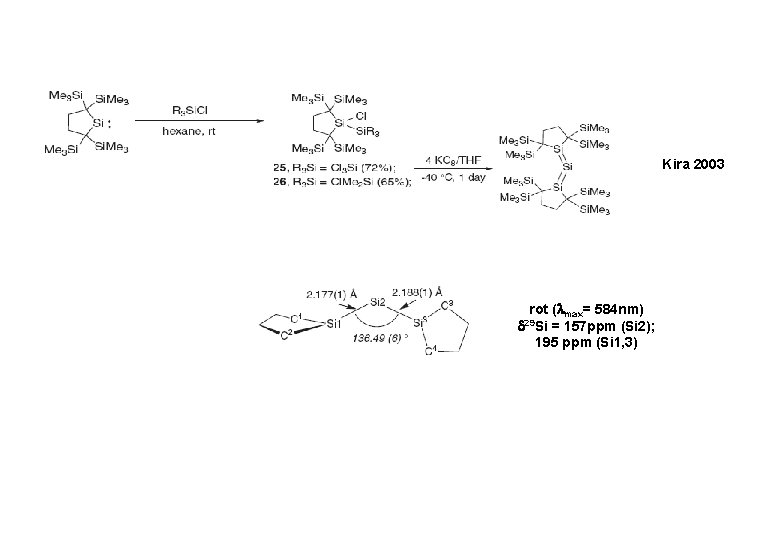
Kira 2003 rot ( max= 584 nm) = 157 ppm (Si 2); 195 ppm (Si 1, 3) 29 Si

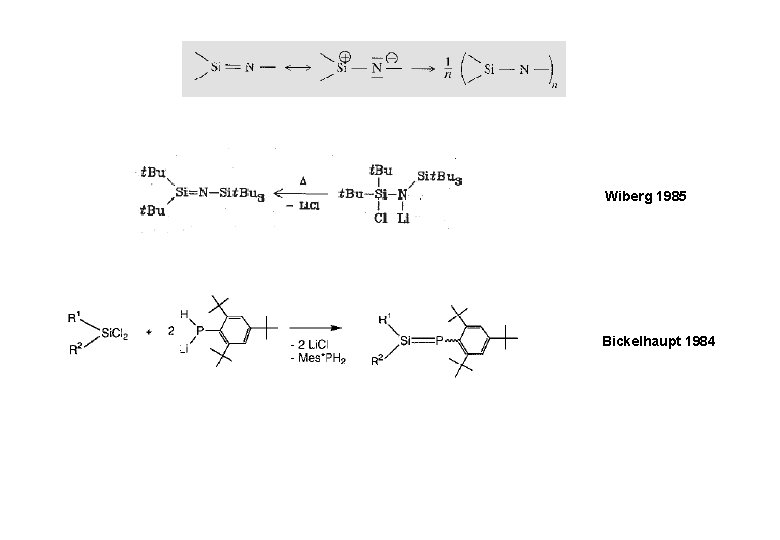
Wiberg 1985 Bickelhaupt 1984

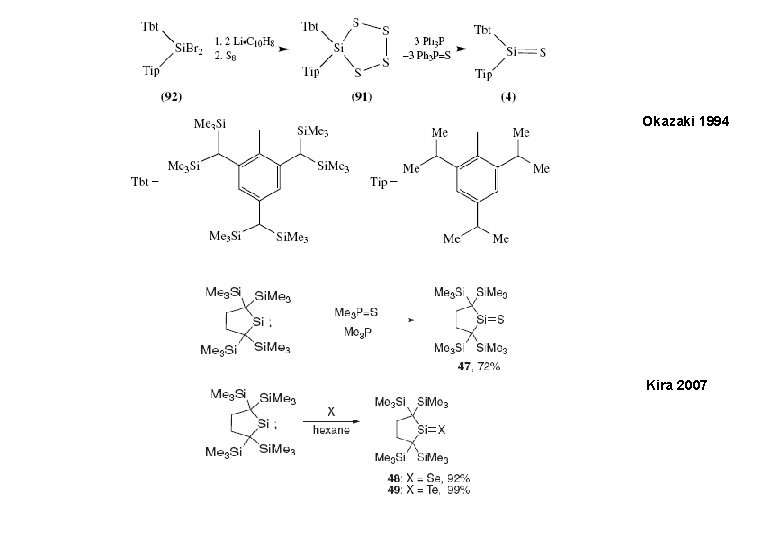
Okazaki 1994 Kira 2007

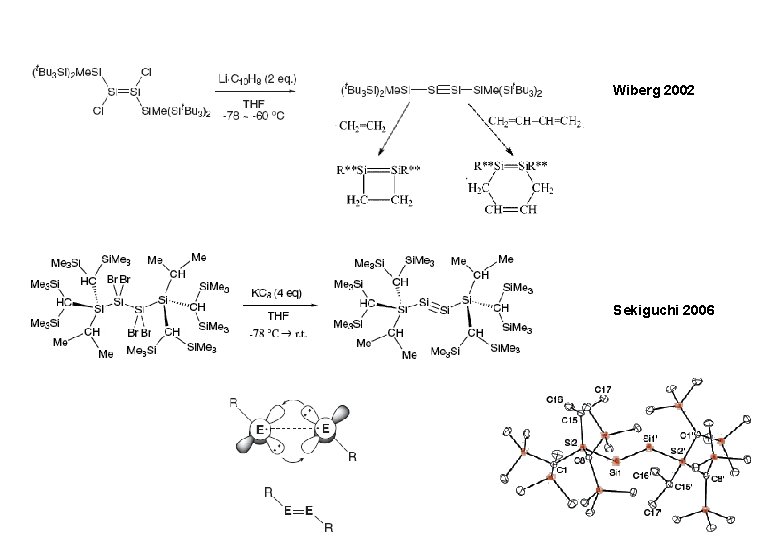
Wiberg 2002 Sekiguchi 2006
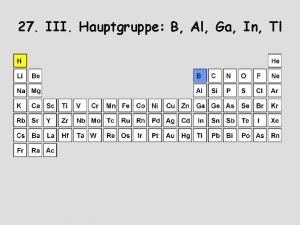
 5. hauptgruppe periodensystem
5. hauptgruppe periodensystem Gruppen pse
Gruppen pse 5 hauptgruppe
5 hauptgruppe 1. hauptgruppe name
1. hauptgruppe name 3 hauptgruppe periodensystem
3 hauptgruppe periodensystem 7 hauptgruppe periodensystem
7 hauptgruppe periodensystem Körperbau rote waldameise
Körperbau rote waldameise Unterschiede moschee und kirche
Unterschiede moschee und kirche Aldehyd keton unterschied
Aldehyd keton unterschied Symbolismus merkmale literatur
Symbolismus merkmale literatur Kulturelle unterschiede deutschland finnland
Kulturelle unterschiede deutschland finnland Kulturelle unterschiede zwischen deutschland und china
Kulturelle unterschiede zwischen deutschland und china Zapfkopf unterschiede
Zapfkopf unterschiede Grnder
Grnder Kryptografie
Kryptografie Mittelalter burg aufbau
Mittelalter burg aufbau Gegenstand der psychologie
Gegenstand der psychologie Der erste tag der woche
Der erste tag der woche Der gott der stadt gedicht text
Der gott der stadt gedicht text Der daumen pflückt die pflaumen
Der daumen pflückt die pflaumen Sorrowing old man painting
Sorrowing old man painting Der weg der atemluft
Der weg der atemluft Der seele heimat ist der sinn
Der seele heimat ist der sinn Weltuntergangstheorie
Weltuntergangstheorie Van der waals gleichung
Van der waals gleichung Impuls chemie 4 lösungen pdf
Impuls chemie 4 lösungen pdf Substrat chemie
Substrat chemie Woudschoten chemie 2021
Woudschoten chemie 2021 Chemie
Chemie Kanonieken
Kanonieken Impuls chemie
Impuls chemie Impuls chemie 4
Impuls chemie 4 Chemie für mediziner
Chemie für mediziner Klinische chemie
Klinische chemie Stöchiometrie dreieck
Stöchiometrie dreieck Impuls chemie 4 lösungen
Impuls chemie 4 lösungen Chemie
Chemie Covalentie zwavel
Covalentie zwavel Beta naphtholorange verwendung
Beta naphtholorange verwendung Voda prezentace chemie
Voda prezentace chemie Krasové jevy chemie
Krasové jevy chemie Ilkovičova rovnice
Ilkovičova rovnice Klasvorming chemie
Klasvorming chemie Oxalsäurediethylester hydrolyse
Oxalsäurediethylester hydrolyse Naturfasern übersicht
Naturfasern übersicht Areny chemie
Areny chemie Koncovky solí
Koncovky solí Impuls chemie
Impuls chemie Chemie
Chemie Sucha chemie
Sucha chemie Chemie
Chemie Fehlvorstellungen chemie
Fehlvorstellungen chemie Groene chemie scheikunde
Groene chemie scheikunde Impuls chemie 4
Impuls chemie 4 Ppp chemie
Ppp chemie Substrat chemie
Substrat chemie Autohaus bonnemann
Autohaus bonnemann Impuls chemie 4 lösungen
Impuls chemie 4 lösungen Sbr6 chemie
Sbr6 chemie Chemie
Chemie Hhu semesterapparat
Hhu semesterapparat Vis vitalis chemie
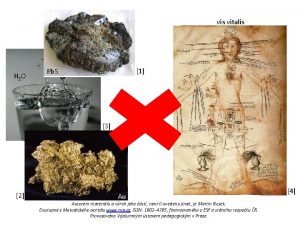
Vis vitalis chemie