Die Chemie der Farbstoffe 1 Gliederung 1 Definition

Die Chemie der Farbstoffe 1

Gliederung 1. Definition 2. Klassifizierung 3. Theorie der Farbigkeit 4. Der Einsatz von Farbstoffen 4. 1 Textilfärberei 4. 2 Lebensmittelfarbstoffe 4. 3 Funktionelle Farbstoffe 5. Schulische Relevanz 2

1. Definition 1. Def. : Farbstoff • Farbgebende Stoffe mit einer Absorption zwischen 400 und 800 nm (DIN: 55944) • Solche Farbmittel, die in ihrem Anwendungsmedium löslich sind (DIN: 55934) • Organische Verbindungen, die Eigenschaft haben, andere Materialien zu färben 3

2. Klassifizierung 4
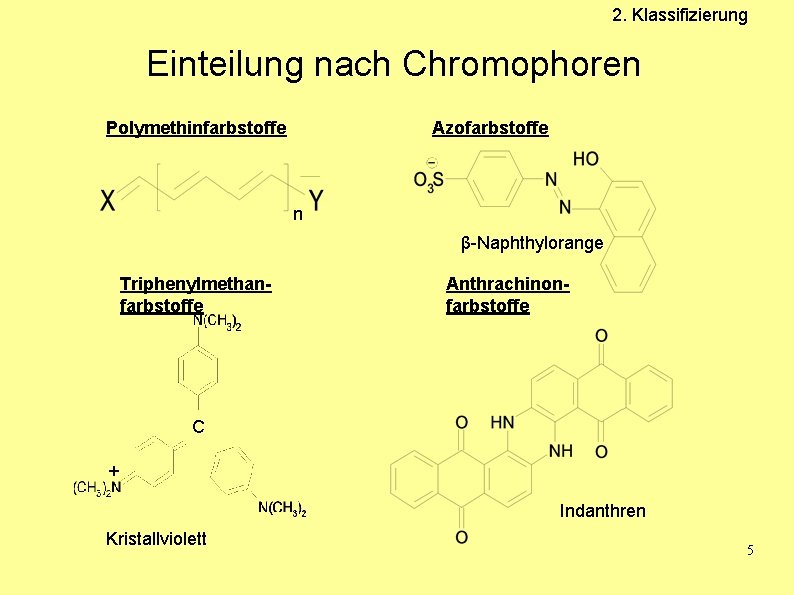
2. Klassifizierung Einteilung nach Chromophoren Polymethinfarbstoffe Azofarbstoffe n β-Naphthylorange Triphenylmethanfarbstoffe Anthrachinonfarbstoffe C + Indanthren Kristallviolett 5

3. Die Theorie der Farbigkeit ● ● Farbigkeit: Resultat der Wechselwirkung von Licht und Materie Licht: elektromagnetische Strahlung im Wellenlängenbereich 400 – 760 nm Zerlegung des weißen Lichts in die einzelnen Spektralfarben: 6

D 1: Lichtbrechung
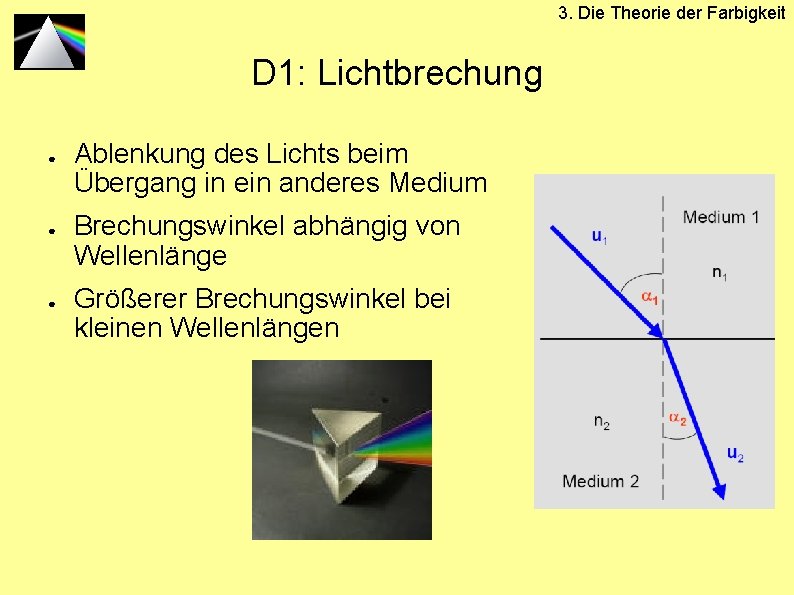
3. Die Theorie der Farbigkeit D 1: Lichtbrechung ● ● ● Ablenkung des Lichts beim Übergang in ein anderes Medium Brechungswinkel abhängig von Wellenlänge Größerer Brechungswinkel bei kleinen Wellenlängen

3. Die Theorie der Farbigkeit ● ● Wellenlängen des sichtbaren Bereichs der elektromagnetischen Strahlung: Lichtenergie ist in Form von Photonen gequantelt: E = h · ν mit v = c/λ E = h · c/λ 9
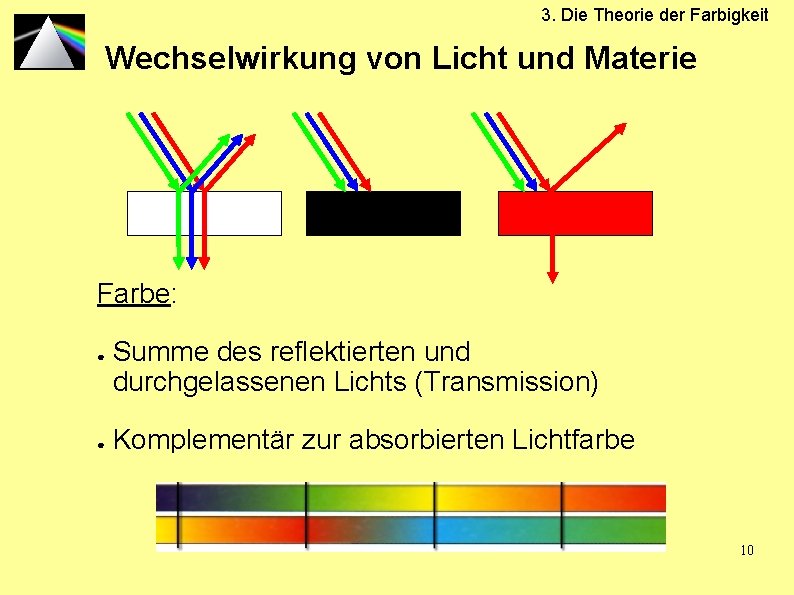
3. Die Theorie der Farbigkeit Wechselwirkung von Licht und Materie Farbe: ● ● Summe des reflektierten und durchgelassenen Lichts (Transmission) Komplementär zur absorbierten Lichtfarbe 10
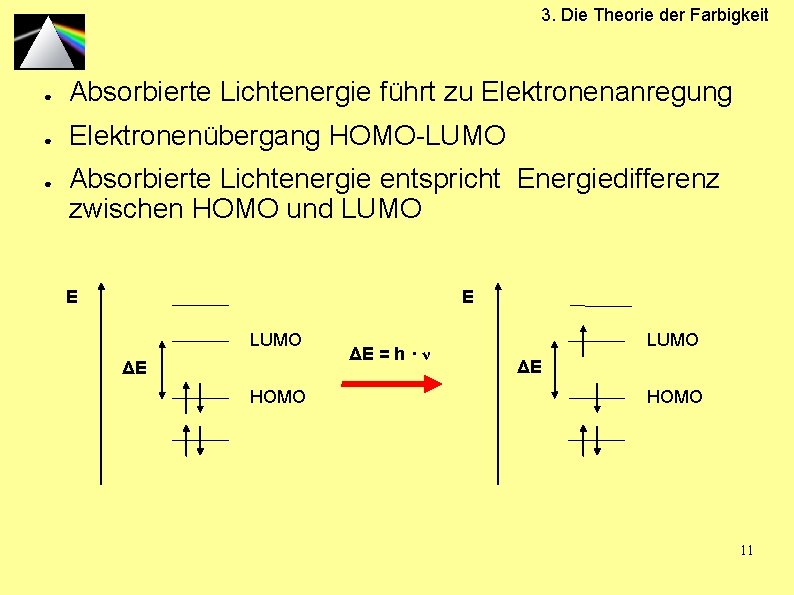
3. Die Theorie der Farbigkeit ● Absorbierte Lichtenergie führt zu Elektronenanregung ● Elektronenübergang HOMO-LUMO ● Absorbierte Lichtenergie entspricht Energiedifferenz zwischen HOMO und LUMO E E LUMO ΔE HOMO ΔE = h · ν LUMO ΔE HOMO 11
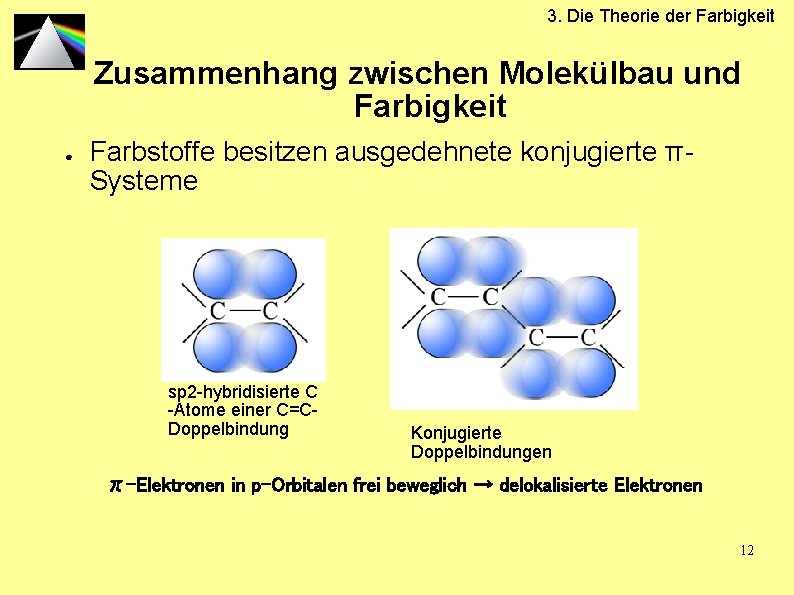
3. Die Theorie der Farbigkeit Zusammenhang zwischen Molekülbau und Farbigkeit ● Farbstoffe besitzen ausgedehnete konjugierte πSysteme sp 2 -hybridisierte C -Atome einer C=CDoppelbindung Konjugierte Doppelbindungen π-Elektronen in p-Orbitalen frei beweglich → delokalisierte Elektronen 12
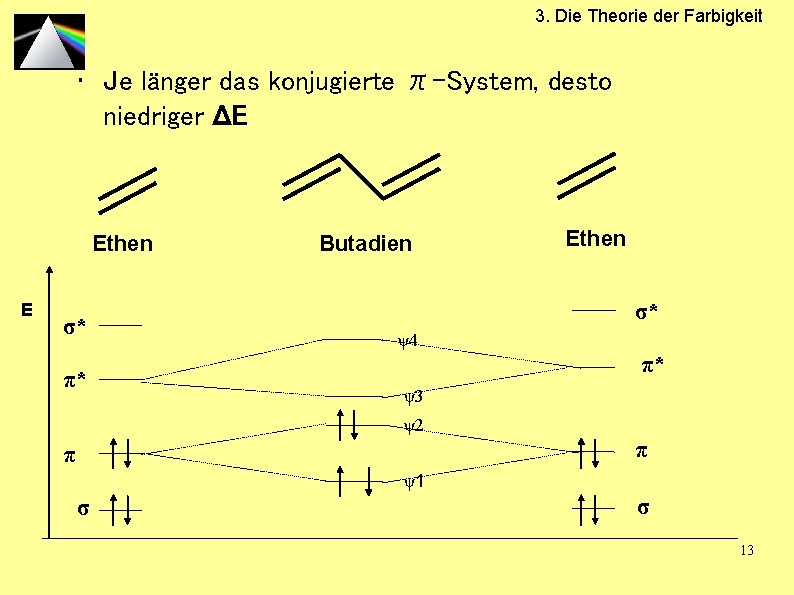
3. Die Theorie der Farbigkeit • Je länger das konjugierte π-System, desto niedriger ΔE Ethen E σ* π* Butadien Ethen σ* ψ4 π* ψ3 ψ2 π π ψ1 σ σ 13
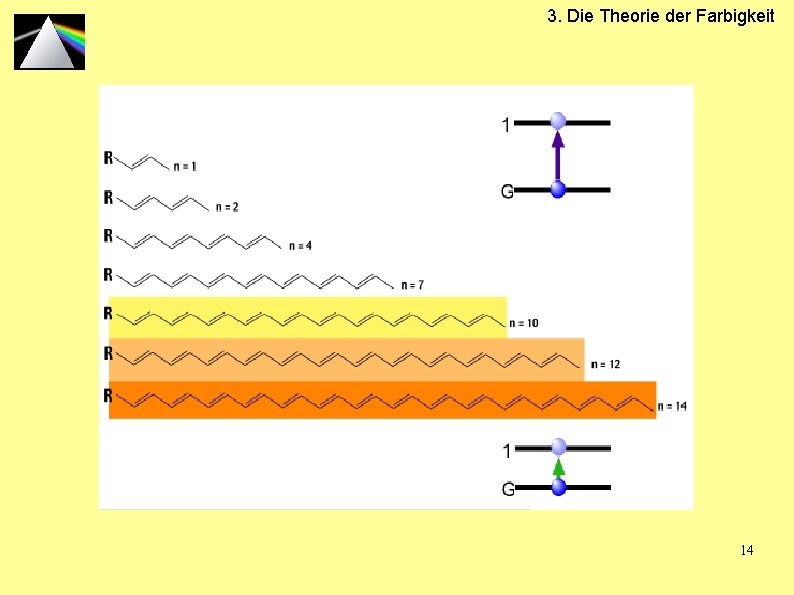
3. Die Theorie der Farbigkeit 14

V 1: Aromatenprobe
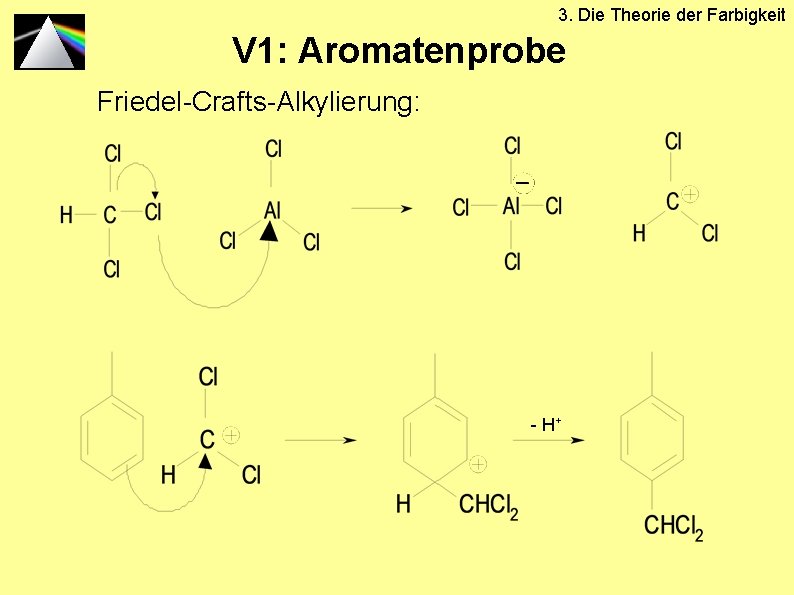
3. Die Theorie der Farbigkeit V 1: Aromatenprobe Friedel-Crafts-Alkylierung: - H+
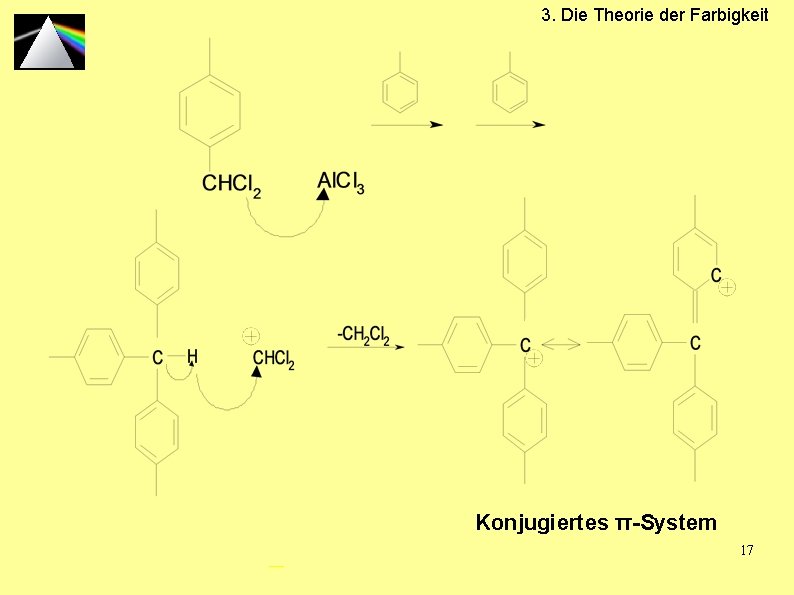
3. Die Theorie der Farbigkeit Konjugiertes π-System 17

4. Der Einsatz von Farbstoffen Einsatz aus ästhetischen Gründen: – Färben von Textilien und Leder – Druckereien, Papierfärbung – Färben von Lebensmitteln – Kosmetika etc. Einsatz aus funktionellen Gründen: – Indikatoren – Sensibilisatoren etc. 18

4. 1 Textilfärberei ● ● ● Farbstoffe sollen Textilien waschecht färben Waschechtheit beruht auf Wechselwirkung zwischen Farbstoff und Fasertypen: Wolle: ionisierte Amino- bzw. Carboxylgruppen Seide: ionisierte Amino- bzw. Carboxylgruppen Baumwolle: Hydroxylgruppen 19

4. 1 Textilfärberei 4. 1. 1 Entwicklungs-Farbstoffe • • • Azo-Entwicklungs-Farbstoffe Grundierung der Textilien mit der wasserlöslichen farblose Kupplungskomponente Nach dem Trocknen Zugabe der Diazoniumsalz-Lösung Azokupplung: Entwicklung des wasserunlöslichen Farbstoffs auf der Faser Haftung durch Adsorption an der Faser 20

V 2: Entwicklungsfärben
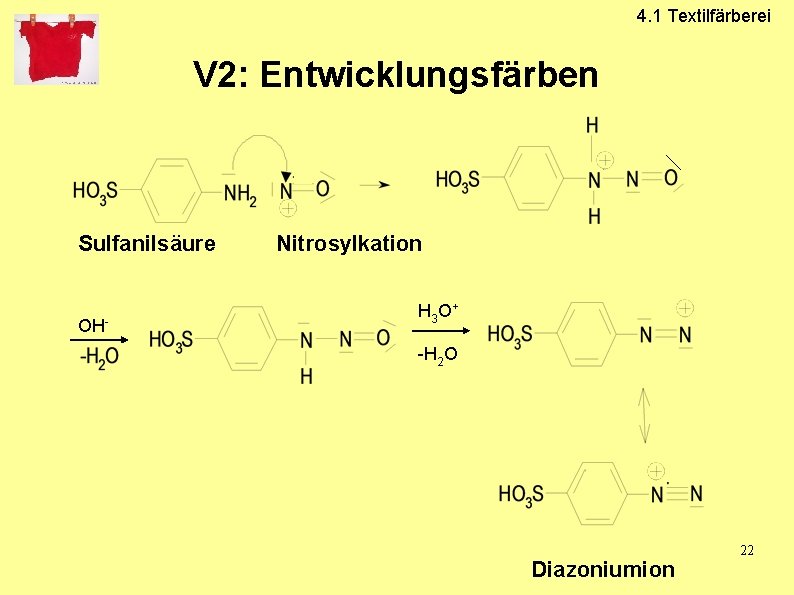
4. 1 Textilfärberei V 2: Entwicklungsfärben Sulfanilsäure OH- Nitrosylkation H 3 O + -H 2 O Diazoniumion 22
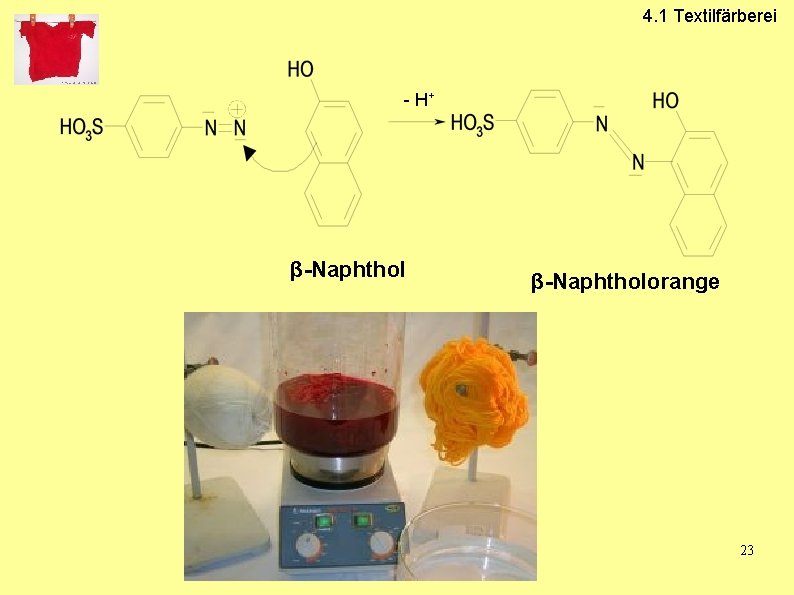
4. 1 Textilfärberei - H+ β-Naphtholorange 23
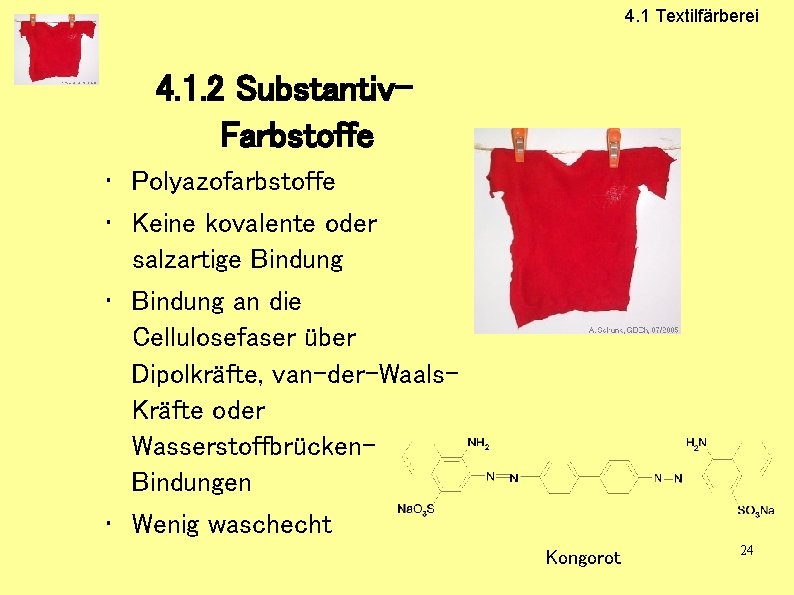
4. 1 Textilfärberei 4. 1. 2 Substantiv. Farbstoffe • Polyazofarbstoffe • Keine kovalente oder salzartige Bindung • Bindung an die Cellulosefaser über Dipolkräfte, van-der-Waals. Kräfte oder Wasserstoffbrücken. Bindungen • Wenig waschecht Kongorot 24

4. 1 Textilfärberei 4. 1. 3 Küpen-Farbstoffe • • Indigo- und Indanthren- Farbstoffe Unlöslicher Farbstoff Keine Direktfärbung möglich Reduktion in lösliche Form (Leuko-) Auf der Faser wird Leukoform zum unlöslichen Farbstoff oxidiert Van-der-Waals-Kräfte Waschecht Nicht abriebfest Indigofera tinctoria 25

V 3: Küpenfärbung
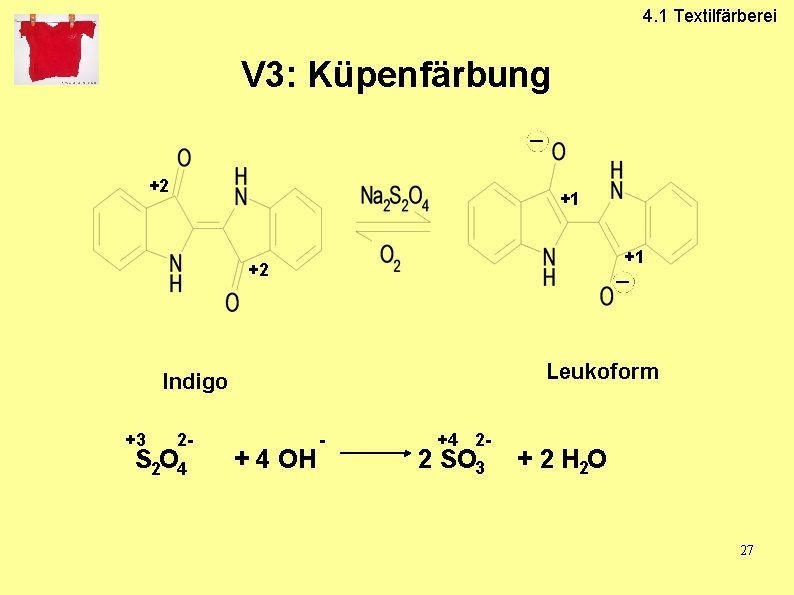
4. 1 Textilfärberei V 3: Küpenfärbung +2 +1 +1 +2 Leukoform Indigo +3 2 - S 2 O 4 + 4 OH - +4 2 - 2 SO 3 + 2 H 2 O 27
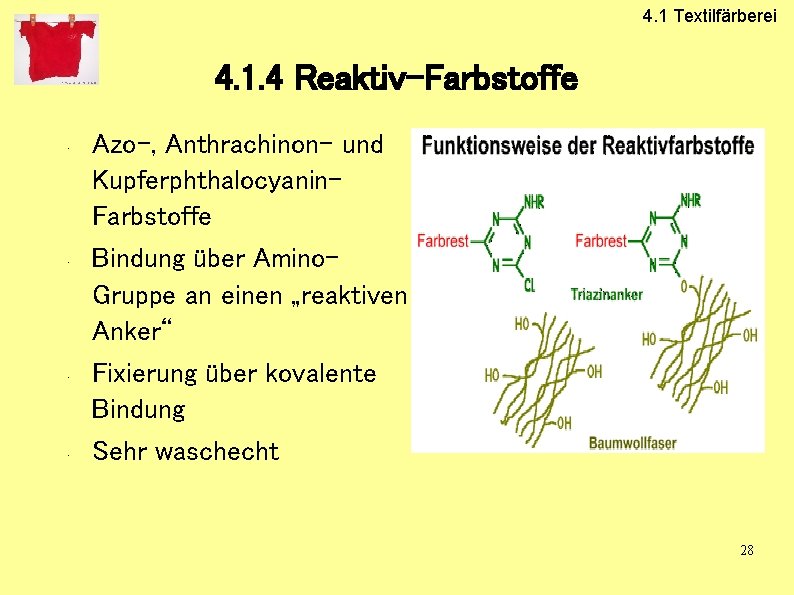
4. 1 Textilfärberei 4. 1. 4 Reaktiv-Farbstoffe • • Azo-, Anthrachinon- und Kupferphthalocyanin. Farbstoffe Bindung über Amino. Gruppe an einen „reaktiven Anker“ Fixierung über kovalente Bindung Sehr waschecht 28

4. 1 Textilfärberei 4. 1. 5 Beizen-Farbstoffe ● ● Metallkomplex-Farbstoffe Beizmittel: wasserlösliche Mineral- oder Metallsalze (Alaun, Eisen- und Kupfersalze) Feste Verbindung zwischen Metallion und Farbstoff Hohe Waschechtheit + + Rubia tinctorum Allizarin 29

4. 2 Lebensmittelfarbstoffe 1. Natürliche, naturidentische oder synthetische Farbstoffe 2. Zum Färben von Nahrungs-, Genuss- und Arztneimitteln 3. Verleihen ein appetitliches Aussehen 4. E 100 - E 200 5. ADI-Werte (Acceptable Daily Intake) 6. Bewertung durch FAO (Food and Agriculture Organization of the United Nations) / WHO (World Health Organization) 30

D 2: Echter oder falscher Lachs?
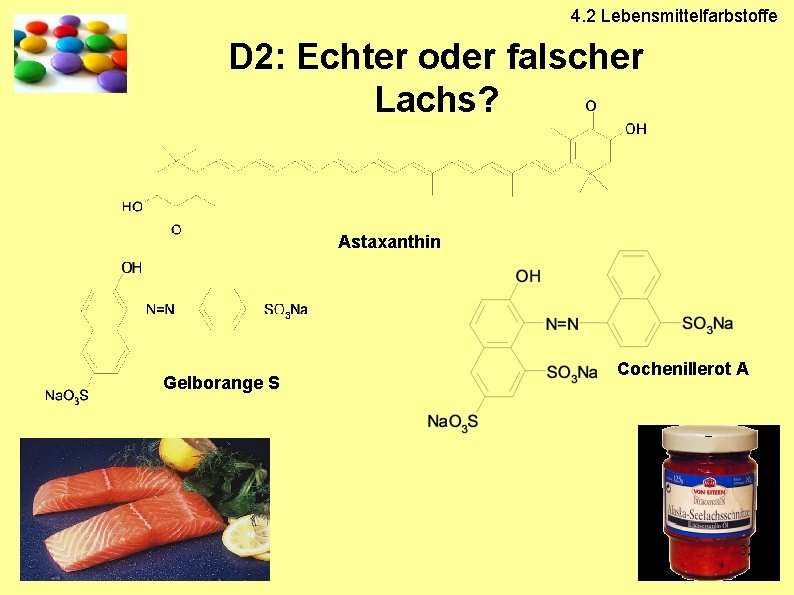
4. 2 Lebensmittelfarbstoffe D 2: Echter oder falscher Lachs? Astaxanthin Gelborange S Cochenillerot A 32

4. 2 Lebensmittelfarbstoffe Fleischfärbung des Lachs ● Carotinoid-Einlagerungen im Muskelgewebe nicht durch einfache Extraktion isolierbar! ● Nahrung der Lachse: Krebstiere ● Futterzusätze in Lachsfarmen: „Carophyll Pink“ 33

4. 3 Funktionelle Farbstoffe ● Anwendung nicht aufgrund ästhetischer Wirkung ● Farbe ist irrelevant ● Erfüllen wohldefinierte Funktion Klassifizierung: ● Lichtabsorbierende- bzw. lichtemittierende Eigenschaften ● Lichtinduzierte Polarisation ● Photoelektrische und photochemische Aktivität 34

4. 3 Funktionelle Farbstoffe Der Einsatz funktioneller Farbstoffe ● ● ● Sensibilisatoren für Silberhalogenide in fotografischen Filmen Optische Datenspeicherung (Elektrofotografie) Photochrome Verbindungen in Sonnenbrillen ● p. H-Indikatoren in der Analytik ● Natürliche Farbstoffe (Chlorophyll, Anthocyane) ● Betain-Farbstoffe für empirische Ermittlung der Lösungsmittelpolarität 35

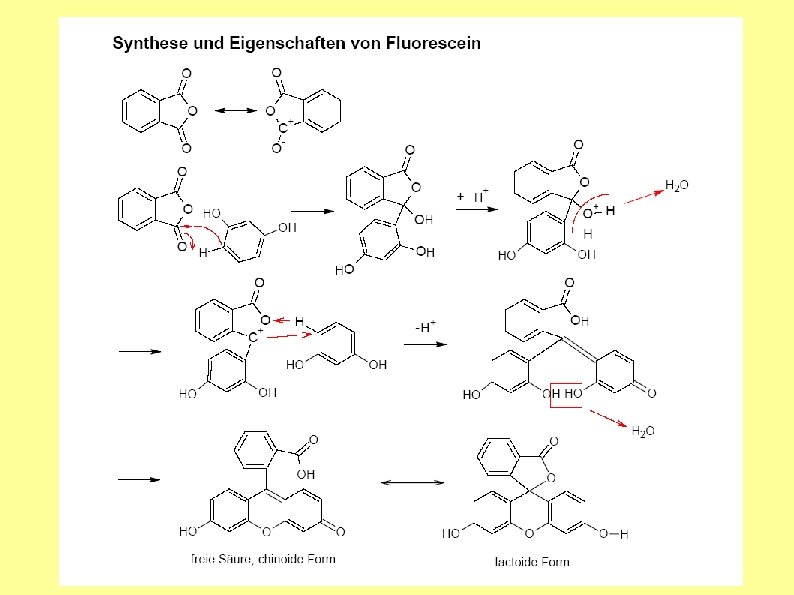
V 4: Darstellung von Fluorescein
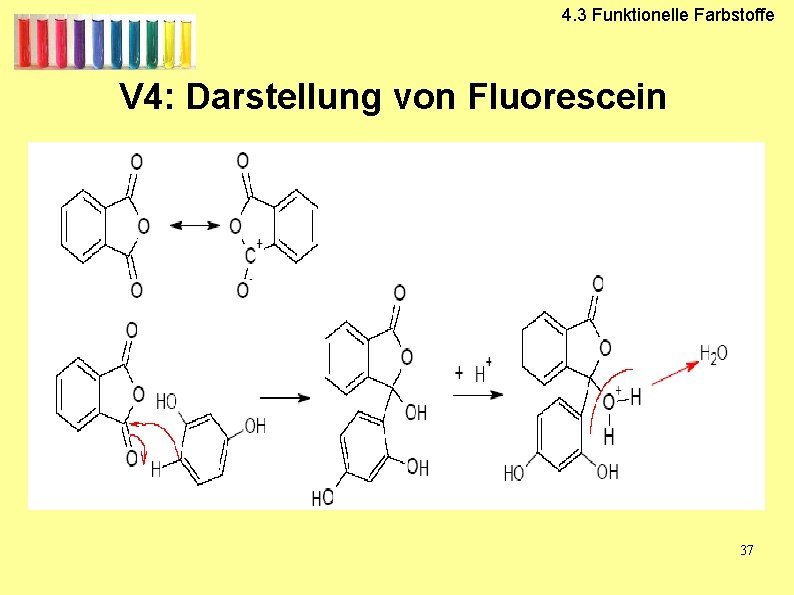
4. 3 Funktionelle Farbstoffe V 4: Darstellung von Fluorescein 37
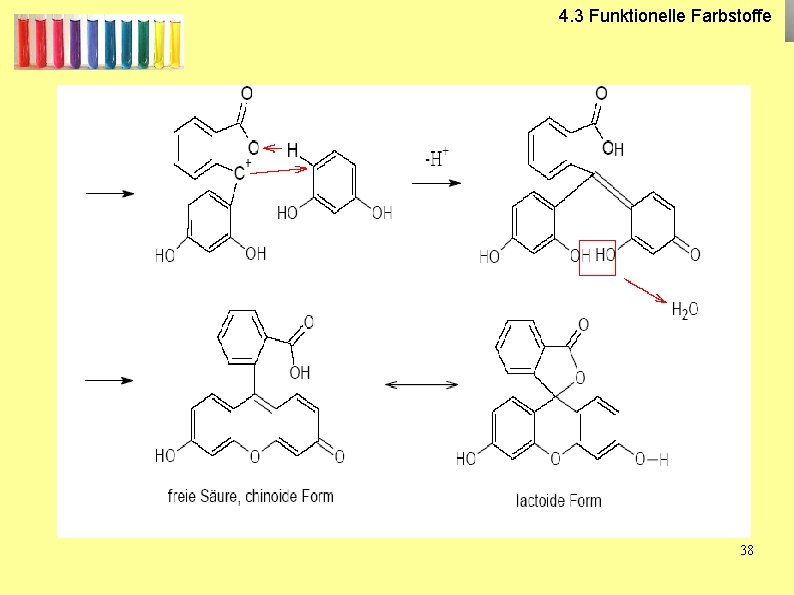
4. 3 Funktionelle Farbstoffe Fluorescein 38
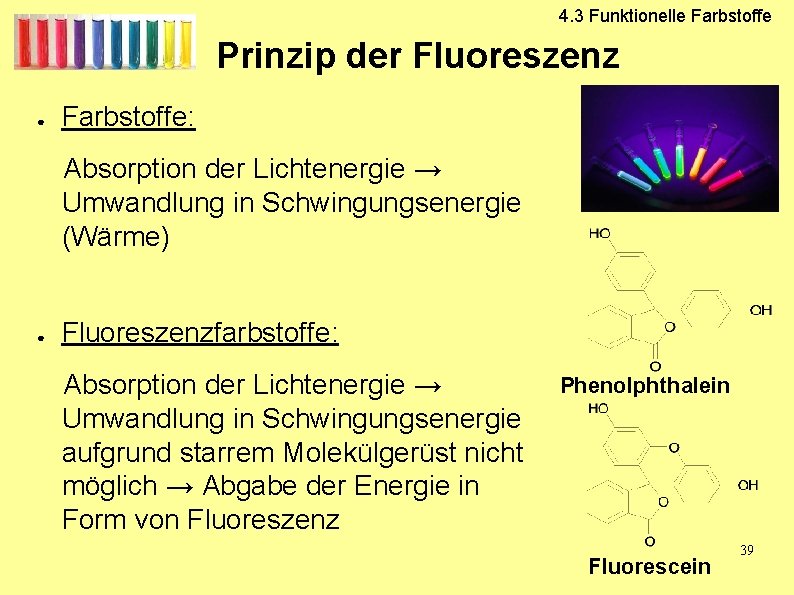
4. 3 Funktionelle Farbstoffe Prinzip der Fluoreszenz ● Farbstoffe: Absorption der Lichtenergie → Umwandlung in Schwingungsenergie (Wärme) ● Fluoreszenzfarbstoffe: Absorption der Lichtenergie → Umwandlung in Schwingungsenergie aufgrund starrem Molekülgerüst nicht möglich → Abgabe der Energie in Form von Fluoreszenz Phenolphthalein Fluorescein 39
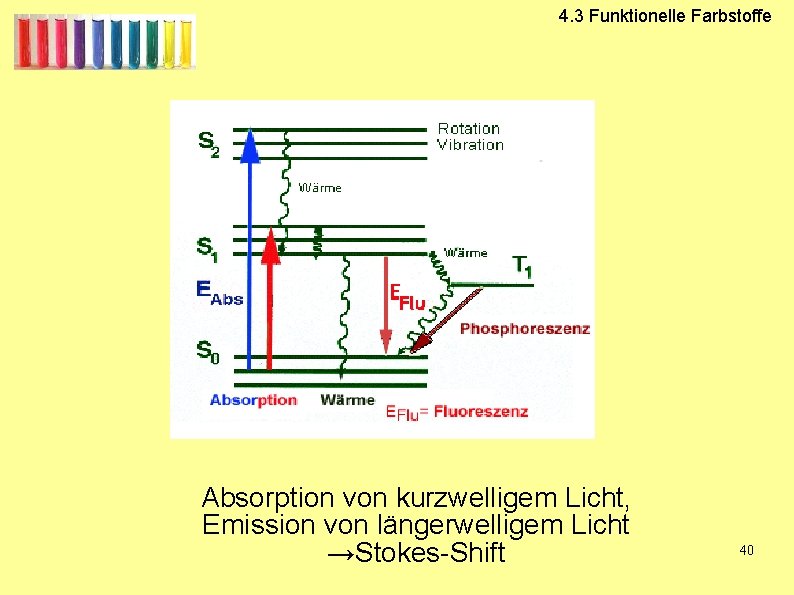
4. 3 Funktionelle Farbstoffe Absorption von kurzwelligem Licht, Emission von längerwelligem Licht →Stokes-Shift 40

4. 3 Funktionelle Farbstoffe Verwendung von Fluorescein ● Fluoreszenzmikroskopie ● Nachweis von Bromiden ● p. H-Indikator für undurchsichtige Lösungen (Bsp. : Klärschlammtitration) ● ● ● Quellenfärbung (Nachweis unterirdischer Wasserläufe) Seenotrettung (500 g färben 4000 qm Wasseroberfläche) Diagnose von Hornhautschäden am Auge 41
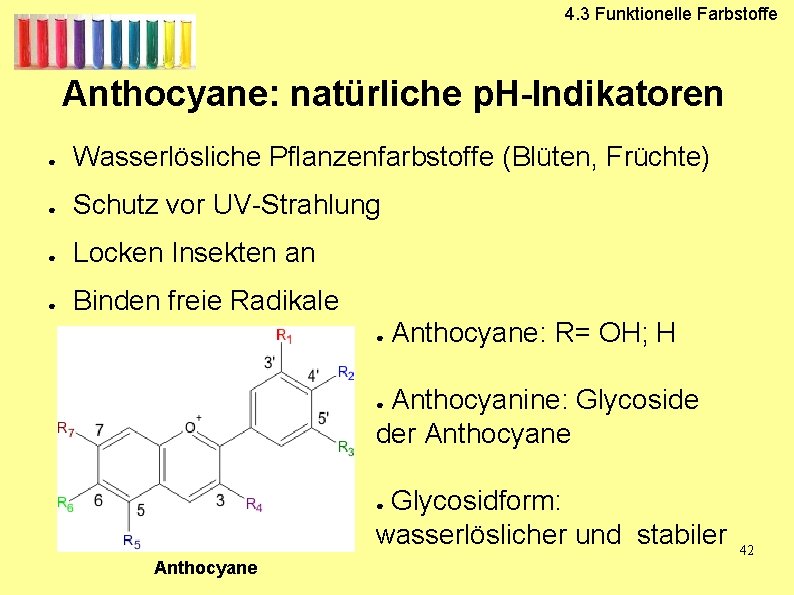
4. 3 Funktionelle Farbstoffe Anthocyane: natürliche p. H-Indikatoren ● Wasserlösliche Pflanzenfarbstoffe (Blüten, Früchte) ● Schutz vor UV-Strahlung ● Locken Insekten an ● Binden freie Radikale ● Anthocyane: R= OH; H Anthocyanine: Glycoside der Anthocyane ● Glycosidform: wasserlöslicher und stabiler ● Anthocyane 42

V 5: Zauberrose
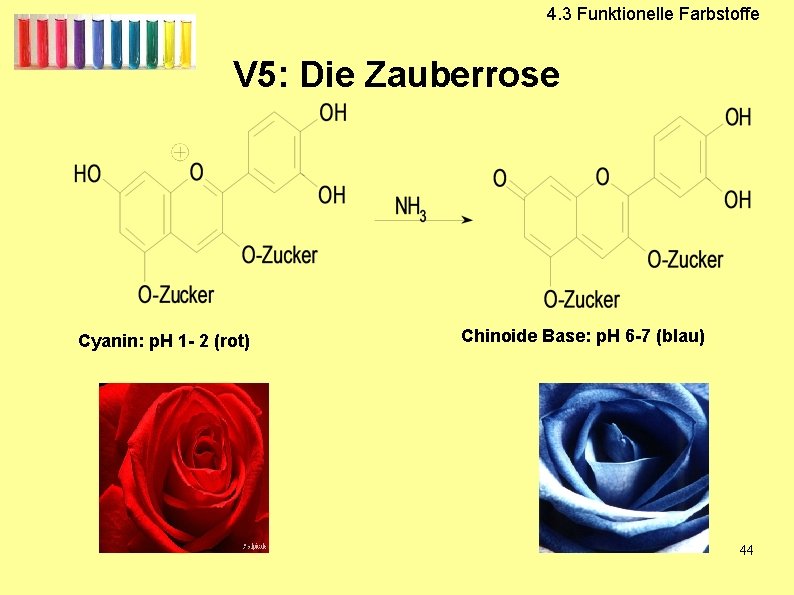
4. 3 Funktionelle Farbstoffe V 5: Die Zauberrose Cyanin: p. H 1 - 2 (rot) Chinoide Base: p. H 6 -7 (blau) 44

D 3: Solvatochromie
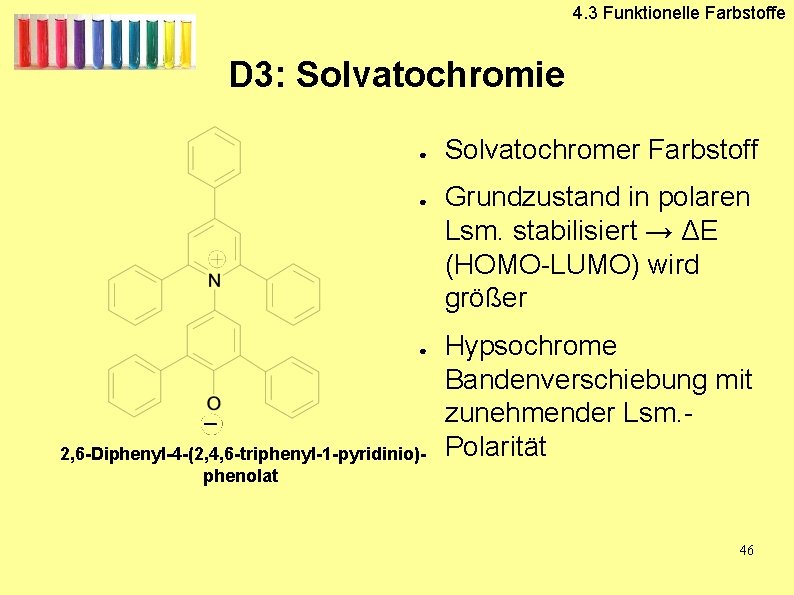
4. 3 Funktionelle Farbstoffe D 3: Solvatochromie ● ● ● 2, 6 -Diphenyl-4 -(2, 4, 6 -triphenyl-1 -pyridinio)phenolat Solvatochromer Farbstoff Grundzustand in polaren Lsm. stabilisiert → ΔE (HOMO-LUMO) wird größer Hypsochrome Bandenverschiebung mit zunehmender Lsm. Polarität 46
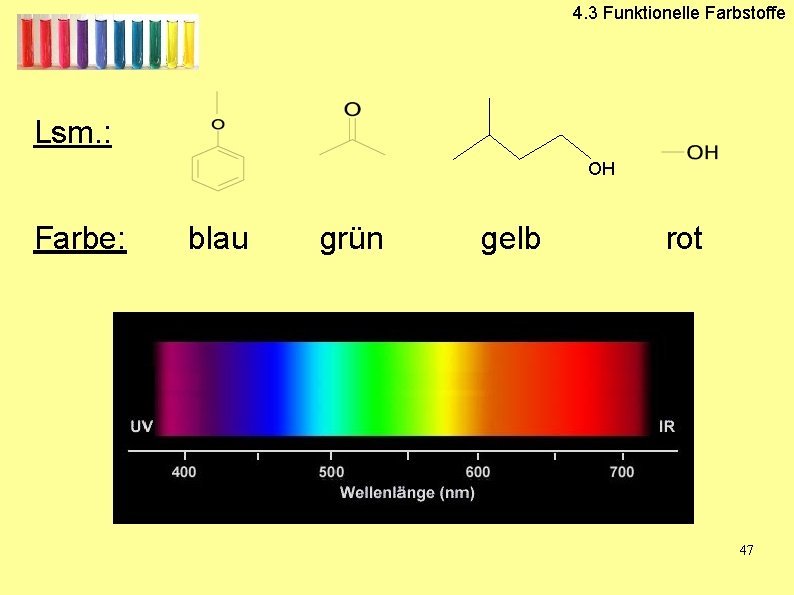
4. 3 Funktionelle Farbstoffe Lsm. : OH Farbe: blau grün gelb rot 47

5. Schulische Relevanz GK / LK 13. 2 Wahlthema „Angewandte Chemie“ (Std. : GK 24; LK 43) ● Licht und Farbe ● Theorien der Farbigkeit ● Einteilung der Farbstoffe nach Farbstoffklassen ● Synthese von Farbstoffen ● Färbetechniken ● p. H-Indikatoren ● Lebensmittelfarbstoffe ● Natürliche Farbstoffe 48

Ende
- Slides: 50