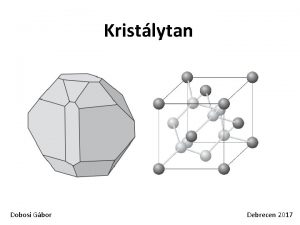
ltalnos Genetika A DNS szerkezete s replikcija 1

























- Slides: 74

Általános Genetika A DNS szerkezete és replikációja 1

A mai óra kulcskérdései • A kettőshélix felfedezése előtt hogyan kísérletesen, hogy az örökítőanyag a DNS ? bizonyították • Milyen korábbi adatok, ismeretek alapján hozták létre a kettős hélix modellt? • Hogyan adódik a DNS replikáció mechanizmusa a kettős hélix szerkezetből? • Milyen szabályszerűségek szerint történik az extranukleáris genetikai állományban tárolt információ áramlása ? • Milyen speciális mechanizmus felelős a kromoszómavégek replikációjáért és milyen egészségügyi következménye van, ha ez a folyamat valamilyen okból nem működik megfelelően ? 2

Az örökítőanyag - a DNS - szerkezetét és működésmódját 1953 -ban írta le James Watson és Francis Crick Munkájukat a következő előzményekre alapozhatták: - Az egyes tulajdonságokat öröklődő részecskék (gének) alakítják ki (Mendel) - A gének fehérjék szerkezetét befolyásolják, egy gén ~ egy enzim. (Beadle és Tatum) - A gének kromoszómákon vannak (Bridges) - A kromoszómák DNS-ből és fehérjékből állnak - Az örökítőanyag a DNS 3

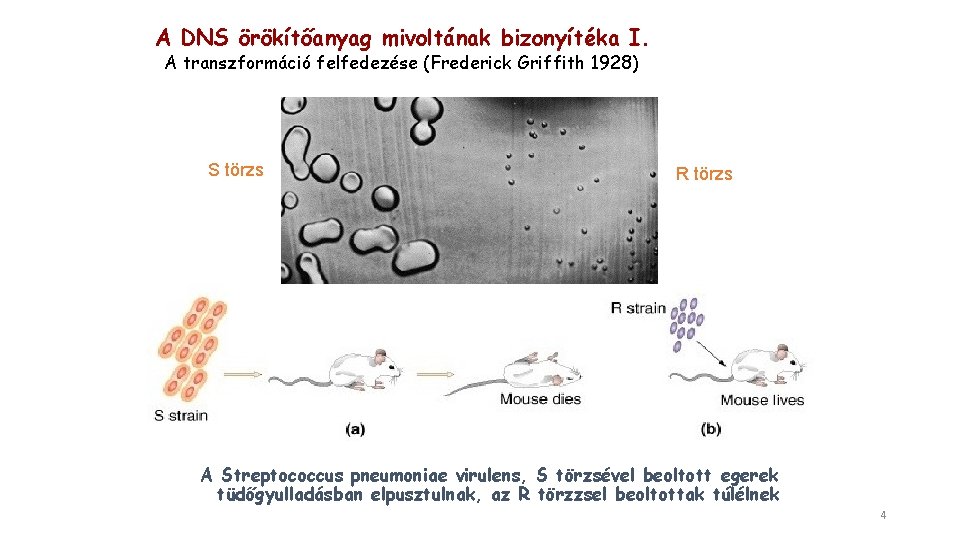
A DNS örökítőanyag mivoltának bizonyítéka I. A transzformáció felfedezése (Frederick Griffith 1928) S törzs R törzs A Streptococcus pneumoniae virulens, S törzsével beoltott egerek tüdőgyulladásban elpusztulnak, az R törzzsel beoltottak túlélnek 4

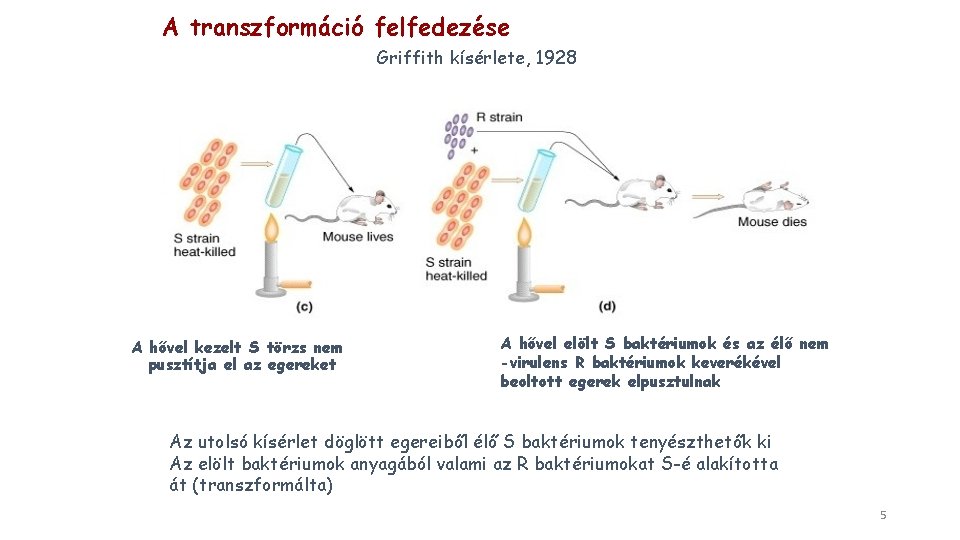
A transzformáció felfedezése Griffith kísérlete, 1928 A hővel kezelt S törzs nem pusztítja el az egereket A hővel elölt S baktériumok és az élő nem -virulens R baktériumok keverékével beoltott egerek elpusztulnak Az utolsó kísérlet döglött egereiből élő S baktériumok tenyészthetők ki Az elölt baktériumok anyagából valami az R baktériumokat S-é alakította át (transzformálta) 5

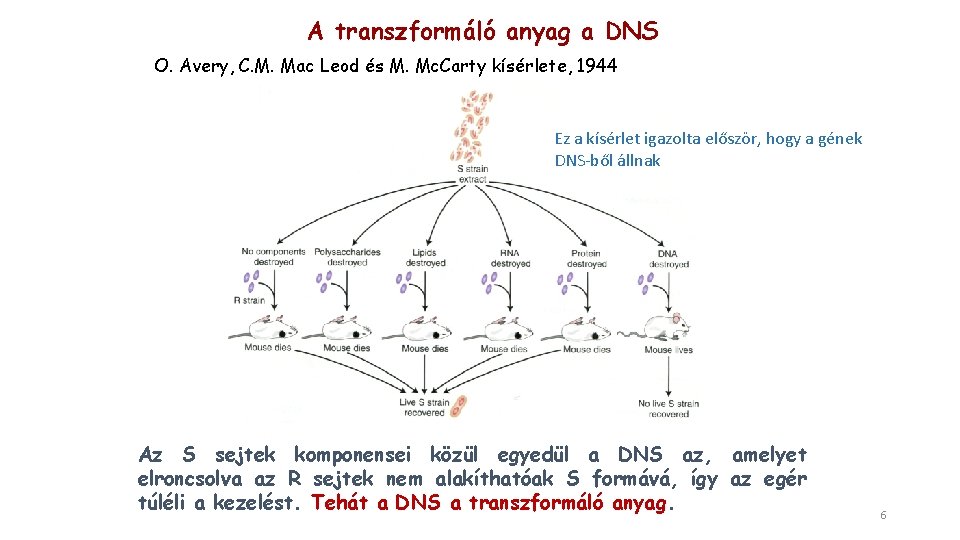
A transzformáló anyag a DNS O. Avery, C. M. Mac Leod és M. Mc. Carty kísérlete, 1944 Ez a kísérlet igazolta először, hogy a gének DNS-ből állnak Az S sejtek komponensei közül egyedül a DNS az, amelyet elroncsolva az R sejtek nem alakíthatóak S formává, így az egér túléli a kezelést. Tehát a DNS a transzformáló anyag. 6

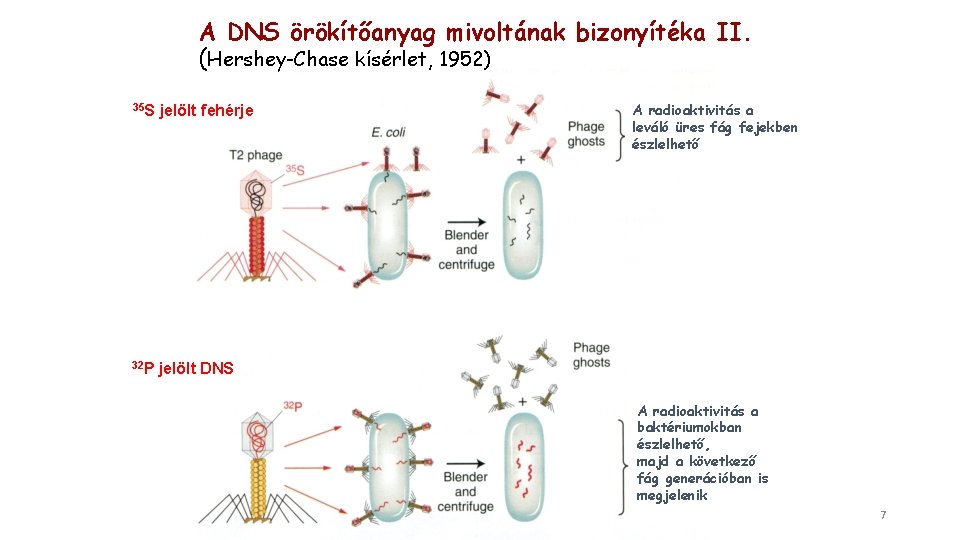
A DNS örökítőanyag mivoltának bizonyítéka II. (Hershey-Chase kísérlet, 1952) 35 S jelölt fehérje 32 P jelölt DNS A radioaktivitás a leváló üres fág fejekben észlelhető A radioaktivitás a baktériumokban észlelhető, majd a következő fág generációban is megjelenik 7

A DNS örökítőanyag mivoltának bizonyítéka II. (Hershey-Chase kísérlet, 1952) A Hershey-Chase kísérlet igazolta, hogy a fágok örökítő anyaga a DNS, nem pedig a fehérje A kísérlet kétféleképpen előkészített T 2 fágot használt. Az egyik esetén a fehérje burkot radioaktív kénnel (35 S) jelölték. A kén nem fordul elő a DNS-ben A másik esetben radioaktív foszforral (32 P) a DNS-t jelölték. A foszfor nem fordul elő a fehérjében Közvetlenül a fágfertőzés után a fágokat keveréssel és centrifugálással elválasztották a baktériumoktól Csak a 35 P injektálódott az E. coli-ba, jelezve, hogy a DNS az új fágok létrejöttéhez szükséges anyag 8

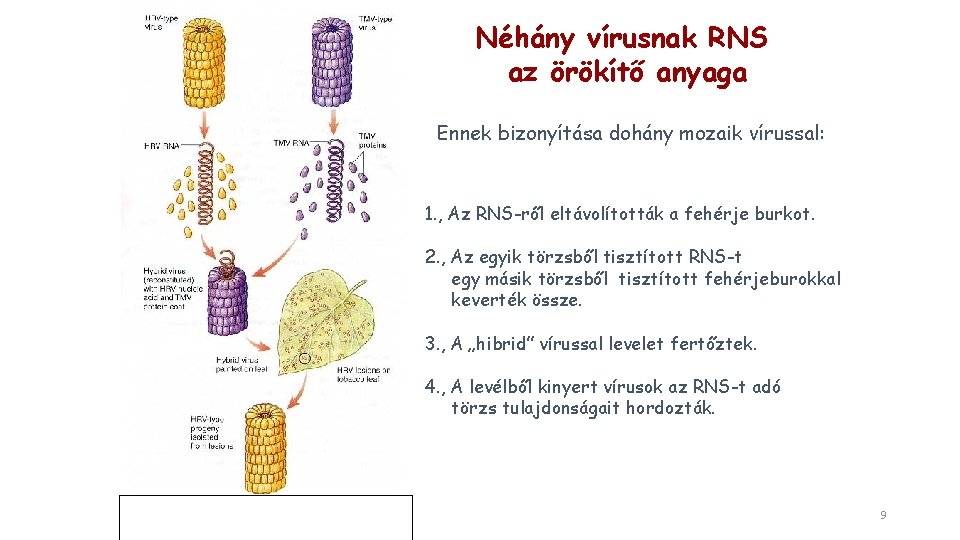
Néhány vírusnak RNS az örökítő anyaga Ennek bizonyítása dohány mozaik vírussal: 1. , Az RNS-ről eltávolították a fehérje burkot. 2. , Az egyik törzsből tisztított RNS-t egy másik törzsből tisztított fehérjeburokkal keverték össze. 3. , A „hibrid” vírussal levelet fertőztek. 4. , A levélből kinyert vírusok az RNS-t adó törzs tulajdonságait hordozták. 9

Mit kell „tudnia” a genetikai anyagnak? 1. , Rendelkeznie kell az információ tárolásának és működtetésének képességével 2. , Képesnek kell lennnie ezen információt pontosan megkétszerezni és változatlan formában továbbadni 3. , Rendelkeznie kell a változékonyság képességével A DNS ismert kémiai szerkezete túlságosan egyszerű felépítésűnek tűnt ahhoz, hogy a fenti feladatoknak megfelelhessen 10

A DNS szerkezete Mit tudtunk róla régen és ma? 11

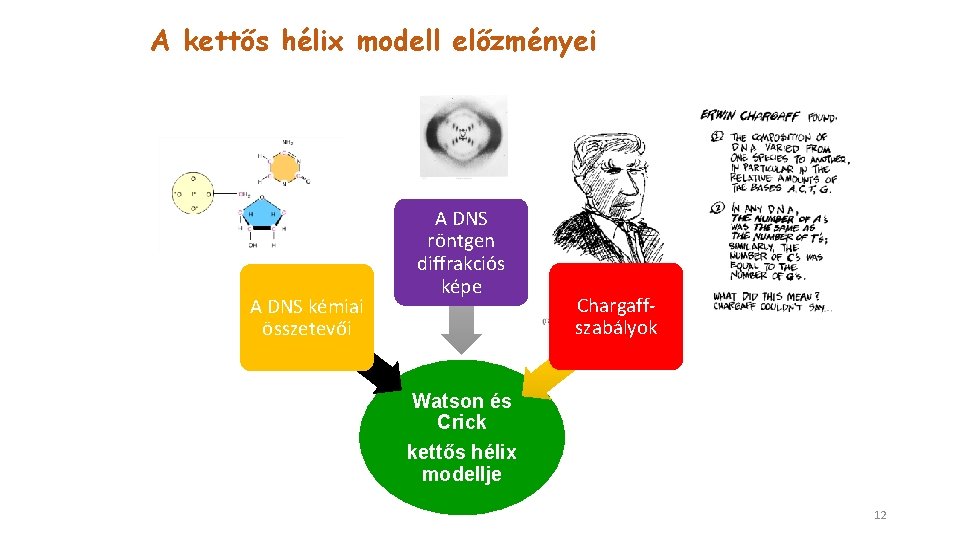
A kettős hélix modell előzményei A DNS kémiai összetevői A DNS röntgen diffrakciós képe Chargaffszabályok Watson és Crick kettős hélix modellje 12

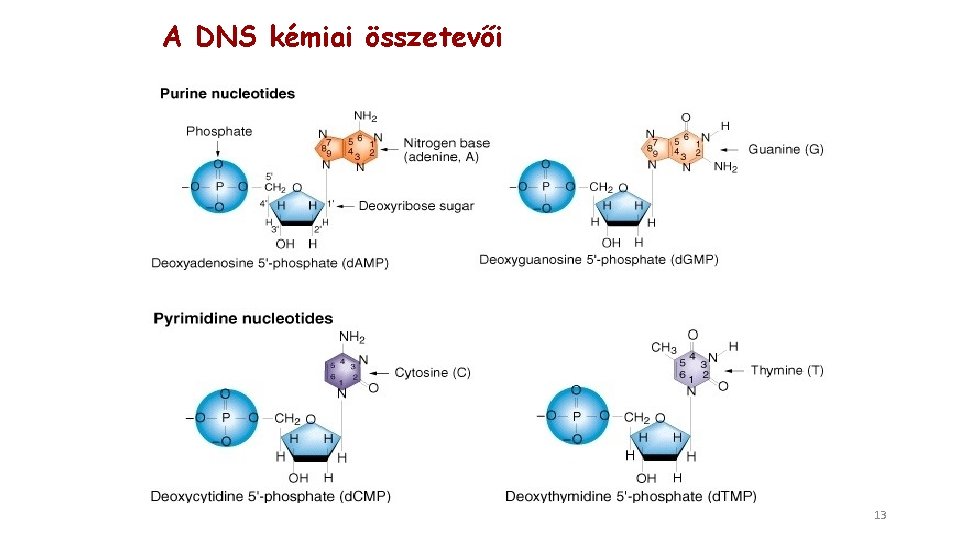
A DNS kémiai összetevői 13

A DNS kémiai összetevői A DNS kémiai felépítésének alapegysége a nukleotid. A nukleotid foszfátot, dezoxiribóz cukrot és négy szerves bázisból egyet tartalmaz. A négy bázis az adenin, a guanin, a citozin és a timin. A cukor és a bázis alkotta egység a nukleozid: dezoxiadenozin, dezoxiguanozin, dezoxicitidin, dezoxitimidin. A nukleotidok teljes kémiai neve: rövidítése dezoxiadenozin 5’-monofoszfát, d. AMP - A dezoxiguanozin 5’-monofoszfát, d. GMP -G dezoxicitidin 5’-monofoszfát, d. CMP -C dezoxitimidin 5’-monofoszfát, d. TMP -T 14

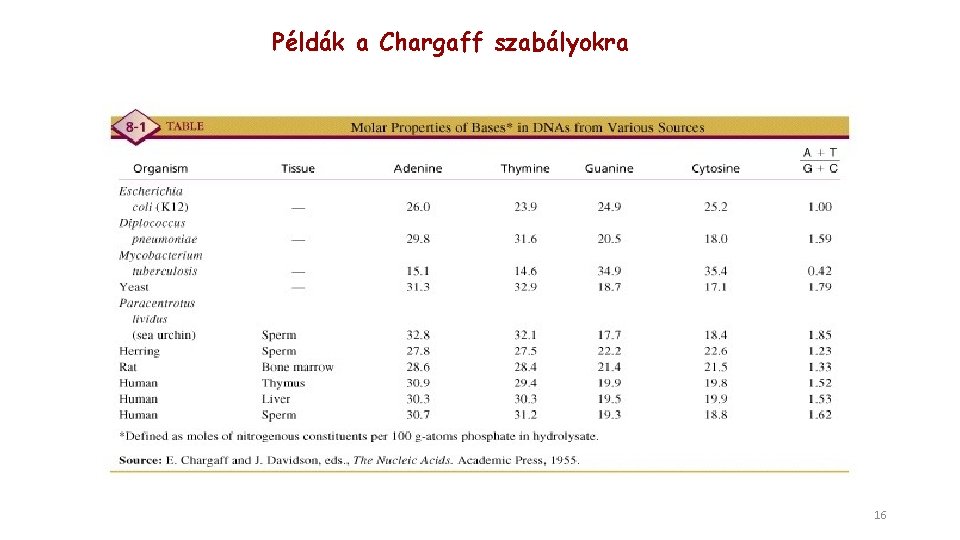
A Chargaff szabályok (1950) Kölönböző élőlényekből kivonható DNS összetételének vizsgálata érdekes törvényszerűségeket tárt fel. A törvényszerűségeket Erwin Chargaff ismerte fel: 1. Az élőlényekből származó DNS-ekben a pirimidin nukleotidok (T + C) mennyisége egyenlő a purin (A + G) nukleotidok mennyiségével 2. A T mennyisége egyenlő az A-val, és C mennyisége egyenlő G-vel Azonban A + T és C + G mennyiségek nem feltétlenül egyenlők, azok aránya jellemző az élőlényre amiből a DNS származik 15

Példák a Chargaff szabályokra 16

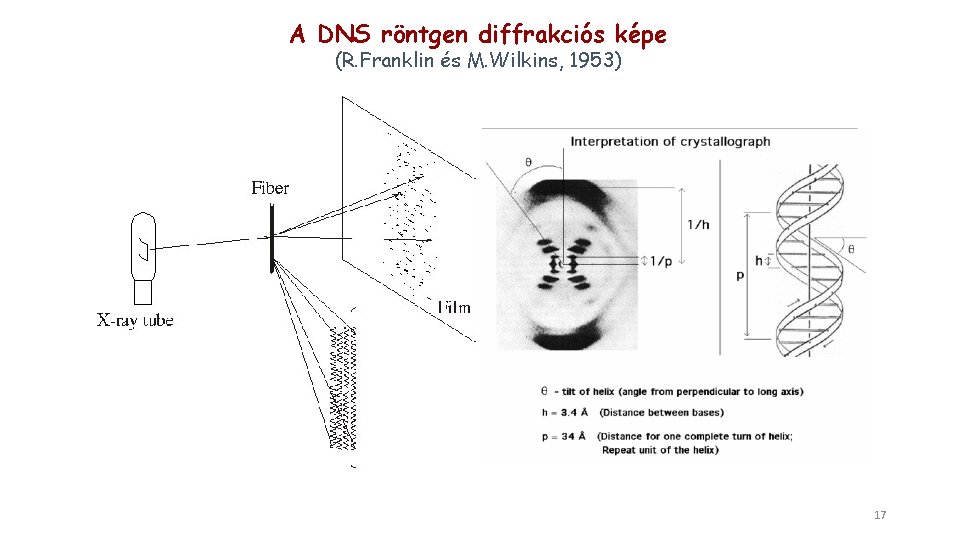
A DNS röntgen diffrakciós képe (R. Franklin és M. Wilkins, 1953) 17

A DNS (B forma) röntgen diffrakciós képe (R. Franklin és M. Wilkins, 1953) A röntgen diffrakcióval kapott adatok azt jelezték, hogy - a molekula fonálszerű - a fonál két párhuzamos szerkezetből áll - egyenletes átmérőjű - spirál alakú 18

A DNS térszerkezetét Watson és Crick oldotta meg l 953 -ban A modell kidolgozása során merészen összeillesztették a röntgen diffrakciós adatokat, a Chragaff szabályokat és a DNS és alkotórészeiről felhalmozódott kémiai ismereteket olymódon, hogy a modell eleget tehessen az örökítőanyag által támasztott követelményeknek 19

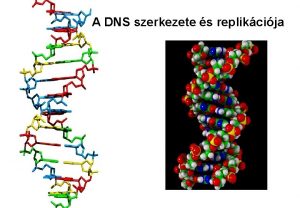
A DNS kettős spirál 20

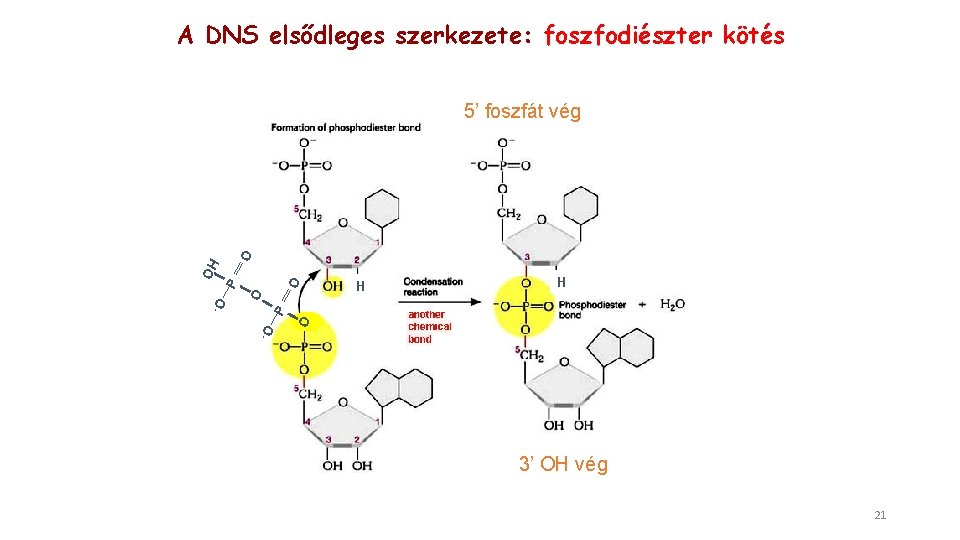
A DNS elsődleges szerkezete: foszfodiészter kötés O H H O - O P OH O 5’ foszfát vég 3’ OH vég 21

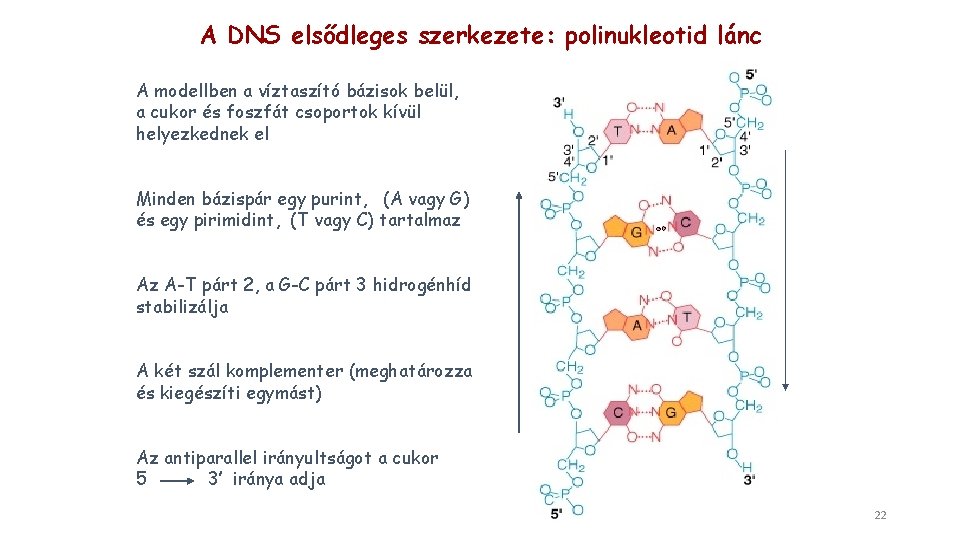
A DNS elsődleges szerkezete: polinukleotid lánc A modellben a víztaszító bázisok belül, a cukor és foszfát csoportok kívül helyezkednek el Minden bázispár egy purint, (A vagy G) és egy pirimidint, (T vagy C) tartalmaz Az A-T párt 2, a G-C párt 3 hidrogénhíd stabilizálja A két szál komplementer (meghatározza és kiegészíti egymást) Az antiparallel irányultságot a cukor 5 3’ iránya adja 22

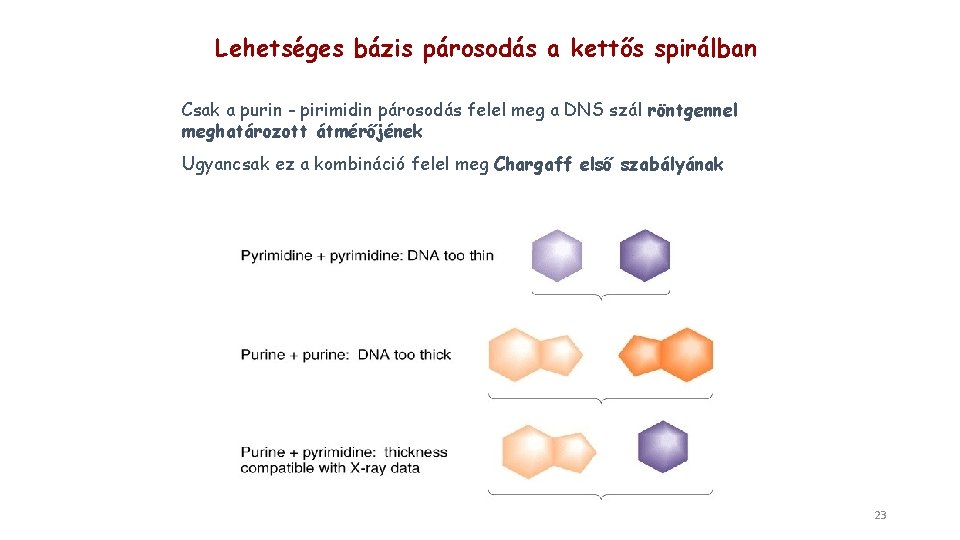
Lehetséges bázis párosodás a kettős spirálban Csak a purin - pirimidin párosodás felel meg a DNS szál röntgennel meghatározott átmérőjének Ugyancsak ez a kombináció felel meg Chargaff első szabályának 23

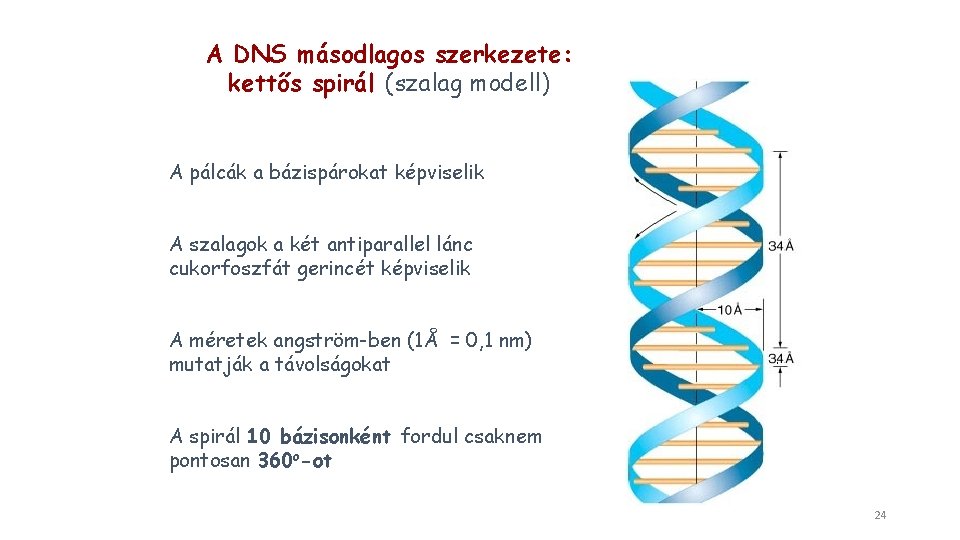
A DNS másodlagos szerkezete: kettős spirál (szalag modell) A pálcák a bázispárokat képviselik A szalagok a két antiparallel lánc cukorfoszfát gerincét képviselik A méretek angström-ben (1Å = 0, 1 nm) mutatják a távolságokat A spirál 10 bázisonként fordul csaknem pontosan 360 o-ot 24

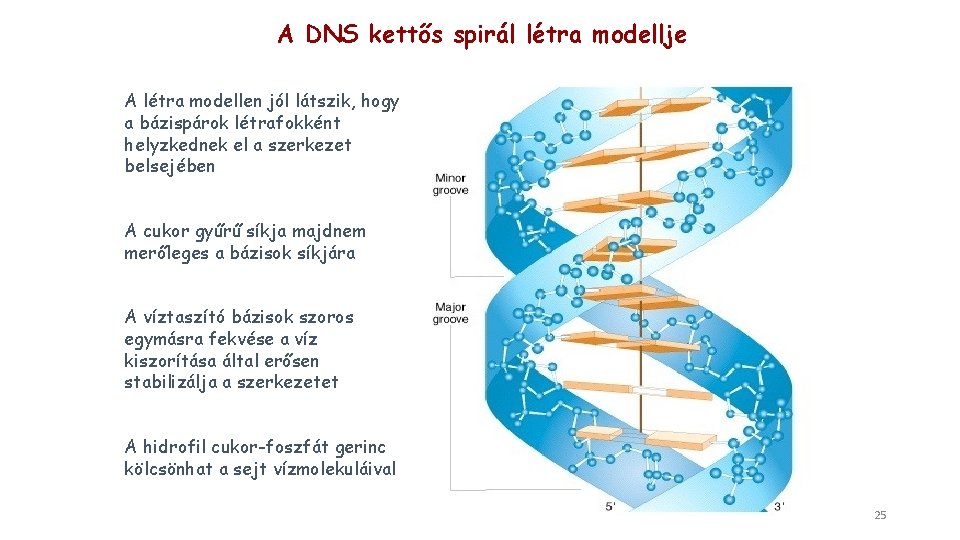
A DNS kettős spirál létra modellje A létra modellen jól látszik, hogy a bázispárok létrafokként helyzkednek el a szerkezet belsejében A cukor gyűrű síkja majdnem merőleges a bázisok síkjára A víztaszító bázisok szoros egymásra fekvése a víz kiszorítása által erősen stabilizálja a szerkezetet A hidrofil cukor-foszfát gerinc kölcsönhat a sejt vízmolekuláival 25

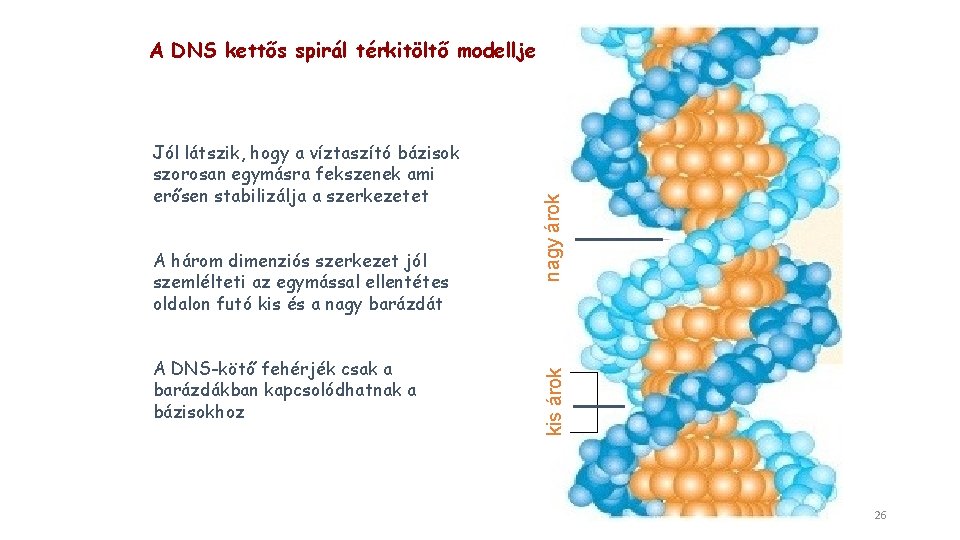
A három dimenziós szerkezet jól szemlélteti az egymással ellentétes oldalon futó kis és a nagy barázdát A DNS-kötő fehérjék csak a barázdákban kapcsolódhatnak a bázisokhoz kis árok Jól látszik, hogy a víztaszító bázisok szorosan egymásra fekszenek ami erősen stabilizálja a szerkezetet nagy árok A DNS kettős spirál térkitöltő modellje 26

A DNS többféle másodlagos szerkezetet vehet fel Az élőlényekben és vizes oldatban a „B” forma a leggyakoribb, ebben a bázisok síkja majdnem merőleges a cukorfoszfát gerincre A B Z Dehidrált körülmények között egy tömörebb „A” forma jön létre, melyben a bázisok síkja megdől Hosszú GCGCGC. . ismétlődések a Z formát vehetik fel, amely balmenetes, zegzugos lefutású és megnyúlt 27

A DNS replikációja prokariótákban 28

A replikációval szembeni követelmények: 1. , Sokszor: Egyetlen ember egyedfejlődése több millió sejtosztódást igényel 2. , Gyorsan: 1000 nukleotid/másodperc (1000 nukleotid/perc sebesség mellett egy E. coli 106 bp méretű genomja 3 napig replikálódna! – sejtciklusa 20 perc) 3. , Pontosan: A genom másolásánál csupán 1/ 100 000 (10 -8) replikációs hiba történik, melynek 99%-át a javító rendszer utólagosan kijavítja. Az átlagos mutációs ráta a replikáció végeztével 10 -10 Vagyis a 109 bp genom-méretű emberi sejt átlagos osztódása során 0 -1 új mutáció keletkezik replikációs hiba folytán 29

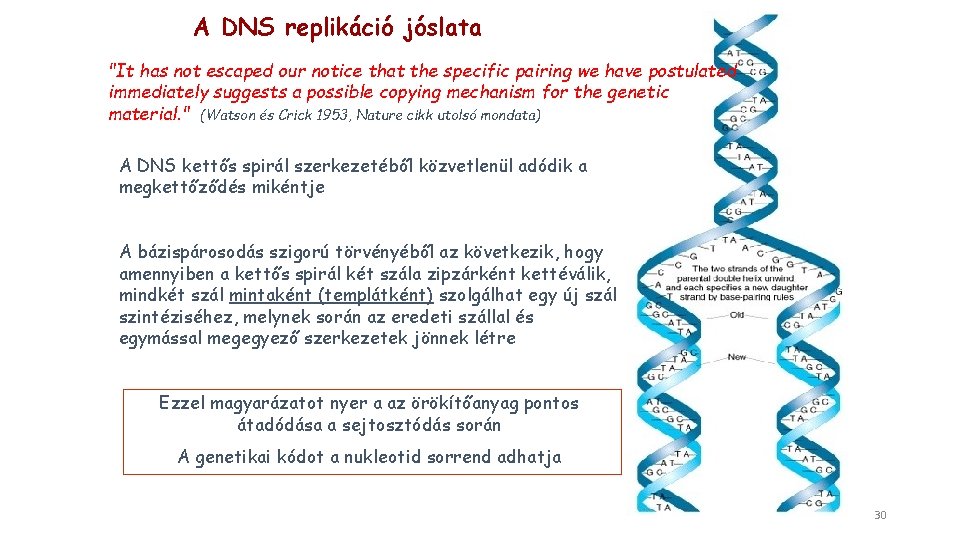
A DNS replikáció jóslata "It has not escaped our notice that the specific pairing we have postulated immediately suggests a possible copying mechanism for the genetic material. " (Watson és Crick 1953, Nature cikk utolsó mondata) A DNS kettős spirál szerkezetéből közvetlenül adódik a megkettőződés mikéntje A bázispárosodás szigorú törvényéből az következik, hogy amennyiben a kettős spirál két szála zipzárként kettéválik, mindkét szál mintaként (templátként) szolgálhat egy új szál szintéziséhez, melynek során az eredeti szállal és egymással megegyező szerkezetek jönnek létre Ezzel magyarázatot nyer a az örökítőanyag pontos átadódása a sejtosztódás során A genetikai kódot a nukleotid sorrend adhatja 30

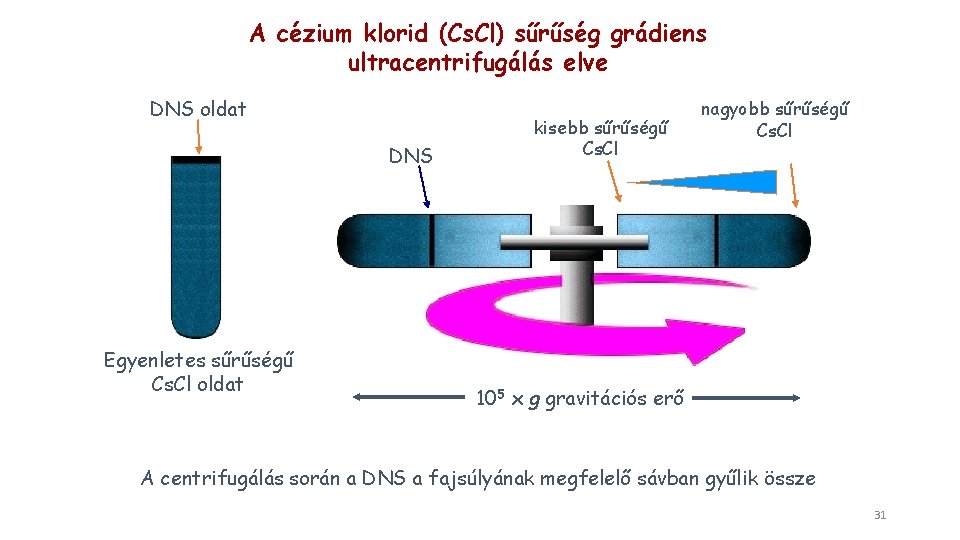
A cézium klorid (Cs. Cl) sűrűség grádiens ultracentrifugálás elve DNS oldat DNS Egyenletes sűrűségű Cs. Cl oldat kisebb sűrűségű Cs. Cl nagyobb sűrűségű Cs. Cl 105 x g gravitációs erő A centrifugálás során a DNS a fajsúlyának megfelelő sávban gyűlik össze 31

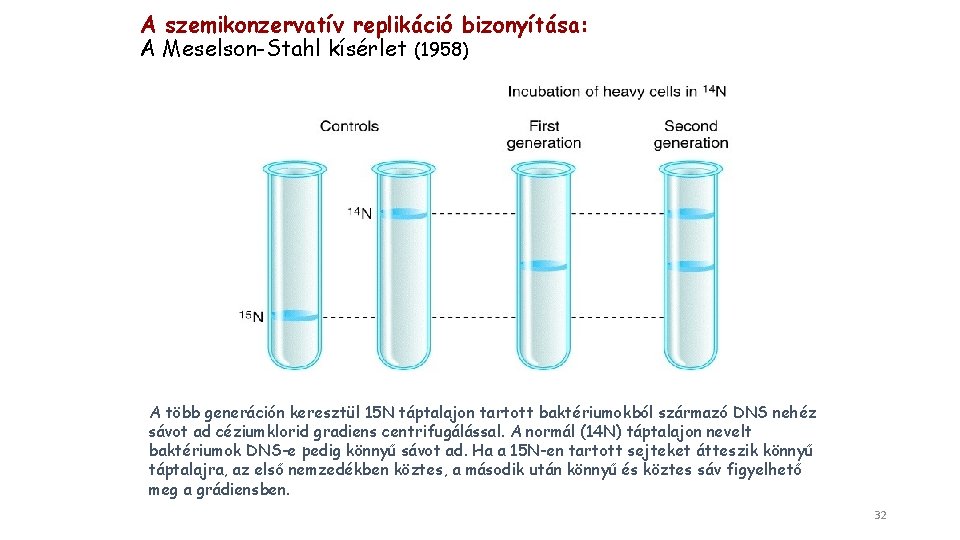
A szemikonzervatív replikáció bizonyítása: A Meselson-Stahl kísérlet (1958) A több generáción keresztül 15 N táptalajon tartott baktériumokból származó DNS nehéz sávot ad céziumklorid gradiens centrifugálással. A normál (14 N) táptalajon nevelt baktériumok DNS-e pedig könnyű sávot ad. Ha a 15 N-en tartott sejteket átteszik könnyű táptalajra, az első nemzedékben köztes, a második után könnyű és köztes sáv figyelhető meg a grádiensben. 32

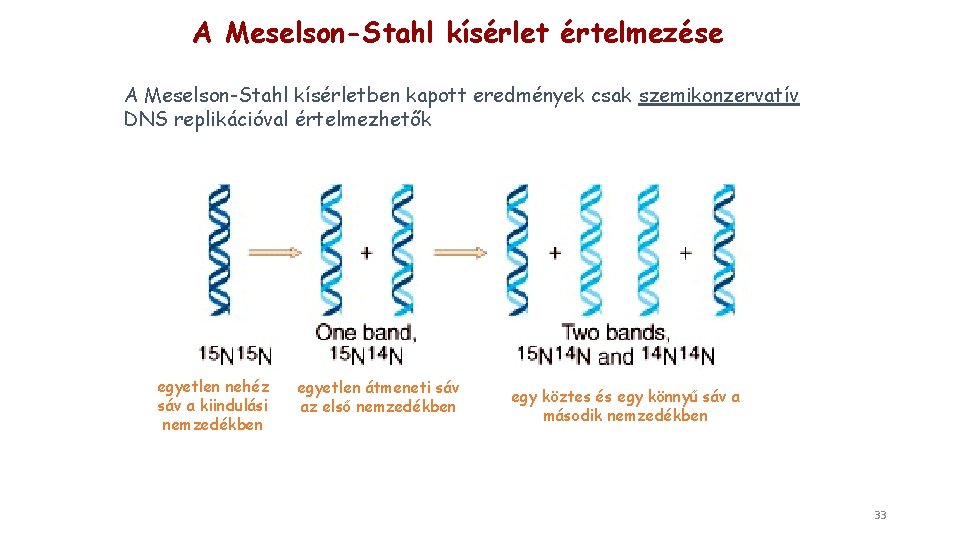
A Meselson-Stahl kísérlet értelmezése A Meselson-Stahl kísérletben kapott eredmények csak szemikonzervatív DNS replikációval értelmezhetők egyetlen nehéz sáv a kiindulási nemzedékben egyetlen átmeneti sáv az első nemzedékben egy köztes és egy könnyű sáv a második nemzedékben 33

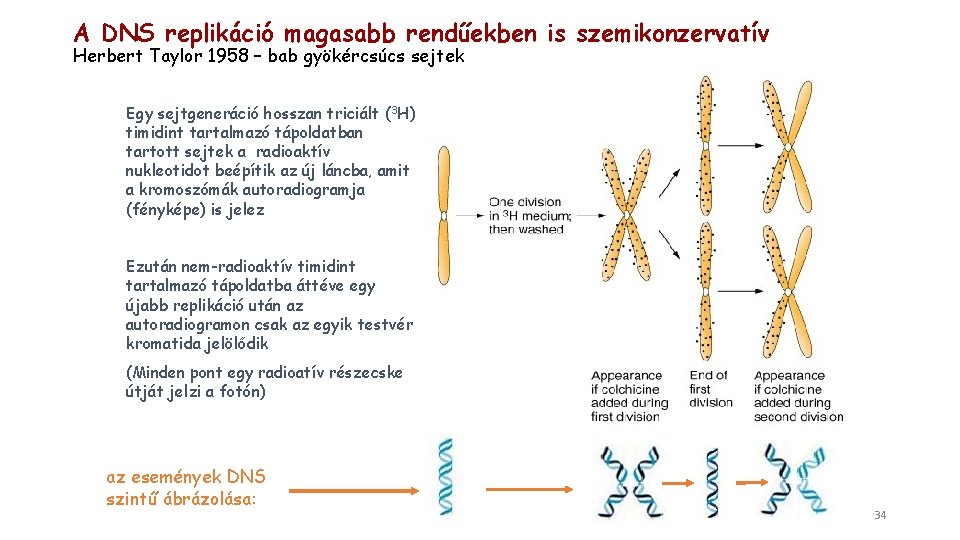
A DNS replikáció magasabb rendűekben is szemikonzervatív Herbert Taylor 1958 – bab gyökércsúcs sejtek Egy sejtgeneráció hosszan triciált (3 H) timidint tartalmazó tápoldatban tartott sejtek a radioaktív nukleotidot beépítik az új láncba, amit a kromoszómák autoradiogramja (fényképe) is jelez Ezután nem-radioaktív timidint tartalmazó tápoldatba áttéve egy újabb replikáció után az autoradiogramon csak az egyik testvér kromatida jelölődik (Minden pont egy radioatív részecske útját jelzi a fotón) az események DNS szintű ábrázolása: 34

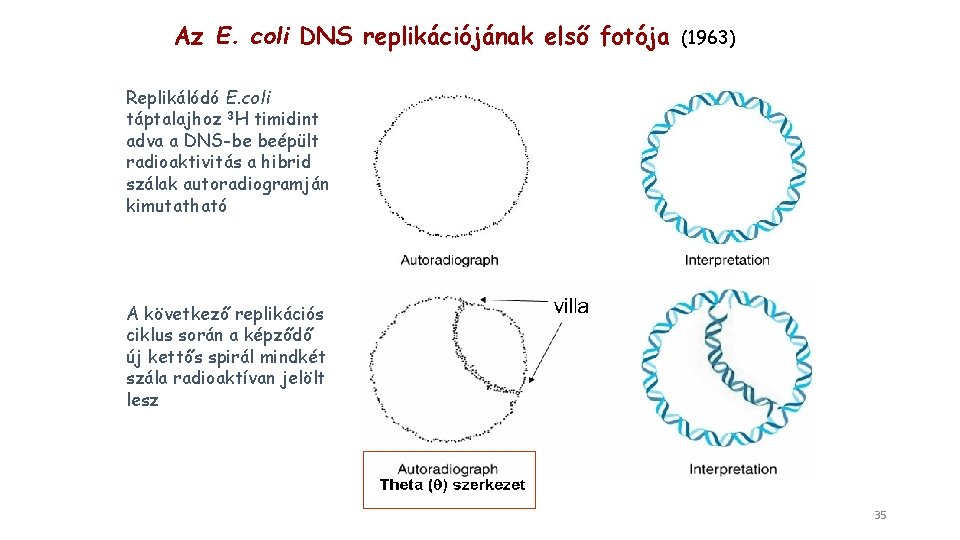
Az E. coli DNS replikációjának első fotója (1963) Replikálódó E. coli táptalajhoz 3 H timidint adva a DNS-be beépült radioaktivitás a hibrid szálak autoradiogramján kimutatható A következő replikációs ciklus során a képződő új kettős spirál mindkét szála radioaktívan jelölt lesz 35

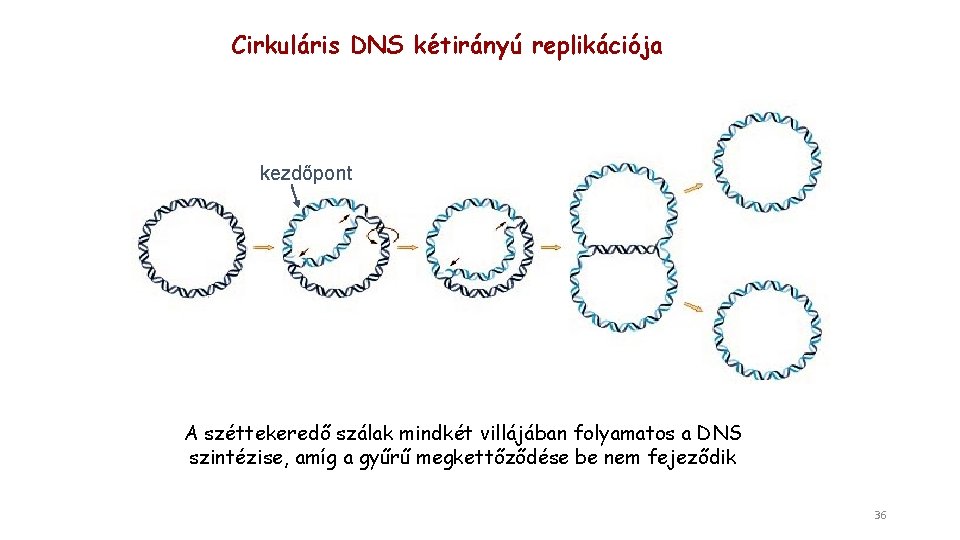
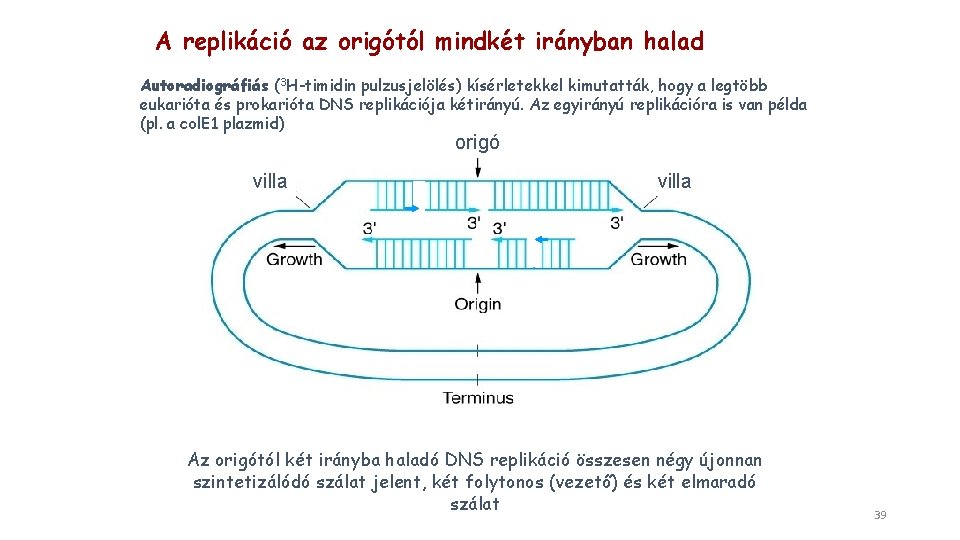
Cirkuláris DNS kétirányú replikációja kezdőpont A széttekeredő szálak mindkét villájában folyamatos a DNS szintézise, amíg a gyűrű megkettőződése be nem fejeződik 36

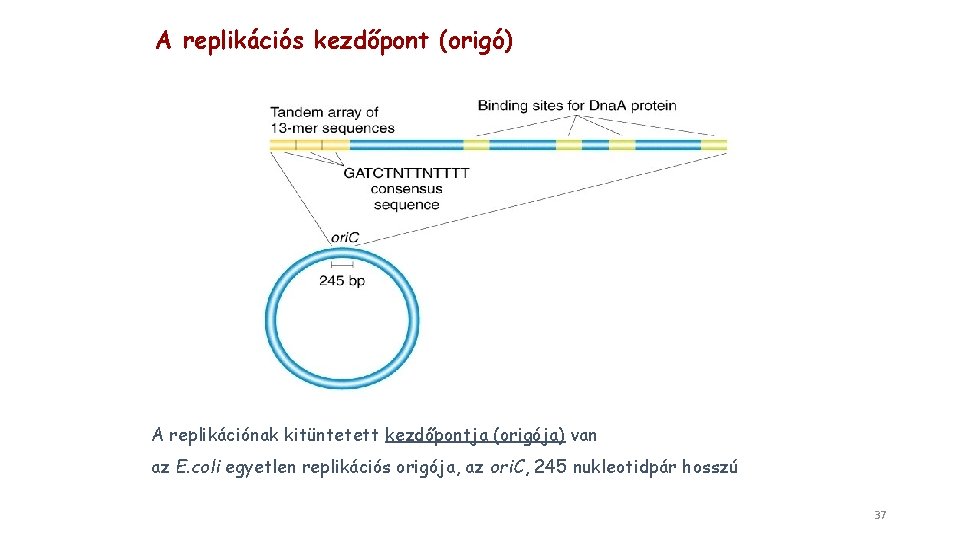
A replikációs kezdőpont (origó) A replikációnak kitüntetett kezdőpontja (origója) van az E. coli egyetlen replikációs origója, az ori. C, 245 nukleotidpár hosszú 37

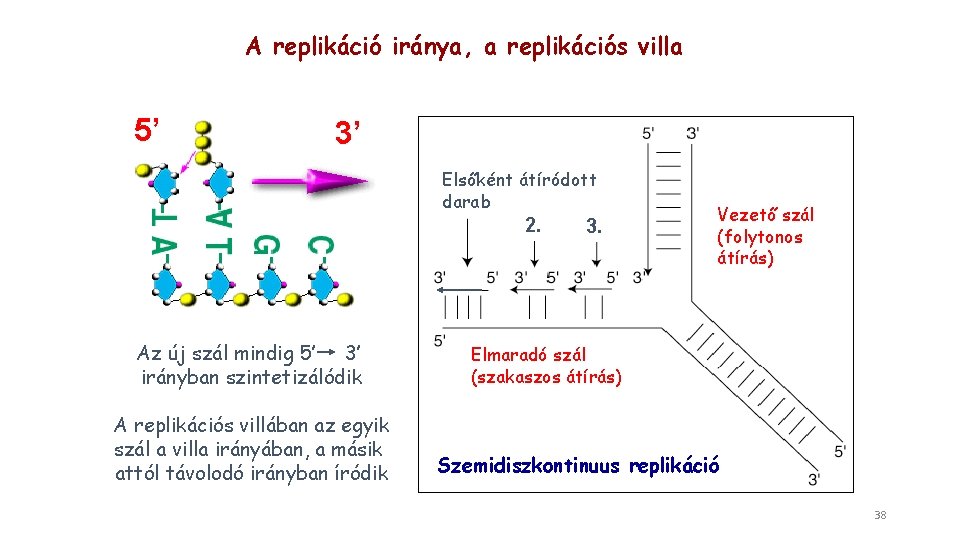
A replikáció iránya, a replikációs villa 5’ 3’ Elsőként átíródott darab 2. Az új szál mindig 5’ 3’ irányban szintetizálódik A replikációs villában az egyik szál a villa irányában, a másik attól távolodó irányban íródik 3. Vezető szál (folytonos átírás) Elmaradó szál (szakaszos átírás) Szemidiszkontinuus replikáció 38

A replikáció az origótól mindkét irányban halad Autoradiográfiás (3 H-timidin pulzusjelölés) kísérletekkel kimutatták, hogy a legtöbb eukarióta és prokarióta DNS replikációja kétirányú. Az egyirányú replikációra is van példa (pl. a col. E 1 plazmid) origó villa Az origótól két irányba haladó DNS replikáció összesen négy újonnan szintetizálódó szálat jelent, két folytonos (vezető) és két elmaradó szálat 39

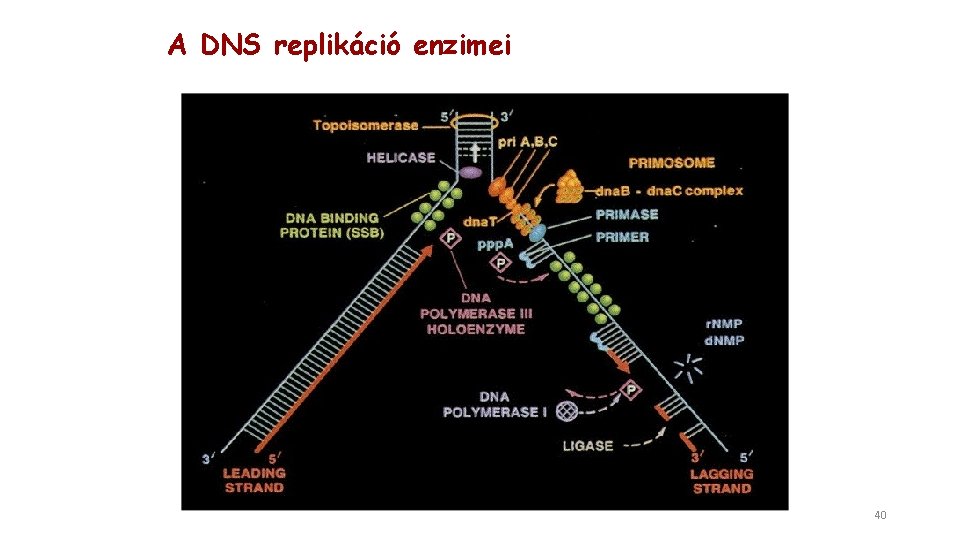
A DNS replikáció enzimei 40

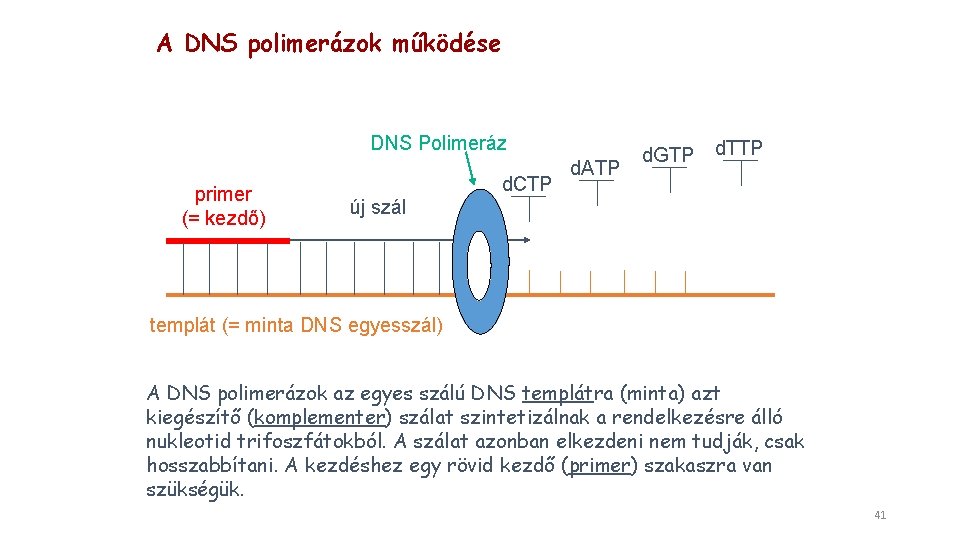
A DNS polimerázok működése DNS Polimeráz primer (= kezdő) d. CTP d. ATP d. GTP d. TTP új szál templát (= minta DNS egyesszál) A DNS polimerázok az egyes szálú DNS templátra (minta) azt kiegészítő (komplementer) szálat szintetizálnak a rendelkezésre álló nukleotid trifoszfátokból. A szálat azonban elkezdeni nem tudják, csak hosszabbítani. A kezdéshez egy rövid kezdő (primer) szakaszra van szükségük. 41

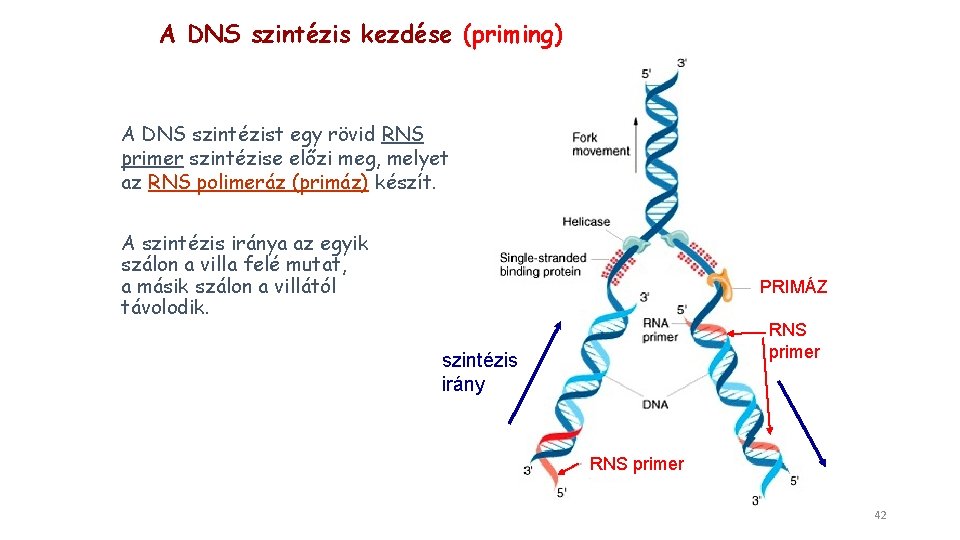
A DNS szintézis kezdése (priming) A DNS szintézist egy rövid RNS primer szintézise előzi meg, melyet az RNS polimeráz (primáz) készít. A szintézis iránya az egyik szálon a villa felé mutat, a másik szálon a villától távolodik. PRIMÁZ RNS primer szintézis irány RNS primer 42

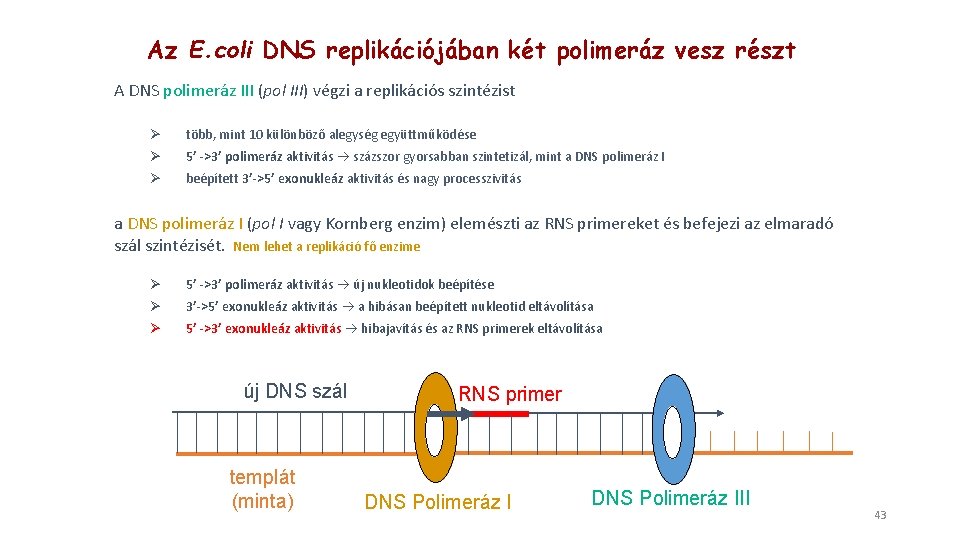
Az E. coli DNS replikációjában két polimeráz vesz részt A DNS polimeráz III (pol III) végzi a replikációs szintézist Ø több, mint 10 különböző alegység együttműködése Ø 5’ ->3’ polimeráz aktivitás százszor gyorsabban szintetizál, mint a DNS polimeráz I Ø beépített 3’->5’ exonukleáz aktivitás és nagy processzivitás a DNS polimeráz I (pol I vagy Kornberg enzim) elemészti az RNS primereket és befejezi az elmaradó szál szintézisét. Nem lehet a replikáció fő enzime Ø 5’ ->3’ polimeráz aktivitás új nukleotidok beépítése Ø 3’->5’ exonukleáz aktivitás a hibásan beépített nukleotid eltávolítása Ø 5’ ->3’ exonukleáz aktivitás hibajavítás és az RNS primerek eltávolítása új DNS szál templát (minta) RNS primer DNS Polimeráz III 43

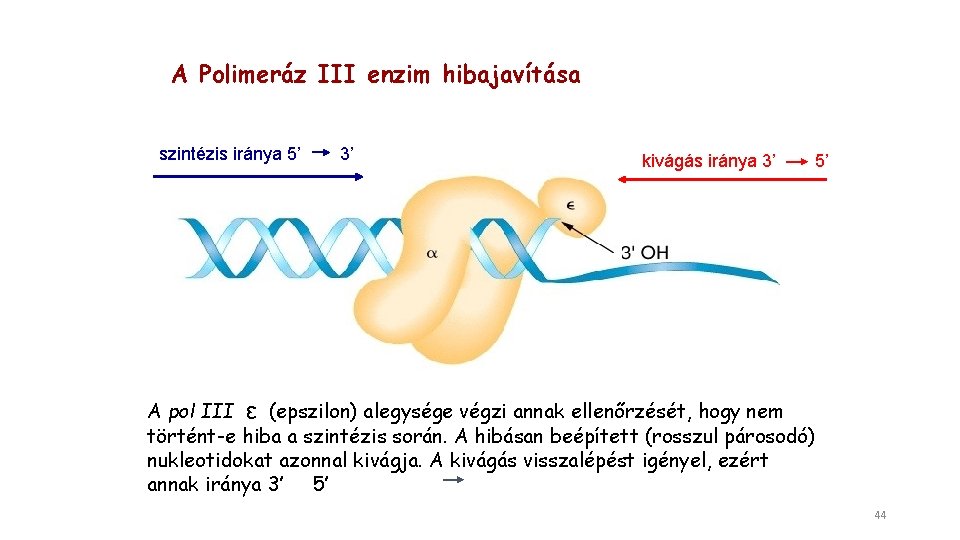
A Polimeráz III enzim hibajavítása szintézis iránya 5’ 3’ kivágás iránya 3’ 5’ A pol III ε (epszilon) alegysége végzi annak ellenőrzését, hogy nem történt-e hiba a szintézis során. A hibásan beépített (rosszul párosodó) nukleotidokat azonnal kivágja. A kivágás visszalépést igényel, ezért annak iránya 3’ 5’ 44

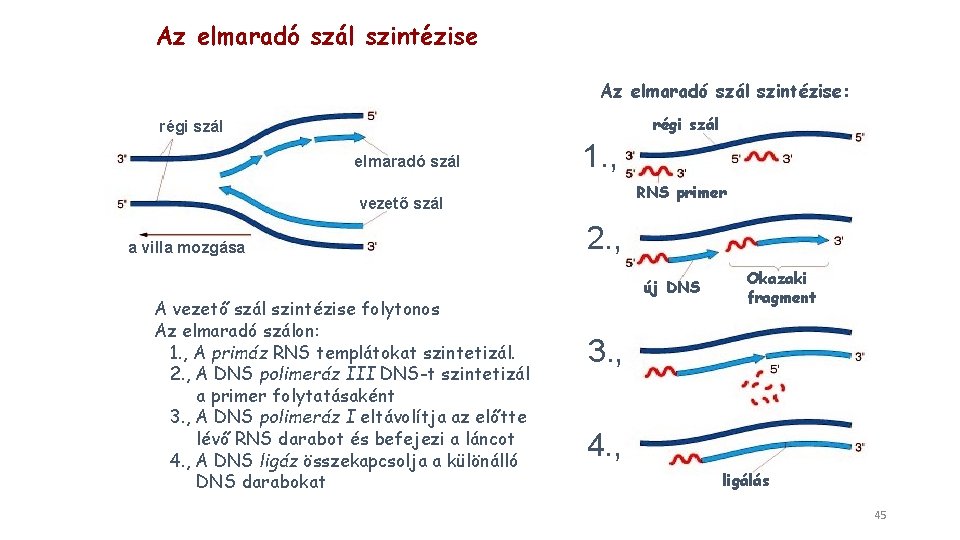
Az elmaradó szál szintézise: régi szál elmaradó szál 1. , RNS primer vezető szál a villa mozgása A vezető szál szintézise folytonos Az elmaradó szálon: 1. , A primáz RNS templátokat szintetizál. 2. , A DNS polimeráz III DNS-t szintetizál a primer folytatásaként 3. , A DNS polimeráz I eltávolítja az előtte lévő RNS darabot és befejezi a láncot 4. , A DNS ligáz összekapcsolja a különálló DNS darabokat 2. , új DNS Okazaki fragment 3. , 4. , ligálás 45

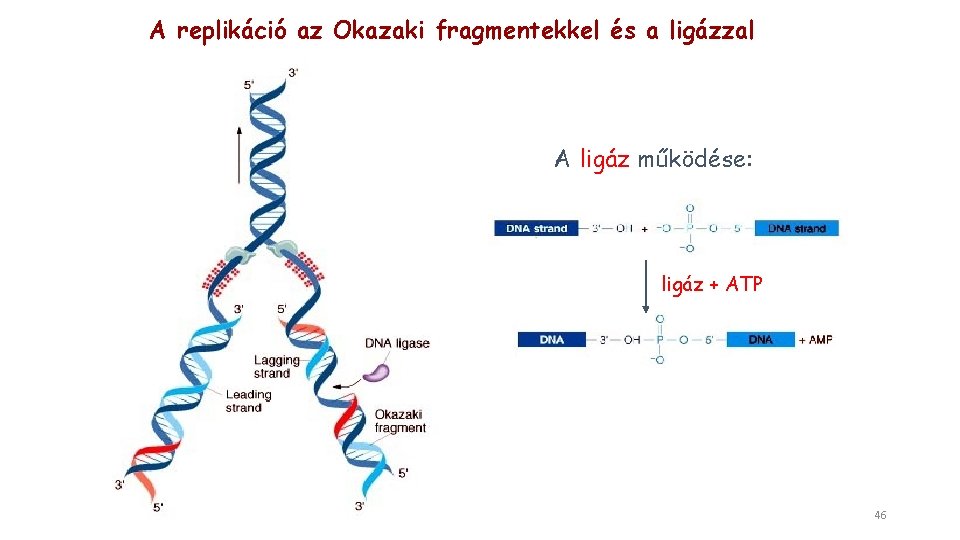
A replikáció az Okazaki fragmentekkel és a ligázzal A ligáz működése: ligáz + ATP 46

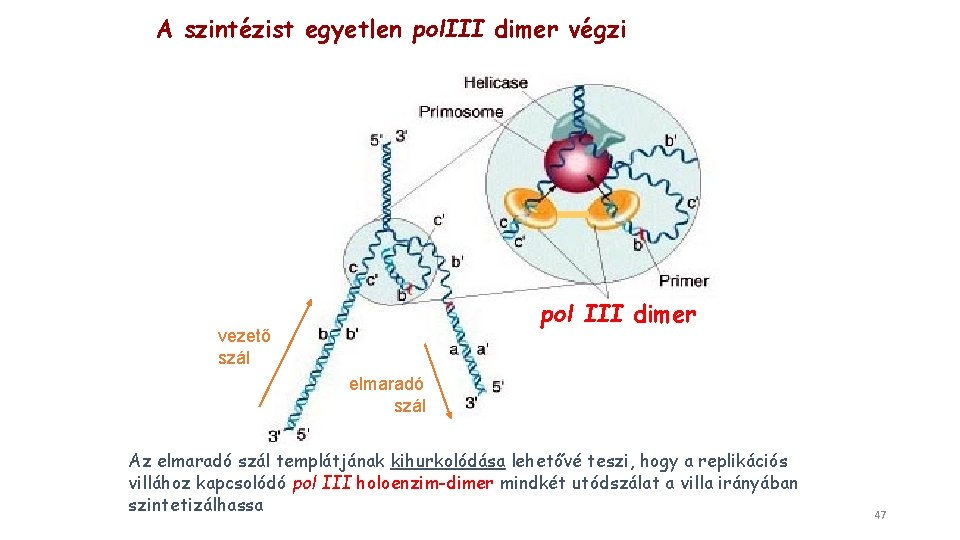
A szintézist egyetlen pol. III dimer végzi pol III dimer vezető szál elmaradó szál Az elmaradó szál templátjának kihurkolódása lehetővé teszi, hogy a replikációs villához kapcsolódó pol III holoenzim-dimer mindkét utódszálat a villa irányában szintetizálhassa 47

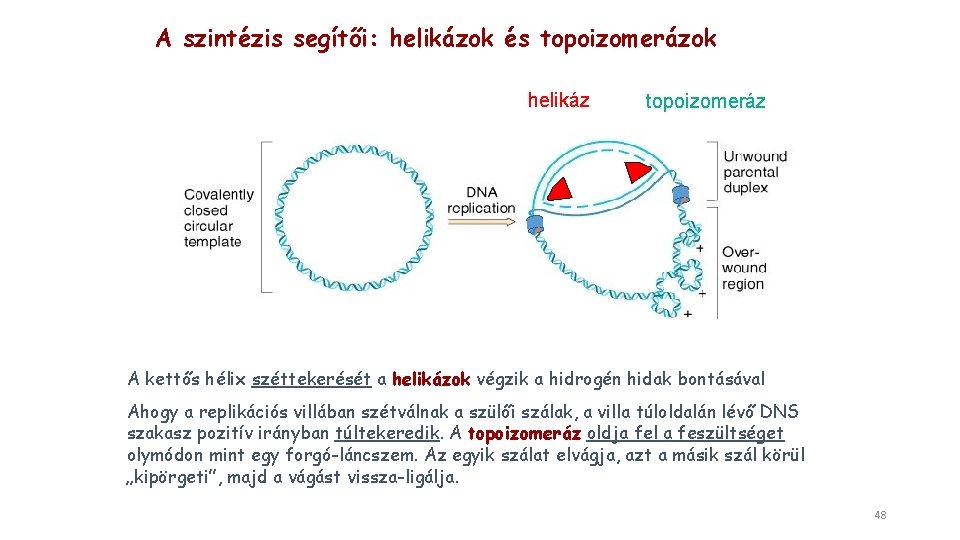
A szintézis segítői: helikázok és topoizomerázok helikáz topoizomeráz A kettős hélix széttekerését a helikázok végzik a hidrogén hidak bontásával Ahogy a replikációs villában szétválnak a szülői szálak, a villa túloldalán lévő DNS szakasz pozitív irányban túltekeredik. A topoizomeráz oldja fel a feszültséget olymódon mint egy forgó-láncszem. Az egyik szálat elvágja, azt a másik szál körül „kipörgeti”, majd a vágást vissza-ligálja. 48

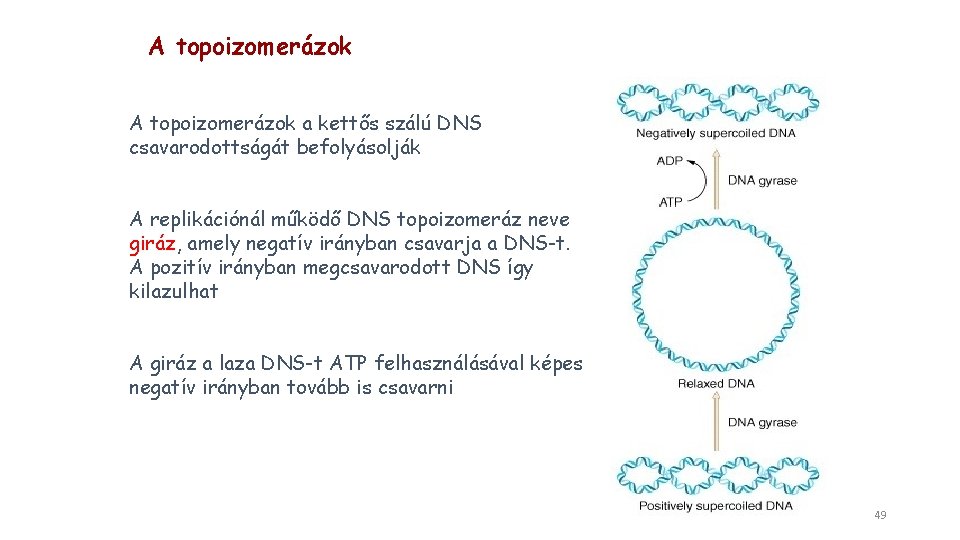
A topoizomerázok a kettős szálú DNS csavarodottságát befolyásolják A replikációnál működő DNS topoizomeráz neve giráz, amely negatív irányban csavarja a DNS-t. A pozitív irányban megcsavarodott DNS így kilazulhat A giráz a laza DNS-t ATP felhasználásával képes negatív irányban tovább is csavarni 49

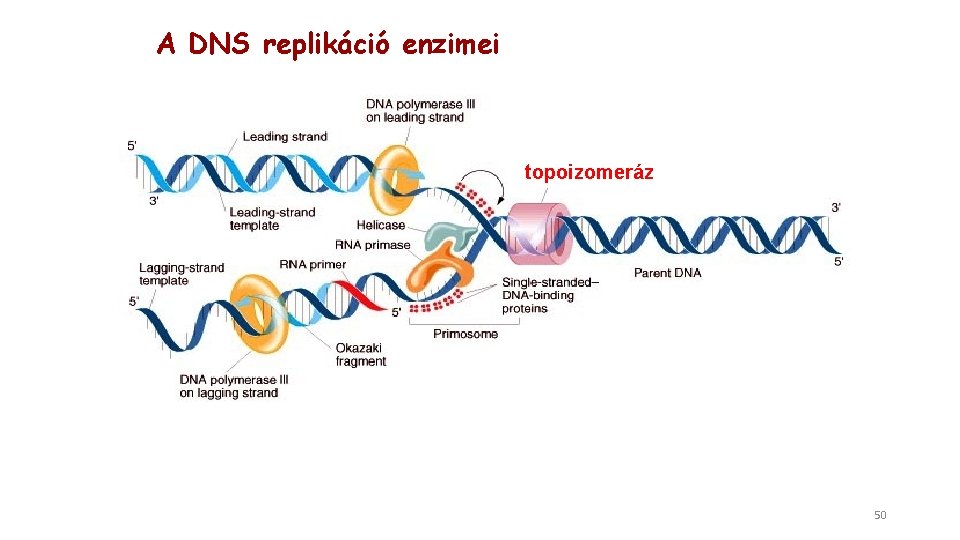
A DNS replikáció enzimei topoizomeráz 50

A replikáció pontossága A szintézis során 104 -106 nukleotidonként történik egy hibás beépülés. Ez igen magas mutációs rátát eredményezne A polimeráz III enzim saját hibajavító rendszerrel rendelkezik, és a hibás beépülések 99%-át azonnal kijavítja, így csak 108 nukleotidonként marad egy hiba A replikáció utáni javítórendszer ennek 99%-át is kijavítja. Így adódik a végső pontosság, ami 1010 nukleotidonként egy hiba (Ez az emberi genom esetén egyetlen hibát jelent egy replikáció során) 51

Több vírus és episzóma „gördülő gyűrű” (rolling circle) módon replikálódik 1. , Az egyik szál pontszerűen bevágódik (nick) 2. , Az ép szálat templátként használva a polimeráz a törött szál 3’ végéhez új nukleotidokat épít körbe-körbe, miközben leszorítja az előtte lévő régi szálat 3. , A leszoruló egyes szál kettős szállá egészül ki 4. , A lineáris kettős szál méretre darabolódik és gyűrűkké zárul konkatemer 5’ 52

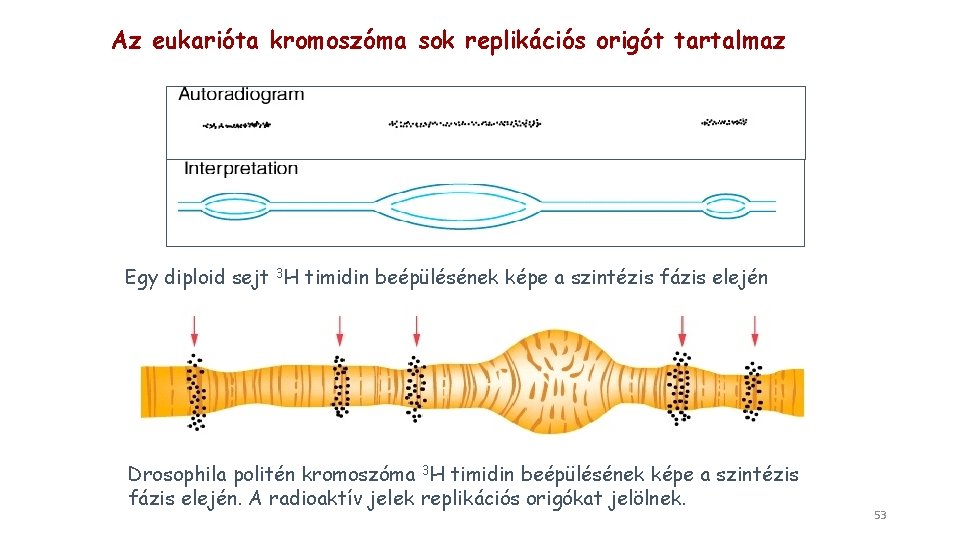
Az eukarióta kromoszóma sok replikációs origót tartalmaz Egy diploid sejt 3 H timidin beépülésének képe a szintézis fázis elején Drosophila politén kromoszóma 3 H timidin beépülésének képe a szintézis fázis elején. A radioaktív jelek replikációs origókat jelölnek. 53

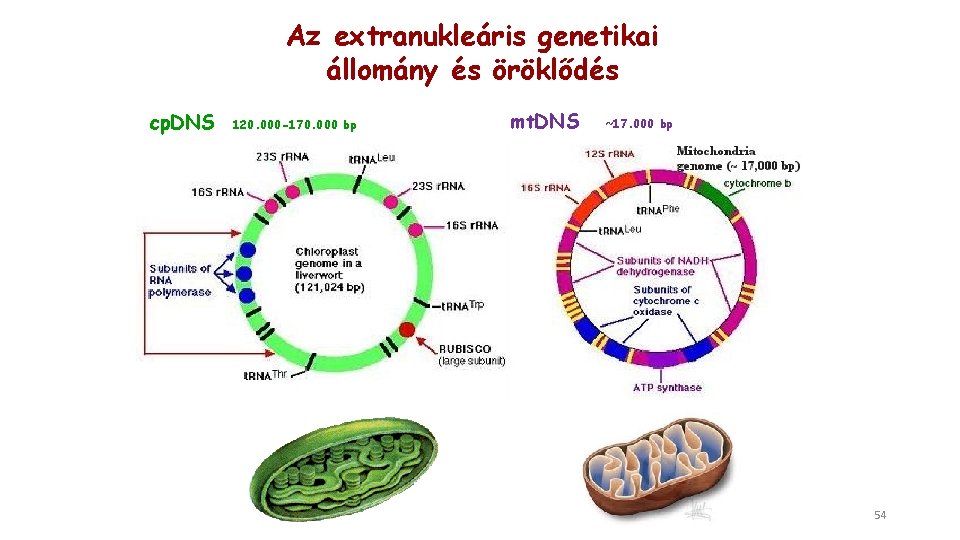
Az extranukleáris genetikai állomány és öröklődés cp. DNS 120. 000 -170. 000 bp mt. DNS ~17. 000 bp 54

Az extranukleáris genom jellemzői • cirkuláris • nukleáris genomtól és sejtciklustól független replikáció • az átírást végző DNS-polimeráz a magban kódolt, DE organellumspecifikus • kópiaszám >1 (cp. DNS és mt. DNS esetében is) változó, fajonként nagy eltérések lehetnek • általában anyai uniparentális öröklődés, de léteznek kivételek 55

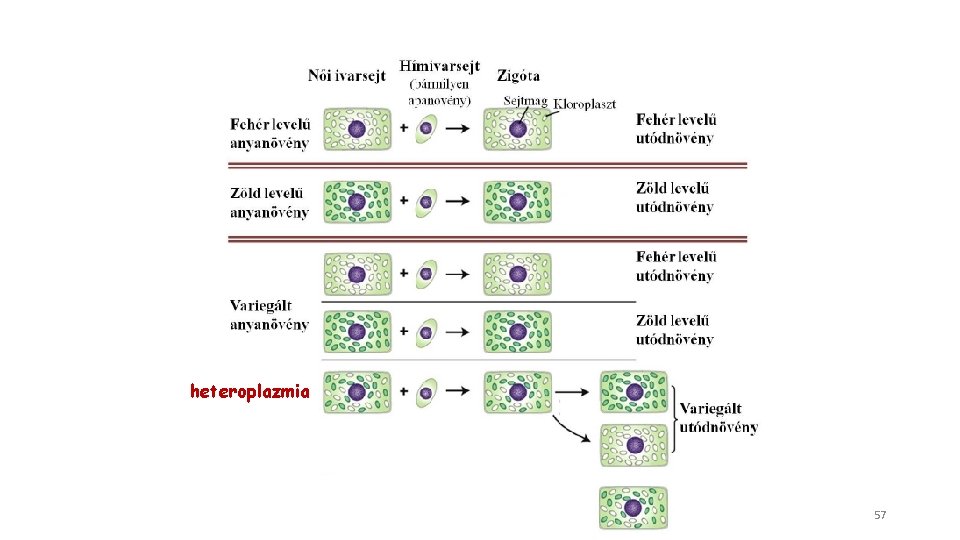
Az anyai öröklődés 1909 Carl Correns kísérlete csodatölcsérrel Fenotípust kizárólagosan az anyai szülő határozza meg • kloroplaszt gének öröklődésével zöld fehér zöld magyarázható • NEM azonos az anyai hatással!!! heteroplazmia (pl. csigaház tekeredésének iránya) 56

heteroplazmia 57

Telomerek Cirkuláris DNS Lineáris DNS – végreplikációs probléma 58

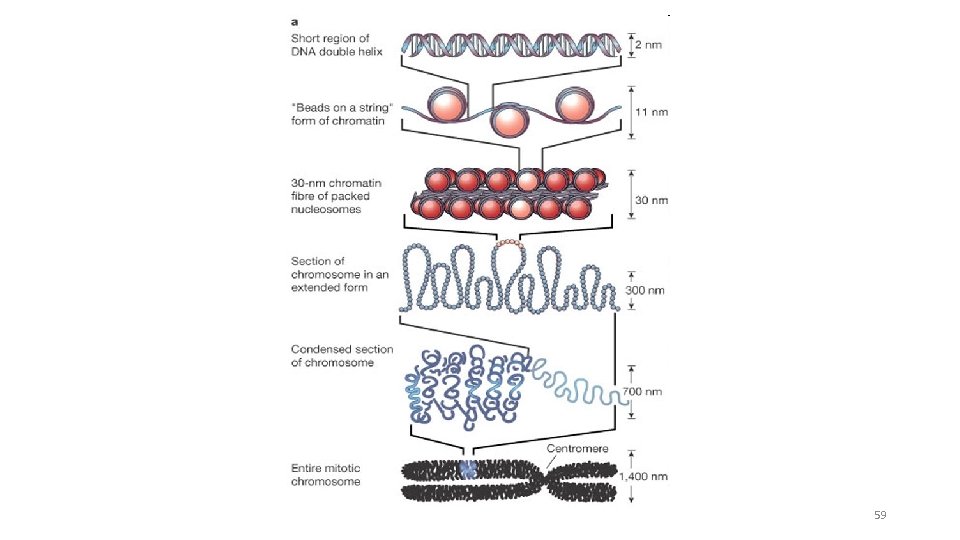
59

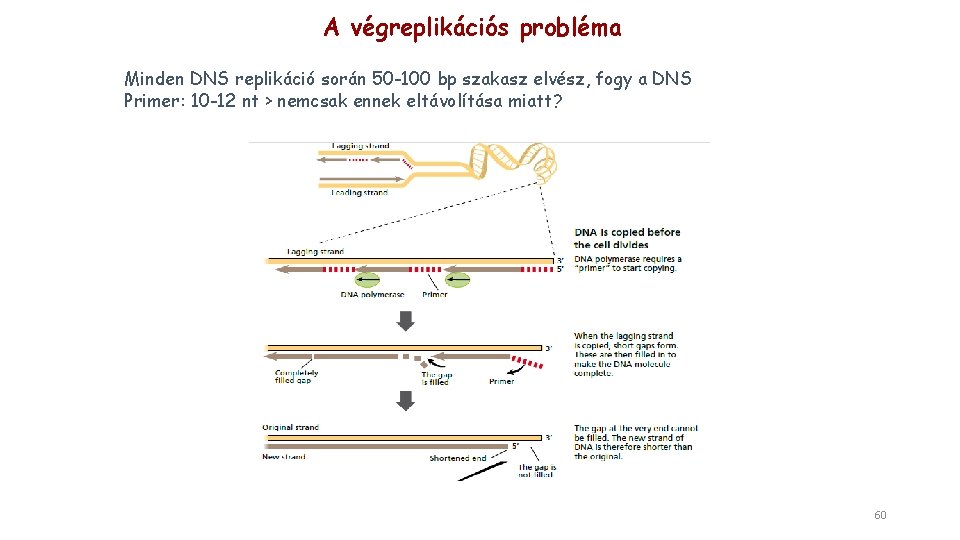
A végreplikációs probléma Minden DNS replikáció során 50 -100 bp szakasz elvész, fogy a DNS Primer: 10 -12 nt > nemcsak ennek eltávolítása miatt? 60

A kromoszómák végeit a telomerek védik, aminek fenntartását a telomeráz enzim végzi 61

A telomer sapkaként védi a kromoszómák végeit Görög: telos (vég) + meros (rész) 62

A telomerek feladata 1. A szabad DNS vég védelme a lebomlástól 2. A replikációs rövidülés megakadályozása 63

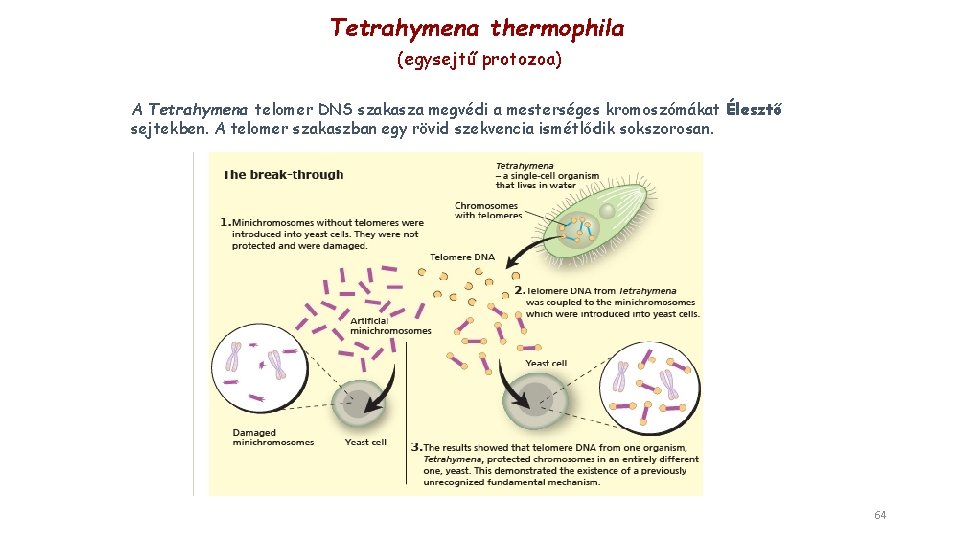
Tetrahymena thermophila (egysejtű protozoa) A Tetrahymena telomer DNS szakasza megvédi a mesterséges kromoszómákat Élesztő sejtekben. A telomer szakaszban egy rövid szekvencia ismétlődik sokszorosan. 64

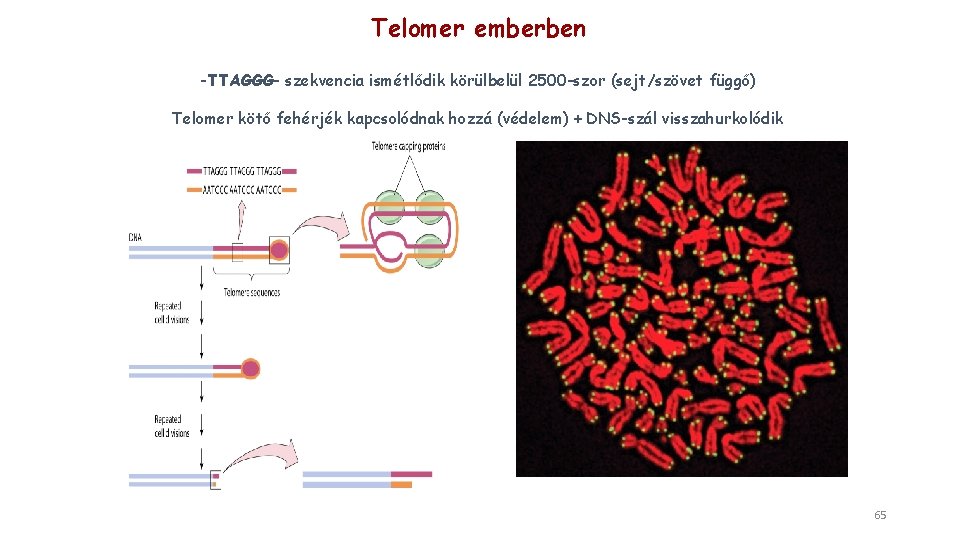
Telomer emberben -TTAGGG- szekvencia ismétlődik körülbelül 2500 -szor (sejt/szövet függő) Telomer kötő fehérjék kapcsolódnak hozzá (védelem) + DNS-szál visszahurkolódik 65

Egy átlagos testi sejtben a telomer minden sejtosztódás során rövidül sejt életkor becslés Kivételek: ivarsejtek, őssejtek (és rákos sejtek!) Ha túl rövid: -telomer-kötő fehérjék nem tudnak kapcsolódni - visszahajlás (loop) nem tud kialakulni - a kromoszómák végei „ragadóssá” válnak – kromoszóma átrendeződésekhez vezet - normálisan leáll a sejtosztódás (replikatív szeneszcencia), beindul az apoptózis 66

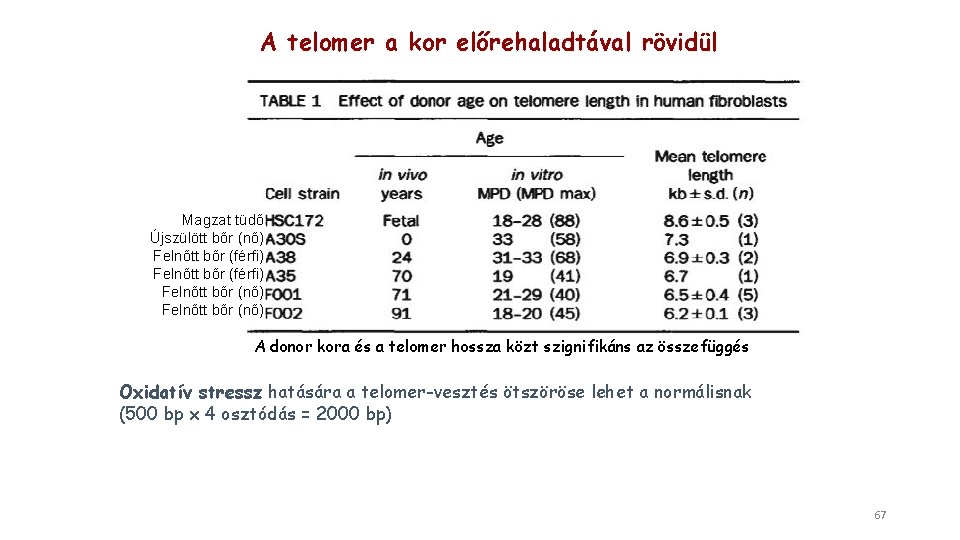
A telomer a kor előrehaladtával rövidül Magzat tüdő Újszülött bőr (nő) Felnőtt bőr (férfi) Felnőtt bőr (nő) A donor kora és a telomer hossza közt szignifikáns az összefüggés Oxidatív stressz hatására a telomer-vesztés ötszöröse lehet a normálisnak (500 bp x 4 osztódás = 2000 bp) 67

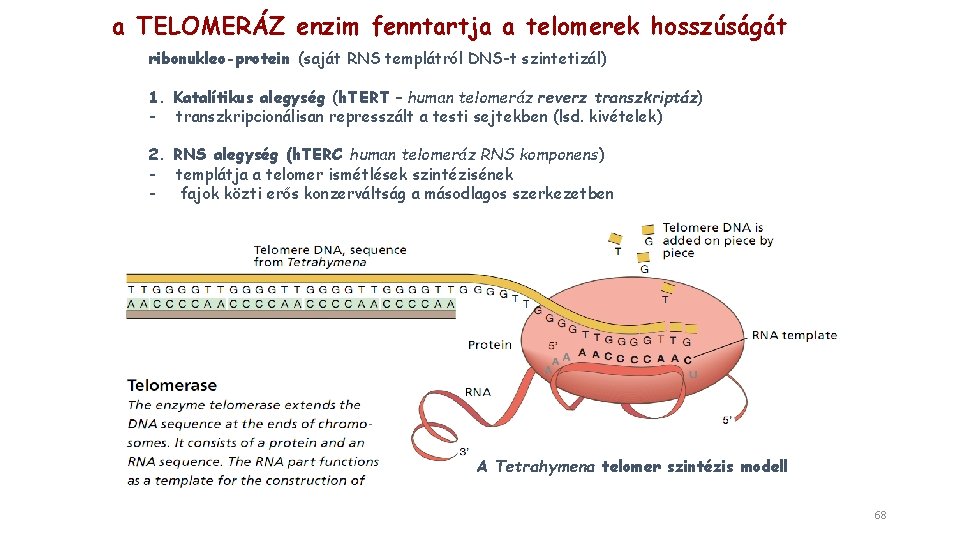
a TELOMERÁZ enzim fenntartja a telomerek hosszúságát ribonukleo-protein (saját RNS templátról DNS-t szintetizál) 1. Katalítikus alegység (h. TERT – human telomeráz reverz transzkriptáz) - transzkripcionálisan represszált a testi sejtekben (lsd. kivételek) 2. RNS alegység (h. TERC human telomeráz RNS komponens) - templátja a telomer ismétlések szintézisének - fajok közti erős konzerváltság a másodlagos szerkezetben A Tetrahymena telomer szintézis modell 68

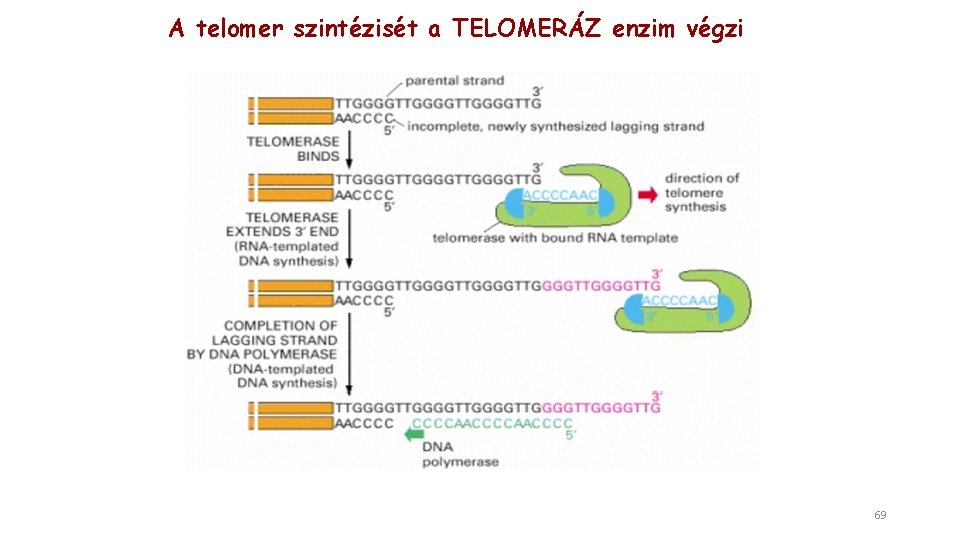
A telomer szintézisét a TELOMERÁZ enzim végzi 69

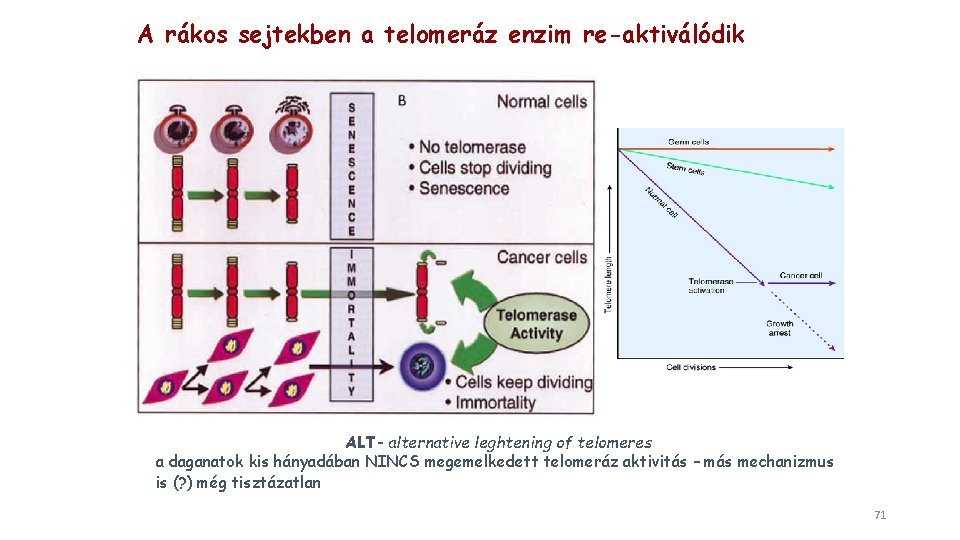
A rákos sejtek korlátlan számú osztódásra képesek Egy normális sejt 60 -70 osztódásra képes A kromoszóma végéről egy szakasz minden osztódás során elvész A genetikailag nem stabil sejt normális esetben elpusztul A rákos sejtek nem pusztulnak el, tovább osztódnak és még több hibát halmoznak fel, képesek “halhatatlanná” tenni magukat pl. a He. La sejtvonal (Henrietta Lacks, 1951 -ben izolálták) Ezt a telomeráz enzim reaktivációjával magyarázzák 70

A rákos sejtekben a telomeráz enzim re-aktiválódik ALT- alternative leghtening of telomeres a daganatok kis hányadában NINCS megemelkedett telomeráz aktivitás – más mechanizmus is (? ) még tisztázatlan 71

A telomereknek fontos szerepük van a rák, az öregedés és néhány örökletes betegség kialakulásában Werner szindróma - Autoszomális recesszív - WRN génben mutáció (helikáz) - fokozott telomer vesztés 72

Daganatterápia telomeráz-gátlással? szelektív, mert a normális szövetekben telomeráz-aktivitás alig van de! hatásuk az őssejtekre (? ) ALT-mechanizmus „áttérve” erre a daganatsejtek rezisztensekké válhatnak 73

74
 Dns szerkezete
Dns szerkezete Dns kettős spirál
Dns kettős spirál Genetikai alapfogalmak
Genetikai alapfogalmak Genetika je nauka o
Genetika je nauka o Genetika
Genetika 2 mendelov zakon
2 mendelov zakon Didaktické zásady příklady
Didaktické zásady příklady Genetika příklady
Genetika příklady Koeficijent inbridinga
Koeficijent inbridinga Megoldás
Megoldás Genetika terapan
Genetika terapan Zer da genetika
Zer da genetika Str polymorfizmus
Str polymorfizmus Genetika je nauka o
Genetika je nauka o Koeficijent inbridinga
Koeficijent inbridinga Struktur percabangan ditandai dengan tanda
Struktur percabangan ditandai dengan tanda Mendeli genetika feladatok
Mendeli genetika feladatok Genetika populasi
Genetika populasi Daltonizam genetika
Daltonizam genetika Terangkan pengertian algoritma genetika
Terangkan pengertian algoritma genetika Euploidije
Euploidije Genetika
Genetika Genetika
Genetika Definisi algoritma genetika
Definisi algoritma genetika Postulat mendel
Postulat mendel Genetika
Genetika Egy estém otthon szerkezete
Egy estém otthon szerkezete Az elektronburok szerkezete
Az elektronburok szerkezete Tudományos forradalmak szerkezete
Tudományos forradalmak szerkezete Kicsalta a leányt édes beszédével
Kicsalta a leányt édes beszédével Method to the madness shakespeare
Method to the madness shakespeare Iliász szerkezete
Iliász szerkezete Himnusz szerkezete
Himnusz szerkezete Glargin inzulin
Glargin inzulin Kloroplasztisz szerkezete
Kloroplasztisz szerkezete Litoszféralemezek
Litoszféralemezek A föld belső szerkezete
A föld belső szerkezete Haimon kreon konfliktus
Haimon kreon konfliktus Sternum punctio
Sternum punctio Drma
Drma Novella szerkezete
Novella szerkezete Csontok szerkezete
Csontok szerkezete Mese szerkezete
Mese szerkezete Vin bravais
Vin bravais Kőszívű ember fiai konfliktusok
Kőszívű ember fiai konfliktusok Retorika fogalma
Retorika fogalma A huszti beteglátogatók szerkezete
A huszti beteglátogatók szerkezete Biblia szerkezete
Biblia szerkezete A világegyetem szerkezete
A világegyetem szerkezete Tökéletes síkság fogalma
Tökéletes síkság fogalma Langerhans szigetek
Langerhans szigetek Tartuffe szerkezete
Tartuffe szerkezete Jaszjana
Jaszjana Gogol köpönyeg szerkezete
Gogol köpönyeg szerkezete Ee dns
Ee dns Dns çeşitleri
Dns çeşitleri Dns tečaj
Dns tečaj Dynamic dns load balancing
Dynamic dns load balancing Dns computer center
Dns computer center Comprobando dns
Comprobando dns What layer is dns
What layer is dns Iterative vs recursive dns
Iterative vs recursive dns Ns sever
Ns sever Dns data mining
Dns data mining Dns chip
Dns chip Dns transport layer protocol
Dns transport layer protocol Dns vulnerabilities
Dns vulnerabilities Cnnic dns
Cnnic dns Dns perf test
Dns perf test Recursive and iterative query
Recursive and iterative query Nnn
Nnn Wha is dns
Wha is dns Kautikus
Kautikus Dns server client
Dns server client Swiss dns
Swiss dns