Lic Ral Qumico Hernndez M Enlace Contenidos 1

































- Slides: 60

Lic. Raúl Químico Hernández M. Enlace

Contenidos 1 Concepto y clasificación 2 Regla del octeto 3 Enlace iónico 4 Enlace Covalente www. raulher. wordpress. com 2 Química

www. raulher. wordpress. com Química

www. raulher. wordpress. com Química

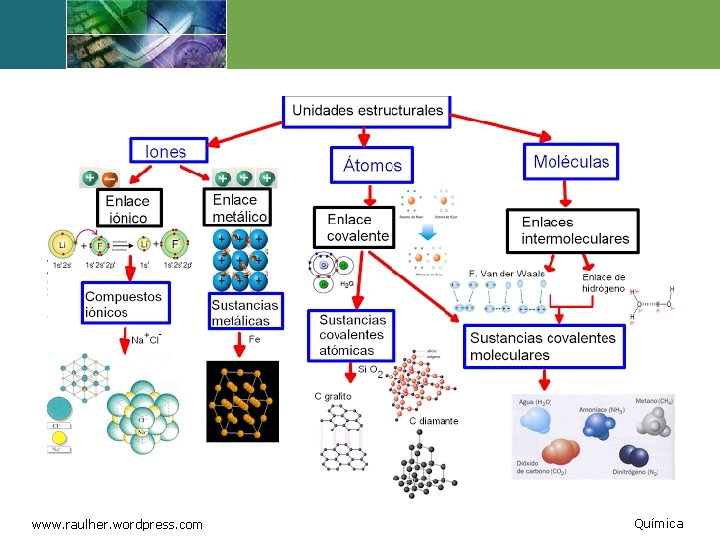
Enlaces y Moléculas 1 2 www. raulher. wordpress. com Cuando los átomos entran en interacción mutua, de modo que se completan sus niveles energéticos exteriores, se forman partículas nuevas más grandes. Estas partículas constituidas por dos o más átomos se conocen como moléculas y las fuerzas que las mantienen unidas se conocen como enlaces. 5 Química

Tipos de Enlace v Hay dos tipos principales de enlaces: iónico y covalente. v Los enlaces iónicos se forman por la atracción mutua de partículas de carga eléctrica opuesta; esas partículas, formadas cuando un electrón salta de un átomo a otro, se conocen como iones v Para muchos átomos, la manera más simple de completar el nivel energético exterior consiste en ganar o bien perder uno o dos electrones. www. raulher. wordpress. com 6 Química

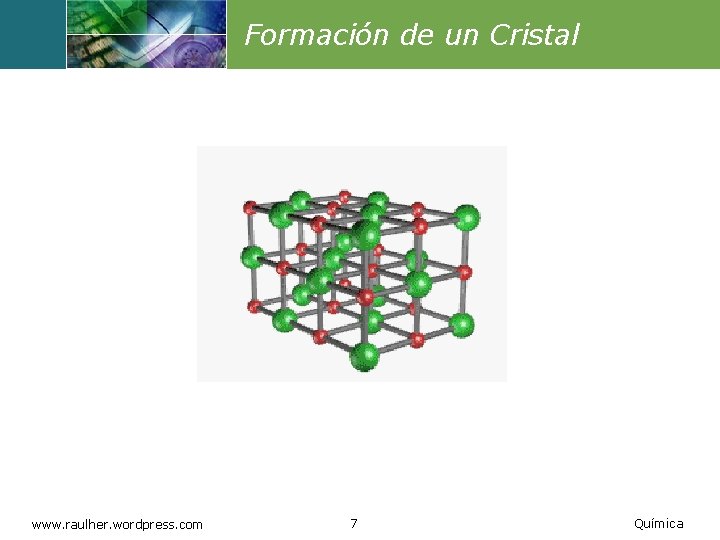
Formación de un Cristal www. raulher. wordpress. com 7 Química

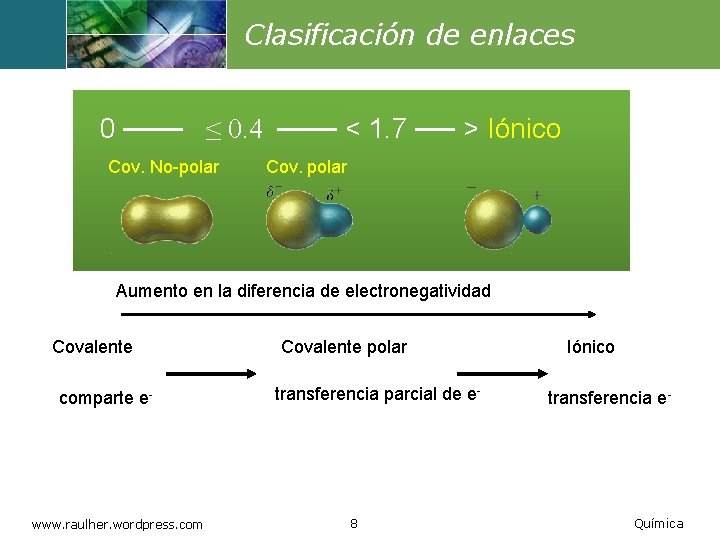
Clasificación de enlaces 0 ─── ≤ 0. 4 ─── < 1. 7 ── > Iónico Cov. No-polar Cov. polar Aumento en la diferencia de electronegatividad Covalente comparte e- www. raulher. wordpress. com Covalente polar transferencia parcial de e- 8 Iónico transferencia e- Química

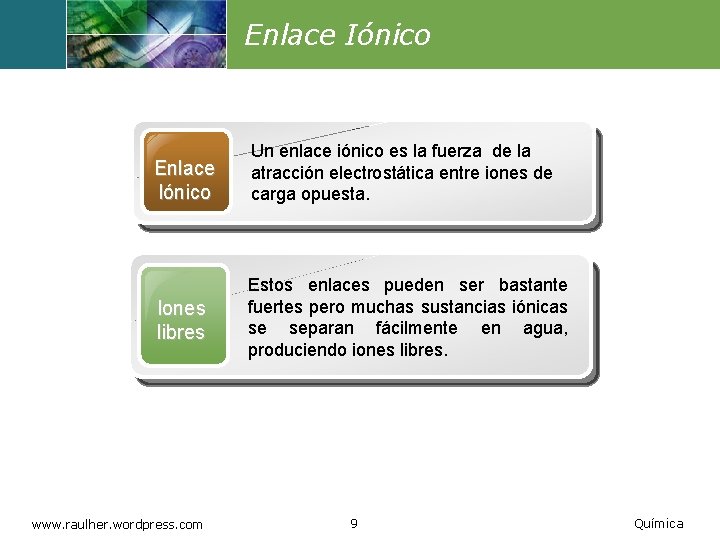
Enlace Iónico Un enlace iónico es la fuerza de la atracción electrostática entre iones de carga opuesta. Iones libres Estos enlaces pueden ser bastante fuertes pero muchas sustancias iónicas se separan fácilmente en agua, produciendo iones libres. www. raulher. wordpress. com 9 Química

v El sodio le transfiere un electrón al cloro por lo que éste queda con carga negativa. www. raulher. wordpress. com 10 Química

Iones v Los metales pierden sus electrones de valencia para formar cationes: v Esta perdida de electrones se llama oxidación. . v Na v Mg: magnesio v . : Al aluminio www. raulher. wordpress. com Na+ + e. Mg 2+ + 2 e. Al 11 3+ sodio + 3 e- Química

Formación de Aniones . : : : v Los no metales ganan electrones y adquieren la configuración de gas noble: v Este proceso se llama reducción. v : Cl. + e: Cl : : O: 2 - oxido 3 - nitruro . : O : + 2 e- : . v : N. + 3 e- : N: : www. raulher. wordpress. com 12 Química

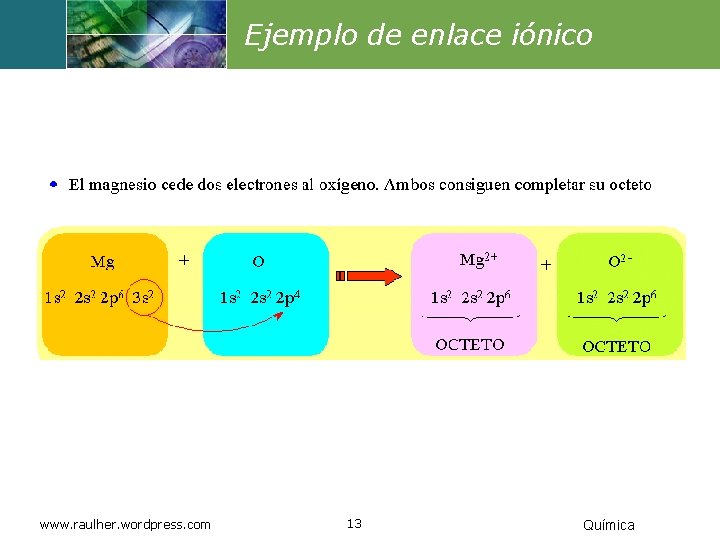
Ejemplo de enlace iónico www. raulher. wordpress. com 13 Química

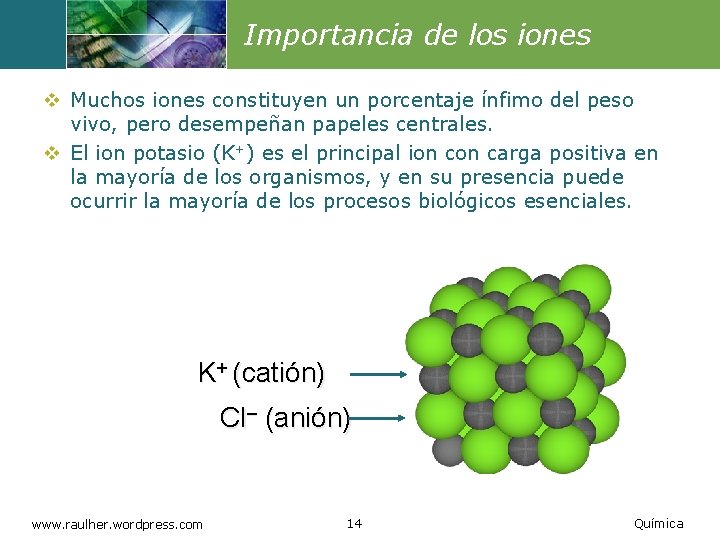
Importancia de los iones v Muchos iones constituyen un porcentaje ínfimo del peso vivo, pero desempeñan papeles centrales. v El ion potasio (K+) es el principal ion carga positiva en la mayoría de los organismos, y en su presencia puede ocurrir la mayoría de los procesos biológicos esenciales. K+ (catión) Cl– (anión) www. raulher. wordpress. com 14 Química

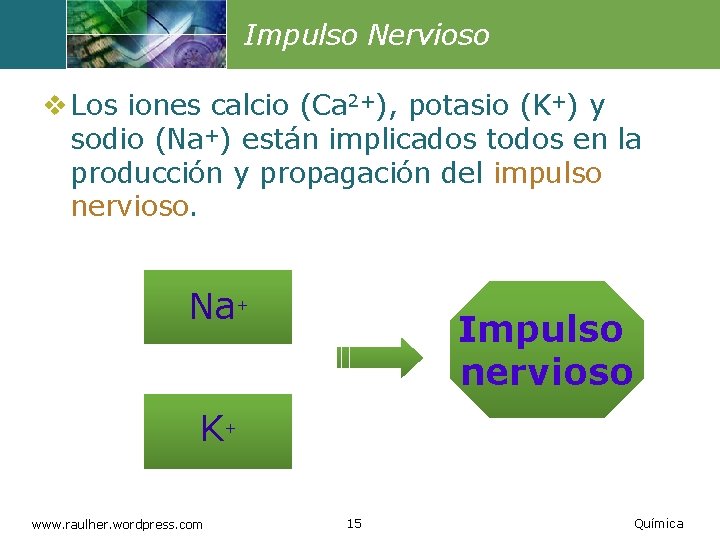
Impulso Nervioso v Los iones calcio (Ca 2+), potasio (K+) y sodio (Na+) están implicados todos en la producción y propagación del impulso nervioso. Na+ Impulso nervioso K+ www. raulher. wordpress. com 15 Química

v En el interior de la neurona existen proteínas e iones con carga negativa. v Esta diferencia de concentración de iones produce también una diferencia de potencial (unos -70 milivoltios) entre el exterior de la membrana y el interior celular. www. raulher. wordpress. com 16 Química

Bomba de sodio/potasio v Esta variación entre el exterior y el interior se alcanza por el funcionamiento de la bomba de sodio/potasio (Na+/K+) www. raulher. wordpress. com 17 Química

Gasto de ATP v. La bomba de Na+/K+ gasta ATP. Expulsa tres iones de sodio que se encontraban en el interior de la neurona e introduce dos iones de potasio que se encontraban en el exterior. v Los iones sodio no pueden volver a entrar en la neurona, debido a que la membrana es impermeable al sodio. www. raulher. wordpress. com 18 Química

Función del calcio v Además, el Ca 2+ es necesario para la contracción de los músculos y para el mantenimiento de un latido cardíaco normal. www. raulher. wordpress. co 19 Química

Molécula de clorofila v El ion magnesio (Mg+2) forma parte de la molécula de clorofila, la cual atrapa la energía radiante del Sol en algunas algas y en las plantas verdes. www. raulher. wordpress. co 20 Química

Enlace Covalente v Los enlaces covalentes están formados por pares de electrones compartidos. v Un átomo puede completar su nivel de energía exterior compartiendo electrones con otro átomo. v En los enlaces covalentes, el par de electrones compartidos forma un orbital nuevo (llamado orbital molecular) que envuelve a los núcleos de ambos átomos. www. raulher. wordpress. co 21 Química

En un enlace de este tipo, cada electrón pasa parte de su tiempo alrededor de un núcleo y el resto alrededor del otro. Así, al compartir los electrones, ambos completan su nivel de energía exterior y neutralizan la carga nuclear. www. raulher. wordpress. co 22 Química

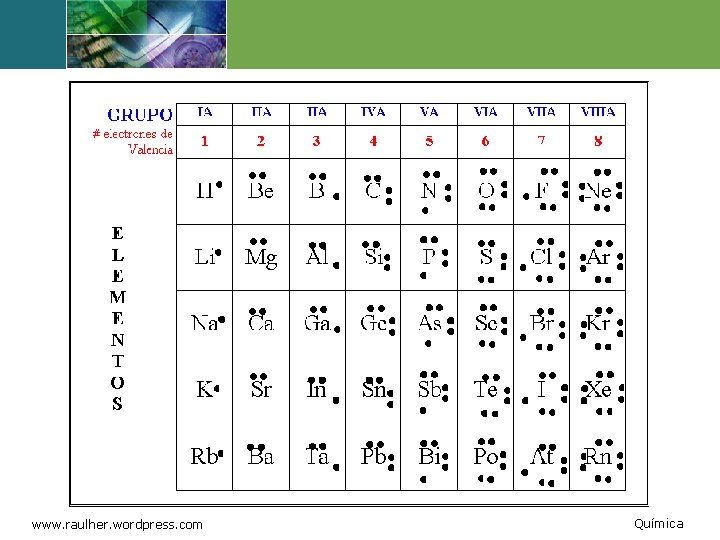
Regla del octeto A principios del siglo XX, el científico Lewis, observando la poca reactividad de los gases nobles (estructura de 8 electrones en su último nivel), sugirió que los átomos al enlazarse “tienden” a adquirir una distribución de electrones de valencia igual a la del gas noble más próximo . . : . . F: Esta regla es muy útil en casos que involucran átomos como C, N, O, y F. www. raulher. wordpress. co 23 Química

ejemplo Al combinar un carbono (4 electrones de valencia) y cuatro átomos de fluor (7 electrones de valencia) . . C. . : . . F. la estructura de Lewis para CF 4 queda así: . . F: . . : : F : . . F: C. . : . . F: Se cumple la regla del octeto para el carbono y fluor. www. raulher. wordpress. co 24 Química

ejemplo Es una práctica común representar un enlace covalente por una linea. Así, se puede escribir: . . F : C. . : . . F : . . : F: como . . : . . F C . . F : : . . F: www. raulher. wordpress. co 25 Química

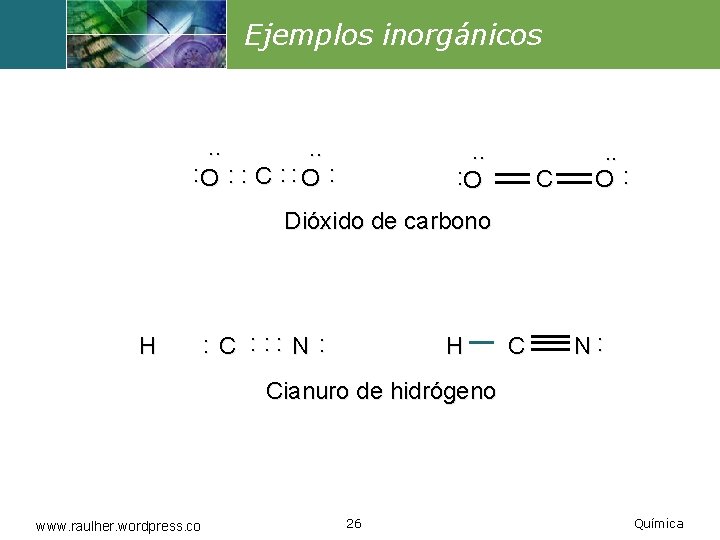
Ejemplos inorgánicos . . : O : : C : : O : . . : O C . . O: Dióxido de carbono H : C : : : N : H C N: Cianuro de hidrógeno www. raulher. wordpress. co 26 Química

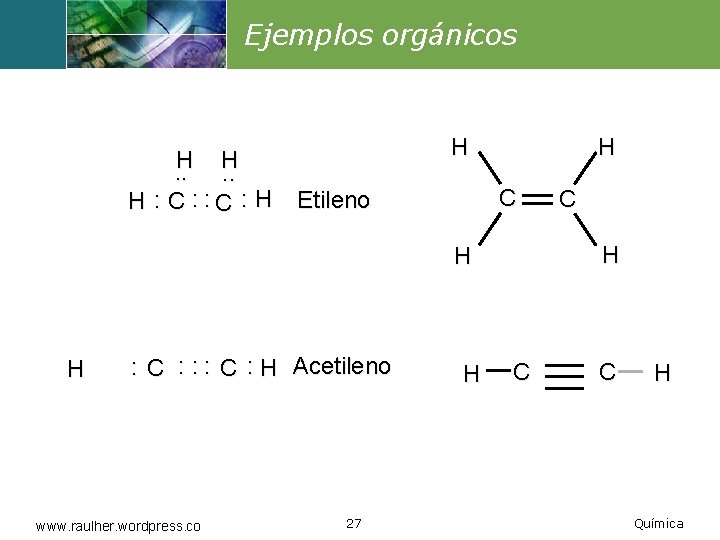
Ejemplos orgánicos H H. . H : C : H H H C Etileno H H H : C : : : C : H Acetileno www. raulher. wordpress. co 27 H C C C H Química

Electronegatividad La electronegatividad es una medida de la habilidad de un elemento de atraer electrones cuando esta enlazado a otro elemento. Un elemento electronegativo atrae electrones. Un elemento electropositivo libera electrones. www. raulher. wordpress. co 28 Química

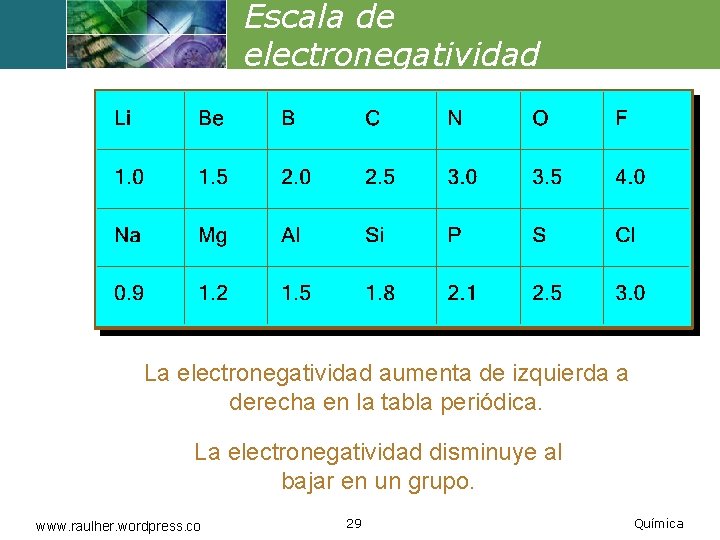
Escala de electronegatividad La electronegatividad aumenta de izquierda a derecha en la tabla periódica. La electronegatividad disminuye al bajar en un grupo. www. raulher. wordpress. co 29 Química

Generalización Entre más grande sea la diferencia de Electronegatividad entre dos átomos enlazados; más polar es el enlace. H—H . . : . . F: . . : N N: Enlaces no-polares conectan dos átomos de la misma electronegatividad www. raulher. wordpress. co 30 Química

Generalización Entre más grande la diferencia en electronegatividad entre dos átomos; más polar es el enlace. d+ H . . d- d+ F: H. . d- d+ O H. . : : O C O. . d-. . d+ d- Los enlaces polares conectan átomos de diferente electronegatividad www. raulher. wordpress. co 31 Química

Porcentaje de carácter iónico v Na. Cl Determinación del % de Carácter iónico Electronegatividad Cl 3. 0 Electronegatividad Na 0. 9 Diferencia 2. 1 % de carácter iónico Según la tabla periódica www. raulher. wordpress. co 32 67% Química

v Mg. F 2 Determinación del % de Carácter iónico Electronegatividad F 4. 0 Electronegatividad Mg 1. 2 Diferencia 2. 8 % de carácter iónico Según la tabla periódica www. raulher. wordpress. co 86% 33 Química

Porcentaje de carácter covalente Determinación del % de Carácter covalente Electronegatividad Cl 3. 5 Electronegatividad H 2. 1 Diferencia 1. 4 % de carácter iónico Según la tabla periódica 39 Carácter covalente = 100 – 39% = 61% Enlace covalente polar www. raulher. wordpress. co 34 Química

Determinación del % de Carácter covalente Electronegatividad H 2. 1 Diferencia 0 % de carácter iónico Según la tabla periódica 0 Carácter covalente = 100 – 0% = 100% Enlace covalente puro o no polar www. raulher. wordpress. co 35 Química

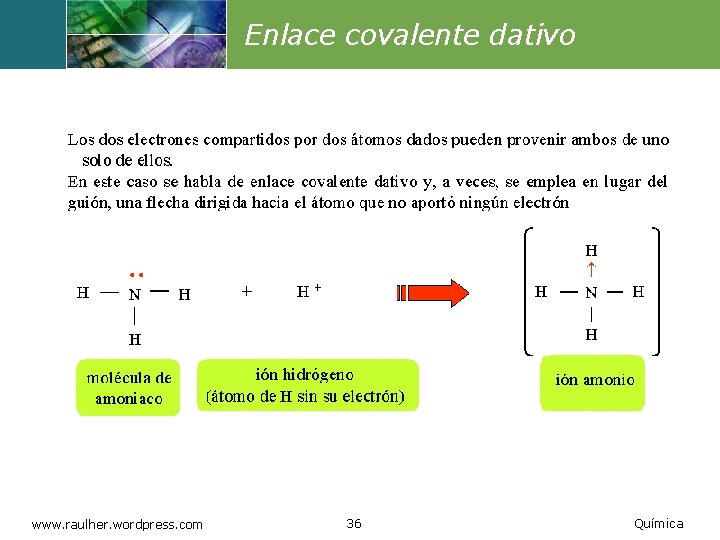
Enlace covalente dativo www. raulher. wordpress. com 36 Química

Estructuras de Lewis En 1916 G. N. Lewis propuso que los átomos se combinan para generar una configuración electrónica más estable. La máxima estabilidad resulta cuando un átomo es isoelectrónico con un gas noble. Un par electrónico que es compartido entre dos átomos constituye un enlace covalente. www. raulher. wordpress. co 37 Química

COMPUESTOS IÓNICOS 1. Son sólidos con punto de fusión altos (por lo general, > 400ºC) 2. Muchos son solubles en disolventes polares, como el agua. . 3. La mayoría es insoluble en disolventes no polares, como el hexano C 6 H 14. 4. Los compuestos fundidos conducen bien la electricidad porque contienen partículas móviles con carga (iones) 5. Las soluciones acuosas conducen bien la electricidad porque contienen partículas móviles con carga (iones). www. raulher. wordpress. com COMPUESTOS COVALENTES 1. Son gases, líquidos o sólidos con punto de fusión bajos (por lo general, < 300ºC) 2. Muchos de ellos son insolubles en disolventes polares. 3. La mayoría es soluble en disolventes no polares, como el hexano C 6 H 14. 4. Los compuestos líquidos o fundidos no conducen la electricidad. 5. Las soluciones acuosas suelen ser malas conductoras de la electricidad porque no contienen partículas con carga. 38 Química

Contenidos 1 Estructuras de Lewis 2 Excepciones a regla del octeto 3 Fuerzas dipolo-dipolo 4 Fuerzas de dispersion 5 Puente de hidrógeno www. raulher. wordpress. com 39 Química

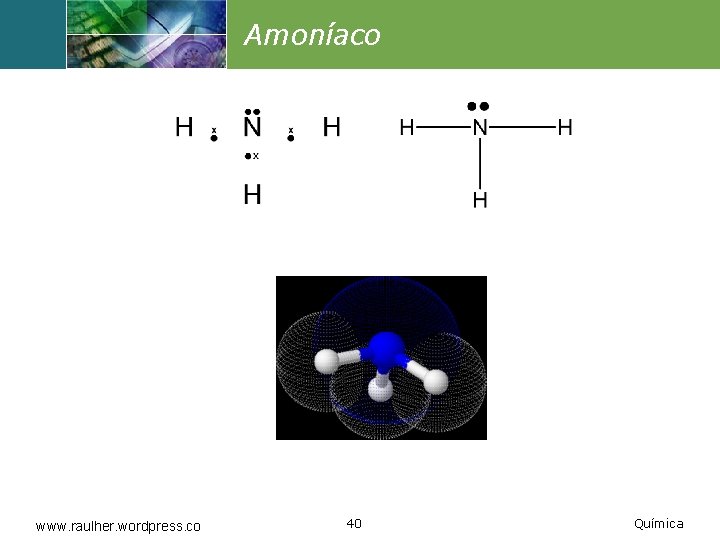
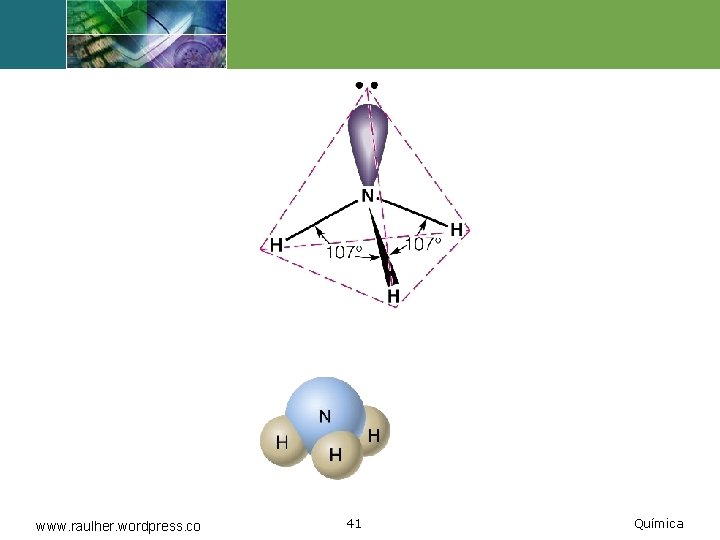
Amoníaco www. raulher. wordpress. co 40 Química

www. raulher. wordpress. co 41 Química

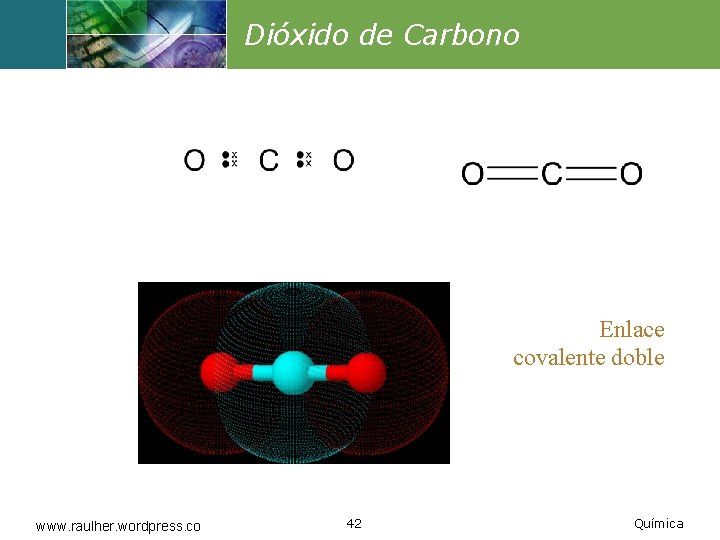
Dióxido de Carbono Enlace covalente doble www. raulher. wordpress. co 42 Química

www. raulher. wordpress. co 43 Química

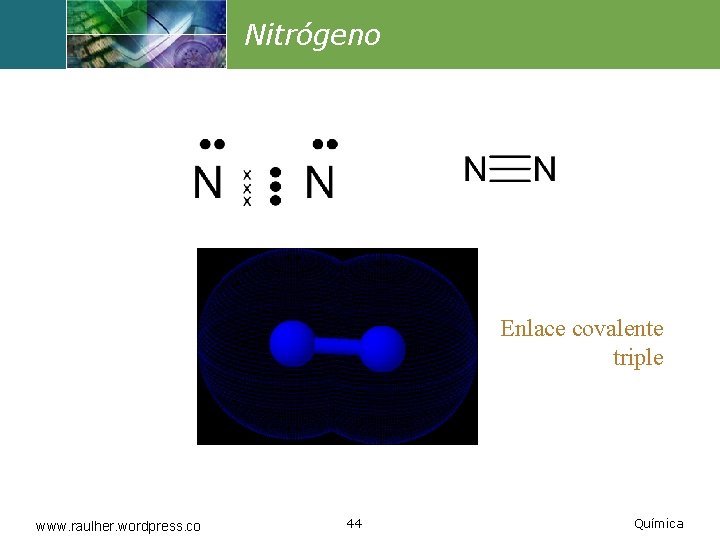
Nitrógeno Enlace covalente triple www. raulher. wordpress. co 44 Química

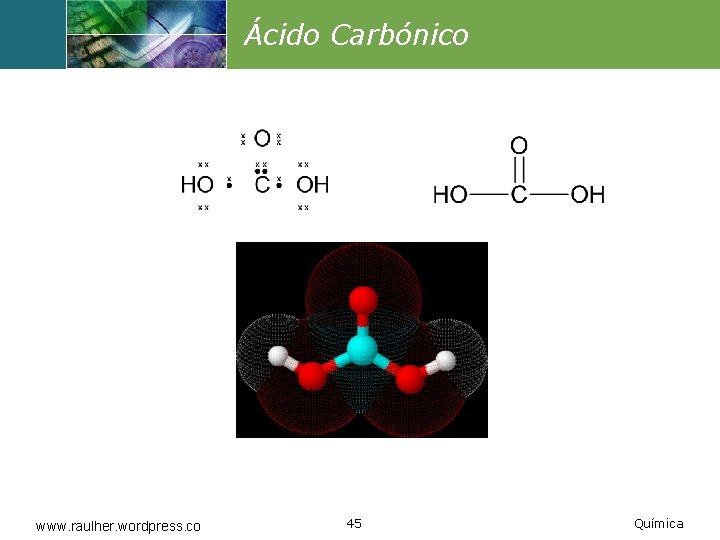
Ácido Carbónico www. raulher. wordpress. co 45 Química

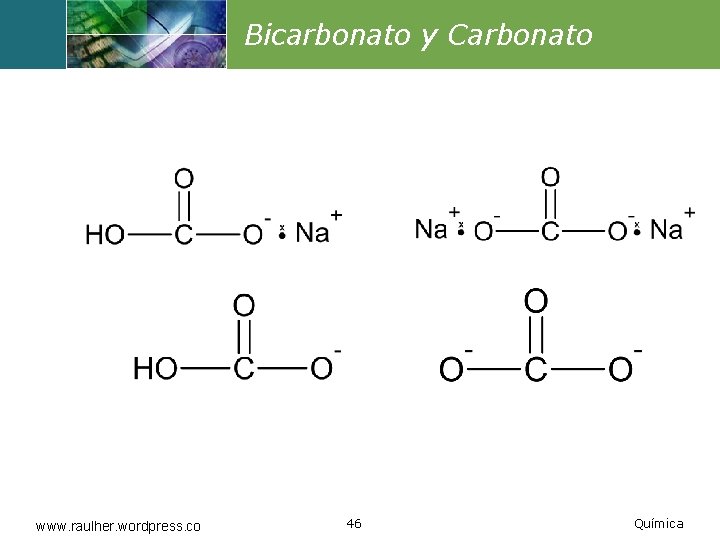
Bicarbonato y Carbonato www. raulher. wordpress. co 46 Química

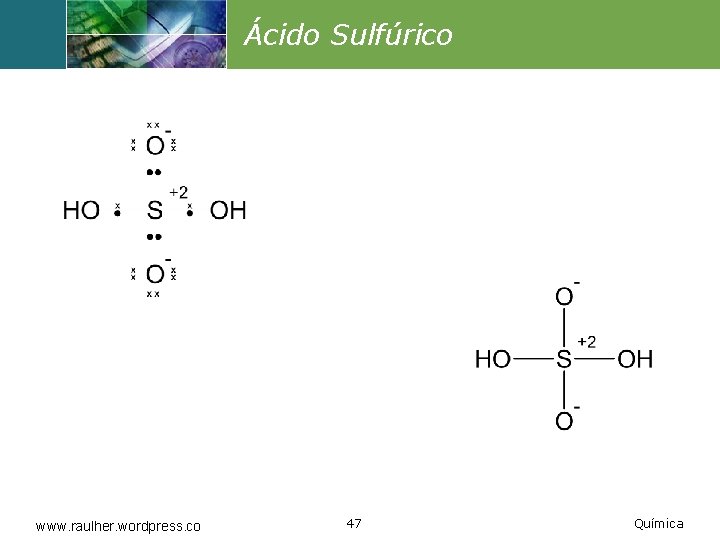
Ácido Sulfúrico www. raulher. wordpress. co 47 Química

Excepciones a Regla del Octeto Excepciones a la Text número par de e- Regla del Octeto Molécula con menos de 8 e- molécula con más de 8 e- www. raulher. wordpress. co 48 Química

Número Impar de Electrones v En la mayor parte de las moléculas, el número de electrones es par y es posible el apareamiento de los spines de los electrones. v No obstante, algunas moléculas como NO contiene 5 + 6 electrones de valencia: es imposible el apareamiento completo de estos electrones y no se puede tener un octeto alrededor de cada uno de los átomos. www. raulher. wordpress. co 49 Química

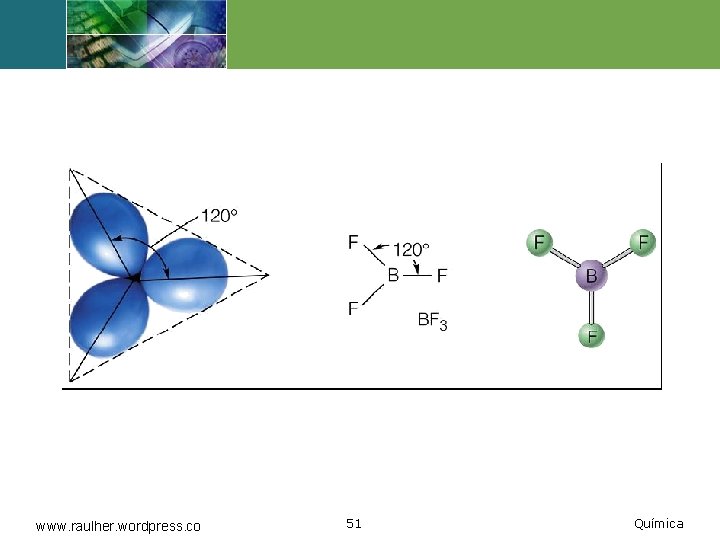
Menos de ocho electrones v Una segunda excepción se presenta cuando hay menos de ocho electrones alrededor de un átomo de una molécula o de un ion. v Esta es una situación relativamente rara y se encuentra con mayor frecuencia en compuestos de boro y berilio. www. raulher. wordpress. co 50 Química

www. raulher. wordpress. co 51 Química

v La tercera y más grande clase de excepciones consiste en las moléculas en que hay más de ocho electrones en la capa de valencia de un átomo. Como ejemplo, consideremos el PCl 5 www. raulher. wordpress. co 52 Química

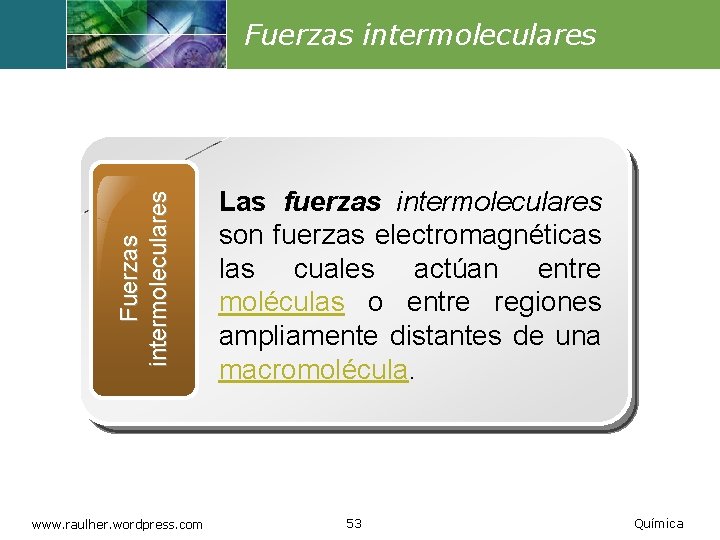
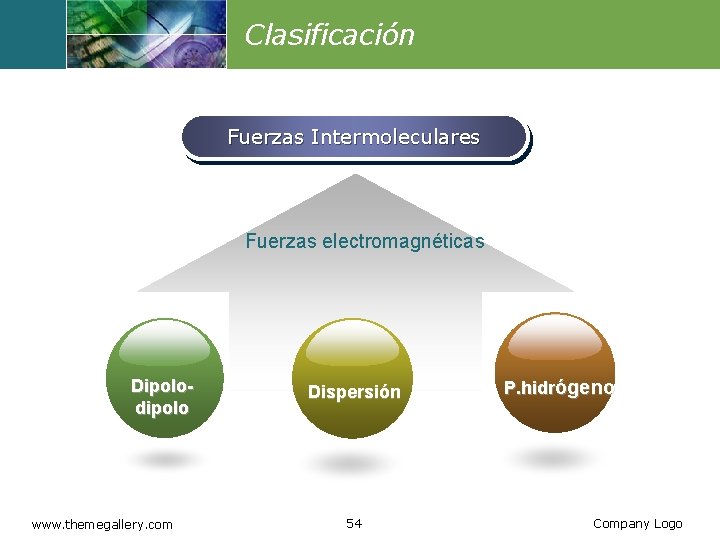
Fuerzas intermoleculares www. raulher. wordpress. com Las fuerzas intermoleculares son fuerzas electromagnéticas las cuales actúan entre moléculas o entre regiones ampliamente distantes de una macromolécula. 53 Química

Clasificación Fuerzas Intermoleculares Fuerzas electromagnéticas Dipolodipolo www. themegallery. com Dispersión 54 P. hidrógeno Company Logo

Dipolo-Dipolo v Son las fuerzas que ocurren entre dos moléculas con dipolos permanentes. v Estas funcionan de forma similar a las interacciones iónicas, pero son más débiles debido a que poseen solamente cargas parciales. Un ejemplo de esto puede ser visto en el ácido clorhídrico: (+)(-) H-Cl---H-Cl (-)(+) Cl-H----Cl-H www. raulher. wordpress. com 55 Química

Fuerzas de Dispersión o London v Son pequeñas y transitorias fuerzas de atracción entre moléculas no polares. v Son más intensas en las moléculas no polares más grandes que en las pequeñas. v Son de mayor magnitud en el Br 2, que en el I 2, que en el F 2. www. raulher. wordpress. com 56 Química

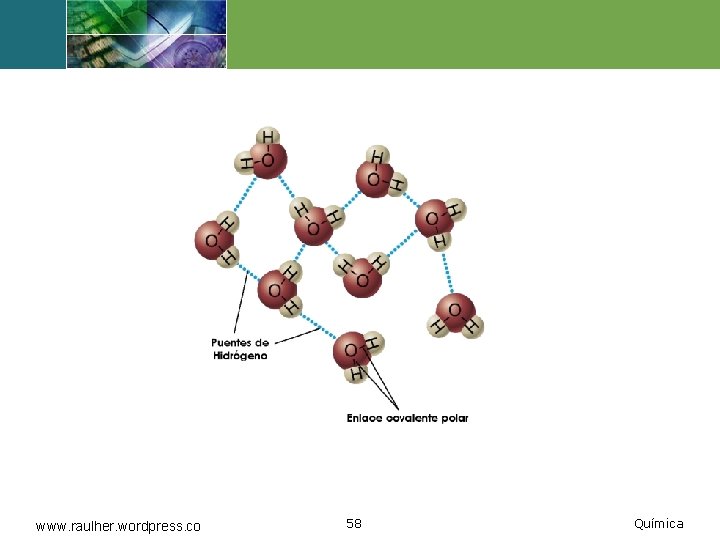
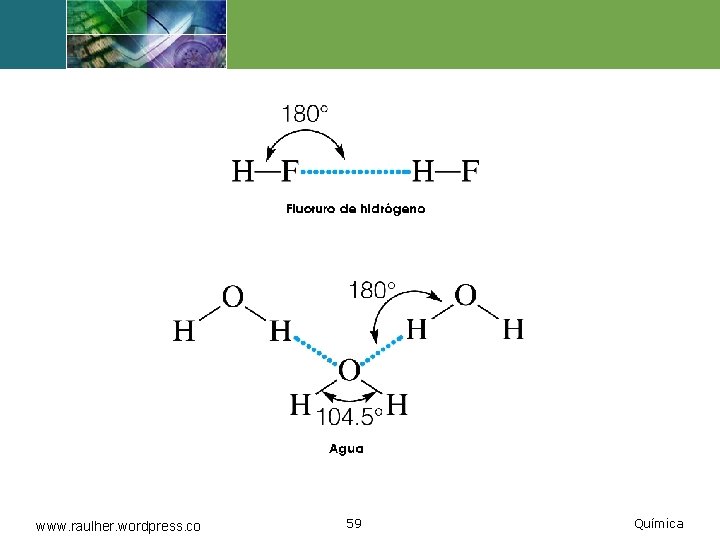
Puente de hidrógeno v. Es un tipo de atracción dipolar particularmente fuerte, en el cual un átomo de hidrógeno hace de puente entre dos átomos electronegativos, sujetando a uno con un enlace covalente y al otro con fuerzas puramente electrostáticas. www. raulher. wordpress. co 57 Química

www. raulher. wordpress. co 58 Química

www. raulher. wordpress. co 59 Química

www. raulherqg. wordpress. com Lic. Raúl Hernández M.
 Oxígeno tipo de enlace
Oxígeno tipo de enlace Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Enlace covalente coordinado
Enlace covalente coordinado Miguel hernndez
Miguel hernndez Mario hernndez
Mario hernndez Miguel hernndez
Miguel hernndez Enlace pi y sigma ejemplos
Enlace pi y sigma ejemplos Texto expositivo ejemplo
Texto expositivo ejemplo Contenidos factuales ejemplos
Contenidos factuales ejemplos Contenidos conceptuales procedimentales y actitudinales
Contenidos conceptuales procedimentales y actitudinales Objetivos de repaso
Objetivos de repaso Introduccion de un trabajo
Introduccion de un trabajo Contenidos de aprendizaje.
Contenidos de aprendizaje. Contenidos desarrollados
Contenidos desarrollados S-nhyzk-bvg -site:youtube.com
S-nhyzk-bvg -site:youtube.com Competencias procedimentales ejemplos
Competencias procedimentales ejemplos Contenidos interdisciplinares
Contenidos interdisciplinares Contenidos procedimentales y actitudinales
Contenidos procedimentales y actitudinales Enfoque pedagogico de conocimiento del medio primer grado
Enfoque pedagogico de conocimiento del medio primer grado Secuenciación de contenidos
Secuenciación de contenidos Biot solunum
Biot solunum Ral project manager
Ral project manager Ral checker
Ral checker Ral tabel
Ral tabel Syarat rancangan acak kelompok
Syarat rancangan acak kelompok Cp ral
Cp ral Estacion semitotal
Estacion semitotal Ral weber
Ral weber Split plot rak
Split plot rak Ral 26000
Ral 26000 Mice project manager
Mice project manager Ral medicina
Ral medicina Uji bnt ral faktorial
Uji bnt ral faktorial Tabel rak
Tabel rak 112 yanık vaka örnekleri
112 yanık vaka örnekleri Ian ral
Ian ral Dr ral
Dr ral Ral tabel
Ral tabel Ral solunum sesi
Ral solunum sesi Web ral
Web ral Isis
Isis Cp ral
Cp ral Z 3
Z 3 Zimbra cnaf
Zimbra cnaf Ian ral
Ian ral Varianza poblacional
Varianza poblacional Ral 1453
Ral 1453 Ral project manager
Ral project manager Tabel ral
Tabel ral Contoh soal rancangan acak lengkap
Contoh soal rancangan acak lengkap Cp ral
Cp ral Tequila cazadores precio chedraui
Tequila cazadores precio chedraui Ral 118
Ral 118 Contoh rancangan kegiatan statistik
Contoh rancangan kegiatan statistik Dr ral
Dr ral Lic en sangre
Lic en sangre Ay.lic
Ay.lic Rural career agent
Rural career agent The endowment assurance policy (plan-14)
The endowment assurance policy (plan-14)