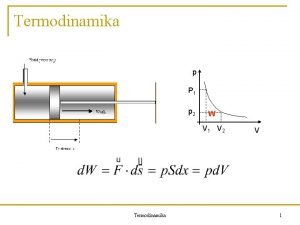
I zakon termodinamike je doveo do uvoenja unutranje








































- Slides: 66

I zakon termodinamike je doveo do uvođenja unutrašnje energije, U koja nam omogućava da odredimo koje termodinamičke promene su moguće: samo one u kojima unutrašnja energija izolovanog sistema ostaje konstantna. I zakon termodinamike govori o kvantitetu energije i njenoj nepromenjljivosti u izolovanim sistemima. II zakon termodinamike razmatra kvalitet energije tj. njenu raspodelu. Pri spontanim promenama kvalitet energije se snižava, energija se degradira, prelazi u oblik koji se u manjoj meri može koristiti za vršenje rada. Razmotrićemo primere spontanih promena i paralelno disperziju - raspodelu energije.

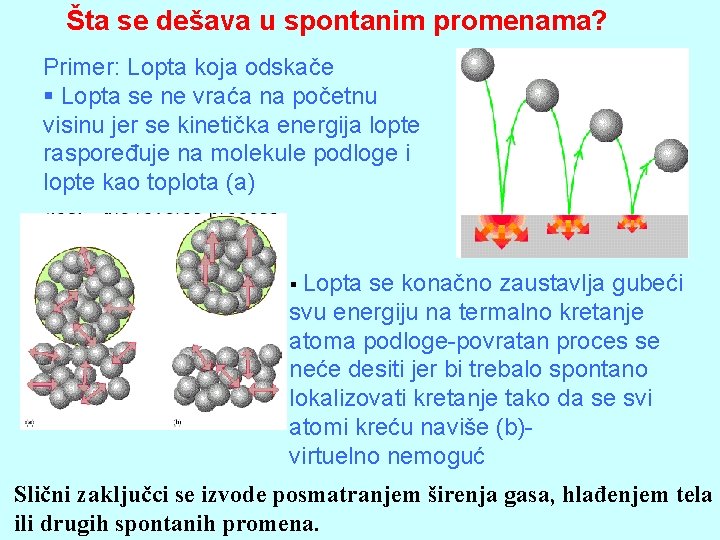
Šta se dešava u spontanim promenama? Primer: Lopta koja odskače § Lopta se ne vraća na početnu visinu jer se kinetička energija lopte raspoređuje na molekule podloge i lopte kao toplota (a) § Lopta se konačno zaustavlja gubeći svu energiju na termalno kretanje atoma podloge-povratan proces se neće desiti jer bi trebalo spontano lokalizovati kretanje tako da se svi atomi kreću naviše (b)virtuelno nemoguć Slični zaključci se izvode posmatranjem širenja gasa, hlađenjem tela ili drugih spontanih promena.

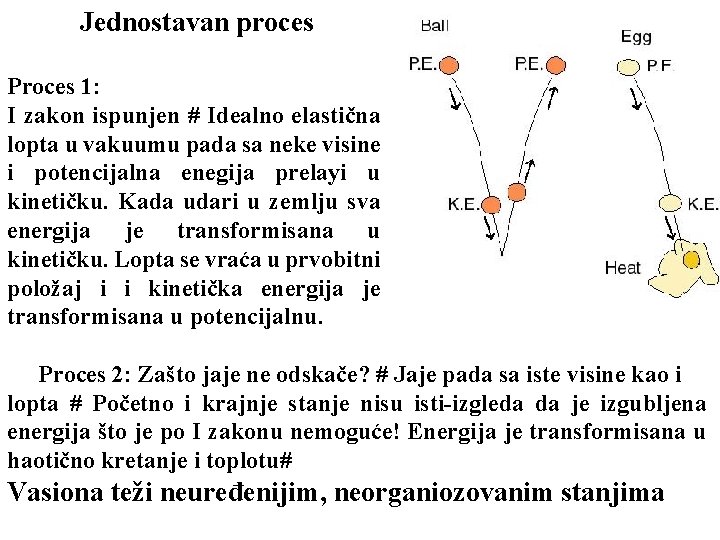
Jednostavan proces Proces 1: I zakon ispunjen # Idealno elastična lopta u vakuumu pada sa neke visine i potencijalna enegija prelayi u kinetičku. Kada udari u zemlju sva energija je transformisana u kinetičku. Lopta se vraća u prvobitni položaj i i kinetička energija je transformisana u potencijalnu. Proces 2: Zašto jaje ne odskače? # Jaje pada sa iste visine kao i lopta # Početno i krajnje stanje nisu isti-izgleda da je izgubljena energija što je po I zakonu nemoguće! Energija je transformisana u haotično kretanje i toplotu# Vasiona teži neuređenijim, neorganiozovanim stanjima

Disperzija Energije Spontane promene su praćene disperzijom energije, njenim prelaskom u neuređeniji oblik, u oblik koji je manje pogodan za prevođenje u rad. U spontanim promenama se menja kvalitet energije, degradira se energija. Zaključak: smer spontanih promena je određen haotičnijom disperzijom ukupne energije izolovanog sistema.

• Empirijski zapaženu tendenciju prirodnih pojava da uvek teku u određenom smeru, nije bilo moguće izraziti ni jednom od do tada poznatih termodinamičkih veličina. Trebalo je definisati novu veličinu koja će biti funkcija stanja sistema, a koja će se jednoznačno menjati (rasti ili opadati) u toku bilo kog spontanog tj. ireverzibilnog procesa.

Kako su spontani procesi ireverzibilni a oni su praćeni porastom entropije to znači da se u ireverzibilnim procesima stvara entropija. Tokom spontanih promena koje se dešavaju u prirodi univerzum teži neuređenijim, haotičnijim stanjima. Entropija služi da se kvantitativno odredi stepen (mera) neuređene raspodele. Porast entropije znači porast neuređenosti i haotičnog kretanja. Nasuprot tome reverzibilni procesi ne stvaraju entropiju (sistem je stalno u ravnoteži sa okolinom, nema disperzije energije u njen haotičniji oblik). Drugim rečima reverzibilni procesi ne stvaraju entropiju. Filozofski aspekt II zakona na sajtovima http: //www. secondlaw. com i http: //www. 2 ndlaw. com

Entropija • Entropija je mera neuređenosti sistema.

Drugi zakon se koristi da se odrede i kvantifikuju spontane promene preko termodinamičke veličine koja je funkcija stanja i zove se entropija, S. Prvi zakon Koristi U da odredi moguće promene Drugi zakon Koristi S da odredi od mogućih spontane promene Entropija izolovanog sistema raste tokom spontane promene: ΔStot>0 gde je ΔStot ukupna entropija sistema i okoline. Entropija je merilo neuređenosti sistema i omogućava nam da odredimo da li se neko stanje može ostvariti spontanim prelaskom iz drugog stanja

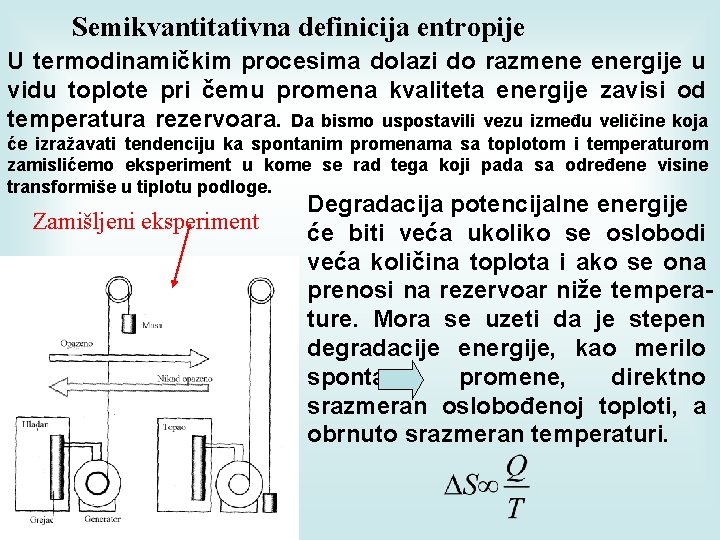
Semikvantitativna definicija entropije U termodinamičkim procesima dolazi do razmene energije u vidu toplote pri čemu promena kvaliteta energije zavisi od temperatura rezervoara. Da bismo uspostavili vezu između veličine koja će izražavati tendenciju ka spontanim promenama sa toplotom i temperaturom zamislićemo eksperiment u kome se rad tega koji pada sa određene visine transformiše u tiplotu podloge. Zamišljeni eksperiment Degradacija potencijalne energije će biti veća ukoliko se oslobodi veća količina toplota i ako se ona prenosi na rezervoar niže temperature. Mora se uzeti da je stepen degradacije energije, kao merilo spontane promene, direktno srazmeran oslobođenoj toploti, a obrnuto srazmeran temperaturi.

Promena Entropije-semikvantitativno • Više toplote preneto, niža temperatura – Proizvodi se veća promena entropije – Manje energije je raspoloživo za transformaciju • Manje toplote preneto, viša temperatura – Proizvodi se manja promena entropije – Više energije je raspoloživo za transformaciju

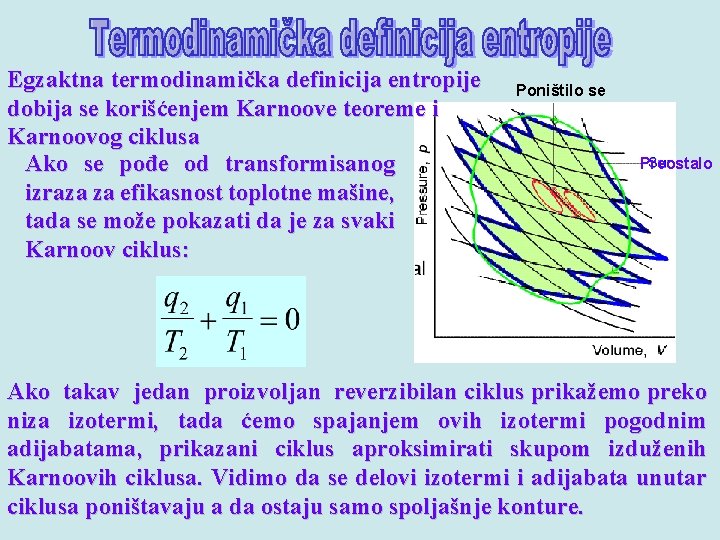
Egzaktna termodinamička definicija entropije dobija se korišćenjem Karnoove teoreme i Karnoovog ciklusa Ako se pođe od transformisanog izraza za efikasnost toplotne mašine, tada se može pokazati da je za svaki Karnoov ciklus: Poništilo se Preostalo Ako takav jedan proizvoljan reverzibilan ciklus prikažemo preko niza izotermi, tada ćemo spajanjem ovih izotermi pogodnim adijabatama, prikazani ciklus aproksimirati skupom izduženih Karnoovih ciklusa. Vidimo da se delovi izotermi i adijabata unutar ciklusa poništavaju a da ostaju samo spoljašnje konture.

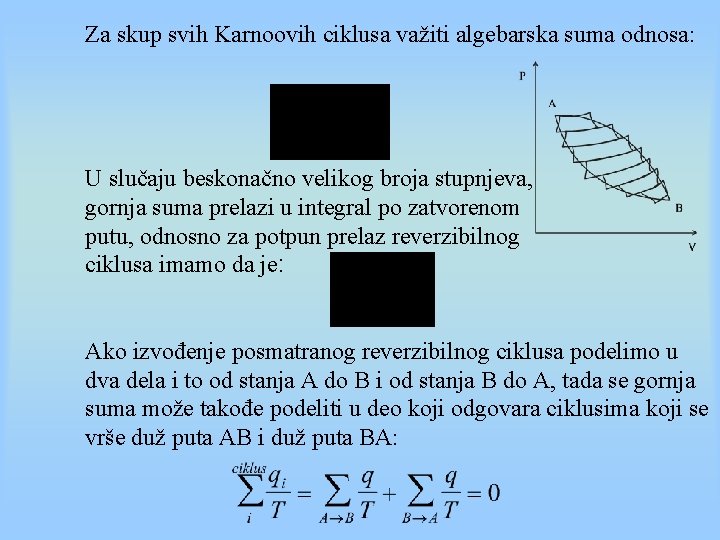
Za skup svih Karnoovih ciklusa važiti algebarska suma odnosa: U slučaju beskonačno velikog broja stupnjeva, gornja suma prelazi u integral po zatvorenom putu, odnosno za potpun prelaz reverzibilnog ciklusa imamo da je: Ako izvođenje posmatranog reverzibilnog ciklusa podelimo u dva dela i to od stanja A do B i od stanja B do A, tada se gornja suma može takođe podeliti u deo koji odgovara ciklusima koji se vrše duž puta AB i duž puta BA:

Pretpostavićemo da se krećemo različitim putevima iz tačke A do tačke B, a uvek istim putem od B do A, što znači da suma koja odgovara ciklusima duž puta BA nije promenjena pa pošto zbir suma mora biti jednak nuli to se ni suma koja odgovara ciklusima duž puta AB takođe ne može menjati, iako se put od A do B menjao. To znači da vrednosti suma ne zavise od pređenog puta već samo od stanja između kojih se reverzibilna promena desila. Stoga ćemo svaku od tih suma izraziti nekom funkcijom stanja koju ćemo označiti sa S, tako da će svaka od suma biti izražena razlikom te funkcije u krajnjem SB i početnom stanju SA: Za beskonačno mali stupanj reverzibilnog procesa biće:

Promena Entropije = Odnos toplote i temperature Toplota preneta sistemu ili od sistema Promena Entropije sistema Apsolutna Temperatura sistema

Beskonačno mala promena entropije je d. S koja može nastati u fizičkoj ili hemijskoj promeni. beskonačno mala promena konačna promena Entropija je merilo dispergovanja energije na haotičan, neuređen način i određena je energijom prenetom u obliku toplote.

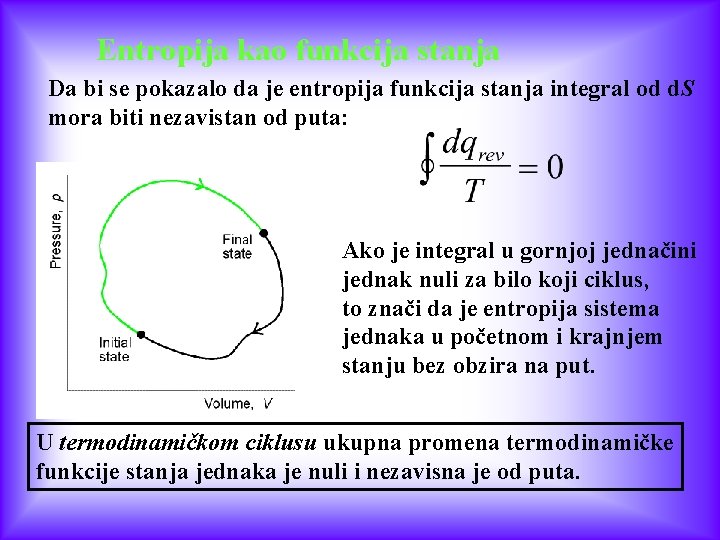
Entropija kao funkcija stanja Da bi se pokazalo da je entropija funkcija stanja integral od d. S mora biti nezavistan od puta: Ako je integral u gornjoj jednačini jednak nuli za bilo koji ciklus, to znači da je entropija sistema jednaka u početnom i krajnjem stanju bez obzira na put. U termodinamičkom ciklusu ukupna promena termodinamičke funkcije stanja jednaka je nuli i nezavisna je od puta.

ENTROPIJA mera tendencije materije da postane haotično raspoređena, neuređena Veći stepen neuređenosti ili haotičnosti u sistemu znači veću entropiju Entropija je funkcija stanja; ekstenzivna veličina – zavisi od količine supstancije Njena beskonačno mala promena je data totalnim diferencijalom Jedinice: J/mol K

Entropija • Entropija se često naziva “Strelom vremena” • Ako zamislimo slike nekog procesa – i poređamo ih po redu rastuće entropije • One će biti i u hronološkom redu takođe. • Entropija uvek raste za realne sisteme

Entropiju kao termodinamički pojam uveo Klauzijus Naziv prema grčkoj reči koja znači menjanje Clausius, Rudolf (1822 -1888)

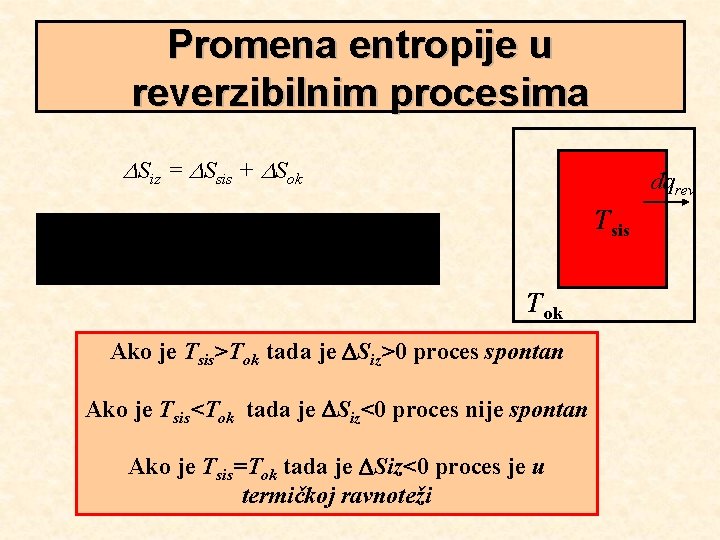
Promena entropije u reverzibilnim procesima Siz = Ssis + Sok dqrev Tsis Tok Ako je Tsis>Tok tada je Siz>0 proces spontan Ako je Tsis<Tok tada je Siz<0 proces nije spontan Ako je Tsis=Tok tada je Siz<0 proces je u termičkoj ravnoteži

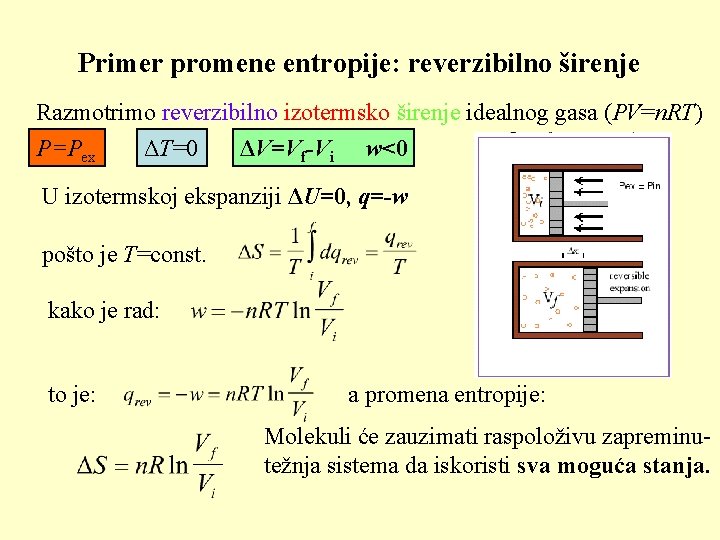
Primer promene entropije: reverzibilno širenje Razmotrimo reverzibilno izotermsko širenje idealnog gasa (PV=n. RT) P=Pex ΔT=0 ΔV=Vf-Vi w<0 U izotermskoj ekspanziji ΔU=0, q=-w pošto je T=const. kako je rad: to je: a promena entropije: Molekuli će zauzimati raspoloživu zapreminutežnja sistema da iskoristi sva moguća stanja.

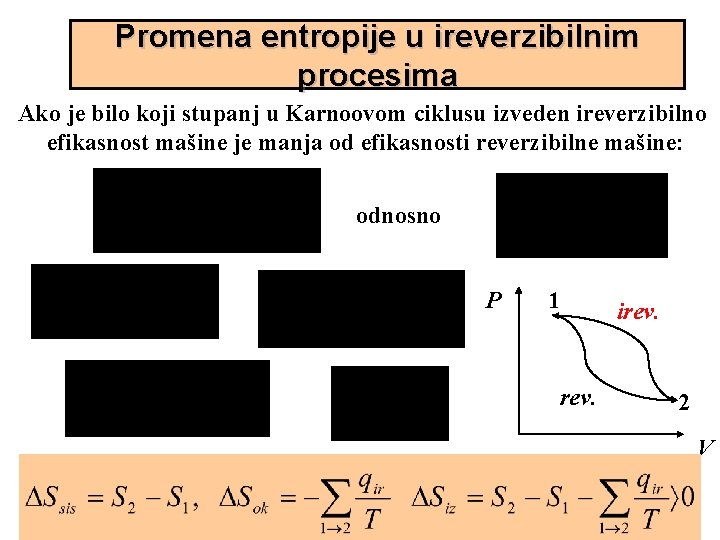
Promena entropije u ireverzibilnim procesima Ako je bilo koji stupanj u Karnoovom ciklusu izveden ireverzibilno efikasnost mašine je manja od efikasnosti reverzibilne mašine: odnosno P 1 rev. irev. 2 V

Entropija i ireverzibilnost • Realni proces: sagorevanje uglja Ugalj Toplota + Pepeo – Entropija raste • Ovaj proces ne može biti povratan! Toplota + Pepeo Ugalj – Entropija bi opadala

Klauzijusova nejednakost Izotermsko širenje edealnog gasa reverzibilno i ireverzibilno: §Uzećemo da je Vf=2 Vi, wrev=-n. RTln. Vf/Vi=-(0, 693)n. RT, wirev=-0, 5 n. RT, (više rada je izvršeno na okolini u reverzibilnom širenju). §Pošto je širenje izotermsko ΔU=0, q=-w §Znači da je qrev>qirev §Ssis je funkcija stanja, nezavisno od puta, ΔSsis=qrev/T=(0, 693)n. R § ΔSokol zavisi od količine prenete toplote, ΔSokol, rev=-(0, 693)n. R, ΔSokol, irev=-(0, 5)n. R

Klauzijusova nejednakost ØU reverzibilnoj promeni Stot, rev=0, jer su promene entropije sistema i okoline jednake a suprotnih znakova. ØU ireverzibilnoj promeni Stot, irev=0, 193 n. R Ovo je opšti zaključak: sve irevrzibilne promene su spontane i imaju ukupnu promenu entropije koja je veća od nule. pošto je d. Sok=-dq/T gde je dq toplota prenesena sistemu, to je za bilo koju promenu reverzibilnu ili ireverzibilnu:

Zakoni Termodinamike • Prvi zakon termodinamike U = q + w (= P V) Energija ne može biti stvorena ni uništena, ali može biti transformisana iz jednog oblika u drugi • Drugi zakon Termodinamike Suniv = Ssys + Ssur Suniv > 0 & Ssys < Ssur (za spontane, ireverzibilne, procesr) • Treći zakon termodinamike S = 0 at 0 K

Drugi zakon termodinamike • Drugi zakon: entropija univerzuma raste. • Za bilo koju hemijsku reakciju koja je spontana, promena entropije univezuma (ukupna promena entropije izolovanog sistema) mora biti pozitivna: Suniverzuma = Ssistem + Sokolina Suniverzuma > 0 • Entropija nije konzervirana! • Entropija univerzuma mora da raste.

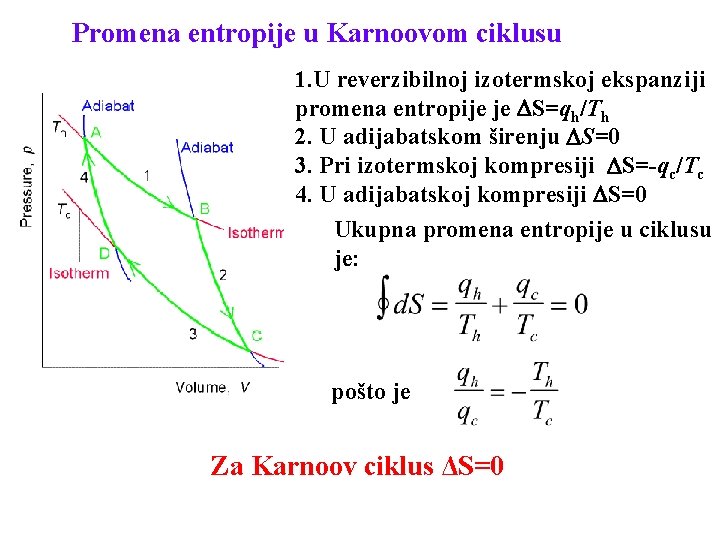
Promena entropije u Karnoovom ciklusu 1. U reverzibilnoj izotermskoj ekspanziji promena entropije je S=qh/Th 2. U adijabatskom širenju S=0 3. Pri izotermskoj kompresiji S=-qc/Tc 4. U adijabatskoj kompresiji S=0 Ukupna promena entropije u ciklusu je: pošto je Za Karnoov ciklus ΔS=0

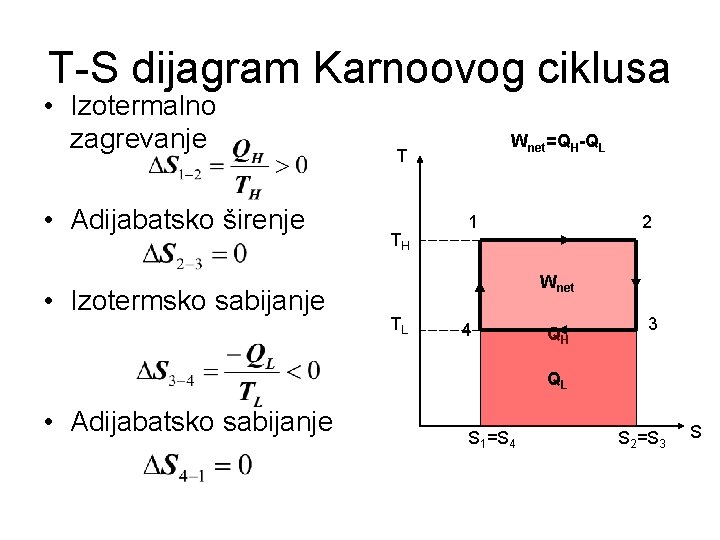
T-S dijagram Karnoovog ciklusa • Izotermalno zagrevanje • Adijabatsko širenje • Izotermsko sabijanje Wnet=QH-QL T TH 1 2 Wnet TL 4 QH 3 QL • Adijabatsko sabijanje S 1=S 4 S 2=S 3 S

Osobine dijagrama koji uključuju entropiju T-S diagram

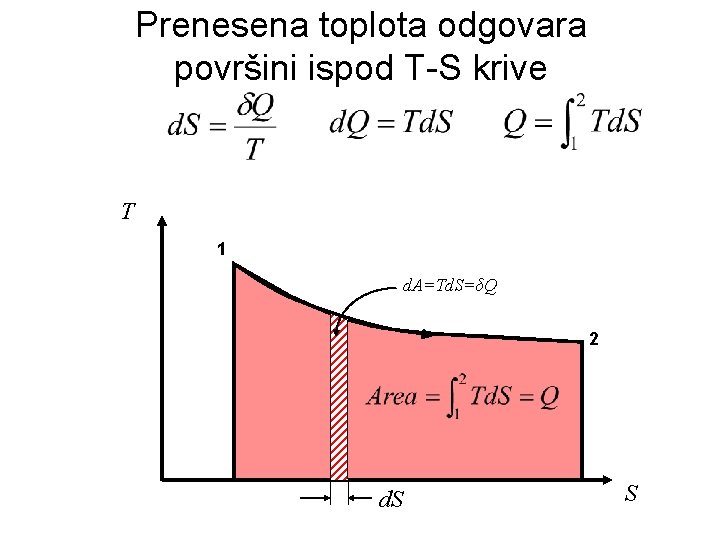
Prenesena toplota odgovara površini ispod T-S krive T 1 d. A=Td. S=δQ 2 d. S S

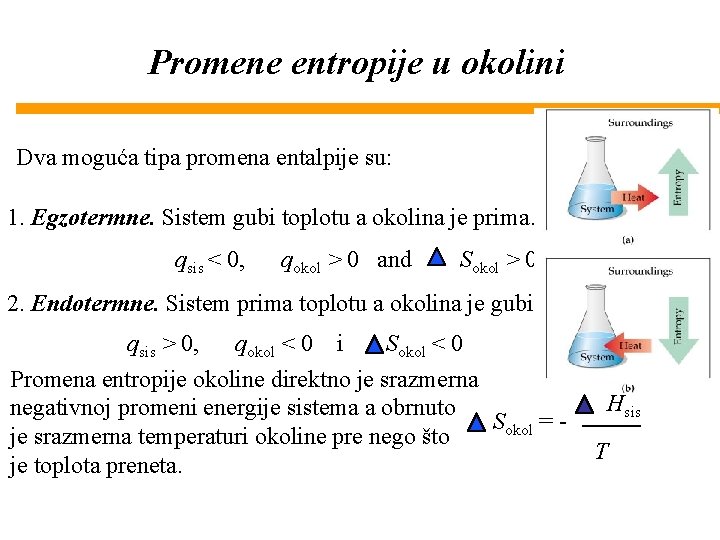
Promene entropije okoline Prema II zakonu termodinamike: Smanjenje entropije sistema može da se desi samo ako ga porast entropije okoline prevaziđe. • Okolina ili predaje energiju sistemu ili uzima energiju od sistema. • Stoga postoje dva moguća tipa promena entalpije u hemijskim reakcijama.

Promene entropije u okolini Dva moguća tipa promena entalpije su: 1. Egzotermne. Sistem gubi toplotu a okolina je prima. qsis < 0, qokol > 0 and Sokol > 0 2. Endotermne. Sistem prima toplotu a okolina je gubi. qsis > 0, qokol < 0 i Sokol < 0 Promena entropije okoline direktno je srazmerna negativnoj promeni energije sistema a obrnuto Sokol = je srazmerna temperaturi okoline pre nego što je toplota preneta. Hsis T

Promene entropije u okolini

Izračunavanje promene entropije • Promena entropije u hemijskim reakcijama se može izračunati iz standardnih molarnih entropija, koje su date u tablicama. • Standardne molarne entropije su apsolutne entropije supstancija u njihovom standardnom stanju. • Standardna molarna entropija elementa u njegovom standardnom stanju nije nula. Molovi produkata Molovi reaktanata

Izračunavanje promene entropije Odrediti promenu stabdardne entropije za sledeću reakciju: CH 4(g) + 2 O 2(g) CO 2(g) + 2 H 2 O(g) Jedinjenje CH 4(g) H 2 O(g) CO 2(g) So (J/mol. K) 187 189 214 205

Rđanje gvožđa 4 Fe(č) + 3 O 2(g) 2 Fe 2 O 3(č) H 0298 = 1648, 4 k. J mol 1

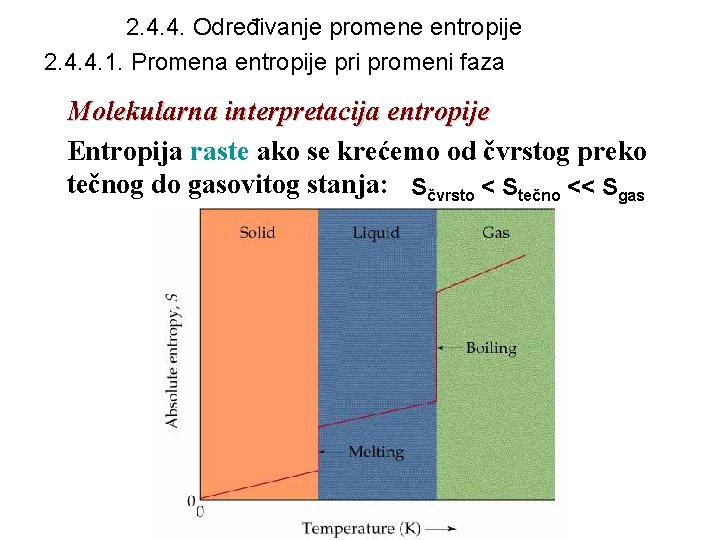
2. 4. 4. Određivanje promene entropije 2. 4. 4. 1. Promena entropije pri promeni faza Molekularna interpretacija entropije Entropija raste ako se krećemo od čvrstog preko tečnog do gasovitog stanja: Sčvrsto < Stečno << Sgas

Porast entropije pri prelasku iz čvrstog u tečno i tečnog u gasovito stanje

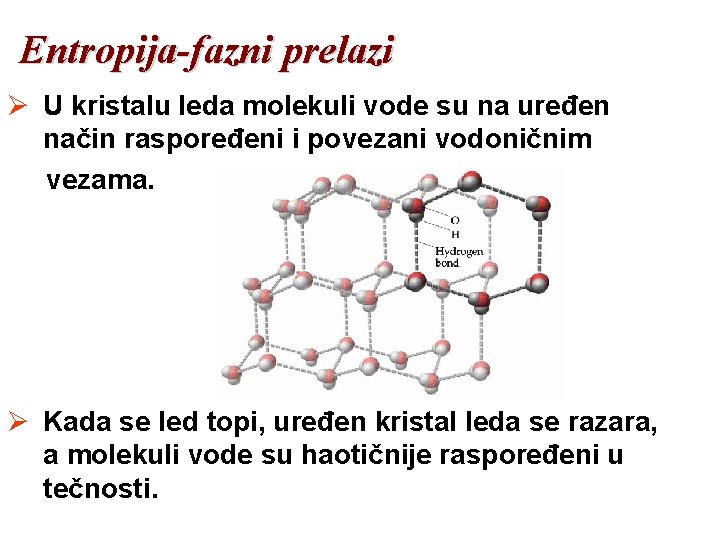
Entropija-fazni prelazi Ø U kristalu leda molekuli vode su na uređen način raspoređeni i povezani vodoničnim vezama. Ø Kada se led topi, uređen kristal leda se razara, a molekuli vode su haotičnije raspoređeni u tečnosti.

Entropija-fazni prelazi • Razmotrimo šta se dešava kada se KCl stavi u vodu. • Znamo da se KCl spontano rastvara, čak i ako je H > 0. • U ovom slučaju, molekuli vode se orijentišu oko jona tako da se red povećava. • Ali joni nisu više čvrsto vezani kao u kristalnoj rešetki, pa su oni više neuređeni.

Promena entropije pri faznim prelazima Entropije isparavanja: 21 cal/(mol K) odnosno 88 J/(mol K).

2. 4. 4. Određivanje promene entropije 2. 4. 4. 1. Promena entropije idealnog gasa

2. 4. 4. 3 -4. Promena entropije sa T, P i V


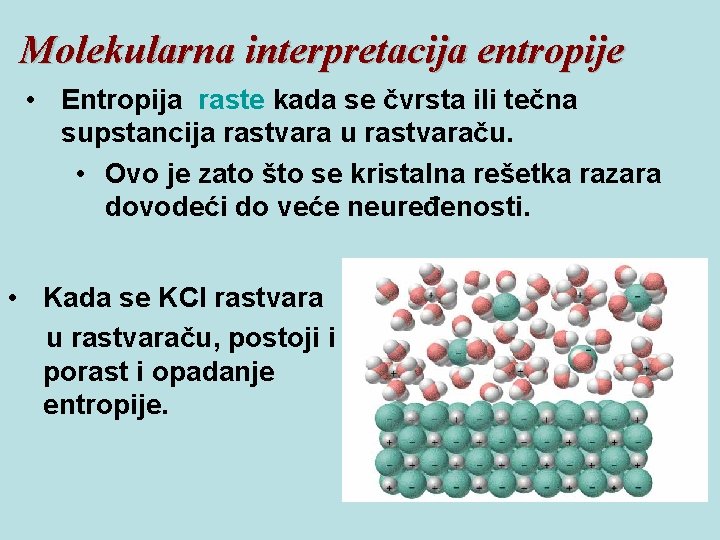
Molekularna interpretacija entropije • Entropija raste kada se čvrsta ili tečna supstancija rastvara u rastvaraču. • Ovo je zato što se kristalna rešetka razara dovodeći do veće neuređenosti. • Kada se KCl rastvara u rastvaraču, postoji i porast i opadanje entropije.

Entropija-rastvaranje • 2 Cs(č) + 2 H 2 O(t) 2 Cs. OH(aq) + H 2(g) 1. Da li je reakcija spontana? 2. Kog znaka je Ho? 3. Kog znaka je So? Jeste. Negativnog. Pozitivnog.

2. 4. 4. 5. Entropija Mešanja Šta se dešava kada se mešaju dva idealna gasa? Šta se dešava kada rastavramo neku supstanciju u rastvaraču?

2. 4. 4. 6. Termodinamičke jednačine stanja

Molekularna interpretacija entropije • Stepeni slobode su u vezi načina kretanja molekula. • Što je molekul pokretljiviji to je njegova entropija veća i ima više stepeni slobode. • III zakon termodinamike: idealan kristal na 0 K ima apsolutnu entropiju nula.

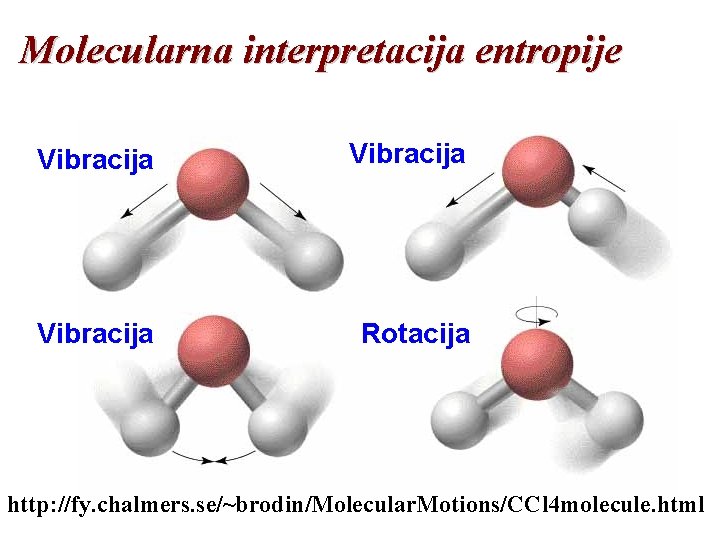
Molekularna interpretacija entropije • Entropije komplikovanijih molekula su veće od entropija jednostavnijih molekula: S(CH 4) < S(C 2 H 6) • Postoje tri tipa kretanja u molekulu: translaciono, rotaciono, i vibraciono. • Translacija uključuje kretanje čitavog molekula sa jednog mesta na drugo. • Gasovi imaju u najvećoj meri translaciono kretanje. • Rotacija uključuje kretanje molekula oko ose. • Vibracija uključuje menjanje dužina i uglova između hemijskih veza.

Molecularna interpretacija entropije Vibracija Rotacija http: //fy. chalmers. se/~brodin/Molecular. Motions/CCl 4 molecule. html

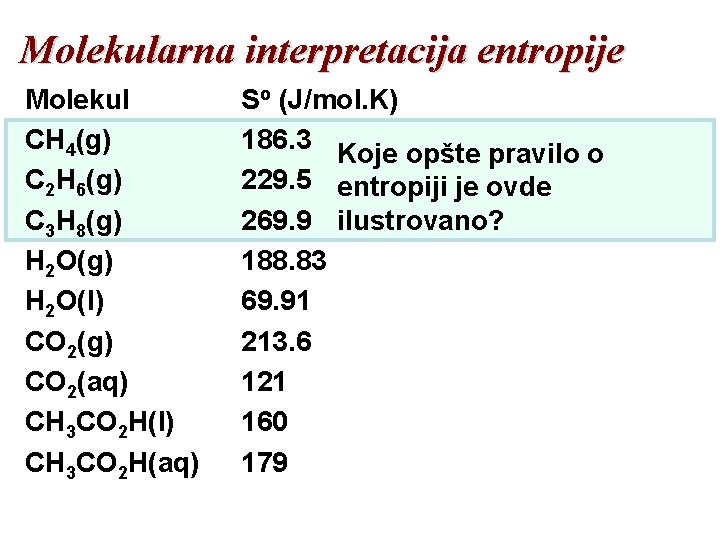
Molekularna interpretacija entropije Molekul CH 4(g) C 2 H 6(g) C 3 H 8(g) H 2 O(l) CO 2(g) CO 2(aq) CH 3 CO 2 H(l) CH 3 CO 2 H(aq) So (J/mol. K) 186. 3 Koje opšte pravilo o 229. 5 entropiji je ovde 269. 9 ilustrovano? 188. 83 69. 91 213. 6 121 160 179

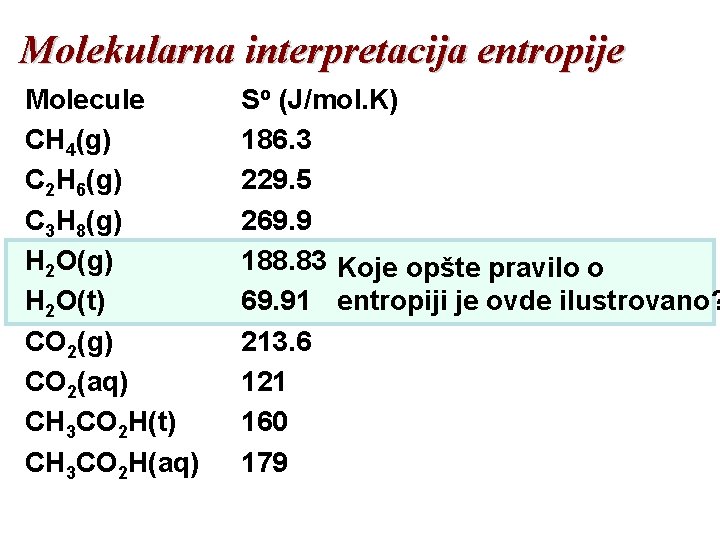
Molekularna interpretacija entropije Molecule CH 4(g) C 2 H 6(g) C 3 H 8(g) H 2 O(t) CO 2(g) CO 2(aq) CH 3 CO 2 H(t) CH 3 CO 2 H(aq) So (J/mol. K) 186. 3 229. 5 269. 9 188. 83 Koje opšte pravilo o 69. 91 entropiji je ovde ilustrovano? 213. 6 121 160 179

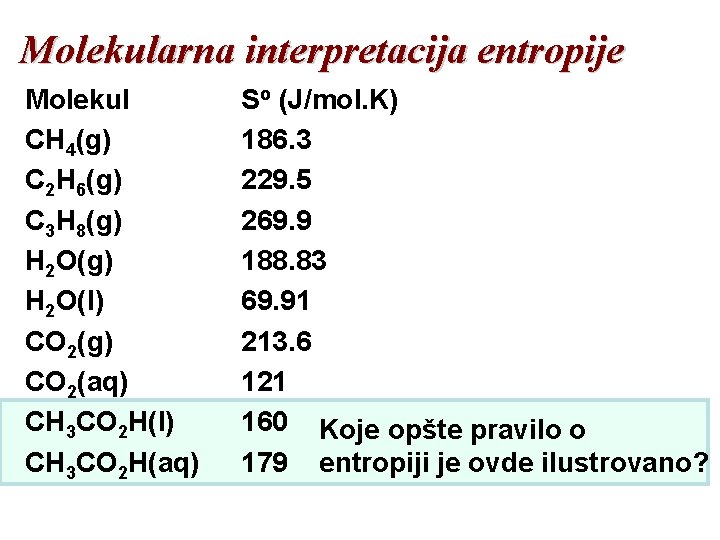
Molekularna Interpretacija Entropije Molekul CH 4(g) C 2 H 6(g) C 3 H 8(g) H 2 O(l) CO 2(g) CO 2(aq) CH 3 CO 2 H(l) CH 3 CO 2 H(aq) So (J/mol. K) 186. 3 229. 5 269. 9 188. 83 69. 91 213. 6 Koje opšte pravilo o entropiji 121 je ovde ilustrovano? 160 179

Molekularna interpretacija entropije Molekul CH 4(g) C 2 H 6(g) C 3 H 8(g) H 2 O(l) CO 2(g) CO 2(aq) CH 3 CO 2 H(l) CH 3 CO 2 H(aq) So (J/mol. K) 186. 3 229. 5 269. 9 188. 83 69. 91 213. 6 121 160 Koje opšte pravilo o 179 entropiji je ovde ilustrovano?

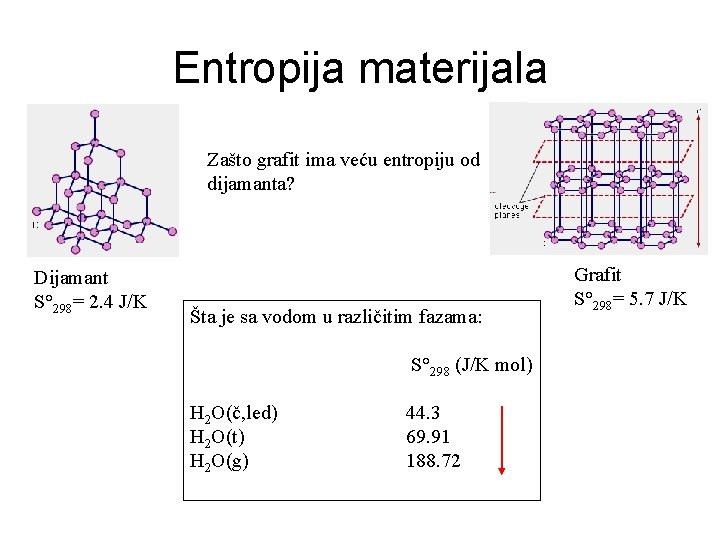
Entropija materijala Zašto grafit ima veću entropiju od dijamanta? Dijamant S° 298= 2. 4 J/K Šta je sa vodom u različitim fazama: S° 298 (J/K mol) H 2 O(č, led) H 2 O(t) H 2 O(g) 44. 3 69. 91 188. 72 Grafit S° 298= 5. 7 J/K

Razumevanje entropije… • Makroskopski pogled: Toplota

Razumevanje entropije… • Mikroskopski pogled: mera neuređenosti Čvrsto Tečno Neuređenost, haotičnost Entropija Gas

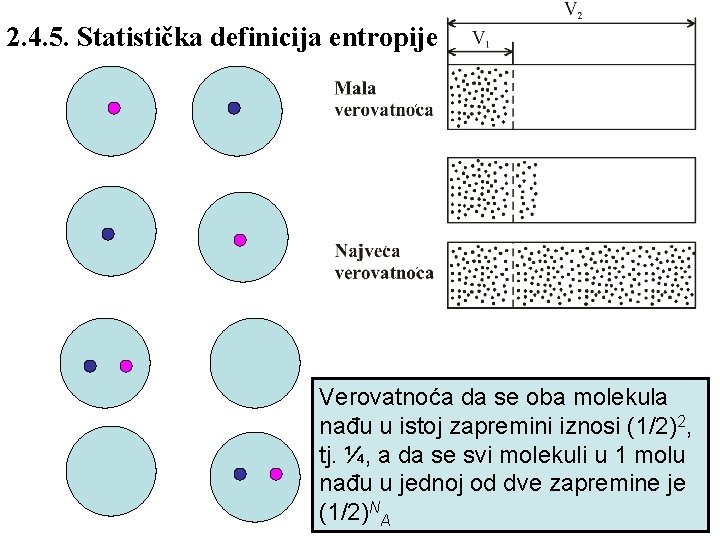
2. 4. 5. Statistička definicija entropije Verovatnoća da se oba molekula nađu u istoj zapremini iznosi (1/2)2, tj. ¼, a da se svi molekuli u 1 molu nađu u jednoj od dve zapremine je (1/2)NA

Makroskopska priroda II zakona Samo je 1 stanje (12, 5 %) u kojima su svi molekuli u istom balonu od od 8 mogućih stanja- . Najverovatnije stanju u kome su molekuli raspoređeni u oba balona.

Termodinamička verovatnoća v. Spontani procesi predstavljaju prelaz sistema iz manje verovatnog u više verovatno stanje. v Entropija je u funkcionalnoj vezi sa termodinamičkom verovatnoćom tog stanja, W: S = f (W) v. Termodinamička verovatnoća stanja sistema predstavlja ukupan broj načina na koji se dati sistem u određenom termodinamičkom stanju može ostvariti prema broju načina na koje se mogu ostvariti sva stanja koja su za dati sistem moguća. v W se može definisati i kao broj mikroskopski različitih konfiguracija sistema, koje sistem može da zauzme, a da se ne oseti makroskopska razlika v. Richard Feynman: ”Mi merimo ”nered” brojem načina na koje se sistem ima urediti, a da spolja izgleda isto”

Entropija-statistička definicija S 1 W 1 S 2 W 2 S 12 W 12 S = kln. W + b b=0 S=kln. W k-Bolcmanova konstanta, k=R/NA=1, 38· 10 -23 J/K

Entropija-statistička definicija • Ludwig Boltzmann je prvi jasno razumeo značaj neredaneuređenosti u razumevanju hemijskih i fizičkih procesa. • Entropija (S): mera neuređenosti sistema. Ludwig Boltzmann 1844 – 1906 S = k log W

Određivanje Entropije • Metode određivanja entropije: • Poziciona neuređenost S = k ln mogući rasporedi sistema; priroda favorizuje najveći broj rasporeda (najveći nered) S = R ln Vf/Vi (1 mol idealnog gasa) S = R ln Pi/Pf Širenje, porast zapremine je spontan proces

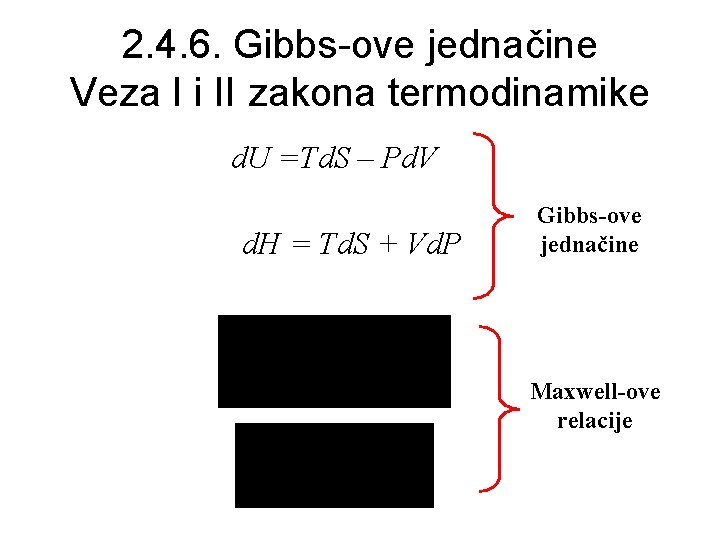
2. 4. 6. Gibbs-ove jednačine Veza I i II zakona termodinamike d. U =Td. S – Pd. V d. H = Td. S + Vd. P Gibbs-ove jednačine Maxwell-ove relacije
 1.zakon termodinamike
1.zakon termodinamike Prvi zakon termodinamike
Prvi zakon termodinamike Adijabatski procesi
Adijabatski procesi Rad pri sirenju gasa
Rad pri sirenju gasa Cv termodinamica
Cv termodinamica Srednja brzina molekula
Srednja brzina molekula Zakoni termodinamike
Zakoni termodinamike Izohora
Izohora Zakoni termodinamike
Zakoni termodinamike Entalpija
Entalpija Elektronski potpis
Elektronski potpis Zakoni odrzanja
Zakoni odrzanja Site:slidetodoc.com
Site:slidetodoc.com Periodick
Periodick Lenzův zákon
Lenzův zákon Mozlijev zakon
Mozlijev zakon Elastična sila zadaci
Elastična sila zadaci Ohmův zákon graf
Ohmův zákon graf Impuls
Impuls 3. keplerov zakon
3. keplerov zakon Zakon o mpp
Zakon o mpp Ultravioletna katastrofa
Ultravioletna katastrofa 18 grupa periodnog sistema elemenata
18 grupa periodnog sistema elemenata Kontinualni spektar
Kontinualni spektar Zakon o zemljišnim knjigama stari
Zakon o zemljišnim knjigama stari Fikov zakon
Fikov zakon Zakon o budžetskom sistemu
Zakon o budžetskom sistemu Zakoni zracenja apsolutno crnog tela
Zakoni zracenja apsolutno crnog tela Lambert beerov zakon
Lambert beerov zakon кирхофов закон
кирхофов закон Najbolji provodnik toplote
Najbolji provodnik toplote První newtonův zákon
První newtonův zákon Kpp zakon
Kpp zakon Yerkes dodsonův zákon
Yerkes dodsonův zákon Vztlaková síla příklady a řešení
Vztlaková síla příklady a řešení Zkony
Zkony Zakon hereditarnosti
Zakon hereditarnosti Mechanika plynů
Mechanika plynů Hookeov zakon
Hookeov zakon Príčinou hydrostatického tlaku v kvapaline je
Príčinou hydrostatického tlaku v kvapaline je Pascalův zákon využití
Pascalův zákon využití Výnimky rytmického krátenia
Výnimky rytmického krátenia Furijeov zakon
Furijeov zakon Fickov zakon
Fickov zakon Zakon o odrzanju mase
Zakon o odrzanju mase Hydrostatická tlaková síla
Hydrostatická tlaková síla Božji zakon u životu židovskog dječaka
Božji zakon u životu židovskog dječaka Zakon radioaktivnog raspada
Zakon radioaktivnog raspada Zakon o informacijskoj sigurnosti
Zakon o informacijskoj sigurnosti Kako glasi zakon o očuvanju mase
Kako glasi zakon o očuvanju mase Zakon o rešavanju sukoba zakona
Zakon o rešavanju sukoba zakona Zakona o fiskalizaciji u prometu gotovinom
Zakona o fiskalizaciji u prometu gotovinom Zakon o sistemu obrazovanja i vaspitanja
Zakon o sistemu obrazovanja i vaspitanja Objavitel radioaktivity
Objavitel radioaktivity Zákon tří jednot
Zákon tří jednot Deformácia pevného telesa
Deformácia pevného telesa Yerkes dodsonův zákon
Yerkes dodsonův zákon Zákon rastúcej ponuky
Zákon rastúcej ponuky Vektor magnetizacije
Vektor magnetizacije Ohm zakon
Ohm zakon Vztlaková síla vzorec
Vztlaková síla vzorec Gradbeni zakon gz-1
Gradbeni zakon gz-1 Odraz svetla
Odraz svetla 1 newtonov zakon
1 newtonov zakon Zakon o izdavanju računa
Zakon o izdavanju računa Napuljska mafija
Napuljska mafija Yerkes dodsonův zákon
Yerkes dodsonův zákon