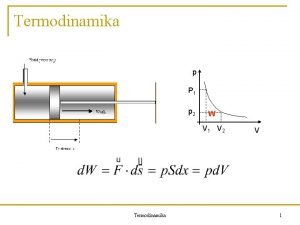
Termodinamika Medicina 201718 1 Kratka povijest Stara Grka

























































- Slides: 71

Termodinamika Medicina 2017/18. 1

Kratka povijest �Stara Grčka – toplina mjera kvalitete � 1592. – Gallilei termoskop � 1620. – Bacon termometar � 1665. – Stalne točke �Niclolas Sadi Carnot – 1824. Reflections on the Motive Power of Fire ◦ Termodinamički kružni procesi �Joules - magnetoelektricitet 2

Rječnik pojmova �Sustav ◦ Dio prirode koji se promatra �Stvarna granica �Zamišljena granica ◦ Sustav i okolina čine svemir �Sustav se definira prema tome što može preći granicu 3

Rječnik pojmova �Otvoreni – plin koji se širi iz boce �Zatvoreni – zatvorena posuda s vrućom vodom �Izolirani – termo-boca 4

Rječnik pojmova �Sustav je od okoline odvojen granicom ◦ ◦ ◦ Adijabatska Dijatermalna Nepropusna Polu propusna 5

Termodinamički parametri �Intenzivni – čija fizička svojstva ne ovise o veličini sustava ◦ Temperatura ◦ Indeks loma ◦ Gustoća �Ekstenzivni – ovise o veličini sustava ◦ Unutarnja energija ◦ Volumen ◦ Masa 6

Termodinamička ravnoteža �Svojstva sustava u termodinamičkoj ravnoteži su nepromjenjena u vremenu ◦ Unutar sustava postoji izmjena energije �Staionarno stanje – parametri sustava se ne mijenjaju tijekom vremena iako sustav s okolinom izmjenjuje energiju 7

Funkcija stanja �Funkcija stanja – ovisi samo o parametria u konačnom i početnom stanju sustava ◦ Ne ovisi o putu ili načinu izvođenja procesa �Procesna funkcija – ovisi o načinu na koji je sustav došao iz početnog u konačno stanje 8

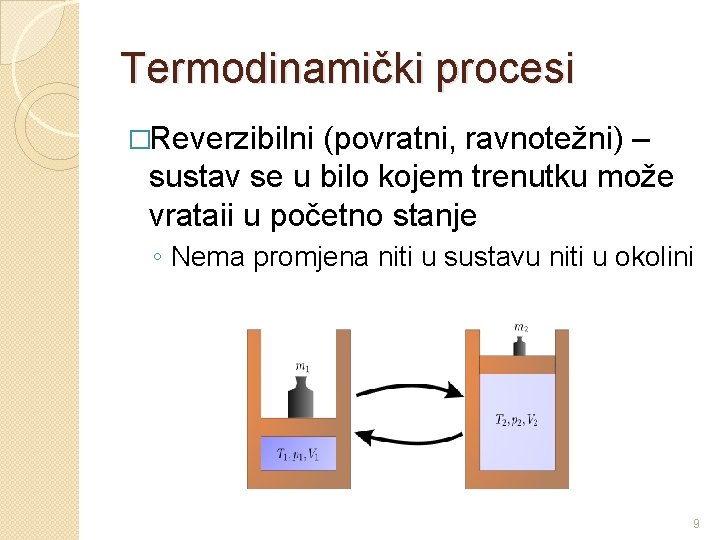
Termodinamički procesi �Reverzibilni (povratni, ravnotežni) – sustav se u bilo kojem trenutku može vrataii u početno stanje ◦ Nema promjena niti u sustavu niti u okolini 9

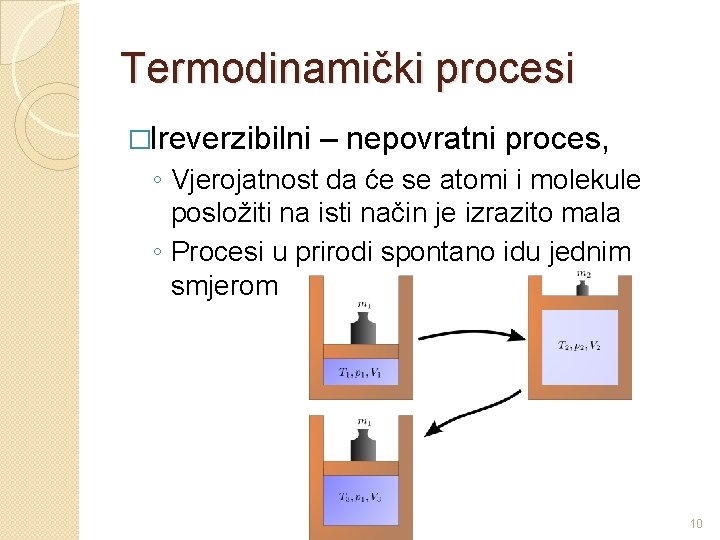
Termodinamički procesi �Ireverzibilni – nepovratni proces, ◦ Vjerojatnost da će se atomi i molekule posložiti na isti način je izrazito mala ◦ Procesi u prirodi spontano idu jednim smjerom 10

11

Unutarnja energija �Zbroj kinetičkih i potencijalnih energija svih molekula sustava �Može se promijeniti: ◦ Zagrijavanjem sustava ◦ Izvođenjem rada na sustavu ◦ Dodavanjem ili uzimanjem tvari 12

Sadržaj unutarnje energije monoatomni molekularni plin tekućina ili čvrstina ovaj doprinos jako varira za različite tvari jako velik za vodu translacijska kinetička energija rotacija i vibracija potencijalna energija intermolekularnih sila 13

Toplina i temperatura �Toplina - dio unutarnje energije tijela koju razmijenjuju sustavi međusobno ili s okolinom �Temperatura - određuje stanje termodinamičke ravnoteže sustava �Ako TMD sustav nije u ravnoteži (različite temperature), toplina prelazi sa zagrijanijih dijelova na hladnije dok se temperatune ne izjednače 14

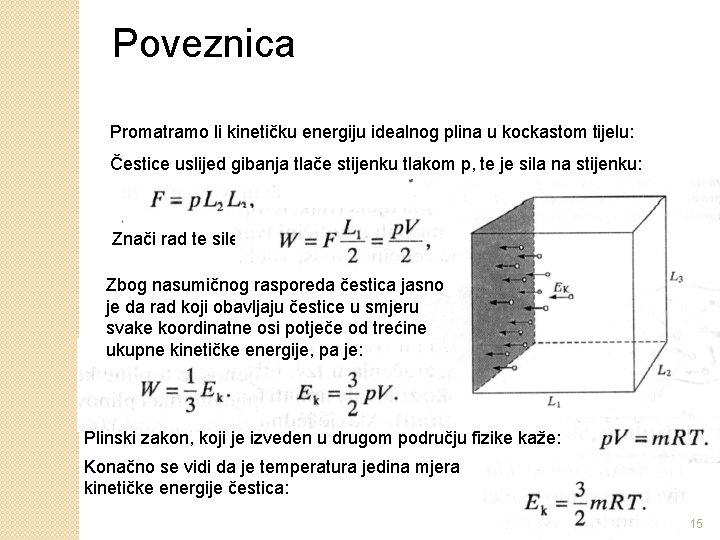
Poveznica Promatramo li kinetičku energiju idealnog plina u kockastom tijelu: Čestice uslijed gibanja tlače stijenku tlakom p, te je sila na stijenku: Znači rad te sile je: Zbog nasumičnog rasporeda čestica jasno je da rad koji obavljaju čestice u smjeru svake koordinatne osi potječe od trećine ukupne kinetičke energije, pa je: Plinski zakon, koji je izveden u drugom području fizike kaže: Konačno se vidi da je temperatura jedina mjera kinetičke energije čestica: 15

Dvije posude sadrže jednake količine vode. U jednoj je temperatura vode 20°C, a u drugoj 80°C. U kojoj posudi voda ima veću unutrašnju energiju? Rj, U posudi s vodom koja ima višu temperaturu 16

Što je jednako a što različito za 1 gram vode na 00 C i 1 g bakra na 00 C ? q jednaka temperatura - jednaka prosječna kinetička energija molekula q nisu jednake unutarnje energije q nisu jednaki toplinski kapaciteti c (vode) = 4186 J/kg K c (bakra) = 386 J/kg K Zašto? q unutarnja energija = translacijska kinetička energija + vibracijska i rotacijska kinetička energija + potencijalna energija od intermolekularnih sila 17

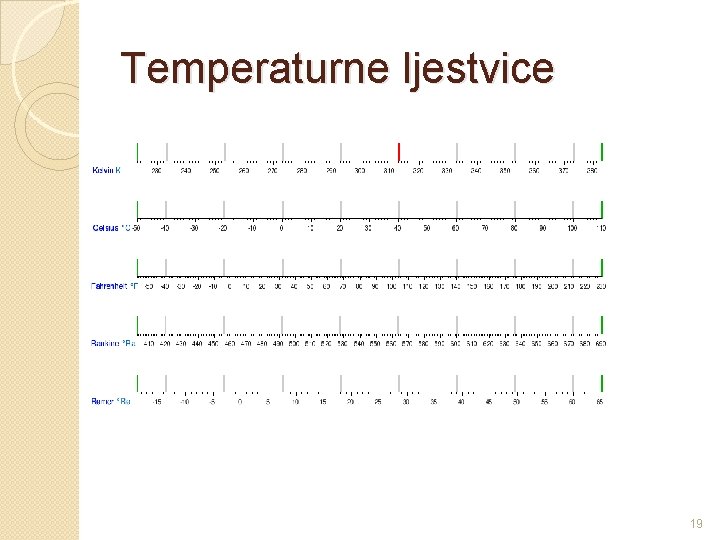
Temperaturne ljestvice � 18

Temperaturne ljestvice 19

Termometar �Uređaj kojim se mjeri temperatura 20

Termodinamički zakoni �Nulti – ako je sustav A u termičkoj ravnoteži sa sustavom C, i sustav B sa sustavom C, onda su i sustav A i B u termičkoj ravnoteži ◦ Potreban za matematičku formulaciju termodinamike 21

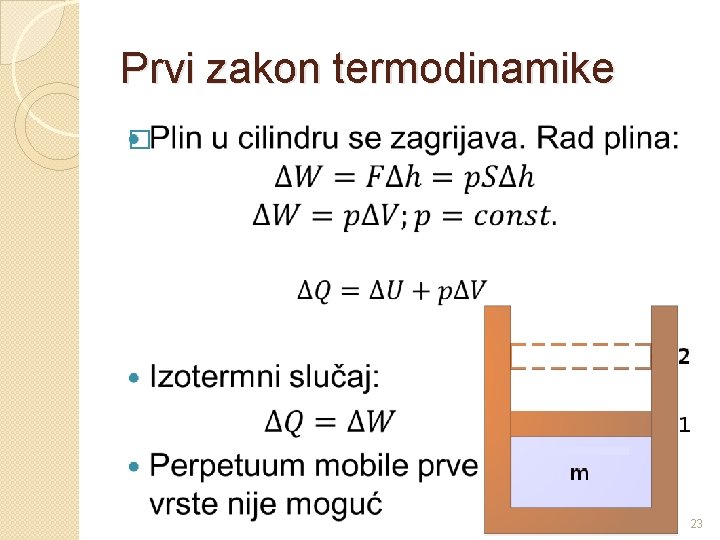
Prvi zakon termodinamike �Dovede li se sustavu neka količina topline (Q), sustavu se poveća unutarnja energija za ΔU i sustav izvrši rad W �Toplina je pozitivna ako se dovodi sustavu, a negativna ako se odvodi. �Rad je pozitivan ako sustav vrši rad, a negativan ako okolina vrši rad 22

Prvi zakon termodinamike � 23

�Kolika je promjena unutrašnje energije sustava kojem predamo 1676 J topline i istodobno obavimo na njemu rad 838 J? Rj, 2, 514 k. J �Kolikoj toplini je ekvivalentan rad što ga u jednom satu obavi dizalica koja ima snagu 735 W? Rj, 2, 646 MJ 24

Drugi zakon termodinamike �Toplina ne može sama od sebe prelaziti s tijela niže na tijelo više temperature ◦ Entropija Svemira stalno raste ◦ Određuje smjer spontanih interakcija �U prirodi bilo koji uređeni sustav spontano teži neuređenosti, odnosno stanju s manjim stupnjem uređenosti 25

Drugi zakon termodinamike �There have been nearly as many formulations of the second law as there have been discussions of it. �Perpeetum mobile druge vrste – nije moguće svu dovedenu toplinu pretvoriti u mehanički rad 26

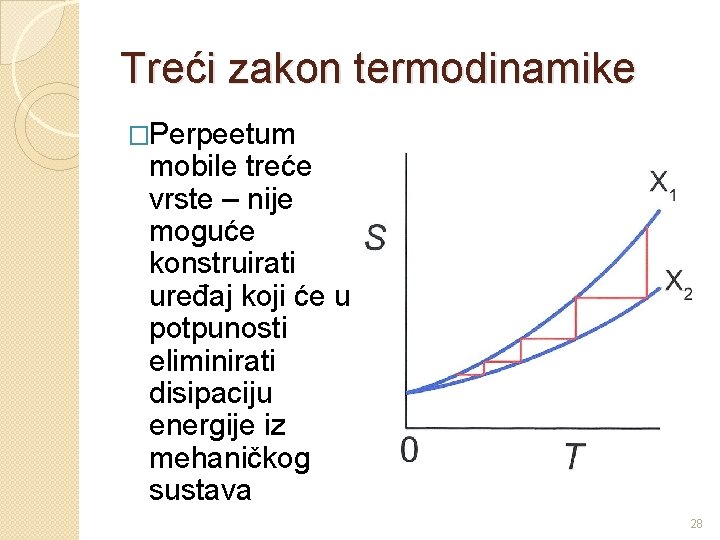
Treći zakon termodinamike �Pri apsolutnoj nuli nestaju razlike entropija između svih stanja koja su u unutrašnjoj termodinamičkoj ravnoteži �Nije moguće konačnim brojem procesa sniziti temperaturu bilo kojeg sustava na 0 K 27

Treći zakon termodinamike �Perpeetum mobile treće vrste – nije moguće konstruirati uređaj koji će u potpunosti eliminirati disipaciju energije iz mehaničkog sustava 28

Entropija �Mjera stupnja uređenosti sustava ◦ Uređeni sustav – niska entropija ◦ d. Q – toplina dovedena sustavu; ◦ Tspr – temperatura spremnika �ΔS(reverzibilni kružni proces)=0 �ΔS(ireverzibilni kružni proces)>0 29

Entropija u kemijskoj termodinamici �Promjena entropije opisuje smjer i veličinu promjene u reakciji �Korisno je specificirati entropiju kao intenzivnu veličinu, odnosno karakteristiku proučavanog sustava (J/kg-1 K-1, J/mol-1 K-1) 30

31

Entalpija �Termodinamički potencijal koji se sastoji od promjene unutrašnje energije i volumnog rada �Budući su U, p i V funkcije stanja , i H je funkcija stanja 32

33

Gibbsova slobodna energija �Slobodna entalpija �Najveći iznos mehaničkog rada koji se može dobiti iz supstance u početnom stanju, bez povećavanja ukupnog volumena i prolaska topline �Maksimalni iznos rada koji se može dobiti iz zatvorenog sustava 34

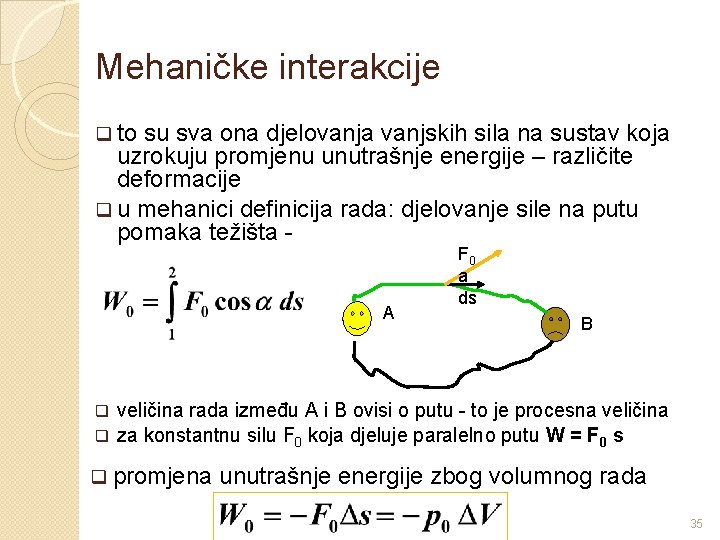
Mehaničke interakcije q to su sva ona djelovanja vanjskih sila na sustav koja uzrokuju promjenu unutrašnje energije – različite deformacije q u mehanici definicija rada: djelovanje sile na putu pomaka težišta - A F 0 a ds B veličina rada između A i B ovisi o putu - to je procesna veličina q za konstantnu silu F 0 koja djeluje paralelno putu W = F 0 s q q promjena unutrašnje energije zbog volumnog rada 35

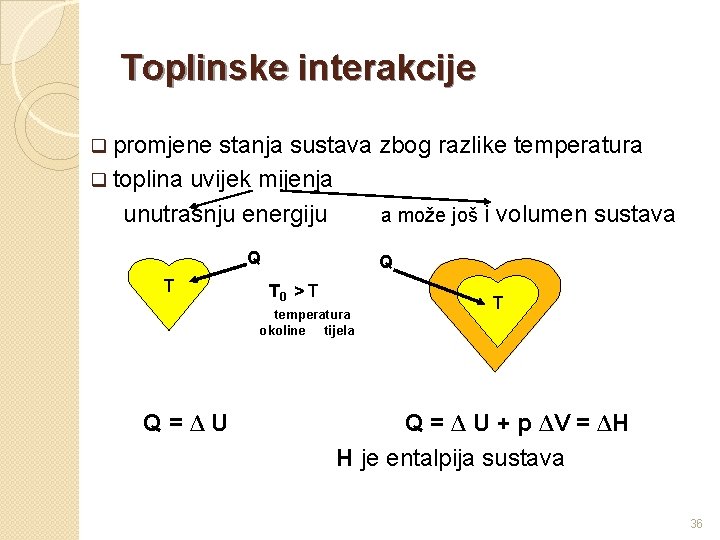
Toplinske interakcije q promjene stanja sustava zbog razlike temperatura q toplina uvijek mijenja unutrašnju energiju a može još i volumen sustava Q T 0 > T temperatura okoline tijela Q=ΔU T Q = Δ U + p ΔV = ΔH H je entalpija sustava 36

TOPLINSKO RASTEZANJE TVARI Promjenom temperature svim se tijelima mijenja obujam, ovisno o tvari. Primjer štapa. Ako se povišenjem temperature Δt duljina štapa poveća za Δl, ukupna duljina štapa je Rastezanje štapa će ovisiti o početnoj duljini i promjeni teperature, uz konstantu proporcionalnosti α, koji se naziva toplinska rastezljivost, te je: 37

�Štap od platine pri 20°C dugačak je 998 mm. Pri kojoj će temperaturi štap biti dugačak 1 m? Rj 243°C �Eiffelov toranj visok je 300 m pri 0°C. Pri kojoj će temperaturi toranj biti 10 cm viši? Rj 28°C 38

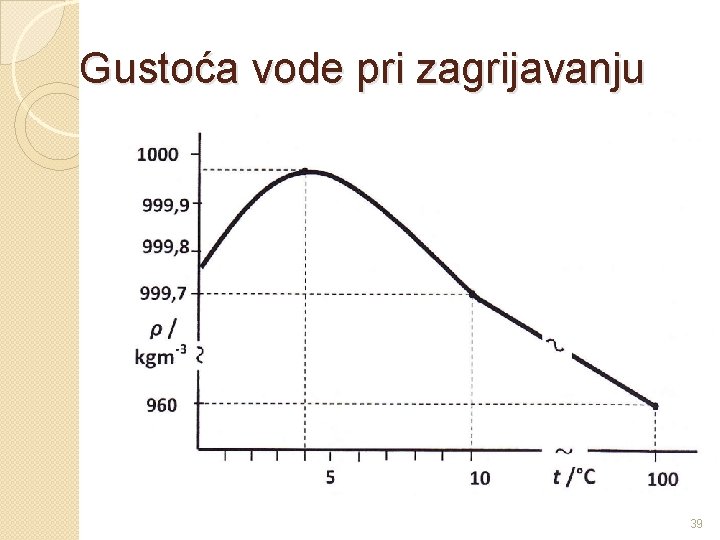
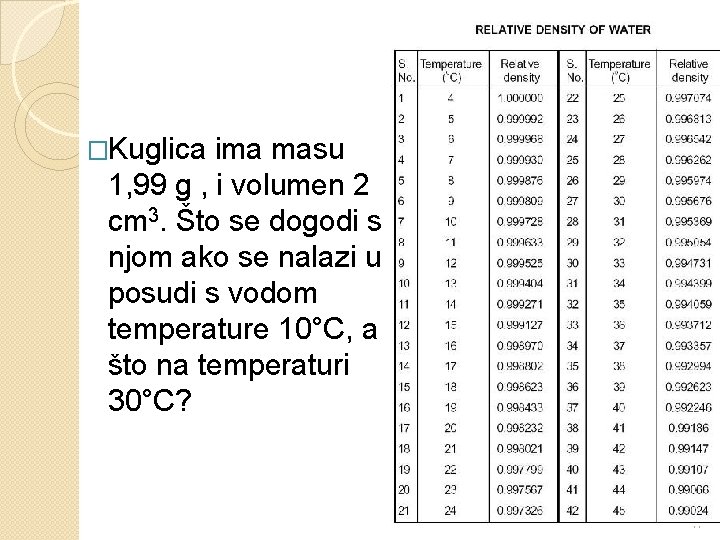
Gustoća vode pri zagrijavanju 39

40

�Kuglica ima masu 1, 99 g , i volumen 2 cm 3. Što se dogodi s njom ako se nalazi u posudi s vodom temperature 10°C, a što na temperaturi 30°C? 41

Agregatna stanja �Plinovito �Tekuće �Čvrsto �Plazma 42

Posljedice toplinske interakcije 1. promjena q temperature sustava: Q = m c ΔT c – specifični toplinski kapacitet tvari – energija potrebna da se temperatura sustava mase od 1 kg promijeni za 1 stupanj 2. promjena agregatnog stanja: Q = q ΔH = Δm Lp, T- latentna toplina prijelaza – energija potrebna da masa 1 kg latentna toplina prijelaza promijeni fazu pri stalnom tlaku i na stalnoj temperaturi 3. kemijske reakcije – egzogene i endogene – toplina se oslobađa iz sustava ili ulazi u sustav ovisno o energiji stanja sudionika u reakciji 43

�Komadu bakra mase 3, 5 kg temperature 170°C hlađenjem snizimo unutrašnju energiju za 1, 6*105 J. Do koje se temperature ohladio komad bakra? Rj, t 50°C �Kolika energija je potrebna da 100 g alkohola na temperaturi 78. 3 °C ispari? Rj, Q = 85, 5 k. J 44

Dijagram zagrijavanja vode 45

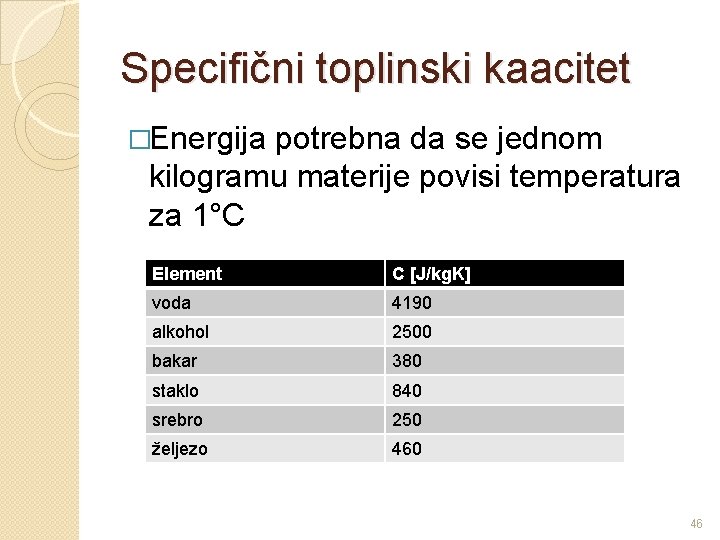
Specifični toplinski kaacitet �Energija potrebna da se jednom kilogramu materije povisi temperatura za 1°C Element C [J/kg. K] voda 4190 alkohol 2500 bakar 380 staklo 840 srebro 250 željezo 460 46

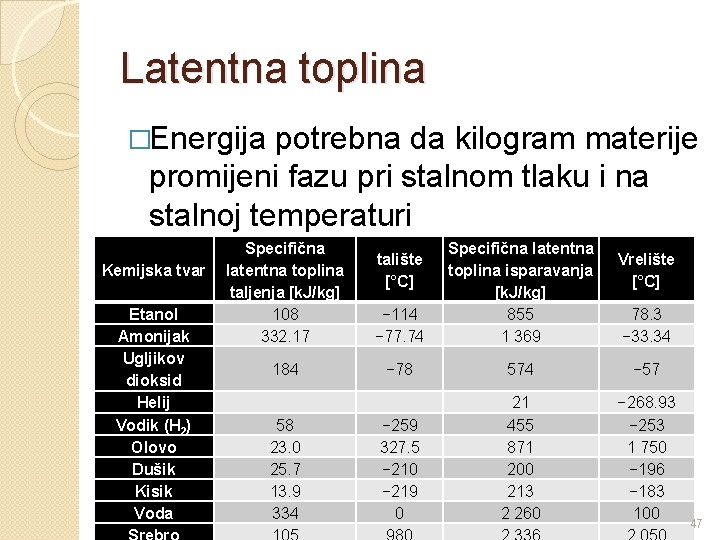
Latentna toplina �Energija potrebna da kilogram materije promijeni fazu pri stalnom tlaku i na stalnoj temperaturi Kemijska tvar Etanol Amonijak Ugljikov dioksid Helij Vodik (H 2) Olovo Dušik Kisik Voda Specifična latentna toplina taljenja [k. J/kg] 108 332. 17 − 114 − 77. 74 Specifična latentna toplina isparavanja [k. J/kg] 855 1 369 184 − 78 574 − 57 58 23. 0 25. 7 13. 9 334 − 259 327. 5 − 210 − 219 0 21 455 871 200 213 2 260 − 268. 93 − 253 1 750 − 196 − 183 100 talište [°C] Vrelište [°C] 78. 3 − 33. 34 47

Dijagram stanja (fazni dijagram) �Pokazuje ravnotežno stanje zatvorenog sustava uz određene vrijednosti tlaka i temperature �Trojna točka određuje ravnotežu triju faza �Krivulje taljenja isparavanja i sublimacije 48

Fazni dijagram vode 49

50

Prijenos topline �Kondukcija ili vođenje �Konvekcija ili prenošenje �Iradijacija ili zračenje �Evaporacija ili isparavanje 51

Kondukcija �Prelazak topline u nekom tijelu s dijela tijela više temperature na dio tijela niže temperature �Količina prenesene enregije je veća što je veća razlika u temperaturama �Hvo – brzina prijenosa; S – presjek; l – duljina; T 1 i T 2 – temperature; kvo – konstanta toplinske vodljivosti 52

Konvekcija �Zagrijavanje -> širenje -> smanjenje gustoće =>konvekcijska cirkulacija �Hladni dijelovi nprekidno zamjenjuju toplije �tt i tf – temperature tijela i fluida; S – presjek; kpr – konstanta prijenosa 53

Radijacija �Tijelo više temperature predaje tijelu niže temperature energiju �Tijelo niže temperature tu energiju apsorbira �Sva tijela zrače energiju u obliku elektromagnetskih valova �e – koeficijent emisije; σ – Stefan- Boltzmannova konstanta 54

Isparavanje �Izlaskom molekula sa velikom kinetičkom energijom iz tekućine smanjuje se prosječna kinetička energija molekula koje ostaju, a time i temperatura �qi – specifična toplina isparavanja 55

Gibbsova energija i kemijski potencijal �Za ravnotežne izotermne i izobarne toplinske procese u zatvorenom sustavu vrijedi: �Iz toga slijedi �p, V = const. �Gibbsova energija 56

�Reverzibilne reakcije ΔG=0 �Promjena entalpije sustava kompenzirana promjenom entropije �Gibbsova energija je onaj dio entalpije koji se može iskoristiti za obavljanje rada 57

Ireverzibilni procesi �Neravnotežni spontani procesi idu u smjeru smanjenja Gibbsove energije do minimalne vrijednosti 58

Kemijski potencijal �Energija potrebna da se prenese 1 mol tvari 59

Mehaničke interakcije i Gibbsova slobodna energija �Spontani su samo oni procesi gdje je ΔS>0 pa je ΔG<0 i ΔW<0 �Sustav spontano izvodi rad prema okolini �U biološkim sustavima W=VΔp 60

�Pretpostavka p. V=n. RT G 0 – Standardna Gibbsova energija za homogeni sustav 61

�Kod razmatranja parcijalnih tlakova otopljnih čestica u razrijeđenim otopinama: 62

Difuzija �Proces prodiranja jedne tvari među čestice druge tvari �Nasumično translatorno gibanje molekula u fluidima �Sudaranje molekula => brzina difuzije ~ gradijent koncentracije (Δc/ Δx) ◦ Δc je razlika koncentracije na nekoj udaljenosti Δx �Fickov zakon: 63

�D – koeficijent difuzije S – presjek; ΔN – broj molekula �Negativan predznak => smjer difuzije je suprotan smjeru porasta koncentracije �Veća temperatura => više gibanja => brža difuzija �Brže se odvija u plinovima nego u tekućinama �https: //www. youtube. com/watch? v=Bz 02 z 4 GSS 0 k 64

�I. Fickov zakon se često piše u diferencijalnom obliku Δx → 0 Δt → 0 �Tok tvari: �I. Fickov zakon: 65

�Kod stacionarne difuzije prisutan je stalni tok čestica, a da se pritom ne mijenja gradijent koncentracije. �Potreban je proces izvan sustava koji će održavati gradijent koncentracije → aktivni trasport → biološki sustavi su otvoreni �aktivni transport je definiran kao pozitivni rad. �Kod nestacionarne difuzije koncentracija ovisi i o prostoru i o vremenu. Protok čestica dovodi do izjednačavanja koncentracija u sistemu. �II. Fickov zakon: 66

Koeficijent difuzije �Fickov zakon ne govori nista o ovisnosti brzine difuzije o temperaturi, veličini čestica ili svojstvima medija. �Te ovisnosti su sadržane u koeficijentu difuzije D (Stokes Einsteinova formula): ◦ Za slučaj kada su čestice kugle radijusa r, koje difundiraju kroz sredstvo viskoznosti η 67

Osmoza �Selektivna difuzija – kroz polupropusne menbrane �Voda 0, 38 nm; Glukoza 0, 88 nm �Efektivna osmotska koncentracija (o): �Osmotski tlak koji proizvodi čisto otapalo na membranu odjeljka u kojem se nalazi otopljena tvar: 68

�https: //www. youtube. com/watch? v=Sr ON 0 n. EEWmo 69

Vrste otopina �Razlika između osmotskih tlakova s unutarnje i vanjske strane membrane mjera je za količinu protokavode kroz membranu ◦ Izotonična otopina – vanjska i unutarnja koncentracija su jednake ◦ Hipertonična – vanjska koncentracija veća od unutarnje – stanica se isušuje ◦ Hipotpnične – vanjska manja od unutarnje – stanica bubri 70

Nernstova jednadžba c 1 i c 2 koncntracije iona unutar i izvan membrane; F – Faradejeva konstanta 71
 Ahejci
Ahejci јонски устанак
јонски устанак Srdžbu mi boginjo pjevaj
Srdžbu mi boginjo pjevaj 10 božjih zapovedi stara zaveza
10 božjih zapovedi stara zaveza Rusija zastava i grb
Rusija zastava i grb Stara pravda kmečki upori
Stara pravda kmečki upori Lime stara zagora
Lime stara zagora Wargawa stara
Wargawa stara Cechy architektury greckiej
Cechy architektury greckiej Smš sb
Smš sb Flaga i herb niemiec
Flaga i herb niemiec Stará kovadlina
Stará kovadlina Niko grafenauer peki besedilo
Niko grafenauer peki besedilo Cywilizacja helleńska
Cywilizacja helleńska Zgradba svetega pisma
Zgradba svetega pisma Le vkup uboga gmajna pomen
Le vkup uboga gmajna pomen Stara wartownia borne sulinowo
Stara wartownia borne sulinowo Blazno resno o šoli kratka obnova
Blazno resno o šoli kratka obnova Basna je
Basna je Bobi obnova
Bobi obnova Neviazana rec
Neviazana rec Kratka osebna predstavitev primer
Kratka osebna predstavitev primer Majdanpek slike
Majdanpek slike Krátká úvaha o přátelství
Krátká úvaha o přátelství Kratka basen o jablku
Kratka basen o jablku Ivan andrejevič krylov vrána a liška
Ivan andrejevič krylov vrána a liška Versovany utvar
Versovany utvar Nominativ pitanja
Nominativ pitanja Literární pojmy test
Literární pojmy test Martin krpan opis osebe
Martin krpan opis osebe Ekg 50 mm/s 1 kratka
Ekg 50 mm/s 1 kratka Zakoni termodinamike
Zakoni termodinamike Rozpočítadlo petrklíč
Rozpočítadlo petrklíč Kratka osnova horvatsko slavenskog pravopisanja
Kratka osnova horvatsko slavenskog pravopisanja Dimitrij ivanovič mendelejev
Dimitrij ivanovič mendelejev Lyriku
Lyriku Proses termodinamika adalah
Proses termodinamika adalah Hemijska termodinamika
Hemijska termodinamika Hukum 2 termodinamika
Hukum 2 termodinamika Aplikasi hukum termodinamika 2
Aplikasi hukum termodinamika 2 Pengertian hukum 2 termodinamika
Pengertian hukum 2 termodinamika Hukum pertama termodinamika
Hukum pertama termodinamika Termodinamika főtételei
Termodinamika főtételei Hukum termodinamika disebut juga sebagai
Hukum termodinamika disebut juga sebagai Carnot körfolyamat
Carnot körfolyamat Termodinamika
Termodinamika Adijabatski procesi
Adijabatski procesi Hukum ke nol termodinamika
Hukum ke nol termodinamika Termodinamika teknik kimia
Termodinamika teknik kimia Strojarski računalni tehničar oroslavje
Strojarski računalni tehničar oroslavje Hukum termodinamika 1
Hukum termodinamika 1 Hukum termodinamika 2
Hukum termodinamika 2 Hukum 2 termodinamika
Hukum 2 termodinamika Termodinamik sistema
Termodinamik sistema Termodinamika főtételei
Termodinamika főtételei Termodinamika
Termodinamika Entalpia cp
Entalpia cp Hukum termodinamika 1
Hukum termodinamika 1 Termokimia dan termodinamika
Termokimia dan termodinamika Hukum 1 termodinamika
Hukum 1 termodinamika Termodinamika főtételei
Termodinamika főtételei Contoh soal termodinamika untuk mahasiswa
Contoh soal termodinamika untuk mahasiswa Cp termodinamika
Cp termodinamika Kolloidok
Kolloidok Konsep dasar termodinamika
Konsep dasar termodinamika Reaksi spontan termodinamika
Reaksi spontan termodinamika Drugi svjetski rat ispit
Drugi svjetski rat ispit Povijest hrvatskog jezika 7 razred
Povijest hrvatskog jezika 7 razred Druga industrijska revolucija 7 razred
Druga industrijska revolucija 7 razred Proceduralno znanje povijest
Proceduralno znanje povijest Povijest hrvatskog jezika od 16. do 18. stoljeća
Povijest hrvatskog jezika od 16. do 18. stoljeća Povijest 8 razred kviz
Povijest 8 razred kviz