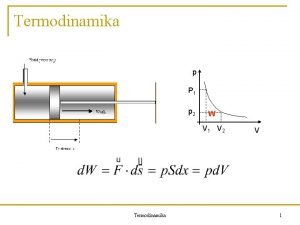
I zakon termodinamike CP m CV m R



















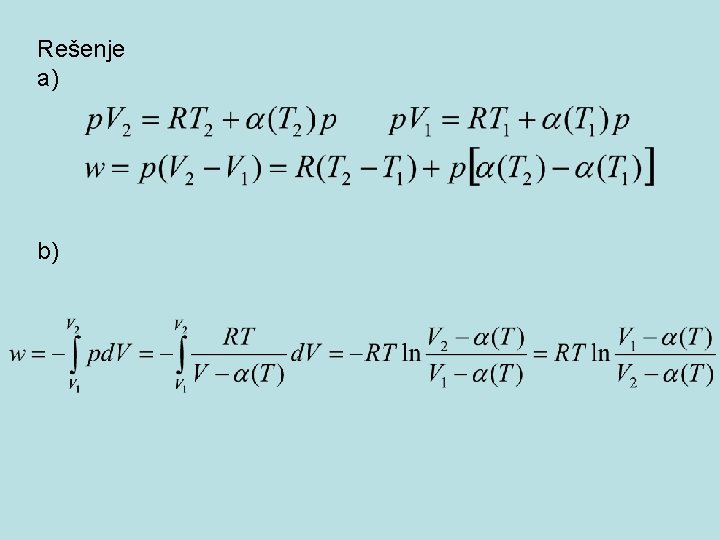















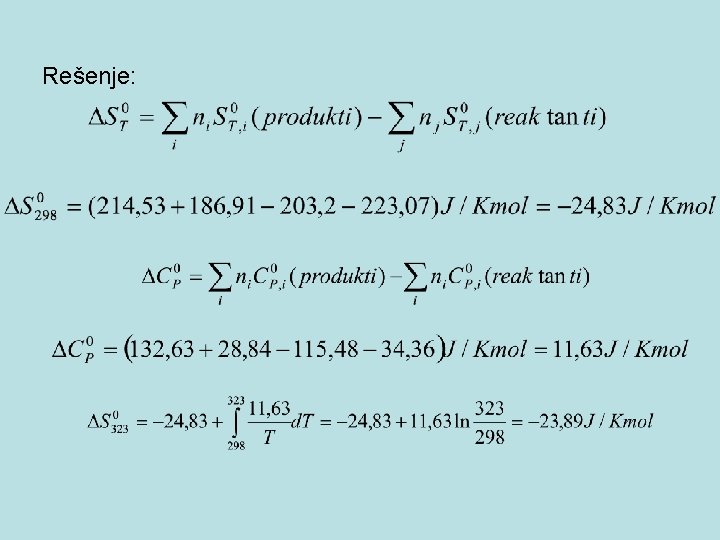
















- Slides: 56

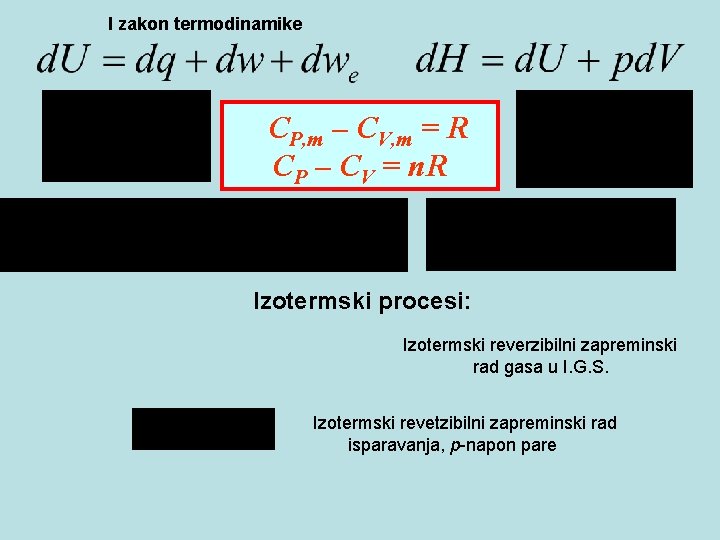
I zakon termodinamike CP, m – CV, m = R CP – CV = n. R Izotermski procesi: Izotermski reverzibilni zapreminski rad gasa u I. G. S. Izotermski revetzibilni zapreminski rad isparavanja, p-napon pare

Adijabatski procesi: Adijabatski zapreminski rad Jednačina adijabate

ZADATAK 1. Jedan mol gasa prelazi iz stanja sa pritiskom P 0 i zapreminom V 0 u stanje sa duplo većom zapreminom i pritiskom. Na p-V dijagramu taj proces je predstavljen pravom linijom. Koliki rad izvrši gas u tom procesu? a)Po. V 0 b) Po. V 0/2 c) 3 Po. V 0/2 d) 2 Po. V 0 e) 3 Po. V 0 f) ne znam P Rešenje: 2 2 Po Po 1 Vo 2 Vo V

ZADATAK 2. 7. U termodinamičkom procesu promena unutrašnje energije sistema je ∆U = -300 J, sistem prima toplotu od 100 J i širi se nasuprot pritiska od 1 bar. Kolika je promena zapremine (L)? a) 2 b) 3 c) 4 d) 5 e) 1 f) ne znam Rešenje:

Zadatak 3. • Električni grejač snage 15 W greje masu od 12 g vode tokom jednog minuta. Ako je početna temperatura vode 35 o. C, kolika će biti krajnja temperatura vode? Specifični toplotni kapacitet vode je 1 cal/g • Rešenje: Snaga grejača je: P=ΔU/t. Energija koju grejač oslobađa je: ΔU=P t=15 J/s 60 s=900 J

Zadatak 4. • 1 mol vode isparava. Kolika je promena entalpije ako je pritisak 1 bar? Promena unutrašnje energije pri isparavanju je 40. 7 k. J/mol. Rešenje:

Zadatak 5. Domaći • Koliko energije treba dovesti masi od 1, 35 kg vode da bi se zagrejala od 20 o. C do • temperature ključanja. Pretpostaviti da je Cvs=4, 18 J/g. K?

ZADATAK 6. : Izračunati U za reakciju sagorevanja 1, 0 mola propana na 25 o. C, ako je H=-2058 k. J. Rešenje: C 3 H 8(t)+5 O 2(g) 3 CO 2(g)+4 H 2 O(t) ng=3 -5=-2 U= H- ng. RT=-2058000 J+2 8, 3145 298=-2053 k. J

ZADATAK 7. Izračunati rad širenja pri elektrolizi 50 g vode pri konstantnom pritisku i temperaturi od 25 o. C. Rešenje: 2 H 2 O(t) 2 H 2(g)+O 2(g) w=-Psp V=-Psp(Vk-Vp) -Psp. Vk=

ZADATAK 8. Rad reverzibilnog izotermskog širenja jednog mola gasa u idealnom gasnom stanju od zapremine V 1 do zapremine V 2 je dat izrazom: a) –p(V 2 -V 1) b) –p(V 1 -V 2) c) d) CV(T 2 -T 1) f) ne znam e)

Zadatak 9. • Izračunati napon pare vode na 35 o. C ako se vodena para širi reverzibilno i izotermski od zapremine 5 cm 3 do zapremine 100 cm 3 ako se pri tome vrši rad od 534 m. J. Rešenje: w=-p(V 2 -V 1) w=-0, 534 J p=0, 534 Nm/95 10 -6 m 3=5621 Pa

Zadatak 10. Dva mola idealnog gasa podleže izotermalnoj reverzibilnoj ekspanziji od početne zapremine V 1 do krajnje zapremine 10 V 1 i vrši rad od 41860 J. Ako je početni pritisak 100 bar kolika je početna zapremina (u L) i temperatura (u K)? Rešenje w=n. RTln. V 2/V 1=n. RT· 2, 3 P 1 V 1=n. RT=w/2, 3=41860/2, 3=18200 J V 1=18200/100· 105=1, 82· 10 -3 m 3=1, 82 L n. RT=18200 J, T= 18200/2· 8, 314=1093 K

ZADATAK 11. Rad reverzibilnog adijabatskog širenja jednog mola gasa u idealnom gasnom stanju od zapremine V 1 pri temperaturi T 1 do zapremine V 2 pri temperaturi T 2, je dat izrazom: a) –p(V 2 -V 1) b) –p(V 1 -V 2) c) d) CV(T 1 -T 2) f) e)

ZADATAK 12. Jedan mol idealnog gasa na 300 K se širi adijabatski i reverzibilno od 20 bar do 1 bar. Koja je temperatura u krajnjem stanju gasa pretpostavljajući da je CV=(3/2) R? a) 105, 5 b) 90, 5 c) 205, 6 d)99, 6 Rešenje: e) 111, 0 f) ne znam

ZADATAK 13. : Izračunati krajnji pritisak argona (bar) posle reverzibilnog i adijabatskog širenja pri kome se zapremina poveća dva puta. Početni pritisak je iznosio 100 k. Pa a γAr=5/3. Rešenje: Iz jednačine adijabate se dobija:

ZADATAK 14. Izračunati rad i promenu unutrašnje energije pri adijabatskom širenju 0, 2 mol Ar od 0, 5 do 1, 0 L. Početna temperatura je izosila 25 o. C, a molarni toplotni kapacitet Ar na konstantnoj zapremini iznosi 12, 48 JK-1 mol-1. Rešenje:

ZADATAK 15: Domaći! Dva mola idealnog gasa za koji je Cv, m=5 R/2 je reverzibilno zagrevan do 356 K na konstantnoj zapremini. Početni pritisak i temperatura su bili P 1=111 k. Pa i T 1=277 K. Izračunati krajnji pritisak, U, q i w. Rešenje:

Zadatak 16. Jedan mol idealnog monoatomskog gasa u početku na 10 atm pritisku i temperaturi od 0 o. C širi se izotermski nasuprot pritiska od 1 atm. Uslovi su takvi da je konačna zapremina 10 puta veća od početne, krajnji pritisak je jednak spoljašnjem pritisku. (a) Izračunati početnu i krajnju zapreminu (b) Izračunati q, w, Uza proces. Kako je V 1=2, 24 L to je V 2=22, 4 L Ukupni proces je izotermski pa je U=0. Izvršeni rad je -P V=-1, 013·105 N/m 2 x(0, 0224 -0, 00224)m 3= w=-2042, 2 J, q=2042, 2 J

ZADATAK 17. Na vrlo niskoj temperaturi toplotni kapacitet čvrstih supstancija se može uzeti da je proporcionalan sa T 3, pa se može pisati da je C=a. T 3. Kolika je promena entalpije takve supstancije pri zagrevanju od 0 do temperature T (koja je bliska 0)? Rešenje:

Zadatak 18. • Gas se pokorava jednačini stanja: a) Odrediti reverzibilni rad koji se vrši pri zagrevanju gasa od T 1 do T 2 pri konstantnom pritisku. b) Odrediti reverzibilni izotermski rad pri širenju od V 1 do V 2.
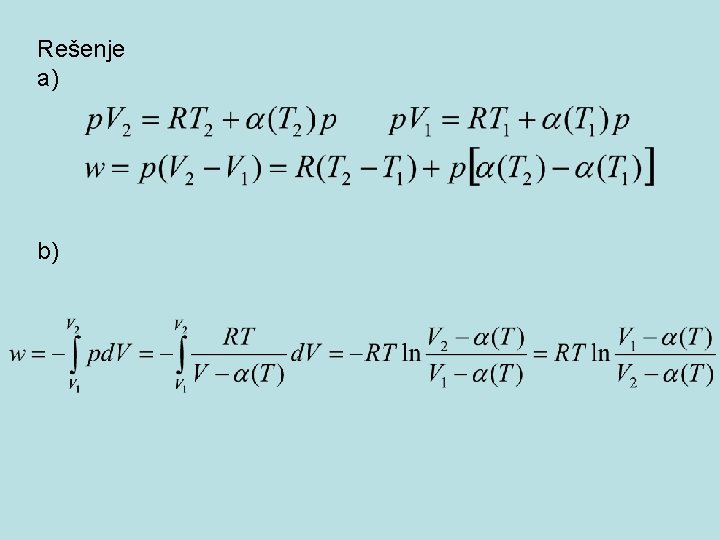
Rešenje a) b)

Zadatak 19. Jedan mol idealnog monoatomskog gasa na početnim P 1=2 atm i T 1=273 K je preveden na pritisak P 2=4 atm reverzibilnim putem definisanim sa P/V=const. Izračunati V 1, V 2 i T 2, U, H, q i w. Rešenje: Iz jedn. id. g. stanja je V 1=11, 2 L. Pošto je P/V=const. to je V 2=22, 4 L. Kombinovanjem P/V=const. sa PV=RT dobija se T/V 2=const. pa je T 2=4 T 1=1092 K U=CV T=(3 R/2)819=10, 21 k. J, H=CP T=17, 022 k. J. Da bi se dobilo w treba odrediti w=∫Pd. V. Iz početnih uslova, P/V=const=2/11, 2=0, 178 atm/L pa je w=0, 178∫Vd. V=0, 089(V 22 -V 12) =0, 089∙ 375=33, 3 Latm ili w=823 cal, q= U+w=3230 cal.

Zadatak 20 Jedan mol idealnog gasa sa CV=20, 93 J/mol step. u početku pri standardnim uslovima prolazi kroz sledeći reverzibilni ciklus: A: izohorsko zagrevanje do dvostruke vrednosti početne temperature od stanja 1 do 2, B: adijabatsko širenje od 2 do 3 do početne temperature C: izotermalnu kompresiju od 3 do 1. Izračunati q, w, ΔU i ΔH za korake A, B i C i za ciklus. Rešenje Korak A: V=const. T=273, 15 K, P=1 bar, w=0, ΔU=qv =CV ΔT= 20, 93·(2 T 1 -T 1)=20, 93· 273, 15=5717 J ii) Korak B: q=0, ΔU=w=CV ΔT=20, 93(T 1 -2 T 1)=-5717 J/mol, ΔH=-7988 J/mol, iii) Korak C: ΔU=0, T 2/T 3=2, V 3/V 2=(T 2/T 3)CV/R , V 2=V 1 w=RT 1 ln. V 3/V 1=RT 1 ln(T 2/T 3) CV/R=CVT 1 2, 303 log 2= 20, 93· 273, 15· 2, 303·log 2=3963, 46 J/mol, q=-3963, 46 J/mol

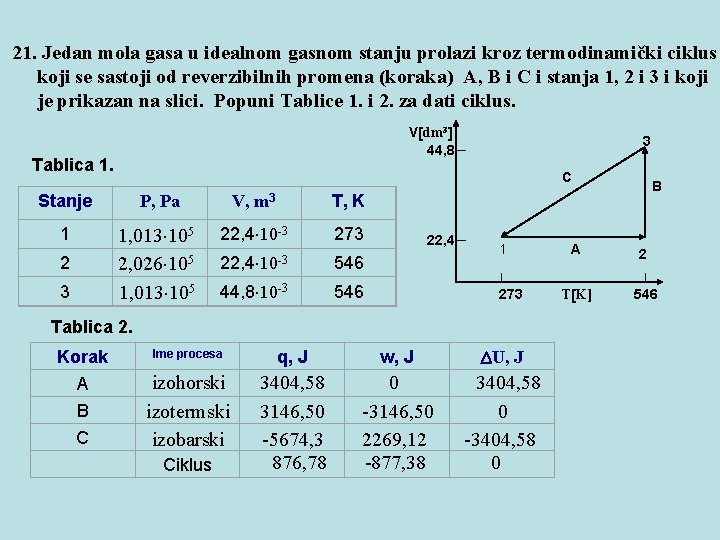
21. Jedan mola gasa u idealnom gasnom stanju prolazi kroz termodinamički ciklus koji se sastoji od reverzibilnih promena (koraka) A, B i C i stanja 1, 2 i 3 i koji je prikazan na slici. Popuni Tablice 1. i 2. za dati ciklus. V dm 3 Tablica 1. C Stanje P, Pa V, m 3 1 5 1, 013 10 5 2, 026 10 5 1, 013 10 22, 4 10 -3 273 22, 4 10 -3 546 44, 8 10 -3 546 2 3 3 44, 8 T, K 22, 4 1 273 Tablica 2. Korak Ime procesa q, J w, J U, J A izohorski izotermski izobarski 3404, 58 3146, 50 -5674, 3 876, 78 0 -3146, 50 2269, 12 -877, 38 3404, 58 0 -3404, 58 0 B C Ciklus B A 2 T K] 546

22. Jedan mol monoatomskog gasa u idealnom gasnom stanju prolazi kroz ciklus koji se sastoji iz tri procesa, što je prikazano na slici. Ispuniti tablice 1 i 2. Tablica 1. Stanje 1 2 3 2 P, atm P, Pa V, m 3 10 -3 T, K 22, 4 101325 202650 101325 2 A 1 B (q=0) 1 C 22, 4 3 V, L Tablica 2. Proces Tip procesa q, J w, J U, J A B C ciklus

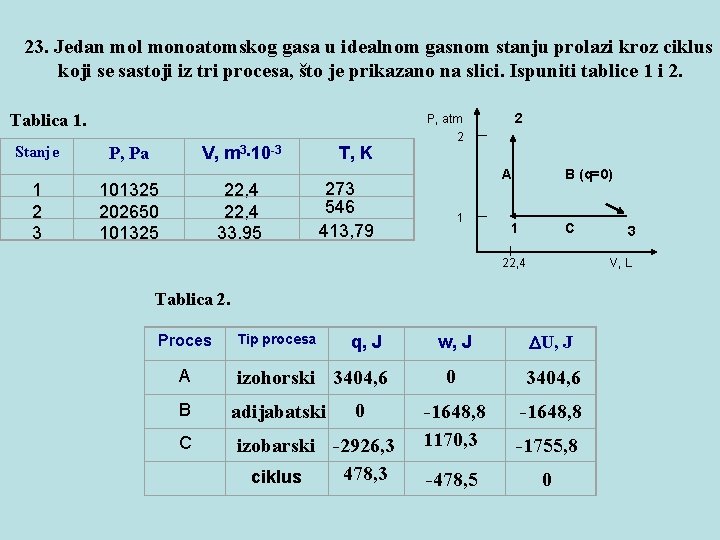
23. Jedan mol monoatomskog gasa u idealnom gasnom stanju prolazi kroz ciklus koji se sastoji iz tri procesa, što je prikazano na slici. Ispuniti tablice 1 i 2. Tablica 1. Stanje 1 2 3 V, m 3 10 -3 P, Pa 101325 202650 101325 22, 4 33, 95 2 T, K A 273 546 413, 79 1 B (q=0) 1 C 22, 4 Proces B C Tip procesa q, J izohorski 3404, 6 adijabatski 0 izobarski -2926, 3 478, 3 ciklus w, J 3 V, L Tablica 2. A 2 P, atm U, J 0 3404, 6 -1648, 8 1170, 3 -1648, 8 -1755, 8 -478, 5 0

24. Domaći: Jedan mola gasa u idealnom gasnom stanju prolazi kroz termodinamički ciklus koji se sastoji od : a) izotermske kompresije od 2 atm i 10 L do 20 atm i 1 L, b) izobarske ekspanzije kojom se gas vraća do zapremine od 10 L a temperatura menja od T 1 do T 2, c) izohorskog hlađenja do početnog stanja. Nacrtati grafik i popuniti tablicu vrednostima q, w i U za procese i ciklus.

25. Benzen (C 6 H 6) gori u vazduhu gradeći ugljendioksid i tečnu vodu. Koliko toplote po molu benzena se oslobodi pri sagorevanju? Standardna entalpija formiranja benzena je 49. 04 k. J/mol, CO 2(g) je -393, 5 k. J/mol i tečne vode je 285, 8 k. J/mol. 2 C 6 H 6 (l) + 15 O 2 (g) 12 CO 2 (g) + 6 H 2 O (l) H 0 rxn = S n H 0 f (produkti) - S m Hf 0 (reaktanti) H 0 rxn = [ 12 H 0 f (CO 2) + 6 H 0 f (H 2 O)] - [ 2 H 0 f (C 6 H 6)] H 0 rxn = [ 12 x(– 393. 5) + 6 x(– 285. 8) ] – [ 2 x 49. 04 ] = -6534. 88 k. J -6535 k. J = - 3267 k. J/mol C 6 H 6 2 mol

26. Izračunati standardnu entalpiju formiranja CS 2 (t): C(grafit) + O 2 (g) CO 2 (g) H 0 = -393. 5 k. J rxn 0 = -296. 1 k. J S(rombični) + O 2 (g) SO 2 (g) Hrxn 0 = -1072 k. J CS 2(t) + 3 O 2 (g) CO 2 (g) + 2 SO 2 (g) Hrxn 1. Napisaćemo entalpiju reakcije nastajanja CS 2 C(grafit) + 2 S(rombični) CS 2 (t) 2. Kombinovati date reakcije tako da se dobije željena reakcija: C(grafit) + O 2 (g) CO 2 (g) H 0 rxn = -393. 5 k. J 2 S(rombični) + 2 O 2 (g) 2 SO 2 (g) H 0 rxn = -296. 1 x 2 k. J + CO 2(g) + 2 SO 2 (g) CS 2 (t) + 3 O 2 (g) H 0 = +1072 k. J rxn C(grafit) + 2 S(rombični) CS 2 (t) H 0 rxn = -393. 5 + (2 x-296. 1) + 1072 = 86. 3 k. J

Zadatak 27. Zadatak: Izračunati standardnu entalpiju formiranja Δf. H za CH 4. Entalpija sagorevanja H 2, C(grafit) i CH 4 su - 285. 8, - 393. 5, i - 890. 4 k. J/mol respektivno. Rešenje: C (graphite) + 2 H 2 CH 4 Hf° = __? ____ 2 H 2(g) + O 2(g) 2 H 2 O(t) H = - 571. 6 k. J C(grafit) + O 2(g) CO 2(g) H = - 393. 5 k. J CO 2(g) + 2 H 2 O(t) CH 4(g) + 2 O 2(g) H= 890. 4 k. J (1) + (2) + (3) C (grafit) + 2 H 2 CH 4 Hf° = - 74. 7 k. J Nacrtati dijagram energetskih nivoa iz ovih podataka

Efikasnost toplotne mašine II zakon termodinamike. Reverzibilni i ireverzibilni Ireverzibilni Fazni prelazi

Maksvelove relacije

Entropija mešanja Termodinamičke jednačine stanja k-Bolcmanova konstanta, k=R/NA=1, 38· 10 -23 J/K

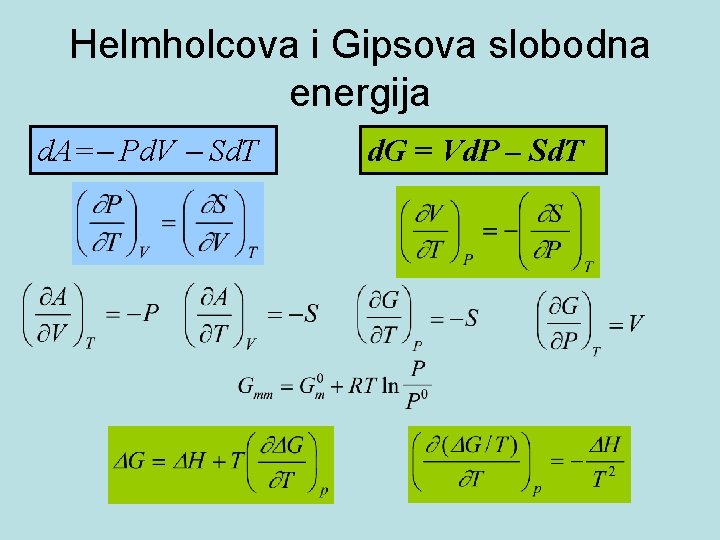
Helmholcova i Gipsova slobodna energija d. A= Pd. V Sd. T d. G = Vd. P – Sd. T

Zadatak 28. Stepen korisnog dejstva mašine koja hladnjaku preda jednu trećinu količine toplote uzete od grejača je: a) 0, 25 b) 0, 35 c) 0, 67 d) 0, 5 e) ne znam Zadatak 25. Izračunati entropiju topljenja (S) u J/mol K za KCl čija je tačka topljenja 7700 C. Promena entalpije topljenja 26, 8 k. J/mol. a) 34, 8 b) 0, 035 c)25, 7 d) 0, 026 e)487, 9 f) ne znam

Zadatak 29 Za sledeću reakciju na 250 C: Cu. O(č)+H 2(g) Cu(č)+H 2 O(g) vrednosti standardnih entropija su: S 0 Cu. Oč=42, 63 J/Kmol, S 0 H 2 g=130, 68 J/Kmol, S 0 Cuč=33, 15 J/Kmol i S 0 H 2 Og=188, 83 J/Kmol. Odrediti da li će se reakcija odigravati spontano sa aspekta sistema. Rešenje: Standardna promena entropije u reakciji je: Za gornju reakciju promena standardne entropije je: Pošto je promena entropije za sistem pozitivna to je reakcija spontana sa aspekta sistema.

30. Grafit i dijamant su dve alotropske modifikacije ugljenika. Izračunati ∆Ssis, ∆Sok i ∆Stot za hemijsku reakciju u kojoj grafit i gasoviti vodonik grade metan: C(graf. )+2 H 2(g) CH 4(g) ∆Ho 298, m=-74, 81 k. J/mol 5, 74 130, 684 186, 26 Somf (J/Kmol) Rešenje: ∆Ssis=186, 26 -2 x 130, 684 -5, 74=-80, 848 J/Kmol ∆Sok=74810/298=251 J/Kmol ∆Stot=-80, 848+251=170, 15 J/Kmol

Zadatak 31. Koja od sledećih reakcija je praćena najpozitivnijom promenom entropije? a) 2 CO(g) + O 2(g)→ 2 CO 2(g) b) N 2(g) + O 2(g) → 2 NO(g) c) 2 CH 4(g) + O 2(g) → 2 CH 3 OH(t) d) 2 H 2 O 2(t) + N 2 H 4(t) → N 2(g) + 4 H 2 O(g) e) C(č, grafit) + H 2 O(g) → CO(g) + H 2(g)

Zadatak 32: Za reakciju : CHCl 3(t)+Cl 2(g) CCl 4(t)+HCl(g) na 250 C standardne entropije su: S 0298(CHCl 3(t))=203, 02 J/Kmol S 0298(Cl 2(g))=223, 07 J/Kmol S 0298(CCl 4(t))=214, 53 J/Kmol S 0298(HCl(g))=186, 91 J/Kmol a toplotni kapaciteti su: C 0 p(CHCl 3(t))=115, 48 J/Kmol C 0 p(Cl 2(g))=34, 36 J/Kmol C 0 p(CCl 4(t))=132, 63 J/Kmol C 0 p(HCl(g))=28, 84 J/Kmol Odrediti standardnu promenu entropije reakcije na 50 o. C.
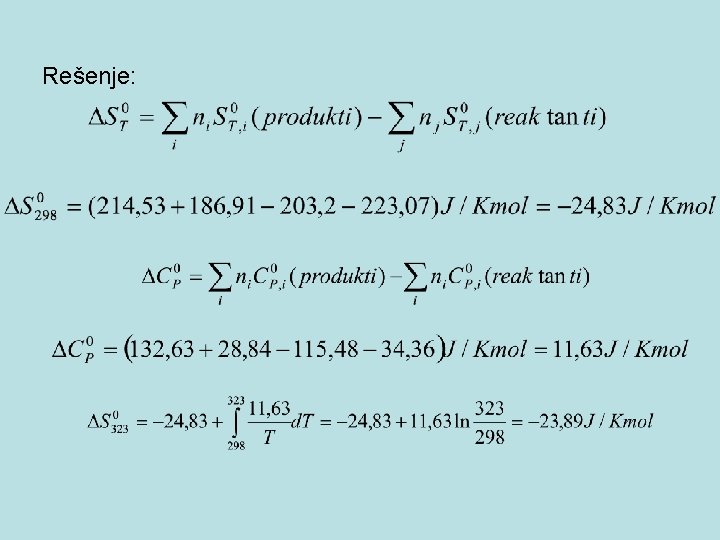
Rešenje:

Zadatak 33: Koliki je porast entropije kada zagrevamo 1 mol hloroforma, CHCl 3 od 240 do 330 K, ako je Cp=(91, 47+7, 5 10 -2 T) J/mol. K ? Rešenje:

Zadatak 34. Izračunati promenu entropije kada se idealan gas čiji je CV, m=5 R/2 komprimuje do jedne trećine svoje početne zapremine i istovremeno zagreje do tri puta veće temperature od početne. Rešenje:

Zadatak 35: U sistemu se odigrava proces u kome se entropija menja za 5, 51 J/K. Za vreme procesa 1, 5 k. J toplote dodato je sistemu na 350 K. Da li je proces termodinamićki reverzibilan? Rešenje: Proces nije termodinamički reverzibilan-ireverzibilan je

Zadatak 36: Uzorak bakra (M=63, 546 g/mol), mase 2, 75 kg i toplotnog kapaciteta 24, 44 J/Kmol, se hladi na konstantnom pritisku od 330 K do 275 K. Izračunati a) energiju koja se mora razmeniti u vidu toplote i b) promenu entropije sistema. Rešenje: a) b)

Zadatak 37: Uzorak azota mase 35 g na 230 K i 21, 1 atm širi se izotermalno do pritiska od 4, 3 atm. Izračunati promenu entropije gasa. Rešenje:

Zadatak 38: Uzorak idealnog gasa u početku na 270 K, 1, 20 atm i 11, 0 L komprimuje se izotermalno. Do koje zapremine treba da se komprimuje da bi se entropija smanjila za 3, 0 J/K Rešenje:

Zadatak 39: Jedan mol čvrstog bakra se širi izotermski od 200 bar do 1 bar. Izračunati promenu entropije sistema za proces u kome je , a gustina =8, 96 103 kgm-3. Rešenje:

Zadatak 40: Jedan mol CO 2(g) na 273 K se hladi do CO 2(t) na 194, 4 K. Hlađenje se vrši reverzibilno i ireverzibilno stavljanjem uzorka u tečni vodonik na 13, 96 K. Izračunati promenu entropije za proces ako je standardna entalpija isparavanja 23, 1752 k. Jmol-1 na 194, 4 K i ako je Cp=32, 22+(22, 18 10 -3)T+(-23, 47 10 -6)T 2. Rešenje: Može se razmatrati proces u dva koraka. Prvi je hlađenje gasa na konstantnom pritisku do tačke ključanja i drugi prevođenje u tečno stanje. Za reverzibilni proces je promena entropije sistema:

Reverzibilan proces: Stoga je ukupna promena entropije za reverzibilan proces:

Ako se promena vrši na irevrzibilan način toplota preneta u okolini je:

Zadatak 41. Promena Gipsove energije za neki izobarski proces može da se prikaže izrazom: Izračuneti promenu entropije i entalpije za taj proces. Rešenje Poznato je da je:

Zadatak 42. Kada se dva mola gasa na 330 K i 3, 5 atm izotermski komprimuje, entropija opadne za 25, 0 J/K. Izračunati krajnji pritisak gasa i promenu Gipsove energije za kompresiju. Rešenje:

Zadatak 43. Kada pritisak 35 g uzorka tečnosti raste izotermalno od 1 atm do 3000 atm, Gibsova energija raste za 12 k. J. Izračunati gustinu tečnosti (u g/cm 3).

Zadatak 44. Jedan mola idealnog monoatomskog gasa se prevodi iz početnog stanja (22, 4 L, 273 K, 1 atm, S=20 cal/K) u krajnje stanje ( 12, 4 L, 2 atm, 303 K). Izračunati U, H, S i G za ovu termodinamičku promenu.

Rešenje: • Označićemo stanja gasa: • Početno: Krajnje: V=22, 4 L=22, 4∙ 10 -3 m 3 V=12, 4 L=12, 4∙ 10 -3 m T=273 K T=303 K P= 1 atm=1, 013∙ 105 Pa P=2 atm=2, 026∙ 105 Pa S= 20 cal/Kmol=83, 72 J/Kmol Pošto je gas u idealnom gasnom stanju to je: U=Cv T=(3 R/2)x 30=374, 13 J H=Cp T=(5 R/2)x 30=623, 55 J

• Promena entropije Gipsove funkcije će se odrediti razmatrajući promenu kroz dva stupnja: • 1. 0, 0224 m 3 , 273 K, 1, 013∙ 105 Pa 0, 02486 m 3, 303 K, 1, 013∙ 105 Pa S 1=Cpln. T 2/T 1=(5 R/2)ln 1, 11=2, 167 J/K (Skrajnje=2, 169 J/K) G 1= H 1 -(T 2 S 2 -T 1 S 1)=623, 55 -(303 x 85, 887 -273 x 83, 72)= -2544, 651 J • 2. 0, 02486 m 3, 303 K, 1, 013∙ 105 Pa 0, 0124 m 3, 303 K; 2, 026∙ 105 Pa S 2=Rln. P 1/P 2=8, 314 x 2, 3 log 0, 5=-5, 763 J/K G 2=RTln. P 2/P 1=1746, 14 J Ukupne promene su: S=2, 167 -5, 763=-3, 596 J/K; G=-2544, 651+1746, 14=-798, 511 J
 адијабатски процес
адијабатски процес Quaako
Quaako Cv termodinamica
Cv termodinamica 1.zakon termodinamike
1.zakon termodinamike I zakon termodinamike
I zakon termodinamike Zakoni termodinamike
Zakoni termodinamike Kineticka teorija gasova
Kineticka teorija gasova Zakoni termodinamike
Zakoni termodinamike Osnove termodinamike
Osnove termodinamike Zakoni termodinamike
Zakoni termodinamike Osnovni cc simboli
Osnovni cc simboli Apsolutno crno tijelo
Apsolutno crno tijelo Monohromator
Monohromator кирхофов закон
кирхофов закон Ohmův zákon prezentace
Ohmův zákon prezentace Toplotni fluks
Toplotni fluks První newtonův zákon
První newtonův zákon Ohm zakon
Ohm zakon Yerkes dodsonův zákon
Yerkes dodsonův zákon Pascalův zákon
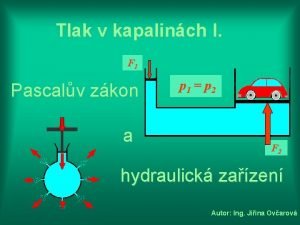
Pascalův zákon Zkony
Zkony Zakon hereditarnosti
Zakon hereditarnosti Relativna deformacija
Relativna deformacija Hydrostatický paradox
Hydrostatický paradox Zakon o sprečavanju nasilja na sportskim priredbama
Zakon o sprečavanju nasilja na sportskim priredbama Pascalův zákon využití
Pascalův zákon využití Výnimky z rytmického krátenia
Výnimky z rytmického krátenia Chemicky a fyzikalny dej test
Chemicky a fyzikalny dej test Furijeov zakon
Furijeov zakon Fickov zakon
Fickov zakon Dopyt ponuka
Dopyt ponuka Božji zakon u životu židovskog dječaka
Božji zakon u životu židovskog dječaka Aktivnost radioaktivnog izvora
Aktivnost radioaktivnog izvora Zakon o informacijskoj sigurnosti
Zakon o informacijskoj sigurnosti Zakon o očuvanju mase
Zakon o očuvanju mase Zakon o delovnih razmerjih
Zakon o delovnih razmerjih Zakona o fiskalizaciji u prometu gotovinom
Zakona o fiskalizaciji u prometu gotovinom Zakon o osnovama sistema obrazovanja i vaspitanja
Zakon o osnovama sistema obrazovanja i vaspitanja Pascalův zákon
Pascalův zákon Ionizujúce žiarenie
Ionizujúce žiarenie Zákon tří jednot
Zákon tří jednot Yerkes dodsonův zákon
Yerkes dodsonův zákon 3. keplerjev zakon
3. keplerjev zakon Zákon rastúcej ponuky
Zákon rastúcej ponuky Vektor magnetizacije
Vektor magnetizacije Centripetalna sila
Centripetalna sila Odraz svetla
Odraz svetla Newtonov zakon gravitacije
Newtonov zakon gravitacije Zakon o trgovačkim društvima
Zakon o trgovačkim društvima Zakon o planiranju prostora i izgradnji objekata
Zakon o planiranju prostora i izgradnji objekata Zakon o izdavanju računa
Zakon o izdavanju računa Kineska mafija
Kineska mafija Yerkes dodsonův zákon
Yerkes dodsonův zákon Lambert beerův zákon
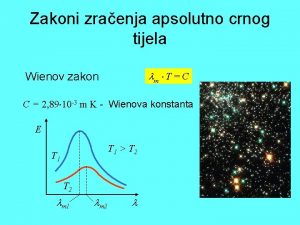
Lambert beerův zákon Wienov zakon
Wienov zakon Definicija brzine hemijske reakcije
Definicija brzine hemijske reakcije Tretí newtonov pohybový zákon znie
Tretí newtonov pohybový zákon znie